
APIDRA
INSULINA GLULISINA
Vial
Caja , 1 y 5 Cartuchos
Caja , 1 Vial
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN
Principio activo: 1 ml contiene 3,5 mg de insulina glulisina, correspondientes a 100 unidades de insulina humana. Cada cartucho, sistema de cartucho y aplicador descartable para cartucho (SoloStar®) contiene 3 ml, equivalentes a 300 unidades de insulina.
Cada vial contiene 10 ml equivalentes a 1000 unidades de insulina.
Excipientes
3,15 mg de m-cresol, 6 mg de trometamol, 5 mg de cloruro de sodio, 0,01 mg de polisorbato 20 y agua para inyectables.
APIDRA® tiene un pH de aproximadamente, 7,3 y se ajusta agregando soluciones acuosas de ácido clorhídrico y/o hidróxido de sodio.
Naturaleza y contenido del envase: Ver información esencial.
DESCRIPCIÓN Y COMPOSICIÓN
Principios Activos
Insulina glulisina
Análogo de insulina humana recombinante.
Químicamente es 3B -lisina-29B-ácido glutámico-insulina humana.
Fórmula empírica: C258H384N64O78S6
Fórmula estructural:
Cadena-A

Cadena-B
Peso molecular: 5823
La insulina glulisina difiere de la insulina humana en que el aminoácido asparagina en la posición B3 es reemplazado por lisina y la lisina en la posición B29 es reemplazada por ácido glutámico.
La insulina glulisina es elaborada mediante tecnología ADN-recombinante, utilizando Escherichia coli (cepas K12).
INDICACIONES: Diabetes mellitus que requiere tratamiento con insulina.
CLASE TERAPÉUTICA O FARMACOLÓGICA: Agente antidiabético.
Grupo farmacoterapéutico: Insulina y análogos de acción rápida. Código ATC (Clasificación Química, Terapéutica y Anatómica): A10AB.
FORMA FARMACÉUTICA: Solución inyectable en viales, cartuchos (diseñados para ser usados con un sistema adecuado para la aplicación de insulinas (ClikStar, Autopen) aplicadores descartables para cartucho (SoloStar®).
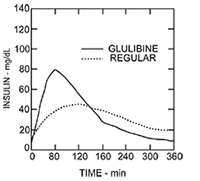
FARMACOCINÉTICA: Absorción y biodisponibilidad: Los perfiles farmacocinéticos en voluntarios sanos y pacientes con diabetes (Tipo 1 o 2) demostraron que la absorción de insulina glulisina era casi el doble de rápida con una concentración pico de, aproximadamente, el doble de elevada comparada con la insulina humana regular.
En un estudio con pacientes con diabetes Tipo 1 (n = 20), luego de la administración subcutánea de 0,15 UI/kg, Tmax fue 55 minutos y Cmax fue 82 mUI/mL para insulina glulisina comparada a una Tmax de 82 minutos y C max fue 46 mUI/mL para insulina humana regular. El tiempo medio de permanencia de la insulina glulisina fue más corto (98 min) que el de la insulina humana regular (161 min). (Ver Figura 2).
Figura 2: Perfil farmacocinético de la insulina glulisina y la insulina humana regular en pacientes diabéticos Tipo 1 luego de una dosis de 0,15 UI/kg.
Cuando APIDRA® fue inyectada subcutáneamente a diferentes áreas del cuerpo, los perfiles tiempo concentración fueron similares con una absorción ligeramente más rápida cuando se la inyectó en el abdomen en comparación con el deltoides o el muslo. La biodisponibilidad absoluta de la insulina glulisina, luego de administración subcutánea, es de aproximadamente un 70%, independientemente del área de inyección (abdomen 73%, deltoides 71%, muslo 68%).
Distribución y eliminación: Luego de su administración intravenosa, la distribución y eliminación de la insulina glulisina y la insulina humana regular son similares con volúmenes de distribución de 13 L y 21 L y vida medias de 13 y 17 minutos, respectivamente.
Luego de su administración subcutánea, la insulina glulisina se elimina más rápidamente que la insulina humana regular con una vida media aparente de 42 minutos versus 86 minutos.
Poblaciones especiales
Pacientes pediátricos: (ref.: CSR 1017)
Las propiedades farmacocinéticas y farmacodinámicas de APIDRA® e insulina humana regular fueron evaluadas en un estudio realizado en pacientes pediátricos con diabetes Tipo 1 (niños [7 – 11 años de edad, n = 10] y adolescentes [12-16 años de edad, n = 10}). Las diferencias relativas en la farmacocinética y farmacodinamia entre APIDRA® y la insulina humana regular en pacientes pediátricos con diabetes Tipo 1 fueron similares a las de los adultos sanos y los adultos con diabetes Tipo 1.
Raza y género: Se carece de información sobre el efecto de la raza y el género sobre la farmacocinética de APIDRA®. Sin embargo, en estudios clínicos de Fase III en adultos (n = 2408), los análisis de subgrupos basados en el género no mostraron diferencia alguna en seguridad y eficacia entre APIDRA® y otras formas de insulina de corta acción.
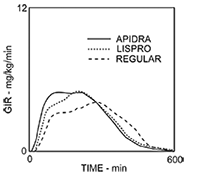
Obesidad: El comienzo más rápido de acción y la menor duración de actividad de APIDRA® e insulina lispro versus la insulina regular humana se mantuvieron en una población obesa no diabética. El comienzo más rápido de acción se mantuvo mejor con insulina glulisina que con insulina lispro (ver Figura 3).
Figura 3: Tasas de infusión de glucosa (GIR) luego de inyección subcutánea de 0,3 UI/kg de APIDRA®, insulina lispro o insulina regular humana en una población obesa.
Compromiso renal: Estudios con insulina humana han demostrado aumentos en los niveles circulantes de insulina en pacientes con insuficiencia renal. En un estudio realizado con 24 sujetos no-diabéticos cubriendo una amplia escala de funciones renales (ClCr>80mL/min; 30-50 mL/min; < 30 mL/min), las propiedades farmacocinéticas de APIDRA® se mantuvieron en general.
Compromiso hepático: No se ha estudiado el efecto de la insuficiencia hepática sobre la farmacocinética de APIDRA®. No obstante, algunos estudios con insulina humana han demostrado aumento en los niveles de insulina circulante en pacientes con insuficiencia hepática (ver Precauciones).
Embarazo: No se ha estudiado el efecto del embarazo sobre la farmacocinética y farmacodinamia de APIDRA®.
FARMACODINAMIA: Mecanismo de acción/ Características farmacodinámicas: La actividad principal de las insulinas y los análogos de insulina, incluida la insulina glulisina, es la regulación del metabolismo de la glucosa. Las insulinas reducen los niveles de glucosa en sangre mediante estimulación de la captación periférica de glucosa por el músculo esquelético y el tejido adiposo, e inhibición de la producción hepática de glucosa. Las insulinas inhiben la lipólisis en el adipocito, inhiben la proteólisis e incrementan la síntesis de proteínas.
Luego de su administración subcutánea, APIDRA® tiene un comienzo de acción más rápido y una menor duración de acción en comparación con la insulina humana regular.
Cuando se las administra por vía intravenosa, las propiedades hipoglucemiantes de APIDRA® y de la insulina humana regular fueron equipotentes.
En estudios con voluntarios sanos y pacientes con diabetes se demostró que APIDRA® tiene un comienzo de acción más rápido y una menor duración de acción en comparación con la insulina humana regular cuando es administrada subcutáneamente.
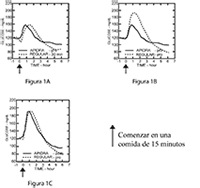
En un estudio en pacientes con diabetes Tipo 1 (n = 20), los perfiles hipoglucemiantes de APIDRA® y de la insulina humana regular fueron evaluados en distintos momentos en relación a una comida estándar a una dosis de 0,15 UI/kg (Ver Figura 1).
Figura 1: Efecto hipoglucemiante a lo largo de 6 horas. APIDRA® administrada 2 minutos (APIDRA® – pre) antes del comienzo de una comida comparada con insulina humana regular administrada 30 minutos (Regular – 30 min) antes del comienzo de una comida (figura 1A) y comparada con insulina humana regular (Regular – pre) administrada 2 minutos antes de una comida (figura 1B). APIDRA® administrada 15 minutos (APIDRA® – post) después del comienzo de una comida comparada con insulina humana regular (Regular – pre) administrada 2 minutos antes de una comida (figura 1C). En el eje x, cero (0) es el comienzo de una comida de 15 minutos.
Uso Intravenoso: Las actividades reductoras de glucosa de APIDRA® y la insulina humana regular son equipotentes cuando se administran por vía intravenosa. Dos estudios Fase I evaluaron la administración de APIDRA® por vía intravenosa. En estos estudios, se demostró que APIDRA® era seguro y bien tolerado.
Eficacia Clínica/ Estudios Clínicos: La seguridad y eficacia de APIDRA® fueron estudiadas en pacientes adultos con diabetes Tipo 1 y Tipo 2 (n = 2408). El parámetro primario de eficacia fue el control glucémico medido por hemoglobina glicada (GHb) y expresado como equivalentes de hemoglobina A1c (A1C).
Diabetes Tipo 1: Un estudio aleatorizado, abierto, controlado de 26 semanas (n = 672) fue realizado con pacientes con diabetes Tipo 1 para evaluar la seguridad y eficacia de APIDRA® comparada con insulina lispro, cuando se las administra por vía subcutánea dentro de los 15 minutos previos a una comida. Se administró insulina glargina una vez por día EN LA NOCHE como insulina basal. Antes del comienzo del estudio, hubo un periodo preinclusión de 4 semanas, combinando insulina lispro e insulina glargina, seguido por la aleatorización. El control glucémico y las tasas de hipoglucemia que requirieron la intervención de un tercero fueron comparables en los dos regímenes de tratamiento. El número de inyecciones diarias de insulina y las dosis diarias totales de APIDRA® e insulina lispro fueron similares. Se observó una disminución en A1C en los pacientes tratados con APIDRA® sin un incremento de la dosis de insulina basal (Ver Tabla 1).
|
Tabla 1: Diabetes Mellitus Tipo 1 – Adultos |
||
|
Duración del tratamiento: |
26 semanas |
|
|
Tratamiento en combinación con la siguiente insulina basal: |
Insulina glargina |
|
|
APIDRA® |
Insulina Lispro |
|
|
Número de pacientes tratados |
339 |
333 |
|
A1C (%) |
||
|
Media al final del estudio |
7,46 |
7,45 |
|
Media del cambio ajustado respecto al valor basal |
-0,14 |
-0,14 |
|
APIDRA® - Insulina Lispro |
0,00 |
|
|
IC 95% para la diferencia de tratamiento |
(-0,09; 0,10) |
|
|
Dosis insulina basal (UI/día) |
||
|
Media al final del estudio |
24,16 |
26,43 |
|
Media del cambio ajustado respecto al valor basal |
0,12 |
1,82 |
|
Dosis insulina de acción corta (UI/día) |
||
|
Media al final del estudio |
29,03 |
30,12 |
|
Media del cambio ajustado respecto al valor basal |
-1,07 |
-0,81 |
|
Hipoglucemia (eventos/mes/paciente)* |
0,02 |
0,02 |
|
Media del número de inyecciones diarias de insulina de acción corta |
3,36 |
3,42 |
|
* Eventos que requirieron la asistencia de un tercero durante los últimos 3 meses del estudio. |
||
Diabetes Tipo 2: Un estudio aleatorizado, abierto, controlado de 26 semanas (n = 876) fue realizado con pacientes con diabetes Tipo 2 para evaluar la seguridad y eficacia de APIDRA® administrada dentro de los 15 minutos previos a una comida versus insulina humana regular administrada 30 a 45 minutos antes de una comida. Se administró insulina humana NPH dos veces por día como insulina basal. Todos los pacientes participaron en un periodo preinclusión de 4 semanas combinando insulina humana regular e insulina humana NPH. El promedio del índice de masa corporal (IMC) de los pacientes fue 34,55 kg/m2. Al momento de la aleatorización, 58% de los pacientes estaban recibiendo un agente antidiabético oral y se les indicó que continuaran usando la misma dosis de su agente antidiabético oral. La mayoría de los pacientes (79%) mezcló su insulina de corta acción con insulina humana NPH inmediatamente antes de la inyección. Se observó una mayor reducción de A1C con respecto al valor basal en el grupo APIDRA®. Al término del periodo de tratamiento, los niveles de glucosa postprandial en sangre en el grupo APIDRA® fueron inferiores a los del grupo de insulina humana regular. Las tasas de hipoglucemia, que requirieron de la intervención de un tercero, fueron comparables con los dos regímenes de tratamiento. No se observaron diferencias en la cantidad de inyecciones diarias ni en las dosis de insulina basal o de corta duración entre los grupos APIDRA® e insulina humana regular (Ver Tabla 2).
|
Tabla 2: Diabetes Mellitus Tipo 2 – Adultos |
||
|
Duración del tratamiento |
26 semanas |
|
|
Tratamiento en combinación con la siguiente insulina basal: |
Insulina humana NPH |
|
|
APIDRA® |
Insulina Humana Regular |
|
|
Número de pacientes tratados |
435 |
441 |
|
A1C (%) |
||
|
Media al final estudio |
7,11 |
7,22 |
|
Media del cambio ajustado respecto al valor basal |
-0,46 |
-0,30 |
|
APIDRA® - Insulina Humana Regular |
-0,16 |
|
|
95% IC para diferencia tratamiento |
(-0,26; -0,05) |
|
|
Dosis insulina basal (UI/día) |
||
|
Media al final estudio |
65,34 |
63,05 |
|
Media del cambio ajustado respecto al valor basal |
5,73 |
6,03 |
|
Dosis insulina de corta acción (UI/día) |
||
|
Media al final estudio |
35,99 |
36,16 |
|
Media del cambio ajustado respecto al valor basal |
3,69 |
5,00 |
|
Hipoglucemia (eventos/mes/paciente)* |
0,00 |
0,00 |
|
Media del número de inyecciones diarias de insulina de acción corta |
2,27 |
2,24 |
|
* Eventos que requirieron la asistencia de un tercero durante los últimos 3 meses del estudio. |
||
Administración antes y después de la comida (Diabetes Tipo 1): Un estudio aleatorizado, abierto, controlado con fármaco activo de 12 semanas (n = 860) fue realizado con pacientes con diabetes Tipo 1 para evaluar la seguridad y eficacia de APIDRA® administrada en diferentes momentos con respecto a una comida. APIDRA® fue administrada subcutáneamente 15 minutos antes o inmediatamente después de una comida y la insulina regular humana fue administrada subcutáneamente 30 a 45 minutos antes de una comida. Las comparaciones efectuadas en este estudio fueron APIDRA® antes de la comida comparada con insulina regular humana, APIDRA® después de la comida comparada con insulina regular humana y APIDRA® depués de la comida comparada con APIDRA® antes de la comida. Como insulina basal, se administró insulina glargina una vez por día, al acostarse. Antes del comienzo del estudio, hubo un periodo preinclusión de 4 semanas combinando insulina humana regular e insulina glargina, seguido por la aleatorización. El control glucémico y las tasas de hipoglucemia que requirieron la intervención de un tercero fueron comparables en los regímenes de tratamiento. En los tres regímenes de tratamiento se observaron reducciones importantes en A1C con respecto al valor basal. No se observaron cambios con respecto al valor basal entre los tratamientos en cuanto al número total de inyecciones diarias de insulina. Se observó un aumento en la dosis diaria de insulina de acción corta versus la insulina humana regular (ver Tabla 3).
|
Tabla 3: Diabetes Mellitus Tipo 1 – Adultos |
|||
|
Duración del tratamiento Tratamiento en combinación con la siguiente insulina basal: |
12 semanas Insulina glargina |
12 semanas Insulina glargina |
12 semanas Insulina glargina |
|
APIDRA® antes de la comida |
APIDRA® después de la comida |
Insulina Humana Regular |
|
|
Cantidad de pacientes tratados |
286 |
296 |
278 |
|
A1C (%) |
|||
|
Media al final estudio |
7,46 |
7,58 |
7,52 |
|
Media del cambio ajust. respecto al valor basal* |
-0,26 |
-0,11 |
-0,13 |
|
Dosis insulina basal (UI/día) |
|||
|
Media al final estudio |
29,49 |
28,77 |
28,46 |
|
Media del cambio ajust. respecto al valor basal |
0,99 |
0,24 |
0,65 |
|
Dosis insulina de corta acción (UI/día) |
|||
|
Media al final estudio |
28,44 |
28,06 |
29,23 |
|
Media del cambio ajust. respecto al valor basal |
-0,88 |
-0,47 |
1,75 |
|
Hipoglucemia (eventos/mes/paciente)** |
0,05 |
0,05 |
0,13 |
|
Cantidad media de inyecciones diarias de insulina de corta acción |
3,15 |
3,13 |
3,03 |
|
* Media del cambio ajustado respecto al valor basal para diferencia entre tratamientos (IC 98,33% para diferencia entre tratamientos): APIDRA® antes de la comida versus Insulina Regular Humana 0,13 (-0,26; 0,01); APIDRA® depués de la comida versus Insulina Regular Humana 0,02 (-0,11; 0,16); APIDRA® después de la comida versus antes de la comida 0,15 (0,02; 0,29). ** eventos que requirieron la asistencia de un tercero durante todo el tratamiento. |
|||
Infusión subcutánea continúa de insulina (CSII) (Diabetes Tipo 1): Un estudio aleatorizado, abierto, controlado con fármaco activo (APIDRA® versus insulina aspart) de 12 semanas (n = 59) fue realizado con pacientes con diabetes Tipo 1 para evaluar el uso de APIDRA® administrada usando una bomba externa. En ambos grupos de tratamiento se observó un bajo nivel de oclusión de catéteres (APIDRA®: 0,08 oclusiones/mes; insulina aspart: 0,15 oclusiones/mes). Una incidencia similar de reacciones en el sitio de infusión se observó con APIDRA® (n = 3/29; 10,3%) e insulina aspart (n = 4/30; 13,3%).
APIDRA® ha sido estudiada en las siguientes bombas y aparatos de infusión: Disetronic® H-Tron® más V100 y D-Tron™ con catéteres Disetronic (Rapid™, RapidC™ y D™ y Tender™); MiniMed® Modelos 506, 507, 507c y 508 con catéteres MiniMed (Sof-set Ultimate QR™ y Quick-set™).
Diabetes tipo 1 - Pediatría: Un estudio Fase III de 26 semanas de duración, abierto, controlado con fármaco activo (n=572), evaluó la eficacia y seguridad de la insulina glulisina en niños y adolescentes con diabetes mellitus Tipo 1, en comparación con insulina lispro cuando se administra por vía subcutánea dentro de los 15 minutos previos a una comida. Como insulina basal, se administraron insulina glargina una vez por día, en la noche, o NPH dos veces al día, en la mañana y en la noche. El estudio consistió en un periodo preinclusión de 4 semanas, durante las cuales los pacientes recibieron NPH o insulina glargina combinadas con insulina lispro, seguido por una fase de tratamiento de 26 semanas. El control glucémico y las tasas de hipoglucemia que requirieron la intervención de un tercero, y la frecuencia de episodios de hipoglicemia reportados como eventos adversos serios fueron comparables en los regímenes de tratamiento. Al final de estudio, los pacientes que recibieron glulisina requirieron menores incrementos con respecto al valor basal de las dosis diarias de insulina basal, de acción rápida y total para lograr un control glucémico similar que los pacientes que recibieron lispro (ver Tabla 4).
|
Tabla 4: Diabetes Mellitus Tipo 1 – Pediatría |
||
|
Duración del tratamiento |
26 semanas |
|
|
Tratamiento en combinación con: |
NPH o LANTUS® |
|
|
APIDRA® |
Insulina lispro |
|
|
HbA1C (%) |
||
|
Número de pacientes |
271 |
291 |
|
Media Basal |
8,20 |
8,17 |
|
Media del cambio ajustado respecto al valor basal |
0,10 |
0,16 |
|
APIDRA® – lnsulina lispro |
-0,06 |
|
|
IC 95% para la diferencia entre tratamientos |
(-0,24;0,12) |
|
|
Dosis insulina basal (UI/día) |
||
|
Media al final estudio |
28,41 |
28,86 |
|
Media del cambio ajustado respecto al valor basal |
1,09 |
2,22 |
|
Dosis insulina de corta acción (UI/día) |
||
|
Media al final estudio |
25,48 |
26,97 |
|
Media del cambio ajustado respecto al valor basal |
1,36 |
2,71 |
|
Porcentaje de pacientes con un número promedio de inyecciones diarias de insulina de acción rápida = 3 |
77,0 |
80,3 |
CONTRAINDICACIONES: Hipersensibilidad al principio activo o a cualquiera de sus excipientes.
EMBARAZO: No existen estudios clínicos controlados sobre el uso de APIDRA® en mujeres embarazadas.
Existe una cantidad limitada de información acerca del uso de APIDRA® en mujeres embarazadas (menos de 300 productos de embarazo reportados). En mujeres expuestas a insulina glulisina, no se han evidenciado riesgos de seguridad durante la gestación, en el feto ni en el recién nacido.
Es esencial que las pacientes con diabetes o antecedentes de diabetes gravídica mantengan un buen control metabólico antes de la concepción y durante el embarazo.
Los requerimientos de insulina pueden disminuir durante el primer trimestre, generalmente aumentan durante el segundo y tercer trimestre, y disminuyen rápidamente después del parto.
En estas pacientes es imprescindible un cuidadoso monitoreo de la glucosa.
Las pacientes con diabetes deben informar a su médico si están embarazadas o si planean quedar embarazadas.
LACTANCIA: Se desconoce si APIDRA® se excreta en la leche humana.
Las mujeres en periodo de lactancia pueden requerir ajustes en la dosis de insulina y en la dieta.
INFORMACIÓN PARA EL PACIENTE: Confusiones accidentales entre insulina glulisina y otras insulinas, particularmente insulinas de acción prolongada, han sido reportadas. Para evitar errores en la medicación entre insulina glulisina y otras insulinas, el paciente debe ser instruido en cuanto a la importancia de verificar siempre en la etiqueta el nombre de la insulina antes de cada aplicación.
CONDUCCIÓN DE VEHÍCULOS O REALIZACIÓN DE OTRAS TAREAS PELIGROSAS: La capacidad de concentración y de reacción del paciente puede verse afectada a consecuencia de una hipoglucemia o hiperglucemia o, por ejemplo, como consecuencia de un deterioro visual. Esto puede constituir un riesgo en situaciones en que estas capacidades son de vital importancia (por ejemplo, conducir un automóvil u operar una maquinaria).
Se debe advertir a los pacientes que adopten precauciones para evitar una hipoglucemia mientras conducen. Esto es especialmente importante en aquellos pacientes con ausencia o reducción de la capacidad para percibir los síntomas de alarma de hipoglucemia o que padecen episodios frecuentes de hipoglucemia. Se debe considerar si es aconsejable conducir o utilizar maquinaria en estas circunstancias.
REACCIONES ADVERSAS: Los eventos adversos observados fueron los conocidos en esta clase farmacológica y, en consecuencia, comunes a las insulinas.
Hipoglucemia: En general la reacción adversa más frecuente de la terapia con insulina, puede ocurrir cuando la dosis de insulina es demasiado elevada en relación con el requerimiento de insulina.
Alergia local: Ocasionalmente, se presenta en algunos pacientes enrojecimiento, inflamación y prurito en el sitio de la inyección. Estas reacciones generalmente se resuelven en el término de unos pocos días a unas pocas semanas. En algunos casos, estas reacciones pueden estar relacionadas con otros factores además de la insulina, tales como irritantes en los productos para la limpieza de la piel o una técnica de inyección deficiente.
Reacciones alérgicas sistémicas a la insulina: Estas reacciones a la insulina (incluyendo la insulina glulisina) pueden estar asociadas, por ejemplo, con una erupción cutánea (incluyendo prurito) en todo el cuerpo, dificultad para respirar, jadeos, reducción de la presión sanguínea, pulso rápido o sudoración. Los casos severos de alergia generalizada, incluyendo reacción anafiláctica, podrían poner en peligro la vida.
Al igual que con cualquier terapia insulínica, se puede producir lipodistrofia en el sitio de inyección y retraso en la absorción local de la insulina. La rotación continua del sitio de inyección dentro del área de inyección puede contribuir a disminuir o prevenir estas reacciones.
Han sido reportados errores en la medicación en los cuales otra insulina, particularmente insulina de acción prolongada, ha sido accidentalmente administrada en lugar de la insulina glulisina.
INTERACCIONES: Diversas sustancias afectan el metabolismo de la glucosa y pueden requerir el ajustes en la dosis de insulina humana.
Entre las sustancias que pueden intensificar el efecto hipoglucemiante e incrementar la susceptibilidad a la hipoglucemia se encuentran: Los agentes antidiabéticos orales, los inhibidores de la enzima convertidora de la angiotensina (ACE), la disopiramida, los fibratos, fluoxetina, los inhibidores MAO, la pentoxifilina, el propoxifeno, los salicilatos y los antibióticos sulfonamídicos.
Entre las substancias que pueden reducir el efecto hipoglucemiante se encuentran: Los corticosteroides, el danazol, el diazóxido, los diuréticos, el glucagón, la isoniazida, los estrógenos y los progestágenos (por ej. en los anticonceptivos orales), los derivados de la fenotiacina, la somatropina, los agentes simpaticomiméticos (por ejemplo, la epinefrina, el salbutamol, la terbutalina), las hormonas tiroideas, los inhibidores de la proteasa y los medicamentos antipsicóticos atípicos (por ej. olanzapina y clozapina).
Los betabloqueantes, la clonidina, las sales de litio o el alcohol pueden potencializar o debilitar el efecto hipoglucemiante de la insulina. La pentamidina puede provocar hipoglucemia que, en algunas veces, puede ser seguida por hiperglucemia.
Adicionalmente, bajo la influencia de medicamentos simpaticolíticos como los betabloqueantes, la clonidina, la guanetidina y la reserpina, los signos de contrarregulación adrenérgica pueden estar reducidos o ausentes.
DATOS DE SEGURIDAD NO CLÍNICA
Carcinogenicidad: No se han realizado estudios estándar de dos años de carcinogenicidad en animales para evaluar el potencial carcinogénico de APIDRA®.
Con ratas Sprague Dawley, se realizó un estudio de toxicidad de 12 meses de duración con dosis de 2,5, 5, 20 o 50 UI/kg de insulina glulisina, dos veces por día (la dosis resultó en una exposición equivalente a, aproximadamente, 26, 54, 258, 662 veces la Cmax humana a la dosis humana promedio, respectivamente).
Hubo una incidencia mayor de tumores de las gandulas mamarias no dosis dependiente en las ratas hembras a las que se les administró APIDRA® versus los controles no-tratados.
La incidencia de tumores mamarios con APIDRA® e insulina humana regular fue similar. Se desconoce la importancia de estos hallazgos para los seres humanos.
En este estudio, los efectos de la insulina glulisina sobre la proliferación celular en glándulas mamarias fueron evaluados utilizando la inmunohistoquímica Ki-67. No hubo diferencias significativas en proliferación celular mamaria entre los grupos de insulina glulisina, insulina humana regular y de control.
Mutagenicidad: APIDRA® no fue mutagénica en las siguientes pruebas: Prueba Ames, tes test de alteración cromosómica en células de mamífero in vitro, en células V79 y prueba de aberración cromosómica mamífera in vivo (prueba micronúcleo del eritrocito).
Teratogenicidad: Estudios sobre reproducción y teratología han sido efectuados con insulina glulisina subcutánea en ratas y conejos utilizando insulina humana regular como comparador.
El medicamento fue administrado a las ratas hembras durante toda la preñez en dosis de hasta 10 UI/kg una vez por día (dosis resultante en una exposición equivalente a aproximadamente 50 veces la Cmax humana a la dosis humana promedio). La insulina glulisina no produjo ningún efecto tóxico sobre el desarrollo embrio fetal en ratas.
La droga fue administrada a las conejas durante toda la preñez en dosis de hasta 1.5 UI/kg/día. Se observaron efectos adversos sobre el desarrollo embrio-fetal únicamente a niveles tóxicos maternos de dosis, induciendo hipoglucemia. Se observó una mayor incidencia de pérdidas post-implantación y defectos esqueléticos a dosis de un nivel de 1.5 UI/kg una vez por día (dosis resultante en una exposición equivalente a aproximadamente 25 veces la Cmax humana a la dosis humana promedio), que también causó mortalidad en madres. Una cierta mayor incidencia de pérdidas post-implantación se observó en el nivel inferior más próximo de dosis de 0.5 UI/kg una vez por día (dosis resultante en una exposición equivalente a aproximadamente 5 veces la Cmax humana a la dosis humana promedio), que también fue asociada con hipoglucemia grave pero no se produjeron defectos a esa dosis. No se observó ningún defecto en conejas a una dosis de 0.25 UI/kg una vez por día (dosis resultante en una exposición equivalente a aproximadamente 3 veces la Cmax humana a la dosis humana promedio).
Los efectos de APIDRA® no fueron diferentes a los observados con insulina humana regular subcutánea a las mismas dosis y fueron atribuidos a efectos colaterales de la hipoglucemia materna.
Deterioro de la fertilidad: No se observaron efectos adversos sobre la fertilidad masculina o femenina o del desempeño reproductivo general de los animales (ratas) en estudios de fertilidad masculina y femenina a dosis subcutáneas de hasta 10 UI/kg una vez por día (dosis resultante en una exposición equivalente a aproximadamente 50 veces la Cmax humana a la dosis humana promedio).
Incompatibilidades / compatibilidades (Ver Posología y Administración).
INTERFERENCIA CON ANÁLISIS DE LABORATORIO Y PRUEBAS DE DIAGNÓSTICO: Ninguna conocida.
Abuso y dependencia: Con APIDRA® no es probable el riesgo de abuso o dependencia.
PRECAUCIONES: Debido a la corta duración de acción de APIDRA®, los pacientes con diabetes también requieren de una terapia con una insulina de acción prolongada o con bomba de infusión de insulina para mantener un control adecuado de la glucosa.
Cualquier cambio de insulina debe ser efectuado con cautela y solamente bajo supervisión médica. Cambios en la potencia de la insulina, el fabricante, el tipo (por ej. normal, NPH, análogos), la especie (animal, humana) o el método de elaboración (rDNA versus insulina de fuente animal) puede requerir un cambio en la posología.
Puede ser necesario ajustar el tratamiento antidiabético oral concomitante.
Las necesidades de insulina pueden variar durante condiciones intercurrentes tales como enfermedad, trastornos emocionales o estrés.
Hipoglucemia: El momento en que ocurre la hipoglucemia depende del perfil de acción de las insulinas utilizadas y, por lo tanto, puede cambiar cuando se modifica el régimen de tratamiento.
Como con todas las insulinas, bajo ciertas condiciones, los síntomas de advertencia de hipoglucemia pueden cambiar, ser menos pronunciados o estar ausentes, por ejemplo:
- Si el control glucémico ha mejorado notablemente,
- Si la hipoglucemia se desarrolla gradualmente,
- En pacientes ancianos,
- Cuando está presente una neuropatía autónoma,
- En pacientes con un prolongado historial de diabetes,
- En pacientes a quienes se administra tratamiento concomitante con ciertos medicamentos (ver Interacciones).
Estas situaciones pueden ocasionar una hipoglucemia severa (con posible pérdida del conocimiento) antes de que el paciente sea consciente de la hipoglucemia.
Compromiso renal: Los requerimientos de APIDRA®, así como de todas las insulinas, pueden estar disminuidos en pacientes con compromiso renal (ver Farmacocinética).
Compromiso hepático: En pacientes con compromiso hepático, los requerimientos de insulina pueden estar disminuidos debido a una capacidad reducida para la gluconeogénesis y un reducido metabolismo de insulina.
Dispositivos para ser utilizados con cartuchos de APIDRA®: Los cartuchos de APIDRA® sólo deben utilizarse con los dispositivos ClikStar o AutoPen y No deben ser utilizados con cualquier otro dispositivo reutilizable dado que la exactitud de dosificación sólo se ha establecido con los dispositivos mencionados.
Bombas de infusión subcutánea continua: El mal funcionamiento de las bombas de infusión de insulina o errores en la manipulación de los mismos pueden producir hiperglicemia y cetoacidosis diabética. La detección y corrección tempranas de la causa de hiperglicemia, cetosis o cetoacidosis diabética es necesaria.
Puede ser necesario el uso provisional de inyecciones subcutáneas de APIDRA®, los pacientes que utilizan bombas de infusión subcutánea deben estar entrenados para la aplicación de un sistema alternativo de insulina. (ver Administración)
POSOLOGÍA Y ADMINISTRACIÓN: General: APIDRA® es un análogo de insulina humana recombinante que ha demostrado ser equipotente a la insulina humana. Una unidad de APIDRA® tiene el mismo efecto hipoglucemiante que una unidad de insulina humana regular. Luego de su administración subcutánea, tiene un comienzo de acción más rápido y una menor duración de acción.
APIDRA® debe ser administrada por inyección dentro de los 15 minutos anteriores o inmediatamente después de una comida.
La dosis de APIDRA® debe ser individualizada y definida con base en las recomendaciones del médico de acuerdo a las necesidades del paciente.
Habitualmente, APIDRA® debe ser utilizada en regímenes que incluyen una insulina de acción prolongada o un análogo de insulina basal.
Para todos los pacientes con diabetes se recomienda monitoreo de glucosa en sangre.
Poblaciones especiales:
Uso pediátrico: APIDRA® puede administrase a niños = 6 años de edad.
Uso geriátrico: La hipoglucemia puede ser difícil de reconocer en ancianos (ver Precauciones).
Compromiso hepático: En pacientes con compromiso hepático los requerimientos de insulina pueden estar disminuidos. (Ver Precauciones)
Compromiso renal: En pacientes con compromiso renal los requerimientos de insulina pueden estar disminuidos. (Ver Precauciones)
Administración
General: APIDRA® es para administración subcutánea por inyección o por bomba de infusión externa. APIDRA® también puede administrase por vía intravenosa.
APIDRA® debe administrase subcutáneamente por inyección en la pared abdominal, el muslo o el deltoides o por infusión subcutánea continua en la pared abdominal.
Así como con todas insulinas, los sitios de inyección y los sitios de infusión dentro de un área de inyección (abdomen, muslo o deltoides) deben rotarse de una inyección a la siguiente.
Así como con todas las insulinas, la tasa de absorción y, en consecuencia, el inicio y duración de la acción, pueden ser afectadas por el sitio de inyección, el ejercicio físico y otras variables.
Mezcla de insulinas para inyección subcutánea: APIDRA® puede mezclarse con insulina humana NPH.
Si APIDRA® se mezcla con insulina humana NPH, primero se debe llenar la jeringa con APIDRA®. La inyección debe aplicarse inmediatamente después de realizada la mezcla.
Las mezclas no deben administrarse por vía intravenosa.
Bomba de infusión subcutánea continua: APIDRA® puede ser usada para Infusión subcutánea Continua de insulina (CSII, por sus siglas en inglés) mediante sistemas adecuados de bombas para infusión de insulina (ver Farmacodinamia). Los pacientes que usen CSII deben ser exhaustivamente instruidos sobre el uso del sistema de bomba.
El equipo de infusión y el reservorio usado con APIDRA® deben ser cambiados por lo menos cada 48 horas utilizando una técnica aséptica. Estas instrucciones pueden diferir de las instrucciones generales de bombas manuales. Es importante que los pacientes cumplan con las instrucciones específicas al utilizar insulina APIDRA®. El incumplimiento de las instrucciones específicas de insulina APIDRA®.puede provocar efectos adversos graves.
Al utilizar APIDRA® en infusión intravenosa o en bombas no debe ser mezcladas con otros diluyentes u otro tipo de insulina.
A los pacientes a los que se les administra APIDRA® por CSII deben tener una sistema de liberación alternativo de insulina en caso de un fallo del sistema de bomba.
PREPARACIÓN Y MANEJO
General: Antes de su uso, APIDRA® debe mantenerse a temperatura ambiente por 1 a 2 horas.
APIDRA® soló deberá usarse si la solución es transparente, incolora, sin partículas sólidas visibles y si tiene una consistencia acuosa.
Las instrucciones acerca del uso de APIDRA® mediante una bomba o un aplicador, deben seguirse cuidadosamente.
Un vial, cartuchos o SoloStar vacíos nunca deben ser reutilizados y deben desecharse de forma apropiada.
Viales: Antes de obtener insulina del vial por primera vez, remover la tapa plástica de protección.
No sacudir el vial en forma enérgica ya que esto podría ocasionar formación de espuma. La espuma puede interferir con la correcta medición de la dosis.
Cartuchos: Los cartuchos de APIDRA® no están diseñados para permitir la mezcla de ninguna otra insulina dentro del cartucho.
Si se produce malfuncionamiento del dispositivo de aplicación, la solución puede extraerse del cartucho mediante una jeringa (apropiada para una insulina de 100 UI/mL) e inyectada.
Uso Intravenoso: Para uso intravenoso, APIDRA® deberá utilizarse a una concentración de 1 unidad/mL de insulina glulisina en sistemas de infusión con solución estéril de cloruro de sodio al 0,9% que utilicen bolsa de infusión de Cloruro de PoliVinilo (PVC) con una línea de infusión exclusiva para su administración.
Después de diluida para el uso intravenoso, se deberá inspeccionar la solución visualmente antes de la administración en búsqueda de material particulado o decoloración, siempre y cuando la solución y el contenedor lo permitan. Nunca utilizar la solución si se ha tornado nubosa o contiene partículas; utilizar sólo si está transparente e incolora.
Se ha encontrado que APIDRA® es incompatible con soluciones dextrosadas o de Ringer y, por lo tanto, no puede emplearse con estas soluciones. No se ha estudiado el uso de otras soluciones.
Manejo de los aplicadores (ClikStar, Autopen, SoloStar):
Referirse a los manuales de cada aplicador para obtener instrucciones detalladas acerca de su manejo.
SOBREDOSIS:
Signos y síntomas: Puede ocurrir hipoglucemia como resultado de un exceso de insulina relacionado con la ingesta de alimento, el gasto de energía o ambos,
Tratamiento: Los episodios leves/moderados de hipoglucemia, generalmente, se pueden tratar con carbohidratos orales. Puede ser necesario un ajuste en la dosis del medicamento, de los patrones de alimentación o de la actividad física.
Los episodios severos con coma, convulsiones o daño neurológico se pueden tratar con glucagón intramuscular/subcutáneo o con glucosa concentrada por vía intravenosa. Puede ser necesaria una ingesta sostenida de carbohidratos y someter al paciente a observación dado que la hipoglucemia puede recurrir después de una aparente recuperación clínica.
PRESENTACIONES:
APIDRA® Caja por 1 y 5 cartuchos, Caja por 1 cartucho en SoloStar, (Reg. San. INVIMA 2015M-0004264 R1).
APIDRA® Caja por 1 Vial, (Reg. San.INVIMA 2015M-0004260 R1).
Dispositivos para la aplicación de cartuchos de APIDRA® CLIKSTAR (Reg. San. INVIMA 2010DM-0005521), AutoPen INVIMA 2008DM-0001577. ALLSTAR (Reg. INVIMA 2014DM-0011119).
CCDSV8
SANOFI-AVENTIS DE COLOMBIA S. A.
Transversal 23 No. 97-73, Pisos 8 y 9
Teléfono: 6214400, Fax: 7444237
Bogotá, D.C., Colombia
CONDICIONES DE ALMACENAMIENTO Y VIDA ÚTIL: Almacenamiento: Vial / cartucho/ aplicador descartable para cartucho SoloStar sin abrir: Los viales, cartuchos, y Solo Star de APIDRA® sin abrir deben ser guardados en un refrigerador, 2ºC-8ºC (36ºF – 46°F). APIDRA® no debe ser guardada en el congelador y no se debe permitir que se congele. Desechar si se ha congelado.
Vial/Cartucho/SoloStar abierto (en uso): Los viales, cartuchos y SoloStar de APIDRA® abiertos, refrigerados o no, deben ser utilizados en el término de 28 días. Deben ser desechados si no se los usa dentro de los 28 días. Si no es posible mantenerlos refrigerados, el vial, el cartucho o el SoloStar abiertos pueden mantenerse sin refrigeración hasta por 28 días lejos del calor y la luz directos, siempre que la temperatura no sea superior a 25ºC (77ºF). Una vez que el cartucho ha sido colocado en un aplicador, no debe ser colocado en un refrigerador.
Equipos de infusión: Los equipos de infusión (reservorios, tubos y catéteres) y APIDRA® en el reservorio deben ser eliminados después de no más de 2 días de uso o luego de exposición a temperaturas que exceden los 37ºC (98.6ºF).
Uso intravenoso: Las bolsas de infusión preparadas como se indica en la sección 20, son estables a temperatura ambiente durante 48 horas.
Vida útil: Dos años.
Una vez en uso, el vial, el cartucho o el SoloStar pueden ser guardados hasta por 4 semanas. Esto es aplicable independientemente de si se usan inmediatamente o se tienen como repuesto por un tiempo.