
ATROVENT
IPRATROPIO
Solución para nebulización
Solución para nebulización,
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN: Para ATROVENT® 20 mcg, solución para inhalación presurizada 1 dosis medida (pulsación) contiene 21 mcg.
(8r)-3α-hidroxi-8-isopropil-1αH,5αH-bromuro de tropanio (±)-tropato monohidrato (= bromuro de ipratropio monohidratado) correspondiente a 20 mcg de bromuro de ipratropio anhidro.
Excipientes**:
Propelente: 1,1,1,2-Tetrafluoroetano (HFA [hidrofluoralcano] 134a).
Otros excipientes**: ácido cítrico anhidro, agua purificada, etanol anhidro, nitrógeno (gas inerte).
Para ATROVENT® 0,025%, solución para nebulización 1 mL (20 gotas) de solución para nebulización contiene 261 mcg (8r)-3α-hidroxi-8-isopropil-1αH,5αH-bromuro de tropanio (±)-tropato
monohidrato (= bromuro de ipratropio monohidratado) correspondiente a 250 mcg de bromuro de ipratropio anhidro
Excipientes**: cloruro de benzalconio, edetato disódico dihidratado, cloruro de sodio, ácido clorhídrico, agua purificada.
INDICACIONES: Broncodilatador.
PROPIEDADES FARMACOLÓGICAS:
Grupo farmacoterapéutico: Anticolinérgicos.
Código ATC: R03BB01.
ATROVENT® (bromuro de ipratropio) es un compuesto de amonio cuaternario con propiedades anticolinérgicas (parasimpatolíticas). En estudios no clínicos, parece inhibir los reflejos vagales porque antagoniza la acción de la acetilcolina, el neurotransmisor liberado por el nervio vago. Los anticolinérgicos impiden el aumento de la concentración intracelular de Ca++ provocada por la interacción de la acetilcolina con los receptores muscarínicos del músculo liso bronquial.
La liberación de Ca++ es mediada por el sistema de segundo mensajero que consiste en IP3 (inositol trifosfato) y DAG (diacilglicerol).
La broncodilatación que sigue a la inhalación de ATROVENT® (bromuro de ipratropio) es principalmente local y específica del pulmón; no es de naturaleza sistémica.
Los datos preclínicos y clínicos no sugieren efectos nocivos de ATROVENT® (bromuro de ipratropio) sobre la secreción mucosa de las vías aéreas, la depuración mucociliar o el intercambio de gases
Estudios clínicos; Para ATROVENT® 20 mcg, solución para inhalación presurizada
Los estudios realizados con tratamientos de hasta tres meses en pacientes adultos asmáticos y con EPOC y niños asmáticos, en los cuales se comparó la formulación con HFA y la formulación con CFC han demostrado que ambas formulaciones son equivalentes desde el punto de vista terapéutico.
En estudios comparativos de 90 días en pacientes con broncoespasmo asociado con enfermedad pulmonar obstructiva crónica (bronquitis crónica y enfisema) se observaron mejorías significativas en la función pulmonar dentro de los 15 minutos, que alcanzaron un pico a las 12 horas y persistieron hasta 46 horas.
En estudios comparativos de 90 días en pacientes con broncoespasmo asociado con asma, se observaron mejoras significativas en la función pulmonar (aumentos en el VEF1 del 15%) en el 51% de los pacientes
Para ATROVENT® 0,025%, solución para nebulización: En estudios comparativos de 8590 días en pacientes con broncoespasmo asociado con la enfermedad pulmonar obstructiva crónica (bronquitis crónica y enfisema) se observaron mejorías significativas en la función pulmonar dentro de los 15 minutos, que alcanzaron un pico a las 12 horas y persistieron hasta 46 horas.
Se ha demostrado el efecto broncodilatador de ATROVENT® en el tratamiento del broncoespasmo agudo asociado con asma en estudios en adultos y niños ≥6 años. En la mayoría de estos estudios se administró ATROVENT® en combinación con un betaagonista inhalado.
Si bien los datos son limitados, se ha demostrado que ATROVENT® posee un efecto terapéutico en el tratamiento del broncoespasmo asociado con bronquiolitis viral y displasia broncopulmonar en lactantes y niños muy pequeños.
Farmacocinética:
Absorción: El efecto terapéutico de ATROVENT® se produce por acción local en las vía aéreas. La farmacocinética sistémica no necesariamente se correlaciona con el efecto broncodilatador.
Tras la inhalación, generalmente de 10 al 30% de la dosis se deposita en los pulmones, dependiendo de la formulación y la técnica de inhalación [75-80]. La mayor parte de la dosis es ingerida y pasa al tracto gastrointestinal.
La porción de la dosis que se deposita en los pulmones alcanza la circulación rápidamente (en minutos).
La eliminación renal acumulada (024 horas) del compuesto original se aproxima al 46% tras la administración de una dosis intravenosa, es inferior al 1% tras la administración oral y es aproximadamente del 3 al 13% de una dosis inhalada. Sobre la base de estos datos se estima que la biodisponibilidad sistémica total de las dosis orales e inhaladas de bromuro de ipratropio es del 2% y del 7 al 28% respectivamente.
Teniendo esto en cuenta, las porciones ingeridas de la dosis de bromuro de ipratropio no contribuyen de manera relevante a la exposición sistémica.
Distribución: Se calcularon los parámetros cinéticos que describen la disposición de ipratropio a partir de las concentraciones plasmáticas tras la administración intravenosa. Se observa una rápida declinación bifásica de las concentraciones plasmáticas. El volumen de distribución aparente en equilibrio (Vdss) es aproximadamente de 176 litros (≈ 2,4 L/kg). La unión del fármaco a las proteínas plasmáticas es mínima (menos del 20%). Los datos no clínicos indican que el ipratropio, una amina cuaternaria, no atraviesa la placenta ni la barrera hematoencefálica.
Biotransformación: Tras la administración intravenosa, se metaboliza alrededor del 60% de la dosis, la mayor parte probablemente en el hígado por oxidación.
Los metabolitos conocidos, formados por hidrólisis, deshidratación o eliminación del grupo hidroximetil en la fracción de ácido trópico, muestran muy poca afinidad o ninguna con el receptor muscarínico y deben considerarse inactivos.
Eliminación: La semivida de la fase de eliminación terminal es de alrededor de 1,6 horas.
El ipratropio presenta una depuración total de 2,3 L/min y una depuración renal de 0,9 L/min.
En un estudio de balance de excreción, la excreción renal acumulada (6 días) de la radioactividad relacionada con el fármaco (como compuesto de origen y todos los metabolitos) representó el 72,1% tras la administración intravenosa, el 9,3% tras la administración oral y el 3,2% tras la inhalación. La radioactividad total excretada en las heces fue del 6,3% tras la aplicación intravenosa, del 88,5% luego de la administración oral y del 69,4% después de la inhalación. Con respecto a la excreción de la radioactividad relacionada con el fármaco tras la administración intravenosa, la principal vía de excreción fue la renal. La semivida de eliminación de la radioactividad relacionada con el fármaco (compuesto de origen y metabolitos) es de 3,6 horas.
Toxicología: Se ha investigado exhaustivamente la tolerabilidad local y sistémica del bromuro de ipratropio en varias especies animales y a través de diversas vías de administración.
Toxicidad con dosis única: Se ha investigado la toxicidad aguda inhalatoria, oral e intravenosa en varias especies de roedores y no roedores.
Cuando se administró mediante inhalación, la dosis letal mínima en cobayos machos fue de 199 mg/kg. En las ratas, no se observó mortalidad con las dosis más elevadas técnicamente factibles (es decir, 0,05 mg/kg después de 4 horas de la administración o de 160 pulsaciones de bromuro de ipratropio, 0,02 mg/pulsación.
Los valores de la DL50 oral para el ratón, la rata y el conejo fueron de 1585, 1925 y 1920 mg/kg, respectivamente. Las DL50 intravenosas para el ratón, la rata y el perro fueron, respectivamente, de 13,6; 15,8 y aproximadamente 18,2 mg/kg. Los signos clínicos fueron midriasis, sequedad de la mucosa oral, disnea, temblor, espasmos y/o taquicardia.
Toxicidad con dosis repetidas: Se llevaron a cabo estudios de toxicidad con dosis repetidas en ratas, conejos, perros y en monos Rhesus.
En estudios por vía inhalatoria de hasta 6 meses en ratas, perros y monos Rhesus, la dosis sin efectos adversos observados (NOAEL) fue de 0,38 mg/kg/día [124], 0,18 mg/kg/día y 0,8 mg/kg/día, respectivamente. En el perro se observó sequedad de la mucosa oral y taquicardia. No se observaron lesiones histopatológicas relacionadas con el fármaco en el sistema broncopulmonar ni en ningún otro órgano. En la rata, la NOAEL tras 18 meses de administración oral fue de 0,5 mg/kg/día.
Los estudios de toxicidad inhalatoria con dosis repetidas realizados en ratas hasta 6 meses y en perros hasta 3 meses con otras formulaciones (formulación intranasal, propelente alternativo HFA 134a y formulación con lactosa en polvo) no revelaron información adicional sobre el perfil de toxicidad general del bromuro de ipratropio.
La administración intranasal hasta 6 meses mostró un nivel sin efecto (NOEL) >0,20 mg/kg/día en perros y confirmó los datos de estudios anteriores con administración intranasal hasta 13 semanas. Los estudios de toxicidad con dosis repetidas de bromuro de ipratropio demostraron que los perfiles toxicológicos de la formulación con HFA y la formulación convencional con CFC son similares.
Tolerancia local: La solución acuosa de bromuro de ipratropio (0,05 mg/kg) fue bien tolerada localmente cuando se administró a ratas por vía inhalatoria (administración única durante 4 horas). En estudios de toxicidad con dosis repetidas, el bromuro de ipratropio fue bien tolerado localmente.
Inmunogenicidad: En el cobayo no se han demostrado anafilaxia activa ni reacciones anafilácticas pasivas.
Genotoxicidad y carcinogenicidad: No hubo evidencia de genotoxicidad in vitro (prueba de Ames) ni in vivo (prueba del micronúcleo, prueba de dominancia letal en ratones, ensayo citogenético en células de la médula ósea del hámster chino).
No se demostraron efectos oncógenos ni carcinógenos en estudios a largo plazo realizados en ratones y ratas.
Toxicidad reproductiva y del desarrollo: Se han realizado estudios para investigar la posible influencia del bromuro de ipratropio sobre la fertilidad, la toxicidad fetal y embrionaria, y el desarrollo peri y posnatal en ratones, ratas y conejos.
Las dosis orales elevadas, por ejemplo, de 1000 mg/kg/día en ratas y de 125 mg/kg/día en conejos resultaron maternotóxicas en ambas especies y embrio y fetotóxicas en la rata, en la que se observó disminución del peso fetal. No se observaron malformaciones relacionadas con el tratamiento.
Las dosis más elevadas técnicamente factibles para inhalación de la solución para inhalación presurizada, de 1,5 mg/kg/día en ratas y de 1,8 mg/kg/día en conejos, no mostraron efectos adversos sobre la reproducción.
CONTRAINDICACIONES: ATROVENT® está contraindicado en pacientes con hipersensibilidad conocida a la atropina o a sus derivados (como el principio activo bromuro de ipratropio) o a cualquier otro componente del producto.
EFECTOS SOBRE LA CAPACIDAD DE CONDUCIR VEHÍCULOS U OPERAR MAQUINARIAS: No se han estudiado los efectos sobre la capacidad de conducir vehículos u operar maquinarias. Sin embargo, se debe avisar a los pacientes que pueden experimentar efectos adversos como mareos, alteraciones de la acomodación, midriasis y visión borrosa durante el tratamiento con ATROVENT®. Por lo tanto, se debe recomendar precaución al conducir vehículos u operar maquinarias.
EFECTOS SECUNDARIOS: Muchos de los efectos adversos listados se pueden asignar a las propiedades anticolinérgicas de ATROVENT®. Como sucede con todos los tratamientos inhalatorios, ATROVENT® puede producir síntomas de irritación local. Las reacciones adversas se identificaron a partir de datos obtenidos en ensayos clínicos y de farmacovigilancia durante el período posterior a la aprobación del medicamento.
Los efectos secundarios observados con mayor frecuencia en los ensayos clínicos fueron dolor de cabeza, irritación de garganta, tos, boca seca, trastornos de la motilidad gastrointestinal (incluidos estreñimiento, diarrea y vómitos), náuseas y mareos.
Trastornos del sistema inmune
— hipersensibilidad
— reacción anafiláctica
Trastornos del sistema nervioso
— dolor de cabeza
— mareos
Trastornos oculares
— visión borrosa
— midriasis
— aumento de la presión intraocular
— glaucoma
— dolor ocular
— visión de halos
— hiperemia conjuntival
— edema corneal
— trastornos de la acomodación
Trastornos cardíacos
— palpitaciones
— taquicardia supraventricular
— fibrilación auricular
— aumento de la frecuencia cardíaca
Trastornos respiratorios, torácicos y mediastínicos
— irritación de la garganta
— tos
— broncoespasmo
— broncoespasmo paradójico
— laringoespasmo
— edema faríngeo
— garganta seca
Trastornos gastrointestinales
— boca seca
— náuseas
— trastornos de la motilidad gastrointestinal
— diarrea
— estreñimiento
— vómitos
— estomatitis
— edema de la boca
Trastornos de la piel y del tejido subcutáneo
— erupción
— prurito
— angioedema
— urticaria
Trastornos renales y urinarios
— retención urinaria
INTERACCIONES: La administración concomitante crónica de ATROVENT® inhalación con otros fármacos anticolinérgicos no ha sido estudiada; por lo tanto, no se recomienda la administración concomitante crónica de ATROVENT® con otros anticolinérgicos.
Los betaadrenérgicos y las preparaciones con xantinas pueden intensificar el efecto broncodilatador.
Para ATROVENT® 0,025%, solución para nebulización
El riesgo de glaucoma agudo en pacientes con antecedentes de glaucoma de ángulo estrecho (véase la sección Advertencias y precauciones especiales) puede aumentar cuando se administran simultáneamente bromuro de ipratropio nebulizado y betamiméticos
Fertilidad, embarazo y lactancia:
Embarazo: No se ha establecido la seguridad de ATROVENT® durante el embarazo humano. Los beneficios de la administración de ATROVENT® durante el embarazo confirmado o presunto deben valorarse con respecto a los posibles riesgos para el feto. Los estudios no clínicos no han mostrado efectos embriotóxicos, ni teratogénicos después de la inhalación o de la aplicación intranasal de dosis considerablemente superiores a las recomendadas en seres humanos.
Lactancia: Se desconoce si el bromuro de ipratropio se elimina en la leche materna. Es improbable que el bromuro de ipratropio llegue al lactante en cantidades importantes, especialmente cuando se lo administra por inhalación. Sin embargo, se debe tener precaución cuando se administre ATROVENT® a madres lactantes.
Fertilidad: No se dispone de datos clínicos sobre fertilidad para el bromuro de ipratropio. Los estudios no clínicos realizados con bromuro de ipratropio no mostraron efectos adversos sobre la fertilidad (véase la sección Toxicología).
ADVERTENCIA: La boquilla de plástico ha sido diseñada especialmente para ser usada con ATROVENT® solución para inhalación presurizada a fin de garantizar que siempre reciba la cantidad correcta de medicamento. La boquilla nunca se debe usar con otra solución para inhalación presurizada ni tampoco debe usarse ATROVENT® solución para inhalación presurizada con cualquier otra boquilla que no sea la que se entrega con el producto.
El envase se encuentra presurizado y bajo ningún motivo debe ser abierto por la fuerza ni expuesto a temperaturas que excedan los 50 °C.
Para ATROVENT® 0,025%, solución para nebulización La dosis recomendada debe diluirse con solución fisiológica hasta un volumen final de 34 mL, y nebulizarla e inhalarla hasta acabar la solución. La solución debe diluirse en el momento antes de cada uso; la solución diluida sobrante debe ser descartada.
La administración puede depender del modo de inhalación y de la calidad de la nebulización.
La duración de la inhalación puede controlarse por el volumen de dilución.
ATROVENT® solución para nebulización puede administrarse con una variedad de nebulizadores disponibles comercialmente. En los casos en que se disponga de oxígeno de pared, la mejor forma de administrar la solución es a una velocidad de flujo de 6 a 8 litros por minuto.
ATROVENT® solución para nebulización es adecuada para la inhalación concomitante con la solución para nebulización de los secretomucolíticos MUCOSOLVAN® y BISOLVON® .
ATROVENT® solución para nebulización y cromoglicato disódico solución para nebulización no deben administrarse simultáneamente con el mismo nebulizador, pues podría producirse precipitación.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES: Hipersensibilidad: Pueden producirse reacciones de hipersensibilidad inmediata después de la administración de ATROVENT®, como lo demuestran raros casos de erupción, urticaria, angioedema, edema orofaríngeo, broncoespasmo y anafilaxia.
Broncoespasmo paradójico: Al igual que con otros medicamentos inhalables, existe la posibilidad de que ATROVENT® provoque un espasmo paradójico, cuadro potencialmente fatal. En caso de producirse un espasmo paradójico, debe suspenderse de inmediato el uso de ATROVENT ® y debe utilizarse otra terapia en su reemplazo.
Complicaciones oculares: ATROVENT® debe usarse con precaución en pacientes con predisposición al glaucoma de ángulo estrecho.
Ha habido informes aislados sobre complicaciones oculares (es decir, midriasis, aumento de la presión intraocular, glaucoma de ángulo estrecho, dolor ocular) cuando el bromuro de ipratropio aerosolizado, ya sea solo o en combinación con un agonista beta2-adrenérgico, tomó contacto con los ojos.
El dolor o malestar ocular, visión borrosa, visión de halos o imágenes coloreadas asociados con enrojecimiento ocular por congestión conjuntival y edema corneal, pueden ser signos de glaucoma de ángulo estrecho agudo. En caso de que aparezca cualquiera de estos síntomas, debe iniciarse el tratamiento con gotas mióticas y consultar al especialista de inmediato.
Los pacientes deben recibir información sobre la administración correcta de ATROVENT®.
Para ATROVENT® 20 mcg, solución para inhalación presurizada
Se debe evitar que el vapor entre en los ojos. Dado que la solución para inhalación presurizada se aplica mediante una boquilla y se controla manualmente, el riesgo de que el vapor entre en contacto con los ojos es limitado.
Para ATROVENT® 0,025%, solución para nebulización: Se debe evitar que la solución o el vapor entren en contacto con los ojos. Se recomienda administrar la solución para nebulización mediante una boquilla. Si no se dispone de una boquilla y se usa una máscara para nebulizar, esta debe ajustarse en forma adecuada. Los pacientes que puedan tener predisposición a glaucoma deben ser advertidos específicamente para que protejan sus ojos.
Efectos renales y urinarios: ATROVENT® debe usarse con precaución en pacientes con obstrucción preexistente del tracto de salida urinario (p. ej., hiperplasia prostática u obstrucción del cuello de la vejiga).
Alteraciones de la motilidad gastrointestinal: Los pacientes con fibrosis quística pueden ser más propensos a sufrir trastornos de la motilidad gastrointestinal.
Efectos locales:
ATROVENT® 0,025%, solución para nebulización: Este producto contiene el conservante cloruro de benzalconio y el estabilizante edetato disódico dihidrato. La inhalación de estos componentes puede provocar broncoespasmo en pacientes sensibles con vías aéreas hiperreactivas.
DOSIS Y ADMINISTRACIÓN: La dosis debe adaptarse a los requerimientos individuales y los pacientes deben permanecer bajo supervisión médica durante el tratamiento. Se recomienda no exceder la dosis diaria recomendada durante el tratamiento agudo o el de mantenimiento.
Si el tratamiento no produce una mejoría significativa o si el cuadro del paciente empeora, se debe buscar consejo médico para determinar un nuevo plan de tratamiento. Se debe advertir a los pacientes que consulten al médico de inmediato en caso de presentar disnea aguda o que empeora rápidamente.
Se recomiendan las siguientes dosis: Para ATROVENT® 20 mcg, solución para inhalación presurizada
Tratamiento de mantenimiento:
Adultos y niños > 6 años: 2 dosis medidas (pulsaciones) 4 veces por día.
Dado que la necesidad del aumento de las dosis sugiere que posiblemente se requieran modalidades terapéuticas adicionales, en general no debe excederse una dosis total diaria de 12 pulsaciones
En caso de exacerbación aguda de la enfermedad pulmonar obstructiva crónica puede indicarse el tratamiento con ATROVENT® solución para nebulización
Dado que existe información limitada sobre el uso en niños, ATROVENT® solución para inhalación presurizada debe utilizarse únicamente por consejo médico y bajo la supervisión de un adulto.
Para ATROVENT® 0,025%, solución para nebulización (20 gotas = aproximadamente 1 mL; 1 gota = 0,0125 mg de bromuro de ipratropio anhidro).
Tratamiento de mantenimiento:
Adultos (incluidos los pacientes de edad avanzada) y adolescentes >12 años: 2,0 mL (40 gotas = 0,5 mg de bromuro de ipratropio anhidro) 3 a 4 veces por día.
Niños de 6 a 12 años: Dado que existe información limitada para este grupo etario se recomienda la siguiente dosis solo bajo supervisión médica: 1,0 mL (20 gotas = 0,25 mg de bromuro de ipratropio anhidro) 3 a 4 veces por día
Niños <6 años: Dado que existe información limitada para este grupo etario se recomienda la siguiente dosis solo bajo supervisión médica:
0,41,0 mL (820 gotas = 0,10,25 mg de bromuro de ipratropio anhidro) 3 a 4 veces por día.
Episodios agudos:
Adultos (incluidos los pacientes de edad avanzada) y adolescentes >12 años: 2,0 mL (40 gotas = 0,5 mg de bromuro de ipratropio anhidro); se pueden administrar dosis repetidas hasta que el paciente se encuentre estable. El intervalo de tiempo entre las dosis puede ser determinado por el médico.
Puede administrarse ATROVENT® en combinación con un betaagonista inhalado.
Niños de 6 a 12 años: Dado que existe información limitada para este grupo etario se recomienda la siguiente dosis solo bajo supervisión médica:
1,0 mL (20 gotas = 0,25 mg de bromuro de ipratropio anhidro); se pueden administrar dosis repetidas hasta que el paciente se encuentre estable. El intervalo de tiempo entre las dosis puede ser determinado por el médico.
Puede administrarse ATROVENT® en combinación con un betaagonista inhalado.
Niños <6 años: Dado que existe información limitada para este grupo etario se recomienda la siguiente dosis solo bajo supervisión médica:
0,41,0 mL (820 gotas = 0,10,25 mg de bromuro de ipratropio anhidro); se pueden administrar dosis repetidas hasta que el paciente se encuentre estable. El intervalo de tiempo entre las dosis puede ser determinado por el médico.
Puede administrarse ATROVENT® en combinación con un betaagonista inhalado.
Las dosis diarias que exceden los 2 mg de bromuro de ipratropio anhidro en adultos y adolescentes >12 años y 1 mg en niños ≤12 años deben administrarse bajo supervisión médica.
INSTRUCCIONES DE USO: Lea las instrucciones de uso atentamente para garantizar la correcta administración.
Para ATROVENT® 20 mcg, solución para inhalación presurizada
La administración correcta es fundamental para el éxito del tratamiento.
• Antes de usar por primera vez: Oprima la válvula dos veces antes de comenzar a usar el inhalador.
• Cada vez que lo use, tenga en cuenta lo siguiente:
1. Retire la tapa protectora.
2. Exhale profundamente.
3. Sostenga el inhalador como se muestra en la fig. 1 y ajuste los labios a la boquilla. La flecha y la base del envase deben apuntar hacia arriba.
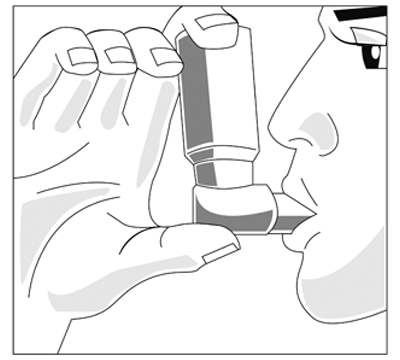
(fig. 1)
4. Inspire tan profundamente como le sea posible y al mismo tiempo presione la base del inhalador, para que libere una dosis medida. Contenga la respiración durante unos pocos segundos, luego retire la boquilla de la boca y exhale. Repita los mismos pasos para realizar una segunda inhalación.
5. Vuelva a colocar la tapa protectora después del uso.
6. Cuando no use el inhalador durante tres días, deberá accionar la válvula una vez.
El recipiente no es trasparente. Por consiguiente, no es posible ver si está vacío. El inhalador contiene 200* pulsaciones. Cuando ya se han usado todas las pulsaciones, puede parecer que el recipiente aún contiene una pequeña cantidad de líquido. No obstante, el inhalador debe ser sustituido porque, de no hacerlo, es posible que no se obtenga la cantidad correcta de medicamento.
La cantidad de medicamento que queda en el inhalador se puede comprobar de la siguiente manera:
— Agitar el inhalador permitirá saber si queda algo de líquido.
— Otra alternativa es separar el recipiente de la boquilla de plástico y ponerlo dentro de un recipiente con agua. El contenido del recipiente se puede estimar observando su posición en el agua.
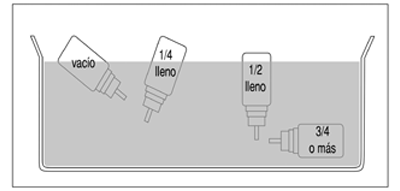
(fig. 2)
— Limpie su inhalador por lo menos una vez por semana.
— Es importante mantener la boquilla del inhalador limpia para garantizar que el medicamento no se acumule y obstruya el vaporizador.
— Para limpiarlo, primero hay que retirar la tapa y luego el recipiente del inhalador. Enjuague haciendo pasar agua caliente a través del inhalador hasta que no quede medicación o suciedad visible.
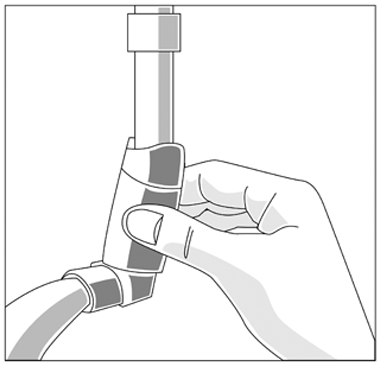
(fig. 3)
— Después de la limpieza sacuda el inhalador y déjelo secar al aire sin usar ningún sistema de secado por calor. Una vez que la boquilla esté seca, vuelva a colocar el recipiente y la tapa de protección.
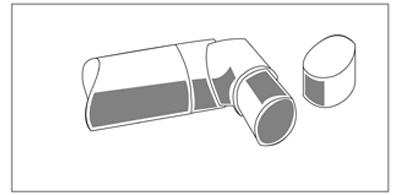
(fig. 4)
SOBREDOSIS: No se han observado síntomas específicos de la sobredosis. En vista del amplio margen terapéutico y debido a la administración tópica de ATROVENT®, no cabe esperar la aparición de síntomas anticolinérgicos graves. Pueden producirse manifestaciones sistémicas menores de la actividad anticolinérgica, como boca seca, trastornos de la acomodación visual y aumento de la frecuencia cardíaca.
PRESENTACIÓN: ATROVENT® HFA: Caja con frasco de acero inoxidable por 10 mL, con válvula dosificadora y boquilla.
(Reg. San. No. INVIMA 2020M-0001838-R2)
ATROVENT® Solución para Inhalar: Caja con un frasco de Vidrio tipo III color ámbar por 20mL, tapón gotero de polietileno de baja densidad y tapa plástica de polipropileno. (Reg. San. No. INVIMA 2021M-000227-R3).
“¡Almacenar en un lugar seguro; fuera del alcance de los niños!
La información de seguridad del producto puede cambiar, consulte la información vigente en la Dirección Médica.
Teléfono: (601) 319 91 00, e-mail: medfora.co@boehringer-ingelheim.com
Carrera 11 No. 84A-09 Piso 5, Bogotá D.C. Colombia.
BOEHRINGER INGELHEIM S.A. Versión 01 del 28 de julio de 2015