
ELIQUIS
APIXABAN
Tabletas recubiertas
Caja , 10, 20 y 6 Tabletas recubiertas , 2.5 Miligramos
Caja , 60, 100 y Tabletas recubiertas , 5 Miligramos
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
INDICACIONES TERAPÉUTICAS
Prevención de ETV: Cirugía de artroplastia de cadera o rodilla: Prevención de eventos tromboembólicos venosos (ETV) en pacientes adultos sometidos a cirugía programada de reemplazo de cadera o rodilla.
Prevención de accidente cerebrovascular y embolia sistémica: Fibrilación auricular no valvular (FANV): ELIQUIS® está indicado para reducir el riesgo de accidente cerebrovascular, embolia sistémica y muerte en pacientes con fibrilación auricular no valvular.
Tratamiento de Tromboembolia Venosa:
ELIQUIS® está indicado para:
• El tratamiento de la trombosis venosa profunda (TVP) y la embolia pulmonar (EP)
• La prevención de trombosis venosa profunda y embolia pulmonar recurrentes.
USO PEDIÁTRICO: No se ha establecido aun la eficacia y seguridad de ELIQUIS® en niños menores de 18 años de edad. No se tienen datos disponibles.
PROPIEDADES FARMACOLÓGICAS
Farmacodinámica: Los efectos farmacodinámicos de apixaban son reflejo del mecanismo de acción (inhibición del FXa). Como resultado de la inhibición de FXa, apixaban prolonga las pruebas de coagulación como el tiempo de protrombina (PT), RNI y el tiempo de tromboplastina parcial activado (aPTT). Los cambios observados en estas pruebas de coagulación a las dosis terapéuticas esperadas son pequeños y están sujetos a un alto grado de variabilidad. No se recomiendan para evaluar los efectos farmacodinámicos de apixaban.
Apixaban también demuestra actividad anti-FXa como se evidencia por la reducción de la actividad de la enzima del Factor Xa en los datos del ensayo cromogénico de heparina Rotachrom® de los estudios clínicos. La actividad anti-FXa exhibe una relación lineal muy directa con la concentración plasmática de apixaban, alcanzado valores máximos en el tiempo de las concentraciones plasmáticas máximas de apixaban. La relación entre la concentración plasmática de apixaban y la actividad anti-FXa es lineal sobre un intervalo amplio de apixaban. Los cambios relacionados con la dosis y la concentración observados después de la administración de apixaban son más pronunciados y menos variables, con una actividad anti-FXa comparada con las pruebas de coagulación.
La Tabla 4 que se encuentra a continuación muestra la exposición del estado de equilibrio previsto y la actividad antiFactor Xa para cada indicación. En los pacientes que toman apixaban para la prevención de ETV luego de una cirugía de reemplazo de rodilla o cadera, los resultados muestran una fluctuación menor a 1,6 veces en los niveles máximos a mínimos. Los pacientes con fibrilación auricular no valvular que toman apixaban para la prevención de accidentes cerebrovasculares y embolia sistémica, los resultados muestran una fluctuación menor a 1,7 veces en los niveles máximos a mínimos. En los pacientes que toman apixaban para el tratamiento de ETV o la prevención de la recurrencia de ETV, los resultados muestran una fluctuación menor a 2,2 veces en los niveles máximos a mínimos.
|
Tabla 4. Exposición del estado de equilibrio previsto del apixaban (ng/mL) y la actividad AntiXa (IU/mL) |
||||
|
Apix. |
Apix. |
Apix. Anti-Xa |
Apix. Anti-Xa Actividad Mín. |
|
|
Mediana [5º, 95º percentiles] |
||||
|
Prevención de ETV: cirugía de artroscopia de cadera o rodilla |
||||
|
2,5 mg BID |
77 [41; 146] |
51 [23; 109] |
1,3 [0,67, 2,4] |
0,84 [0,37; 1,8] |
|
Prevención de accidente cerebrovascular y embolia sistémica: FANV |
||||
|
2,5 mg BID* |
123 [69; 221] |
79 [34; 162] |
1.8 [1,0; 3,3] |
1,2 [0,51, 2,4] |
|
5 mg BID |
171 [91; 321] |
103 [41; 230] |
2.6 [1,4; 4,8] |
1,5 [0,61; 3,4] |
|
Tratamiento de ETV |
||||
|
2,5 mg BID |
67 [30; 153] |
32 [11; 90] |
1,1 [0,47; 2,4] |
0,51 [0,17; 1,4] |
|
5 mg BID |
132 [59; 302] |
63 [22; 177] |
2,1 [0,93; 4,8] |
1,0 [0,35; 2,8] |
|
10 mg BID |
251 [111; 572] |
120 [41; 335] |
4,0 [1,8; 9,1] |
1,9 [0,65; 5,3] |
|
* Población con dosis ajustada con base en 2 de los 3 criterios de reducción de la dosis en el estudio ARISTOTLE. |
||||
Aunque el tratamiento con apixaban no requiere monitoreo de rutina de la exposición, un ensayo cuantitativo calibrado anti-FXa puede ser útil en situaciones en las que el conocimiento de la exposición a apixaban puede ayudar a tomar decisiones clínicas informadas.
Mecanismo de acción: Apixaban es un potente inhibidor de sitio activo altamente selectivo, oral, reversible, directo del factor Xa. No requiere antitrombina III para actividad antitrombótica. Apixaban inhibe el factor Xa libre y unido a coágulos y la actividad de la protrombinasa. Apixaban no tiene efectos directos sobre la agregación de plaquetas, pero indirectamente inhibe la agregación de plaquetas inducidas por la trombina. Mediante la inhibición del factor Xa, apixaban evita la generación de trombina y el desarrollo de trombos. Los estudios preclínicos de apixaban en modelos animales han demostrado eficacia antitrombótica para la prevención de trombosis arterial o venosa a dosis que preservaron la hemostasia.
FARMACOCINÉTICA
Absorción: La biodisponibilidad absoluta de apixaban es aproximadamente 50% para dosis de hasta 10 mg. Apixaban es rápidamente absorbido con concentraciones máximas (Cmax) que aparecen a las 3 a 4 horas después del consumo de la tableta. El consumo con alimento no afecta la ABC o Cmax de apixaban a dosis de 10 mg. Apixaban puede tomarse con o sin alimento. Apixaban demuestra farmacocinética lineal con aumentos proporcionales de la dosis en exposición para dosis orales de hasta 10 mg. A dosis mayores o iguales de 25 mg, apixaban presenta absorción limitada por la disolución con disminución de la biodisponibilidad. Los parámetros de exposición de apixaban muestran variabilidad leve a moderada reflejada por una variabilidad intra e intersujeto de ~20% CV y ~30% CV, respectivamente.
Distribución: La unión a proteínas plasmáticas en humanos es aproximadamente 87%. El volumen de distribución (Vss) es aproximadamente 21 litros.
Metabolismo y eliminación: Apixaban tiene múltiples vías de eliminación. De la dosis administrada de apixaban en humanos, aproximadamente el 25% se recuperó como metabolitos, la mayoría en las heces. La eliminación renal de apixaban equivale a aproximadamente el 27% de la depuración total. Las contribuciones adicionales de eliminación biliar e intestinal directa fueron observadas en estudios clínicos y no clínicos, respectivamente.
Apixaban tiene una depuración total de aproximadamente 3,3 L/h y una vida media de aproximadamente 12 horas.
La O-desmetilación e hidroxilación al metabolito activo 3-Oxopiperidinilo son las formas principales de biotransformación. Apixaban se metaboliza principalmente vía CYP3A4/5 con contribuciones menores de CYP1A2, 2C8, 2C9, 2C19 y 2J2. Apixaban sin cambio es el principal componente relacionado con el fármaco en el plasma humano sin metabolitos de circulación activos presentes. Apixaban es un sustrato de las proteínas transportadoras, Gp-P y la proteína de resistencia del cáncer de mama (BCRP).
Insuficiencia Renal: No existe ningún impacto de la insuficiencia renal sobre la concentración máxima de apixaban. Existió un aumento en la exposición de apixaban correlacionada con la insuficiencia renal, cuando se evaluaba a través de la medición de la depuración de creatinina. En las personas con insuficiencia renal leve (depuración de creatinina 51-80 mL/min), moderada (depuración de creatinina 30-50 mL/min) y severa (depuración de creatinina 15-29 mL/min), las concentraciones plasmáticas de apixaban (ABC) aumentaron en 16, 29 y 44% respectivamente comparada con personas con depuración normal de creatinina. La insuficiencia renal no tiene ningún efecto evidente sobre la relación entre la concentración plasmática de apixaban y la actividad anti-FXa. No es necesario ningún ajuste de la dosis en pacientes con insuficiencia renal leve, moderada o severa, excepto según lo descrito en la Sección Posología y método de administración, Prevención de accidente cerebrovascular y embolia sistémica: FANV.
En sujetos con enfermedad renal terminal (ESRD, por sus siglas en inglés), el AUC de apixaban se incrementó un 36% al administrar una dosis única de apixaban 5 mg inmediatamente después de la hemodiálisis, comparada con la observada en sujetos con función renal normal. La hemodiálisis, iniciada dos horas después de la administración de una sola dosis de apixaban 5 mg, redujo un 14% el AUC en estos sujetos con ESRD, correspondiendo a una eliminación de 18 mL/min de apixaban en la diálisis.
Insuficiencia hepática: Apixaban no se ha estudiado en pacientes con insuficiencia hepática severa o enfermedad hepatobiliar activa. Apixaban no se recomienda en pacientes con insuficiencia hepática severa (ver sección Advertencias y precauciones de utilización, Insuficiencia hepática).
En un estudio que comparaba pacientes con insuficiencia hepática leve y moderada (clasificados como Child Pugh A y B, respectivamente) con pacientes de control sanos, la farmacocinética y farmacodinámica de una única dosis de apixaban 5 mg no se alteraron en los pacientes con insuficiencia hepática. Los cambios en la actividad anti-factor Xa y RNI fueron similares entre los pacientes con insuficiencia hepática leve a moderada y los pacientes sanos. No se requiere ajuste de la dosis en pacientes con insuficiencia hepática leve o moderada; sin embargo, dado el número limitado de pacientes estudiados, se aconseja precaución cuando se utiliza ELIQUIS® en estas poblaciones (ver sección Posología y método de administración, Insuficiencia hepática y Advertencias y precauciones de utilización, Insuficiencia hepática).
Ancianos: Los pacientes ancianos (mayores de 65 años) presentaron concentraciones plasmáticas mayores que los pacientes más jóvenes, con valores medios de ABC de aproximadamente 32% o más. No se requiere ningún ajuste de la dosis.
Sexo: La exposición a apixaban fue aproximadamente 18% mayor en las mujeres que en los hombres. No se requirió ningún ajuste de la dosis.
Origen étnico y raza: Los resultados sobre los estudios de fase 1 no mostraron diferencia discernible en la farmacocinética de apixaban entre pacientes blancos/caucásicos, asiáticos y negros/afroamericanos. Los hallazgos obtenidos de un análisis farmacocinético poblacional en pacientes que recibieron apixaban fueron consistentes con los resultados de la fase 1. No se requirió ningún ajuste de la dosis.
Peso corporal: En una comparación de la exposición a apixaban con respecto a pacientes con peso corporal de 65 a 85 kg, los pacientes con peso corporal >120 kg estuvieron asociados con aproximadamente 30% menos de exposición y el peso corporal <50 kg estuvo asociado con aproximadamente 30% más de exposición. No se requiere ningún ajuste de la dosis, excepto como se describe en la sección Posología y método de administración, Prevención de accidente cerebrovascular y embolia sistémica: FANV.
Relación farmacocinética/farmacodinámica: La relación farmacocinética/farmacodinámica (PK/PD) entre la concentración plasmática de apixaban y varios criterios de valoración de la PD (actividad anti-FXa, RNI, PT, aPTT) se evaluó después de la administración de un intervalo amplio de dosis (0,5-50 mg). La relación entre la concentración plasmática de apixaban y la actividad anti-factor Xa fue descrita mejor por un modelo lineal. La relación entre la PK/PD observada en pacientes que recibieron apixaban en los estudios clínicos Fase 2 y Fase 3 fue consistente con la establecida en pacientes sanos.
CONTRAINDICACIONES: Hipersensibilidad al ingrediente activo o a cualquiera de los excipientes.
Hemorragia activa clínicamente significativa.
EMBARAZO, LACTANCIA Y FERTILIDAD
Embarazo: Existen datos limitados sobre la utilización de apixaban en mujeres embarazadas. Los estudios en animales no indicaron efectos dañinos directos e indirectos con relación a toxicidad para la reproducción. No se recomienda utilizar apixaban durante el embarazo.
Lactancia: Se desconoce si apixaban o sus metabolitos se eliminan en la leche materna. Los datos disponibles en los animales han demostrado eliminación de apixaban en la leche. No se puede excluir un riesgo para los neonatos y lactantes.
Se debe tomar la decisión de interrumpir la lactancia o interrumpir/abstenerse de realizar el tratamiento con apixaban.
Fertilidad: Los estudios en animales administrados directamente con apixaban no mostraron efectos sobre la fertilidad.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y OPERAR MÁQUINAS: ELIQUIS® no tiene influencia o ésta es insignificante sobre la capacidad para conducir y operar máquinas.
Pacientes con prótesis valvulares cardiacas: No se ha estudiado la seguridad y eficacia de ELIQUIS® en pacientes con prótesis valvulares cardiacas, con o sin fibrilación auricular. Por lo tanto, no se recomienda el uso de ELIQUIS® en estas circunstancias.
EP aguda en pacientes hemodinámicamente inestables o pacientes que requieren trombolisis o embolectomía pulmonar:
Tratamiento de ETV: No está recomendado iniciar ELIQUIS® como una alternativa a la heparina no fraccionada para el tratamiento inicial de pacientes con EP que presentan inestabilidad hemodinámica o que pueden recibir trombolisis o embolectomía pulmonar.
EFECTOS ADVERSOS
Experiencia clínica
Prevención de ETV: cirugía de artroscopia de cadera o rodilla: La seguridad de apixaban se ha evaluado en un estudio de fase II y en tres estudios de fase III que incluyeron 5.924 pacientes expuestos a apixaban 2,5 mg dos veces al día que se sometieron a cirugía ortopédica mayor de las extremidades inferiores (de reemplazo de cadera o rodilla programadas) tratados por hasta 38 días.
En total, el 11% de los pacientes tratados con apixaban 2,5 mg dos veces al día experimentaron reacciones adversas. Como sucede con otros anticoagulantes, la hemorragia puede ocurrir durante el tratamiento con apixaban en presencia de factores de riesgo asociados como lesiones dadas a hemorragia. Las reacciones adversas comunes fueron anemia, hemorragia, contusión y náuseas. Las incidencias generales de reacciones adversas de hemorragia, anemia y anormalidades de las transaminasas (por ejemplo concentraciones de alanina aminotransferasa) fueron numéricamente menores en pacientes bajo apixaban comparadas con enoxaparina en estudios de fase II y fase III en cirugía programada de reemplazo de cadera y rodilla. Las reacciones adversas deben interpretarse dentro del entorno quirúrgico.
Como ocurre con cualquier anticoagulante, la utilización de ELIQUIS® puede estar asociada con un aumento en el riesgo de hemorragia oculta o evidente de cualquier tejido u órgano, que puede llevar a anemia post-hemorrágica. Los signos, síntomas y severidad variarán de acuerdo con la ubicación y el grado o nivel de la hemorragia (ver secciones Advertencias y precauciones de utilización, Riesgo de hemorragia y Información de estudios clínicos).
Las reacciones adversas en un estudio de fase II y en tres estudios de fase III se presentan en la Tabla I clasificadas por sistema orgánico (MedDRA) y por frecuencia.
|
Tabla 1. Reacciones adversas debidas al tratamiento presentadas en pacientes después de cirugía ortopédica |
||
|
Frecuentes |
Poco frecuentes |
Raras |
|
Trastornos del sistema sanguíneo y linfático |
||
|
Anemia (incluida anemia postoperatoria y hemorrágica y parámetros respectivos de laboratorio) |
Trombocitopenia (incluidas disminuciones del recuento de plaquetas) |
|
|
Trastornos del sistema inmunitario |
||
|
Hipersensibilidad |
||
|
Trastornos oculares |
||
|
Hemorragia ocular (incluida hemorragia de la conjuntiva) |
||
|
Trastornos vasculares |
||
|
Hemorragia (incluidos hematoma y hemorragia vaginal y uretral) |
Hipotensión (incluida hipotensión durante el procedimiento) |
|
|
Trastornos respiratorios, torácicos y mediastínicos |
||
|
Epistaxis |
Hemoptisis |
|
|
Trastornos gastrointestinales |
||
|
Náuseas |
Hemorragia gastrointestinal (incluidas hematemesis y melena) hematoquecia |
Hemorragia rectal, hemorragia gingival |
|
Trastornos hepatobiliares |
||
|
Aumento de transaminasas (incluida aumento de alanina aminotransferasa y alanina aminotransferasa anormal), aumento de aspartato aminotransferasa, aumento de gamma-glutamiltransferasa, pruebas de la función hepática anormales, aumento de la fosfatasa alcalina sanguínea, aumento de la bilirrubina sanguínea |
||
|
Trastornos musculoesqueléticos y del tejido conectivo |
||
|
Hemorragia muscular |
||
|
Trastornos renales y urinarios |
||
|
Hematuria (incluidos parámetros respectivos de laboratorio) |
||
|
Lesión, envenenamiento y complicaciones del procedimiento |
||
|
Contusión |
Hemorragia después del procedimiento (incluido hematoma postprocedimiento, hemorragia de la herida, hematoma en el sitio de punción del bazo y hemorragia en el sitio del catéter), secreción de la herida, hemorragia en el sitio de incisión (incluido hematoma en el sitio de incisión), hemorragia durante la operación |
|
Prevención de accidente cerebrovascular y embolia sistémica: FANV: La seguridad de apixaban se evaluó en los estudios ARISTOTLE y AVERROES, que incluyeron 11284 pacientes expuestos a apixaban 5 mg dos veces al día y 602 pacientes expuestos a apixaban 2,5 mg dos veces al día. Las exposiciones a apixaban fueron mayores o iguales de 12 meses para 9375 pacientes y mayores o iguales de 24 meses para 3369 pacientes en los dos estudios. En el estudio ARISTOTLE, la duración media de la exposición fue 89,2 semanas para apixaban y 87,5 semanas para warfarina; el total de pacientes año expuestos fue 15534 para apixaban y 15184 para warfarina. En el estudio AVERROES, la duración media de la exposición fue aproximadamente 59 semanas en ambos grupos de tratamiento; el total de pacientes año expuestos fue 3193 para apixaban y 3150 para ácido Acetil Salicílico (ASA).
La tasa total de retiro debido a reacciones adversas fue 1,8% para apixaban y 2,6% para warfarina en el estudio ARISTOTLE, y 1,5% para apixaban y 1,3% para ASA en el estudio AVERROES. La incidencia total de reacciones adversas relacionadas con hemorragia fue numéricamente menor en los pacientes bajo tratamiento con apixaban en comparación con los tratados con warfarina en el estudio ARISTOTLE (24,3% vs 31,0%) y fue similar en pacientes bajo tratamiento con apixaban comparados con ASA en el estudio AVERROES (9,6% vs 8,5%).
Las reacciones adversas en los estudios ARISTOTLE y AVERROES se enumeran en la Tabla 2 por clasificación de sistema de órganos (MedDRA) y por frecuencia. Las asignaciones de frecuencia en la Tabla 2 se basan principalmente en las frecuencias observadas en el estudio ARISTOTLE. Las reacciones adversas observadas en el estudio AVERROES fueron consistentes con las del estudio ARISTOTLE.
|
Tabla 2. Reacciones Adversas Debidas al Tratamiento en Pacientes con FANV |
||
|
Frecuentes |
Poco Frecuentes |
Raras |
|
Trastornos del Sistema Inmunitario |
||
|
Hipersensibilidad (incluida hipersensibilidad medicamentosa como exantema cutáneo y reacción anafiláctica como edema alérgico) |
||
|
Trastornos del Sistema Nervioso |
||
|
Hemorragia cerebral, otras hemorragias intracraneales o intraespinales (incluido hematoma subdural, hemorragia subaracnoide y hematoma espinal) |
|
|
|
Trastornos Oculares |
||
|
Hemorragia Ocular (incluida hemorragia conjuntival) |
||
|
Trastornos Vasculares |
||
|
Otras hemorragias, hematomas |
Hemorragia Intrabd-ominal |
|
|
Trastornos Respiratorios, torácicos y mediastínicos |
||
|
Epístaxis |
Hemoptisis |
Hemorragia de las vías respiratorias (incluida hemorragia alveolopulmonar, hemorragia laríngea y hemorragia faríngea) |
|
Trastornos Gastrointestinales |
||
|
Hemorragia Gastrointestinal (incluida hematemesis y melena), hemorragia rectal, sangrado gingival |
Hemorragia hemorroidal, hematoquecia, hemorragia bucal |
Hemorragia Retroperitoneal |
|
Trastornos Renales y Urinarios |
||
|
Hematuria |
||
|
Trastornos del Sistema Reproductor y de las Mamas |
||
|
Hemorragia vaginal anormal, hemorragia urogenital |
||
|
Trastornos General y Condiciones en el Sitio de Administración |
||
|
Sangrado en el sitio de aplicación |
||
|
Investigaciones |
||
|
Positivo oculto en sangre |
||
|
Lesión, envenenamiento y complicaciones del procedimiento |
||
|
Contusión |
Hemorragia Traumática, hemorragia postprocedimiento, hemorragia en el sitio de incisión |
|
Tratamiento de ETV: La seguridad de apixaban se evaluó en los estudios AMPLIFY y AMPLIFY-EXT, que incluyeron 2676 pacientes expuestos a apixaban 10 mg dos veces al día, 3359 pacientes expuestos a apixaban 5 mg dos veces al día y 840 pacientes expuestos a apixaban 2,5 mg dos veces al día. La duración media de la exposición a apixaban fue de 154 días y la de la exposición a enoxaparina/warfarina fue de 152 días en el estudio AMPLIFY. En el estudio AMPLIFY-EXT, la duración media de la exposición a apixaban fue de aproximadamente 330 días y la de la exposición al placebo fue de 312 días.
En el estudio AMPLIFY, las reacciones adversas relacionadas con hemorragia ocurrieron en 417 (15,6%) de los pacientes tratados con apixaban en comparación con 661 (24,6%) de los pacientes tratados con enoxaparina/warfarina. La tasa de interrupción debido a casos de hemorragia fue del 0,7% en los pacientes tratados con apixaban en comparación con el 1,7% en los pacientes tratados con enoxaparina/warfarina del estudio AMPLIFY.
En el estudio AMPLIFY-EXT, las reacciones adversas relacionadas con hemorragia ocurrieron en 219 (13,3%) de pacientes tratados con apixaban en comparación con 72 (8,7%) de los pacientes tratados con placebo. La tasa de interrupción debido a casos de hemorragia fue de aproximadamente el 1% en los pacientes tratados con apixaban comparado con el 0,4% en aquellos pacientes del grupo placebo del estudio AMPLIFY-EXT.
Las reacciones adversas frecuentes (³1%) fueron la hemorragia gingival, epístaxis, contusión, hematuria, hematoma y menorragia.
Las reacciones adversas en los estudios AMPLIFY y AMPLIFY-EXT se enumeran en la Tabla 3 por clasificación de órganos del sistema MedDRA y por frecuencia.
|
Tabla 3.Reacciones adversas debidas al tratamiento presentadas en pacientes con ETV |
||
|
Frecuentes |
Poco frecuentes |
Raras |
|
Trastornos del sistema sanguíneo y linfático |
||
|
Anemia hemorrágica, diátesis hemorrágica, hematoma espontáneo |
||
|
Trastornos del sistema nervioso |
||
|
Hemorragia cerebral, accidente hemorrágico |
||
|
Trastornos oculares |
||
|
Hemorragia conjuntival |
Hemorragia ocular, hemorragia retiniana, hemorragia escleral, hemorragia vítrea |
|
|
Trastornos del oído y del laberinto |
||
|
Hemorragia del oído |
||
|
Trastornos cardiacos |
||
|
Hemorragia pericárdica |
||
|
Trastornos vasculares |
||
|
Hematoma |
Hemorragia, hematoma intrabdominal, shock hemorrágico |
|
|
Trastornos respiratorios, torácicos y mediastínicos |
||
|
Epístaxis |
Hemoptisis |
Hemorragia alveolar pulmonar |
|
Trastornos gastrointestinales |
||
|
Sangrado gingival |
Hemorragia rectal, hematoquecia, hemorragia hemorroidal, hemorragia gastrointestinal, hematem-esis |
Melena, hemorragia anal, hemorragia de úlcera gástrica, hemorragia bucal, hematoma de la pared abdominal, síndrome Mallory-Weiss, hemorragia gástrica, hemorragia por úlcera péptica, hemorragia del intestino delgado |
|
Trastornos de la piel y tejidos subcutáneos |
||
|
Equimosis, hemorragia cutánea |
Petequia, púrpura, mayor tendencia a sangrar, ampolla de sangre, hemorragia por úlcera de piel |
|
|
Trastornos musculoesqueléticos y del tejido conectivo |
||
|
Hemorragia muscular |
||
|
Trastornos renales y urinarios |
||
|
Hematuria |
Hemorragia del tracto urinario |
|
|
Trastornos del sistema reproductor y de las mamas |
||
|
Menorragia |
Hemorragia vaginal, metrorragia |
Menometrorragia, hemorragia uterina, hemorragia genital, hematoma de mama, hematospermia, hemorragia posmenopáusica |
|
Trastornos generales y afecciones en el lugar de la administración |
||
|
Hematoma en el lugar de la inyección, hematoma en lugar de punción del vaso |
Hemorragia en el lugar de la inyección, hematoma en el lugar de la infusión |
|
|
Investigaciones |
||
|
Presencia de sangre en la orina, examen de orina positivo oculto para sangre |
Sangre oculta, examen de orina positivo para glóbulos rojos |
|
|
Lesión, envenenamiento y complicaciones del procedimiento |
||
|
Contusión |
Hemorragia de la herida, hemorragia posterior al procedimiento, hematoma traumático |
Hematoma periorbital, pseudoaneurisma vascular, hematoma subcutáneo, hematoma del procedimiento, hematoma posterior al procedimiento, hematuria posterior al procedimiento, hematoma extradural, hematoma renal, hemorragia subdural |
INTERACCIÓN CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN
Efecto de otros medicamentos sobre apixaban
Inhibidores de CYP3A4 y Gp-P: La coadministración de apixaban con ketoconazol (400 mg una vez al día), un inhibidor fuerte de CYP3A4 y Gp-P, produjo aumento del doble del ABC promedio de apixaban y un aumento de 1,6 veces de la Cmax promedio de apixaban. No se requiere ningún ajuste de apixaban cuando se administra concomitantemente con ketoconazol, sin embargo apixaban debe utilizarse con precaución en pacientes que reciben tratamiento sistémico concomitante con antimicóticos del tipo azol como por ejemplo ketoconazol u otros inhibidores fuertes de CYP3A4 y Gp-P (ver sección Interacción con inhibidores del Citocromo P450 3A4 (CYP3A4) y glucoproteína P (Gp-P)).
Se espera que los ingredientes activos que no se consideran inhibidores fuertes de CYP3A4 y glicoproteína P (por ejemplo, diltiazem, naproxeno, amiodarona, verapamilo, quinidina) aumenten la concentración plasmática de apixaban a un menor grado.
Por ejemplo, diltiazem (360 mg una vez al día), considerado un inhibidor moderado de CYP3A4 y débil de Gp-P, produjo un aumento de 1,4 veces en la ABC promedio y de 1,3 veces en la Cmax de apixaban. Naproxeno (dosis única de 500 mg), un inhibidor de Gp-P pero no inhibidor de CYP3A4, produjo un aumento de 1,5 veces y 1,6 veces en la ABC y Cmax promedio de apixaban, respectivamente. Ningún ajuste de la dosis para apixaban se requiere cuando se coadministra con inhibidores menos potentes de CYP3A4 y/o Gp-P.
Inductores de CYP3A4 y Gp-P: La coadministración de apixaban con rifampina, un inductor fuerte de CYP3A4 y Gp-P, produjo una disminución aproximada de 54% y 42% en la ABC y Cmax promedio de apixaban, respectivamente. La utilización concomitante de apixaban con otros inductores fuertes de CYP3A4 y Gp-P (por ejemplo fenitoína, carbamazepina, fenobarbital o la Hierba de San Juan) puede también reducir las concentraciones plasmáticas de apixaban. No se requiere ningún ajuste de la dosis de apixaban durante el tratamiento concomitante con dichos agentes, para la prevención de ETV luego de una cirugía de artroscopia de cadera o rodilla o para la prevención de un accidente cerebrovascular y embolia sistémica en pacientes con fibrilación auricular no valvular, sin embargo los inductores fuertes de CYP3A4 y de Gp-P deben coadministrarse con precaución (ver secciones Advertencias y precauciones de utilización, Prevención de ETV: cirugía electiva de reemplazo de cadera o rodilla y Prevención de accidente cerebrovascular y embolia sistémica: FANV).
Para el tratamiento de TVP y EP, no se recomienda el tratamiento concomitante con inductores fuertes de CYP3A4 y Gp-P (ver sección Advertencias y precauciones de utilización, Tratamiento de ETV). Para la prevención de TVP y EP recurrentes, se deben coadministrar con precaución los inductores fuertes de CYP3A4 y Gp-P (ver sección Advertencias y precauciones de utilización, Tratamiento de ETV).
Anticoagulantes, inhibidores de agregación de plaquetas y AINES: Después de la administración combinada de enoxaparina (dosis única de 40 mg) con apixaban (dosis única de 5 mg) se observó un efecto aditivo sobre la actividad anti-factor Xa.
Las interacciones farmacocinéticas o farmacodinámicas no fueron evidentes en pacientes sanos cuando apixaban se coadministró con ácido acetilsalicílico 325 mg una vez al día.
Apixaban coadministrado con clopidogrel (75 mg una vez al día), con la combinación de clopidogrel 75 mg y ácido acetilsalicílico 162 mg una vez al día, o con prasugrel (60 mg seguidos de 10 mg una vez al día) en estudios de fase 1 no mostró ningún aumento relevante en el tiempo de hemorragia, o inhibición adicional de la agregación de plaquetas comparado con la administración de agentes antiplaquetarios sin Apixaban. El aumento de las pruebas de coagulación (PT, RNI y aPTT) fueron consistentes con los efectos de Apixaban solamente.
Naproxeno (500 mg), un inhibidor de Gp-P, produjo en pacientes sanos un aumento 1,5 veces y 1,6 veces en la ABC y Cmax promedio de apixaban, respectivamente. Aumentos correspondientes en las pruebas de coagulación fueron observados para apixaban. Ningún cambio fue observado en el efecto de naproxeno sobre la agregación de plaquetas inducidas por el ácido araquidónico y ninguna prolongación clínicamente relevante del tiempo de hemorragia fue observado después de la administración concomitante de apixaban y naproxeno.
A pesar de estos hallazgos, ELIQUIS® debe utilizarse con precaución cuando se coadministra con AINES (incluido ácido acetilsalicílico) debido a que estos medicamentos típicamente aumentan el riesgo de hemorragia.
No se recomienda la utilización concomitante con ELIQUIS® de agentes asociados con hemorragia seria, como por ejemplo: heparina no fraccionada y derivados de la heparina (incluidas heparinas de bajo peso molecular (HBPM)) oligosacáridos inhibidores del factor Xa (por ejemplo fondaparinux), inhibidores directos de trombina II (por ejemplo desirudin), agentes trombolíticos, antagonistas de receptores GPIIb/IIIa, dipiridamol, dextran, sulfinpirazona, antagonistas de la vitamina K y otros anticoagulantes orales. Debe tenerse en cuenta que la heparina no fraccionada se puede administrar a dosis necesarias para mantener un catéter para vena central o arterial permeable (ver sección Advertencias y precauciones de utilización, Interacción con otros medicamentos que afectan la hemostasia).
En pacientes con fibrilación auricular y una condición que justifique monoterapia o terapia dual antiplaquetaria, deberá realizarse una cuidadosa evaluación de los posibles beneficios con relación a los posibles riesgos antes de combinar esta terapia con ELIQUIS® (ver sección Advertencias y precauciones de utilización, Interacción con otros medicamentos que afectan la hemostasia).
Otros tratamientos concomitantes: Ninguna interacción farmacocinética o farmacodinámica clínicamente relevante se observó cuando apixaban se coadministraba con atenolol o famotidina. La coadministración de apixaban 10 mg con atenolol 100 mg no presentó efecto clínicamente relevante sobre la farmacocinética de apixaban. Después de la administración simultánea de los dos medicamentos, la ABC y Cmax promedio de apixaban fueron 15% y 18% menores que cuando se administraban solos. La administración de apixaban 10 mg con famotidina 40 mg no tuvo ningún efecto sobre la ABC o Cmax de apixaban.
Parámetros de laboratorio: Las pruebas de coagulación (por ejemplo PT, RNI y aPTT) se afectan de la manera esperada por el mecanismo de acción de apixaban (ver sección Propiedades farmacológicas, Mecanismo de acción). Los cambios observados en estas pruebas de coagulación a las dosis terapéuticas previstas son pequeños y están sujetos a gran variabilidad (ver sección Propiedades farmacológicas, Farmacodinámica).
Población pediátrica: Los estudios de interacción se han realizado únicamente en adultos.
Efectos de apixaban sobre otros medicamentos: Los estudios in vitro de apixaban no mostraron ningún efecto inhibitorio sobre la actividad de CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2D6 o CYP3A4 (CI50>45 µM) y un efecto inhibitorio débil sobre la actividad de CYP2C19 (CI50>20 µM) a concentraciones que son significativamente mayores que las concentraciones plasmáticas máximas observadas en los pacientes. Apixaban no indujo CYP1A2, CYP2B6, CYP3A4/5 hasta una concentración de 20 µM. Por lo tanto, no se espera que apixaban altere la depuración metabólica de los medicamentos coadministrados que se metabolizan por estas enzimas. Apixaban no es un inhibidor significativo de Gp-P.
En estudios realizados en pacientes sanos, como se describe a continuación, apixaban no alteró significativamente la farmacocinética de digoxina, naproxeno o atenolol.
Digoxina: La coadministración de apixaban (20 mg una vez al día) y digoxina (0,25 mg una vez al día), un sustrato de Gp-P, no afectó las ABC o Cmax de digoxina. Por lo tanto apixaban no inhibe el transporte de sustancias mediadas por Gp-P.
Naproxeno: La coadministración de dosis única de apixaban (10 mg) y naproxeno (500 mg), un AINE utilizado comúnmente, no presentó ningún efecto sobre la ABC o Cmax de naproxeno.
Atenolol: La coadministración de una única dosis de apixaban (10 mg) y atenolol (100 mg), un betabloqueante común, no alteró la farmacocinética de atenolol.
INFORMACIÓN DE ESTUDIOS CLÍNICOS
Prevención de ETV: cirugía de artroscopia de cadera o rodilla: El programa clínico de apixaban se diseñó para demostrar la eficacia y seguridad de apixaban para la prevención de la ETV en un intervalo amplio de pacientes adultos sometidos a reemplazo programado de cadera o rodilla. Un total de 8.464 pacientes fueron asignados aleatoriamente en dos estudios pivotales, doble enmascarados, multinacionales que comparaban a apixaban 2,5 mg administrado oralmente dos veces al día o enoxaparina 40 mg una vez al día. Incluidos en ese total estuvieron 1.262 pacientes de 75 años o más, 1.004 pacientes con bajo peso corporal (=60 kg), 1.495 pacientes con BMI =33 kg/m2 y 437 pacientes con insuficiencia renal severa o moderada. El estudio ADVANCE-3 incluyó 5.407 pacientes sometidos a reemplazo programado de cadera y el estudio ADVANCE-2 incluyó 3.057 pacientes sometidos a reemplazo programado de rodilla. Los pacientes recibieron apixaban 2,5 mg administrados vía oral dos veces al día (po bid) o enoxaparina 40 mg administrada subcutáneamente una vez al día (sc od). La primera dosis de apixaban fue administrada 12 a 24 horas después de la cirugía, mientras que la enoxaparina se inicio 9 a 15 horas antes de la cirugía. Tanto apixaban como enoxaparina fueron administradas durante 32-38 días en el estudio ADVANCE-3 y durante 10-14 días en el estudio ADVANCE-2.
Apixaban demostró reducción estadísticamente superior en el criterio de valoración principal, una variable compuesta de total ETV/muerte por cualquier causa y en el criterio de valoración ETV Mayor, una variable compuesta de ETV proximal, PE no mortal y muerte relacionada con ETV, comparada con enoxaparina tanto en cirugías programadas en reemplazo de cadera como de rodilla (ver Tabla 5).
|
Tabla 5: Resultados de eficacia de estudios pivotales de fase III |
||||||
|
Estudio |
ADVANCE-3 (cadera) |
ADVANCE-2 (rodilla) |
||||
|
Tratamiento del estudio |
Apixaban |
Enoxaparina |
Valor p |
Apixaban |
Enoxaparina |
Valor p |
|
Dosis |
2,5 mg po bid |
40 mg sc od |
2,5 mg po bid |
40 mg sc od |
||
|
Duración del tratamiento |
35 ± 3 d |
35 ± 3 d |
12 ± 2 d |
12 ± 2 d |
||
|
ETV total/muerte por cualquier causa |
||||||
|
Número de eventos/pacientes |
27/1949 |
74/1917 |
<0,0001 |
147/976 |
243/997 |
<0,0001 |
|
Tasa de eventos |
1,39% |
3,86% |
15,06% |
24,37% |
||
|
Riesgo relativo |
0,36 |
0,62 |
||||
|
IC 95% |
(0,22, 0,54) |
(0,51, 0,74) |
||||
|
ETV Mayor |
||||||
|
Número de eventos/pacientes |
10/2199 |
25/2195 |
0,0107 |
13/1195 |
26/1199 |
0,0373 |
|
Tasas de eventos |
0,45% |
1,14% |
1,09% |
2,17% |
||
|
Riesgo relativo |
0,40 |
0,50 |
||||
|
IC 95% |
(0,15, 0,80) |
(0,26, 0,97) |
||||
Los criterios de valoración de la seguridad de la hemorragia mayor, la variable compuesta de hemorragia mayor y no mayor clínicamente relevante (HNMCR) y todas las hemorragias demostraron tasas similares para pacientes con apixaban 2,5 mg comparados con los tratados con enoxaparina 40 mg (ver Tabla 6). Todos los criterios de hemorragia incluyeron hemorragia en el sitio quirúrgico.
En los estudios de Fase III, la hemorragia se evaluó empezando con la primera dosis del medicamento del estudio doble enmascarado, que fue enoxaparina o placebo inyectable administrados 9 a 15 horas antes de la cirugía. La hemorragia durante el periodo de tratamiento incluyó eventos que ocurrían antes de la primera dosis de apixaban, que fue administrada 12-24 horas después de la cirugía. La hemorragia durante el periodo de tratamiento después de la cirugía únicamente incluyó eventos que ocurrían después de la primera dosis del medicamento del estudio después de la cirugía. Más de la mitad de las ocurrencias de hemorragias mayores en el grupo de apixaban ocurrieron antes de la primera dosis de apixaban. La Tabla 6 muestra los resultados para hemorragia obtenidos en el periodo de tratamiento y el periodo de tratamiento después de la cirugía.
|
Tabla 6. Resultados para hemorragia obtenidos en los estudios pivotales de fase III* |
||||
|
ADVANCE-3 |
ADVANCE-2 |
|||
|
Apixaban |
Enoxaparina |
Apixaban |
Enoxaparina |
|
|
Total tratados |
n=2673 |
n=2659 |
n=1501 |
n=1508 |
|
Periodo de Tratamiento |
||||
|
Mayor |
22 (0,8%) |
18 (0,7%) |
9 (0,6%) |
14 (0,9%) |
|
Mortal |
0 |
0 |
0 |
0 |
|
Mayor + HNMCR |
129 (4,8%) |
134 (5,0%) |
53 (3,5%) |
72 (4,8%) |
|
Todos |
313 (11,7%) |
334 (12,6%) |
104 (6,9%) |
126 (8,4%) |
|
Periodo de tratamiento después de la cirugía |
||||
|
Mayor |
9 (0,3%) |
11 (0,4%) |
4 (0,3%) |
9 (0,6%) |
|
Mortal |
0 |
0 |
0 |
0 |
|
Mayor + HNMCR |
96 (3,6%) |
115 (4,3%) |
41 (2,7%) |
56 (3,7%) |
|
Todos |
261 (9,8%) |
293 (11,0%) |
89 (5,9%) |
103 (6,8%) |
|
*Todos los criterios para hemorragia incluyeron hemorragia en el sitio quirúrgico |
||||
Prevención de accidente cerebrovascular y embolia sistémica: FANV: El programa clínico fue diseñado para demostrar la eficacia y seguridad de apixaban para la prevención de accidente cerebrovascular y embolia sistémica en pacientes aptos para AVK (ARISTOTLE) y en pacientes aptos para AVK (AVERROES). Ambos estudios fueron ensayos multinacionales, de grupo paralelo, doble enmascarados, aleatorizados, controlados con activo (vs warfarina en el estudio ARISTOTLE y vs ASA en el estudio AVERROES), en pacientes con fibrilación auricular (FA) no valvular, persistente, paroxística o permanente o aleteo auricular (AA) y uno o más de los siguientes factores de riesgo:
• Accidente cerebrovascular o ataque isquémico transitorio (AIT) previo (también embolia sistémica previa en el estudio ARISTOTLE).
• Edad =75 años.
• Hipertensión arterial que requiere tratamiento.
• Diabetes mellitus.
• Insuficiencia cardiaca =Clase 2 según la Asociación del Corazón de Nueva York.
• Disminución de la fracción de eyección ventricular izquierda (FEVI).
• Arteriopatía periférica documentada (únicamente en el estudio AVERROES).
|
Tabla 7. Características Demográficas de los Pacientes en los estudios clínicos |
||
|
ARISTOTLE |
AVERROES |
|
|
Pacientes Aleatorizados |
18201 |
5598 |
|
Media de la Edad |
69,1 |
69,9 |
|
=65 años |
69,9% |
69,3% |
|
=75 años |
31,2% |
33,8% |
|
Sexo |
||
|
Masculino |
64,7% |
58,5% |
|
Femenino |
35,3% |
41,5% |
|
Raza |
||
|
Blanca/Caucásica |
82,6% |
78,6% |
|
Asiática |
14,5% |
19,4% |
|
Negra/Afroamericana |
1,2% |
0,6% |
|
Accidente cerebrovascular o AIT previo |
18,6% |
13,6% |
|
Hipertensión |
87,4% |
86,4% |
|
Diabetes |
25,0% |
19,6% |
|
Insuficiencia Cardíaca |
(o FEVI =40%) 35,4% |
(o FEVI =35%) 33,7% |
|
Puntaje CHADS2 Medio |
2,1 |
2,0 |
|
CHADS2 =1 |
34,0% |
38,3% |
|
CHADS2=2 |
35,8% |
35,2% |
|
CHADS2 =3 |
30,2% |
26,5% |
Estudio ARISTOTLE: Los pacientes fueron asignados aleatoriamente a tratamiento con apixaban 5 mg dos veces al día vía oral (o 2,5 mg dos veces al día en algunos pacientes seleccionados, 4,7%) o al tratamiento con warfarina (intervalo de RNI objetivo 2,0-3,0) y se sometieron a seguimiento durante un tiempo medio de 89,86 semanas para apixaban y 87,79 semanas para warfarina. La dosis de 2,5 mg dos veces al día de apixaban se asignó a pacientes con al menos 2 de las siguientes características: edad mayor o igual a 80 años, peso corporal menor o igual a 60 Kg, o creatinina sérica mayor o igual a 1,5 mg/dL (133 micromoles/L). 43% fueron tratados por primera vez con AVK, definidos como pacientes que no habían recibido previamente o que habían recibido 30 o menos días de tratamiento consecutivo con warfarina u otro AVK. La arteriopatía coronaria se observó en 33,2% de los pacientes.
Para los pacientes asignados aleatoriamente a warfarina, la mediana porcentual del tiempo en el intervalo terapéutico (RNI 2-3) fue 66%.
El objetivo principal del estudio fue determinar si apixaban 5 mg dos veces al día (o 2,5 mg dos veces al día en pacientes seleccionados) era no inferior a warfarina para la prevención del accidente cerebrovascular (isquémico, hemorrágico o no específico) y la embolia sistémica. Las evaluaciones de superioridad de apixaban versus warfarina fueron también preestablecidas para el criterio de valoración principal y para muerte debida a cualquier causa.
Los criterios de valoración principales del estudio fueron preespecificados y evaluados de una forma secuencial y jerárquica para conservar un error total tipo 1. Apixaban se sometió a prueba para compararlo con warfarina con respecto a: (1) no inferioridad con relación al criterio de valoración compuesto de accidente cerebrovascular y embolia sistémica, (2) superioridad sobre el criterio de valoración compuesto de accidente cerebrovascular y embolia sistémica, (3) superioridad con respecto a hemorragia mayor y (4) superioridad con respecto a muerte por cualquier causa.
En el estudio, apixaban logró superioridad estadísticamente significativa en el criterio de valoración principal de prevención de accidente cerebrovascular (hemorrágico o isquémico) y embolia sistémica (ver Tabla 8 y Figura 1). La superioridad estadísticamente significativa fue alcanzada también para muerte por cualquier causa (ver Tabla 8). Se observaron reducciones numéricas de las muertes CV y no CV.
Apixaban redujo la incidencia de accidente cerebrovascular en comparación con warfarina dentro de cada categoría de severidad de accidente cerebrovascular, incluidos los accidentes cerebrovasculares menos severos (puntaje en la escala de Rankin 0 a 2, HR=0,89 [IC=0,64, 1,26]) y los accidentes cerebrovasculares fatales o discapacitantes clínicamente más importantes (calificadas con puntajes de Rankin de 3 a 6, HR=0,71 [IC=0,54, 0,94]). La reducción en la incidencia de accidente cerebrovascular y embolia sistémica fue observada sin importar el riesgo de accidente cerebrovascular al ingreso según se categorizó utilizando el puntaje CHADS2.
|
Tabla 8. Criterios de Valoración Principales de Eficacia en Pacientes con Fibrilación Auricular en el Estudio ARISTOTLE |
||||
|
Apixaban |
Warfarina |
Razón de Peligro |
Valor p |
|
|
n (%/año) |
n (%/año) |
|||
|
Accidente cerebrovascular o embolia sistémica* |
212 (1,27) |
265 (1,60) |
0,79 (0,66, 0,95) |
0,0114 |
|
Accidente cerebrovascular |
||||
|
Isquémica o no determinada |
162 (0,97) |
175 (1,05) |
0,92 (0,74, 1,13) |
|
|
Hemorrágica |
40 (0,24) |
78 (0,47) |
0,51 (0,35, 0,75) |
|
|
Embolia Sistémica |
15 (0,09) |
17 (0,10) |
0,87 (0,44, 1,75) |
|
|
Muerte por Cualquier Causa*† |
603 (3,52) |
669 (3,94) |
0,89 (0,80, 1,00) |
0,0465 |
|
* Evaluada mediante la estrategia de prueba secuencial para superioridad diseñada para controlar el error total tipo 1 en el ensayo. † Criterio de Valoración Secundario Los eventos asociados a cada criterio de valoración fueron contados uno por paciente, pero los pacientes pueden haber contribuido con eventos a múltiples criterios de valoración. |
||||
La tasa de infarto de miocardio fue similar entre los grupos de tratamiento con apixaban y warfarina (0,53%/año y 0,61%/año, respectivamente).
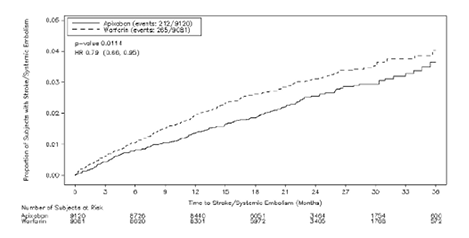
Figura 1. Estimado del Tiempo Hasta el Primer Accidente Cerebrovascular o Embolia Sistémica Utilizando la Curva de Kaplan-Meier para el Estudio ARISTOTLE.
Los centros fueron clasificados post hoc por el porcentaje de tiempo que los pacientes tratados con warfarina estuvieron en el intervalo terapéutico (RNI 2-3). En la Tabla 9 se presentan los resultados para accidente cerebrovascular/embolia sistémica, hemorragias mayores y muerte por cualquier causa para los centros que se encontraron por encima y por debajo del nivel medio del control RNI. Los beneficios de apixaban con respecto a warfarina fueron consistentes en los pacientes incluidos en los centros con control RNI por debajo o por encima de la mediana.
|
Tabla 9: Control RNI en los Centros para el Estudio ARISTOTLE |
||
|
Centros con control RNI por debajo de la mediana de 66% Razón de Peligro (Intervalo de confianza del 95%) |
Centros con control RNI por encima de la mediana de 66% Razón de Peligro (Intervalo de confianza del 95%) |
|
|
Accidente cerebrovascular/embolia sistémica |
0,78 (0,62, 0,98) |
0,81 (0,61, 1,08) |
|
Hemorragia Mayor |
0,56 (0,45, 0,70) |
0,82 (0,68, 1,00) |
|
Muerte por cualquier causa |
0,86 (0,74, 1,00) |
0,93 (0,79, 1,10) |
Estudio AVERROES: Los pacientes fueron asignados aleatoriamente para tratamiento con apixaban 5 mg dos veces al día vía oral (o 2,5 mg dos veces al día en algunos pacientes seleccionados, 6,4%) o al tratamiento con 81 mg a 324 mg de ASA una vez al día. La selección de una dosis de ASA de 81, 162, 243 o 324 mg fue a discreción del investigador y al momento de la asignación aleatoria 90,5% de los pacientes recibían una dosis de 81 mg (64,3%) o 162 mg (26,2%).
En el estudio, el tratamiento con AVK se había intentado pero se interrumpió en 40% de los pacientes antes de su inclusión en el estudio. Las razones frecuentes para que un paciente no fuera apto para un tratamiento con AVK en el estudio AVERROES incluyeron incapacidad/improbabilidad para obtener las RNI a los intervalos solicitados (42,6%), rechazo de los pacientes al tratamiento con AVK (37,4%), puntaje CHADS2 = 1 y no recomendación por parte del médico de AVK (21,3%), no disposición del paciente para adherirse a las instrucciones de medicación con AVK (15,0%) y dificultad/posible dificultad para contactar al paciente en caso de un cambio de dosis urgente (11,7%).
El objetivo principal del estudio fue determinar si apixaban 5 mg dos veces al día (o 2,5 mg dos veces al día en pacientes seleccionados) era superior a ASA (81 mg-324 mg QD) para prevenir el criterio de valoración compuesto de accidente cerebrovascular o embolia sistémica. Las evaluaciones de superioridad de apixaban versus ASA fueron también preestablecidas para eventos vasculares mayores (criterio de valoración compuesto de accidente cerebrovascular, embolia sistémica, infarto del miocardio o muerte vascular) y para muerte debida a cualquier causa.
El estudio AVERROES fue interrumpido de manera anticipada por recomendación del Comité de Monitoreo de Datos independiente del ensayo que determinó que un análisis provisional preestablecido reveló evidencia clara de que apixaban producía una reducción clínicamente importante de accidente cerebrovascular y embolia sistémica y un perfil de seguridad aceptable.
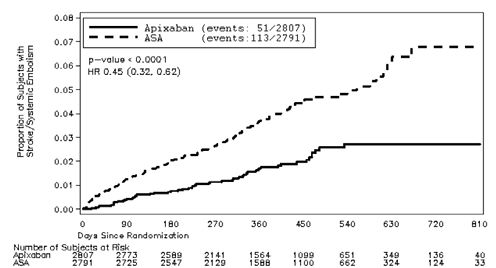
En el estudio, apixaban demostró superioridad estadísticamente significativa en el criterio de valoración principal de prevención de accidente cerebrovascular (hemorrágica o isquémica) y embolia sistémica (ver Tabla 10 y Figura 2). Se observó una reducción clínicamente importante en el criterio de valoración compuesto secundario de accidente cerebrovascular, embolia sistémica, infarto de miocardio o muerte vascular (ver Tabla 10).
Apixaban redujo la incidencia de accidente cerebrovascular comparado con ASA dentro de cada categoría de severidad de accidente cerebrovascular (Puntaje en la escala modificada de Rankin 0 a 2, HR=0,51 [IC=0,29, 0,91]; puntaje en la escala modificada de Rankin de 3 a 6, HR=0,43 [IC=0,28, 0,65]). La reducción en la incidencia de accidente cerebrovascular se observó sin importar el riesgo de accidente cerebrovascular al ingreso al estudio según se categorizó utilizando el puntaje CHADS2.
Apixaban también redujo la incidencia de hospitalizaciones cardiovasculares con respecto a ASA (HR =0,79, IC=0,69, 0,91).
|
Tabla 10. Criterios de Valoración Principales de Eficacia en Pacientes con Fibrilación Auricular para el Estudio AVERROES |
||||
|
Apixaban |
ASA |
Razón de Peligro (IC 95%) |
Valor p |
|
|
n (%/año) |
n (%/año) |
|||
|
Accidente cerebrovascular o embolia sistémica* |
51 (1,62) |
113 (3,63) |
0,45 (0,32, 0,62) |
<0,0001 |
|
Accidente cerebrovascular |
||||
|
Isquémica o no determinada |
43 (1,37) |
97 (3,11) |
0,44 (0,31, 0,63) |
|
|
Hemorrágica |
6 (0,19) |
9 (0,28) |
0,67 (0,24, 1,88) |
|
|
Embolia Sistémica |
2 (0,06) |
13 (0,41) |
0,15 (0,03, 0,68) |
|
|
Accidente cerebrovascular o embolia sistémica, IM, o muerte vascular* |
132 (4,21) |
197 (6,35) |
0,66 (0,53, 0,83) |
0,003 |
|
Infarto de Miocardio |
24 (0,76) |
28 (0,89) |
0,86 (0,50, 1,48) |
|
|
Muerte Vascular |
84 (2,65) |
96 (3,03) |
0,87 (0,65, 1,17) |
|
|
Muerte por Cualquier Causa*† |
111 (3,51) |
140 (4,42) |
0,79 (0,62, 1,02) |
0,068 |
|
* Evaluada mediante la estrategia de prueba secuencial diseñada para controlar el error total tipo 1 en el ensayo. † Criterio de Valoración Secundario. Los eventos asociados a cada criterio de valoración fueron contados uno por paciente, pero los pacientes pueden haber contribuido con eventos a múltiples criterios de valoración. |
||||
Figura 2: Estimado del Tiempo Hasta el Primer Accidente Cerebrovascular o Embolia Sistémica Utilizando la Curva de Kaplan-Meier para el Estudio AVERROES.
Hemorragia en Pacientes con Fibrilación Auricular: En los estudios ARISTOTLE y AVERROES, el criterio de valoración principal de seguridad fue la hemorragia mayor, que se definió como hemorragia aguda clínicamente evidente que estaba acompañada por una o más de las siguientes características: Disminución de la hemoglobina de 2 g/dL o más; trasfusión de 2 o más unidades de concentrado de eritrocitos; hemorragia que ocurre en al menos uno de los siguientes sitios críticos, intracraneal, intraespinal, intraocular (dentro del cuerpo del ojo; por lo tanto, una hemorragia conjuntival no es una hemorragia intraocular), pericardica, intrarticular, intramuscular con síndrome compartimental, retroperitoneal; hemorragia que es fatal. La hemorragia intracraneal incluida la intracerebral (incluso accidente cerebrovascular hemorrágico), subaracnoide y subdural.
La hemorragia no mayor clínicamente relevante (HNMCR) fue definida como hemorragia aguda clínicamente evidente que no satisface los criterios adicionales requeridos para evento hemorrágico como para definirla como evento hemorrágico mayor y satisface al menos uno de los siguientes criterios: hospitalización por hemorragia; tratamiento médico o quirúrgico para hemorragia guiado por un médico; cambio en el tratamiento antitrombótico (tratamiento anticoagulante o antiplaquetario).
Estudio ARISTOTLE: Existió también una reducción estadísticamente superior en la incidencia de hemorragia mayor según la Sociedad Internacional de Trombosis y Hemostasia (ISTH) entre los grupos de tratamiento de apixaban y warfarina (ver Tabla 11). Existió también una reducción sustancial en la incidencia de hemorragia mayor según ISTH + HNMCR y todas las hemorragias.
|
Tabla 11. Eventos Hemorrágicos en Pacientes con Fibrilación Auricular para el Estudio ARISTOTLE |
||||
|
Apixaban |
Warfarina |
Razón de Peligro |
Valor p |
|
|
N=9088 |
N=9052 |
(IC 95%) |
||
|
n (%/año) |
n (%/año) |
|||
|
Mayor* |
327 (2,13) |
462 (3,09) |
0,69 (0,60, 0,80) |
<0,0001 |
|
Fatal |
10 (0,06) |
37 (0,24) |
||
|
Intracraneal |
52 (0,33) |
122 (0,80) |
||
|
Mayor + HNMCR |
613 (4,07) |
877 (6,01) |
0,68 (0,61, 0,75) |
<0,0001 |
|
Todas |
2356 (18,1) |
3060 (25,8) |
0,71 (0,68, 0,75) |
<0,0001 |
|
* Evaluada mediante la estrategia de prueba secuencial para superioridad diseñada para controlar el error total tipo 1 en el ensayo. Los eventos asociados a cada criterio de valoración fueron contados uno por paciente, pero los pacientes pueden haber contribuido con eventos a múltiples criterios de valoración. |
||||
La hemorragia intracraneal se redujo más del 50% con apixaban. La hemorragia severa según la escala GUSTO y la hemorragia mayor según la escala TIMI se redujeron en más del 40% con apixaban. La hemorragia fatal se redujo en más del 70% con apixaban.
La interrupción del tratamiento debido a hemorragia relacionada con reacciones adversas ocurrió en 1,7% y 2,5% de los pacientes tratados con apixaban y warfarina, respectivamente.
La incidencia de hemorragias gastrointestinales mayores según ISTH (incluidas hemorragias GI superiores, GI inferiores y rectales) fue menor con apixaban (0,76%/año) comparada con warfarina (0.86%/año).
La incidencia de hemorragia intraocular mayor según ISTH fue superior con apixaban (0,18%/año) comparada con warfarina (0,13%/año).
Estudio AVERROES: Existió un aumento en la incidencia de hemorragia mayor entre los grupos de tratamiento de apixaban y ASA, que no fue estadísticamente significativa (ver Tabla 12). La frecuencia de hemorragia fatal e intracraneal fue similar en los dos grupos de tratamiento.
|
Tabla 12. Eventos Hemorrágicos en Pacientes con Fibrilación Auricular para el estudio AVERROES |
||||
|
Apixaban |
ASA |
Razón de Peligro (IC 95%) |
Valor p |
|
|
N=2798 |
N=2780 |
|||
|
n (%/año) |
n (%/año) |
|||
|
Mayor |
45 (1,41) |
29 (0,92) |
1,54 (0,96, 2,45) |
0,0716 |
|
Fatal |
5 (0,16) |
5 (0,16) |
||
|
Intracraneal |
11 (0,34) |
11 (0,35) |
||
|
Mayor + HNMCR |
140 (4,46) |
101 (3,24) |
1,38 (1,07, 1,78) |
0,0144 |
|
Todas |
325 (10,85) |
250 (8,32) |
1,30 (1,10, 1,53) |
0,0017 |
|
Los eventos asociados a cada criterio de valoración fueron contados uno por paciente, pero los pacientes pueden haber contribuido con eventos a múltiples criterios de valoración. |
||||
La interrupción del tratamiento debido a reacciones adversas relacionadas con hemorragia ocurrió en 1,5% y 1,3% de los pacientes tratados con apixaban y ASA, respectivamente.
Análisis Subpoblacional: En el estudio ARISTOTLE, los resultados para los criterios de valoración principal de eficacia y los resultados para hemorragia mayor fueron en general consistentes sobre todos los subgrupos principales incluida la edad, el peso, el puntaje CHADS2, el estado de utilización por primera vez de warfarina, el grado de insuficiencia renal, la asignación a apixaban a dosis reducida y ASA al momento de la asignación aleatoria (ver Figura 3).
De manera similar, en el estudio AVERROES, los resultados para el criterio de valoración principal de eficacia y los resultados para hemorragia mayor fueron consistentes para todos los subgrupos principales incluida la edad, el puntaje CHADS2, grado de insuficiencia renal y la utilización previa de AVK o el rechazo de AVK (ver Figura 4).
De manera notoria, los resultados para eficacia y seguridad para ambos estudios en los pacientes ancianos (incluidos los =75 años) fueron consistentes con la población general.
Figura 3: Razones de Peligro para Accidente Cerebrovascular y Embolia Sistémica (A) y Hemorragia (B) por Características al Inicio del Estudio ARISTOTLE
|
A. Criterio de Valoración Principal: Accidente Cerebrovascular y Embolia Sistémica |
||||||
|
Subgrupo |
No. de Pacientes |
Apixaban |
Warfarina |
Razón de Peligro con IC 95% |
Valor p para Interacción |
|
|
No. de Eventos (% por año) |
||||||
|
Todos los Pacientes |
18201 |
212 (1,27) |
265 (1,60) |
|
||
|
Estado Previo de Warfarina/AVK |
0,39 |
|||||
|
Utilizado Previamente |
10401 |
102(1,1) |
138 (1,5) |
|||
|
No utilizado previamente |
7800 |
110 (1,5) |
127 (1,8) |
|||
|
Edad |
0,12 |
|||||
|
<65 años de edad |
5471 |
51 (1,0) |
44 (0,9) |
|||
|
= 65 a < 75 años de edad |
7052 |
82 (1,3) |
112 (1,7) |
|||
|
= 75 años de edad |
5678 |
79 (1,6) |
109 (2,2) |
|||
|
Sexo |
0,60 |
|||||
|
Masculino |
11785 |
132 (1,2) |
160 (1,5) |
|||
|
Femenino |
6416 |
80 (1,4) |
105 (1,8) |
|||
|
Peso |
0,26 |
|||||
|
= 60 kg |
1985 |
34 (2,0) |
52 (3,2) |
|||
|
> 60 kg |
16154 |
177 (1,2) |
212 (1,4) |
|||
|
Tipo de Fibrilación Auricular |
0,70 |
|||||
|
Permanente/Persistente |
15412 |
191 (1,4) |
235 (1,7) |
|||
|
Paroxismal |
2786 |
21 (0,8) |
30 (1,1) |
|||
|
Accidente Cerebrovascular o AIT |
0,71 |
|||||
|
Si |
3436 |
73 (2,5) |
98 (3,2) |
|||
|
No |
14765 |
139 (1,0) |
167 (1,2) |
|||
|
Diabetes Mellitus |
0,71 |
|||||
|
Si |
4547 |
57 (1,4) |
75 (1,9) |
|||
|
No |
13654 |
155 (1,2) |
190 (1,5) |
|||
|
Insuficiencia Cardiaca |
0,50 |
|||||
|
Si |
5541 |
70 (1,4) |
79 (1,6) |
|||
|
No |
12660 |
142 (1,2) |
186 (1,6) |
|||
|
Puntaje CHADS2 |
0,45 |
|||||
|
=1 |
6183 |
44 (0,7) |
51 (0,9) |
|||
|
=2 |
6516 |
74 (1,2) |
82 (1,4) |
|||
|
=3 |
5502 |
94 (1,9) |
132 (2,8) |
|||
|
Nivel de Insuficiencia Renal |
0,72 |
|||||
|
Grave o Moderada |
3017 |
54 (2,1) |
69 (2,7) |
|||
|
Leve |
7587 |
87 (1,2) |
116 (1,7) |
|||
|
Normal |
7518 |
70 (1,0) |
79 (1,1) |
|||
|
Dosis de Apixaban |
0,22 |
|||||
|
2,5 mg BID o placebo |
831 |
12 (1,7) |
22 (3,3) |
|||
|
5 mg BID o placebo |
17370 |
200 (1,3) |
243 (1,5) |
|||
|
Región Geográfica |
0,44 |
|||||
|
Norteamérica |
4474 |
42 (1,0) |
56 (1,3) |
|||
|
Latinoamérica |
3468 |
43 (1,4) |
52 (1,8) |
|||
|
Europa |
7343 |
75 (1,1) |
77 (1,1) |
|||
|
Asia/Pacífico |
2916 |
52 (2,0) |
80 (3,1) |
|||
|
Aspirina a la Asignación Aleatoria |
0,44 |
|||||
|
Si |
5632 |
70 (1,3) |
94 (1,9) |
|||
|
No |
12569 |
142 (1,2) |
171 (1,5) |
|||
|
Apixaban |
Warfarina |
|||||
|
B. Hemorragia Mayor |
||||||
|
Subgrupo |
No. de Pacientes |
No de Eventos (% por año) |
Razón de Peligro (IC 95%) |
Valor p para Interacción |
||
|
Apixaban |
Warfarina |
|||||
|
Todos los Pacientes |
18140 |
327 (2,13) |
462 (3,09) |
|
||
|
Estado Previo de Warfarina/AVK |
0.50 |
|||||
|
Utilizado Previamente |
10376 |
185 (2,1) |
274 (3,2) |
|||
|
No utilizado previamente |
7764 |
142 (2,2) |
188 (3,0) |
|||
|
Edad |
0.64 |
|||||
|
<65 años de edad |
5455 |
56 (1,2) |
72 (1,5) |
|||
|
= 65 a < 75 años de edad |
7030 |
120 (2,0) |
166 (2,8) |
|||
|
= 75 años de edad |
5655 |
151 (3,3) |
224 (5,2) |
|||
|
Sexo |
0.08 |
|||||
|
Masculino |
11747 |
225 (2,3) |
294 (3,0) |
|||
|
Femenino |
6393 |
102 (1,9) |
168 (3,3) |
|||
|
Peso |
0.22 |
|||||
|
= 60 kg |
1978 |
36 (2,3) |
62 (4,3) |
|||
|
> 60 kg |
16102 |
290 (2,1) |
398 (3,0) |
|||
|
Tipo de Fibrilación Auricular |
0.75 |
|||||
|
Permanente/Persistente |
15361 |
283 (2,2) |
402 (3,2) |
|||
|
Paroxismal |
2776 |
44 (1,9) |
60 (2,6) |
|||
|
Accidente Cerebrovascular o AIT Previo |
0.71 |
|||||
|
Si |
3422 |
77 (2,8) |
106 (3,9) |
|||
|
No |
14718 |
250 (2,0) |
356 (2,9) |
|||
|
Diabetes Mellitus |
0.003 |
|||||
|
Si |
4526 |
112 (3,0) |
114 (3,1) |
|||
|
No |
13614 |
215 (1,9) |
348 (3,1) |
|||
|
Insuficiencia Cardiaca |
0.30 |
|||||
|
Si |
5527 |
87 (1,9) |
137 (3,1) |
|||
|
No |
12613 |
240 (2,2) |
325 (3,1) |
|||
|
Puntaje CHADS2 |
0.40 |
|||||
|
=1 |
6169 |
76 (1,4) |
126 (2,3) |
|||
|
=2 |
6492 |
125 (2,3) |
163 (3,0) |
|||
|
=3 |
5479 |
126 (2,9) |
173 (4,2) |
|||
|
Nivel de Insuficiencia Renal |
0.03 |
|||||
|
Grave o Moderada |
3005 |
73 (3,2) |
142 (6,4) |
|||
|
Leve |
7565 |
157 (2,5) |
199 (3,2) |
|||
|
Normal |
7496 |
96 (1,5) |
119 (1,8) |
|||
|
Dosis de Apixaban |
0.21 |
|||||
|
2,5 mg BID o placebo |
826 |
20 (3,3) |
37 (6,7) |
|||
|
5 mg BID o placebo |
17314 |
307 (2,1) |
425 (3,0) |
|||
|
Región Geográfica |
0.16 |
|||||
|
Norteamérica |
4463 |
106 (2,8) |
137 (3,6) |
|||
|
Latinoamérica |
3460 |
60 (2,1) |
94 (3,5) |
|||
|
Europa |
7313 |
110 (1,7) |
135 (2,2) |
|||
|
Asia/Pacífico |
2904 |
51 (2,1) |
96 (4,1) |
|||
|
Aspirina a la Asignación Aleatoria |
0.40 |
|||||
|
Si |
5608 |
129 (2,7) |
164 (3,7) |
|||
|
No |
12532 |
198 (1,9) |
298 (2,8) |
|||
|
Apixaban |
Warfarina |
|||||
Figura 4: Razones de Peligro para Accidente Cerebrovascular y Embolia Sistémica (A) y Hemorragia (B) por Características al Inicio del Estudio AVERROES
|
A. Criterio de Valoración Principal: Accidente Cerebrovascular y Embolia Sistémica |
||||||
|
Subgrupo |
No. de Pacientes |
Apixaban |
ASA |
Razón de Peligro con IC 95% |
Valor p para Interacción |
|
|
No de Eventos (% por año) |
||||||
|
Todos los Pacientes |
5598 |
51 (1,62) |
113(3,63) |
|
||
|
No Aptos para Warfarina/AVK |
0,14 |
|||||
|
Demostrada |
2215 |
17 (1,4) |
52 (4,2) |
|||
|
Esperada |
3383 |
34 (1,8) |
61 (3,3) |
|||
|
Edad |
0,11 |
|||||
|
<65 años de edad |
1720 |
7 (0,7) |
19 (1,9) |
|||
|
= 65 a < 75 años de edad |
1987 |
24 (2,0) |
29 (2,8) |
|||
|
=75 años de edad |
1891 |
20 (2,0) |
65 (6,0) |
|||
|
Sexo |
0,43 |
|||||
|
Masculino |
3277 |
26 (1,4) |
49 (2,7) |
|||
|
Femenino |
2321 |
25 (1,9) |
64 (4,9) |
|||
|
Peso |
0,02 |
|||||
|
=60 kg |
881 |
18 (3,9) |
20 (4,6) |
|||
|
> 60 kg |
4715 |
33 (1,2) |
93 (3,5) |
|||
|
Tabaquismo o AIT Previo |
0,18 |
|||||
|
Si |
764 |
10 (2,5) |
33 (8,3) |
|||
|
No |
4834 |
41 (1,5) |
80 (3,0) |
|||
|
Diabetes Mellitus |
0,17 |
|||||
|
Si |
1095 |
14 (2,4) |
22 (3,5) |
|||
|
No |
4503 |
37 (1,4) |
91 (3,7) |
|||
|
Insuficiencia Cardiaca |
0,52 |
|||||
|
Si |
1810 |
19 (1,8) |
35 (3,5) |
|||
|
No |
3788 |
32 (1,5) |
78 (3,7) |
|||
|
Puntaje CHADS2 |
0,41 |
|||||
|
=1 |
2142 |
12 (1,0) |
19 (1,6) |
|||
|
=2 |
1973 |
23 (2,0) |
43 (4,0) |
|||
|
=3 |
1483 |
16 (2,1) |
51 (6,0) |
|||
|
Nivel de Insuficiencia Renal |
0,31 |
|||||
|
Grave o Moderada |
1084 |
13 (2,3) |
32 (5,6) |
|||
|
Leve |
2149 |
22 (1,8) |
58 (5,0) |
|||
|
Normal |
1878 |
12 (1,1) |
16 (1,5) |
|||
|
Dosis de Apixaban |
0,37 |
|||||
|
2,5 mg BID o placebo |
361 |
3 (1,6) |
12 (6,2) |
|||
|
5 mg BID o placebo |
5237 |
48 (1,6) |
101(3,5) |
|||
|
Región Geográfica |
0,09 |
|||||
|
Norteamérica |
804 |
5 (0,9) |
18 (3,4) |
|||
|
Latinoamérica |
1185 |
8 (1,3) |
31 (5,1) |
|||
|
Europa |
2507 |
23 (1,6) |
46 (3,2) |
|||
|
Asia/Pacífico |
1102 |
15 (2,9) |
18 (3,4) |
|||
|
Apixaban |
ASA |
|||||
|
B. Hemorragia Mayor |
||||||
|
Subgrupo |
No. de Pacientes |
No de Eventos (% por año) |
Razón de Peligro (IC 95%) |
Valor p para Interacción |
||
|
Apixaban |
ASA |
|||||
|
Todos los Pacientes |
5578 |
45 (1,41) |
29 (0,92) |
|
||
|
No Aptos para Warfarina/AVK |
0.97 |
|||||
|
Demostrada |
2207 |
23 (1,8) |
15 (1,2) |
|||
|
Esperada |
3371 |
22 (1,1) |
14 (0,7) |
|||
|
Edad |
1.00 |
|||||
|
<65 años de edad |
1717 |
8 (0,8) |
5 (0,5) |
|||
|
= 65 a < 75 años de edad |
1979 |
11 (0,9) |
6 (0,6) |
|||
|
= 75 años de edad |
1882 |
26 (2,7) |
18 (1,7) |
|||
|
Sexo |
0.59 |
|||||
|
Masculino |
3269 |
27 (1,4) |
19 (1,0) |
|||
|
Femenino |
2309 |
18 (1,4) |
10 (0,8) |
|||
|
Peso |
0.55 |
|||||
|
= 60 kg |
876 |
9 (1,9) |
4 (0,9) |
|||
|
> 60 kg |
4701 |
36 (1,3) |
25 (0,9) |
|||
|
Accidente Cerebrovascular o AIT Previo |
0.15 |
|||||
|
Si |
763 |
15 (3,6) |
5 (1,2) |
|||
|
No |
4815 |
30 (1,1) |
24 (0,9) |
|||
|
Diabetes Mellitus |
0.93 |
|||||
|
Si |
1092 |
10 (1,7) |
7 (1,1) |
|||
|
No |
4486 |
35 (1,4) |
22 (0,9) |
|||
|
Insuficiencia Cardiaca |
0.13 |
|||||
|
Si |
1803 |
13 (1,2) |
13 (1,3) |
|||
|
No |
3775 |
32 (1,5) |
16 (0,8) |
|||
|
Puntaje CHADS2 |
0.39 |
|||||
|
=1 |
2133 |
7 (0,6) |
4 (0,3) |
|||
|
=2 |
1967 |
15 (1,3) |
13 (1,2) |
|||
|
=3 |
1478 |
23 (3,0) |
12 (1,4) |
|||
|
Nivel de Insuficiencia Renal |
0.25 |
|||||
|
Grave o Moderada |
1080 |
20 (3,5) |
9 (1,6) |
|||
|
Leve |
2140 |
12 (1,0) |
13 (1,1) |
|||
|
Normal |
1872 |
8 (0,7) |
4 (0,4) |
|||
|
Dosis de Apixaban |
0.34 |
|||||
|
2,5 mg BID o placebo |
360 |
8 (4,5) |
3 (1,6) |
|||
|
5 mg BID o placebo |
5218 |
37 (1,2) |
26 (0,9) |
|||
|
Región Geográfica |
0.54 |
|||||
|
Norteamérica |
800 |
9 (1,8) |
5 (1,0) |
|||
|
Latinoamérica |
1184 |
9 (1,4) |
5 (0,8) |
|||
|
Europa |
2498 |
20 (1,4) |
10 (0,7) |
|||
|
Asia/Pacífico |
1096 |
7 (1,3) |
9 (1,6) |
|||
|
Apixaban |
ASA |
|||||
Tratamiento de ETV: El programa clínico se diseñó para demostrar la eficacia y seguridad de apixaban para el tratamiento de TVP y EP (AMPLIFY) y el tratamiento extendido para la prevención de la TVP y EP recurrentes luego de 6 a 12 meses de tratamiento anticoagulante para TVP y/o EP (AMPLIFY-EXT). Ambos estudios fueron ensayos multinacionales, de grupos paralelos, doble ciegos, aleatorizados en pacientes con TVP proximal sintomática y/o EP sintomática. Todos los criterios de valoración clave de inocuidad y eficacia fueron adjudicados por un comité ciego independiente.
|
Tabla 13. Características demográficas de los pacientes de los estudios clínicos |
||
|
AMPLIFY |
AMPLIFY-EXT |
|
|
Pacientes aleatorizados |
5395 |
2482 |
|
Edad media |
56,9 |
56,7 |
|
>75 años |
14,3% |
13,3% |
|
Sexo (masculino) |
58,7% |
57,4% |
|
Raza |
||
|
Blanca/Caucásica |
82,7% |
85,3% |
|
Negra/Afroamericana |
3,8% |
3,2% |
|
Asiática |
8,4% |
4,8% |
|
Tabla 14. Factores de riesgo de TVP/EP para los pacientes de los estudios clínicos |
||
|
AMPLIFY |
AMPLIFY-EXT |
|
|
Eventos no provocados |
89,8% |
91,7% |
|
Episodio anterior de EP o TVP proximal |
16,2% |
n/a* |
|
Inmovilización |
6,4% |
2,8% |
|
Cáncer (activo) |
2,7% |
1,7% |
|
Cáncer (antecedente) |
9,7% |
9,2% |
|
Función renal |
||
|
Normal CrCl |
64,5% |
70,1% |
|
CrCL 50 - £80 mL/min |
20,3% |
21,6% |
|
CrCL 30 - £50 mL/min |
5,7% |
5,3% |
|
CrCL £30 mL/min |
0,5% |
0,2% |
|
Antecedentes del genotipo protrombótico |
2,5% |
3,8% |
|
* Se requirió que todos los pacientes de AMPLIFY-EXT hubieran tenido un episodio de EP o TVP proximal para participar del estudio. |
||
Estudio AMPLIFY: Los pacientes fueron asignados aleatoriamente a un tratamiento con apixaban 10 mg dos veces al día por vía oral durante 7 días seguido por apixaban 5 mg dos veces al día por vía oral durante 6 meses, o enoxaparina 1 mg/kg dos veces al día por vía subcutánea durante al menos 5 días (hasta alcanzar INR ³2) y warfarina (rango objetivo de INR 2,0 a 3,0) por vía oral durante 6 meses. Los pacientes que requerían tromboectomía, inserción de un filtro de la vena cava o la administración de un agente fibrinolítico, y los pacientes con eliminación de creatinina de <25 mL/min, enfermedad hepática importante o hemorragia activa fueron excluidos del estudio. Se permitió que los pacientes participaran del estudio tuvieran o no anticoagulación parenteral previa (hasta 48 horas).
Para los pacientes aleatorizados al grupo de warfarina, la media del porcentaje del tiempo en el rango terapéutico (INR 2,0 a 3,0) fue de 60,9.
El objetivo principal del estudio fue determinar si apixaban era no inferior al tratamiento de enoxaparina/warfarina para el criterio de valoración combinado de ETV sintomática recurrente adjudicada (TVP no mortal o EP no mortal) o muerte relacionada con ETV durante 6 meses de tratamiento.
En el estudio, se demostró que apixaban es no inferior a la enoxaparina/warfarina para el criterio de valoración combinado de la ETV sintomática recurrente adjudicada (TVP o EP no mortales) o el fallecimiento relacionado con ETV (ver Tabla 15).
|
Tabla 15. Resultados de eficacia del estudio AMPLIFY |
|||
|
Apixaban N=2609 n(%) |
Enoxaparina/Warfarina N=2635 n(%) |
Riesgo Relativo (IC del 95%) |
|
|
ETV o muerte relacionada con ETV* |
59 (2,3) |
71 (2,7) |
0,84 (0,60, 1,18) |
|
TVP |
20 (0,7) |
33 (1,2) |
|
|
EP |
27 (1,0) |
23 (0,9) |
|
|
Muerte relacionada con ETV |
12 (0,4) |
15 (0,6) |
|
|
ETV o muerte por cualquier causa |
84 (3,2) |
104 (4,0) |
0,82 (0,61, 1,08) |
|
Muerte relacionada con CV o ETV |
61 (2,3) |
77 (2,9) |
0,80 (0,57, 1,11) |
|
ETV, muerte relacionada con ETV, o sangrado importante |
73 (2,8) |
118 (4,5) |
0,62 (0,47, 0,83) |
|
* No inferior comparado con enoxaparina/warfarina (Valor P <0,0001) |
|||
La Figura 5 es un gráfico del tiempo transcurrido desde la aleatorización hasta la ocurrencia del primer evento del criterio de valoración de la eficacia principal en los dos grupos del estudio AMPLIFY.
Figura 5: Estimación de Tiempo Kaplan-Meier hasta la Primera TVP o EP o Muerte Relacionada con ETV en el Estudio AMPLIFY (Población con Intención de Tratar)
La eficacia de apixaban en el tratamiento inicial de ETV fue consistente entre los pacientes que se trataron por una EP [Riesgo relativo 0,9, intervalo de confianza de 95% (0,5; 1,6)] o TVP [Riesgo relativo 0,8, intervalo de confianza de 95% (0,5; 1,3)]. La eficacia entre los subgrupos, incluidos los de edad, sexo, función renal, índice de masa corporal (IMC), extensión de la EP principal, ubicación de los trombos de TVP y el uso de heparina parenteral previa por lo general fue consistente (ver Figura 6).
Figura 6: Riesgo Relativo de ETV Sintomática Recurrente (TVP no fatal o EP no fatal) o de Muerte Relacionada con ETV por Características Basales
|
Subgrupo |
Apixaban |
Eno/Warfarina |
Razón de Peligro con IC 95% |
Valor p para Interacción |
||
|
No. de eventos |
No. de pacientes |
No. de eventos |
No. de pacientes |
|||
|
Global |
59 |
2609 |
71 |
2635 |
|
|
|
Índice del evento |
0.8198 |
|||||
|
EP (con o sin TVP) |
21 |
900 |
23 |
886 |
||
|
TVP solamente |
38 |
1698 |
47 |
1736 |
||
|
Sexo |
0.4514 |
|||||
|
Masculino |
35 |
1524 |
38 |
1557 |
||
|
Femenino |
24 |
1085 |
33 |
1078 |
||
|
Edad |
0.3427 |
|||||
|
<65 años de edad |
39 |
1678 |
47 |
1714 |
||
|
65 a < 75 años de edad |
13 |
542 |
11 |
561 |
||
|
=75 años de edad |
7 |
389 |
13 |
360 |
||
|
Nivel de Insuficiencia Renal |
0.8757 |
|||||
|
Grave o Moderada |
7 |
169 |
7 |
158 |
||
|
Leve |
14 |
531 |
12 |
530 |
||
|
Normal |
38 |
1676 |
42 |
1719 |
||
|
Peso |
0.4344 |
|||||
|
= 60 kg |
6 |
225 |
10 |
232 |
||
|
> 60 kg a <100 kg |
42 |
1870 |
43 |
1892 |
||
|
> 100 kg |
11 |
509 |
18 |
508 |
||
|
IMC |
0.0639 |
|||||
|
= 25 kg/m2 |
16 |
693 |
16 |
694 |
||
|
> 25 a 30 kg/m2 |
27 |
985 |
26 |
1014 |
||
|
> 30 a 35 kg/m2 |
9 |
568 |
16 |
575 |
||
|
> 35 kg/m2 |
7 |
349 |
12 |
335 |
||
|
Extensión anatómica del índice EP |
0.0569 |
|||||
|
Limitado |
3 |
72 |
2 |
88 |
||
|
Intermedio |
13 |
382 |
7 |
385 |
||
|
Extenso |
5 |
351 |
12 |
318 |
||
|
Extensión anatómica del índice TVP |
0.2808 |
|||||
|
Vena Popliteal |
9 |
412 |
12 |
437 |
||
|
Vena Femoral |
11 |
556 |
7 |
571 |
||
|
Iliaco o femoral común |
18 |
730 |
26 |
725 |
||
|
Uso de LMWH/UFH |
0.4576 |
|||||
|
No uso de LMWH/UFH |
6 |
350 |
12 |
374 |
||
|
> 0 a 12 horas |
7 |
361 |
10 |
329 |
||
|
> 12 horas |
46 |
1893 |
49 |
1927 |
||
El criterio de valoración primario de seguridad fue el sangrado mayor. En el estudio, apixaban fue estadísticamente superior a enoxaparina/warfarina para el criterio de valoración primario de seguridad [Riesgo relativo 0,31, intervalo de confianza 95% (0,17, 0,55), valor P <0,0001] (ver Tabla 16).
|
Tabla 16. Resultados de Sangrado en el Estudio AMPLIFY |
||||
|
Apixaban N=2676 n(%) |
Enoxaparina/Warfarina N=2689 n(%) |
Riesgo Relativo (IC 95%*) |
Valor P |
|
|
Mayor |
15 (0,6) |
49 (1,8) |
0,31 (0,17; 0,55) |
<0,0001 |
|
HNMCR† |
103 (3,9) |
215 (8,0) |
0,48 (0,38; 0,60) |
|
|
Mayor + HNMCR |
115 (4,3) |
261 (9,7) |
0,44 (0,36; 0,55) |
|
|
Menor |
313 (11,7) |
505 (18,8) |
0,62 (0,54; 0,70) |
|
|
Todo |
402 (15,0) |
676 (25,1) |
0,59 (0,53; 0,66) |
|
|
*Intervalo de confianza. †HNMCR = sangrado no mayor clínicamente relevante. Los eventos asociados con cada uno de los criterios de valoración se contaron uno por paciente pero los pacientes pueden haber contribuido a múltiples criterios de valoración. |
||||
El sangrado mayor adjudicado y el sangrado HNMCR en cualquier lugar anatómico generalmente fueron inferiores en el grupo de apixaban en comparación con el grupo de enoxaparina/warfarina. El sangrado gastrointestinal mayor ISTH adjudicado ocurrió en 6 (0,2%) pacientes tratados con apixaban y en 17 (0,6%) pacientes tratados con enoxaparina/warfarina.
Durante los 6 meses del estudio, en el grupo de apixaban se hospitalizaron menos pacientes [153 (5,7%)] en comparación con los pacientes tratados con warfarina [190 (7,1%)].
Estudio AMPLIFY-EXT: Los pacientes fueron aleatorizados al tratamiento con apixaban 2,5 mg dos veces al día por vía oral, apixaban 5 mg dos veces al día por vía oral o placebo durante 12 meses después de completar el tratamiento anticoagulante inicial de 6 a 12 meses. Aproximadamente un tercio de los pacientes participaron en el estudio AMPLIFY anterior antes de enrolarse en el estudio AMPLIFY-EXT.
El objetivo principal del estudio era determinar si apixaban era superior al placebo para el criterio de valoración combinado de ETV sintomática, recurrente (TVP no fatal o EP no fatal) o muerte por cualquier causa.
En el estudio, ambas dosis de apixaban fueron estadísticamente superiores al placebo para el criterio de valoración primario de ETV sintomática, recurrente o muerte por cualquier causa (ver Tabla 17).
|
Tabla 17. Resultados de Eficacia del Estudio AMPLIFY-EXT |
||||||
|
Apixaban |
Apixaban |
Placebo |
Riesgo Relativo (IC 95%) |
Valor P |
||
|
2,5 mg (N=840) |
5,0 mg (N=813) |
(N=829) |
Apix 2,5 mg frente a Placebo |
Apix 5,0 mg frente a Placebo |
||
|
n (%) |
||||||
|
ETV recurrente o muerte por cualquier causa |
19 (2,3) |
14 (1,7) |
77 (9,3) |
0,24 (0,15; 0,40) |
0,19 (0,11; 0,33) |
<0,0001 |
|
TVP* |
6 (0,7) |
7 (0,9) |
53 (6,4) |
|||
|
EP* |
7 (0,8) |
4 (0,5) |
13 (1,6) |
|||
|
Muerte por cualquier causa |
6 (0,7) |
3 (0,4) |
11 (1,3) |
|||
|
ETV recurrente o muerte relacionada con ETV |
14 (1,7) |
14 (1,7) |
73 (8,8) |
0,19 (0,11; 0,33) |
0,20 (0,11; 0,34) |
|
|
ETV recurrente o muerte relacionada con CV |
14 (1,7) |
14 (1,7) |
76 (9,2) |
0,18 (0,10; 0,32) |
0,19 (0,11; 0,33) |
|
|
TVP no mortal† |
6 (0,7) |
8 (1,0) |
53 (6,4) |
0,11 (0,05; 0,26) |
0,15 (0,07; 0,32) |
|
|
EP no mortal† |
8 (1,0) |
4 (0,5) |
15 (1,8) |
0,51 (0,22; 1,21) |
0.27 (0.09; 0,80) |
|
|
Muerte relacionada con ETV |
2 (0,2) |
3 (0,4) |
7 (0,8) |
0,28 (0,06; 1,37) |
0.45 (0,12; 1,71) |
|
|
Muerte relacionada con CV |
2 (0,2) |
3 (0,4) |
10 (1,2) |
0,20 (0,04; 0,90) |
0,31 (0,09; 1,11) |
|
|
* Para pacientes con más de un evento que contribuyera al criterio de valoración compuesto, solamente se informó el primer evento (p.ej., si un paciente experimentó TVP y luego EP, solamente se informó la TVP). † Los pacientes pueden haber experimentado más de un evento y estar representados en ambas clasificaciones. |
||||||
La Figura 7 es un gráfico del tiempo transcurrido desde la aleatorización hasta la ocurrencia del primer evento del criterio de valoración de la eficacia principal en los tres grupos de tratamiento del estudio AMPLIFY-EXT.
Figura 7. Estimación de Tiempo Kaplan-Meier hasta la Primera TVP o EP o Muerte por Cualquier Causa en el Estudio AMPLIFY-EXT (Población con Intención de Tratar)
La eficacia de apixaban para la prevención de recurrencia de ETV se mantuvo en todos los subgrupos, incluidos los de edad, sexo, IMC y función renal.
El criterio de valoración primario de seguridad fue el sangrado mayor durante el periodo de tratamiento. En el estudio, la incidencia del sangrado mayor fue similar entre los grupos de apixaban y placebo. No hubo una diferencia estadísticamente importante en la incidencia de + HNMCR mayor, menor y todos los sangrados entre los grupos de tratamiento con apixaban 2,5 mg dos veces al día y de placebo. La frecuencia de una HNMCR+ mayor en el grupo de apixaban 5 mg dos veces al día no fue estadísticamente diferente de la del grupo de placebo. La frecuencia de HNMCR, sangrado menor y todo sangrado del grupo de apixaban 5 mg dos veces al día fue estadísticamente diferente al grupo de placebo (ver Tabla 18).
|
Tabla 18. Resultados de Hemorragias en el Estudio AMPLIFY-EXT |
|||||
|
Apixaban |
Apixaban |
Placebo |
Riesgo Relativo (IC 95%*) |
||
|
2.5 mg (N=840) |
5.0 mg (N=811) |
(N=826) |
Apix 2.5 mg frente a Placebo |
Apix 5.0 mg frente a Placebo |
|
|
n (%) |
|||||
|
Mayor |
2 (0,2) |
1 (0,1) |
4 (0,5) |
0,49 (0,09; 2,64) |
0,25 (0,03; 2,24) |
|
HNMCR† |
25 (3,0) |
34 (4,2) |
19 (2,3) |
1,29 (0.72; 2,33) |
1,82 (1,05; 3,18) |
|
HNMCR + mayor |
27 (3,2) |
35 (4,3) |
22 (2,7) |
1,20 (0,69; 2,10) |
1,62 (0,96; 2,73) |
|
Menor |
75 (8,9) |
98 (12,1) |
58 (7,0) |
1.26 (0.91; 1.75) |
1,70 (1,25; 2,31) |
|
Todas |
94 (11,2) |
121 (14,9) |
74 (9,0) |
1.24 (0,93; 1,65) |
1,65 (1,.26; 2.16) |
|
*Intervalo de confianza. †HNMCR = hemorragia no mayor clínicamente relevante. Los eventos asociados con cada criterio de valoración se contaron como uno por paciente pero los pacientes pueden haber participado de eventos en múltiples criterios de valoración. |
|||||
La Figura 8 es un gráfico del tiempo transcurrido desde la aleatorización hasta la ocurrencia del primer evento de sangrado mayor o no mayor clínicamente relevante en los tres grupos de tratamiento del estudio AMPLIFY-EXT.
Figura 8. Estimación de Kaplan-Meier del Sangrado Mayor/No Mayor Clínicamente Relevante durante el Período de Tratamiento en el Estudio AMPLIFY-EXT
El sangrado gastrointestinal mayor ISTH ocurrió en un 1 (0,1%) paciente tratado con apixaban con la dosis de 5 mg dos veces al día, no hubo ningún paciente con 2,5 mg dos veces al día y 1 (0,1%) paciente tratado con placebo.
Durante los 12 meses del estudio, se hospitalizaron menos pacientes de los grupos de apixaban [42 (5%) del grupo de 2,5 mg dos veces al día; 34 (4,2%) del grupo de 5 mg dos veces al día] en comparación con los pacientes tratados con placebo [62 (7,5%)].
ADVERTENCIAS Y PRECAUCIONES DE UTILIZACIÓN
Riesgo de hemorragia: Como ocurre con otros anticoagulantes, los pacientes que estén tomando ELIQUIS® deben estar bajo observación cuidadosa con relación a signos de hemorragia. Se recomienda utilizar con precaución ELIQUIS® en condiciones con mayor riesgo de hemorragia, como por ejemplo: Trastornos hemorrágicos congénitos o adquiridos; enfermedad gastrointestinal ulcerosa activa; endocarditis bacteriana; trombocitopenia; enfermedades de las plaquetas; antecedentes de accidentes cerebrovasculares hemorrágicos; hipertensión severa no controlada y cirugía reciente del cerebro, columna vertebral u oftalmológica. ELIQUIS® no se recomienda en pacientes con enfermedad hepática asociada con coagulopatia y riesgo de hemorragia clínicamente relevante.
La administración de ELIQUIS® debe interrumpirse si se presenta hemorragia severa (ver sección Sobredosis).
En caso de complicaciones hemorrágicas, debe interrumpirse el tratamiento e investigar la fuente de la hemorragia. Deberá tomarse en consideración el inicio de tratamiento apropiado, por ejemplo hemostasia quirúrgica o transfusión de plasma fresco congelado. Si la hemorragia potencialmente mortal no puede controlarse por los medios antes indicados, puede considerarse la administración del factor recombinante VIIa. Sin embargo, actualmente no existe ninguna experiencia con la utilización del factor recombinante VIIa en personas que están recibiendo apixaban.
Interrupción temporal de ELIQUIS®: La interrupción de los anticoagulantes, incluido ELIQUIS®, durante hemorragia activa, cirugía programada o procedimientos invasivos pone a los pacientes en mayor riesgo de trombosis. Evite interrupciones durante el tratamiento y si por alguna razón debe interrumpirse temporalmente la anticoagulación con ELIQUIS®, reinicie el tratamiento tan pronto como sea posible.
Insuficiencia renal
Prevención de ETV: cirugía de artroscopia de cadera o rodilla: Debido a que existe experiencia clínica limitada en pacientes con depuración de creatinina <15 mL/min y no existen datos en pacientes sometidos a diálisis, apixaban, no se recomienda en estos pacientes (ver secciones Posología y método de administración, Prevención de ETV: Cirugía de artroscopia de cadera o rodilla e Insuficiencia Renal).
Prevención de accidente cerebrovascular y embolia sistémica: FANV: No existen datos en pacientes sometidos a diálisis; por consiguiente, ELIQUIS® no se recomienda en estos pacientes (véase sección Propiedades farmacológicas, Insuficiencia Renal).
Tratamiento de ETV: Debido a que la experiencia clínica existente en pacientes con depuración de creatinina <15 mL/min es limitada, y que no existen datos en pacientes sometidos a diálisis, apixaban no se recomienda en estos pacientes (ver Propiedades farmacológicas, Insuficiencia Renal).
Insuficiencia hepática: ELIQUIS® no está recomendado en pacientes con insuficiencia hepática severa (ver sección Propiedades farmacológicas, Insuficiencia hepática).
ELIQUIS® puede utilizarse con precaución en pacientes con insuficiencia hepática leve o moderada (Child Pugh A o B) (ver secciones Posología y método de administración, Insuficiencia hepática y Propiedades farmacológicas, Insuficiencia hepática).
Interacción con inhibidores del Citocromo P450 3A4 (CYP3A4) y glucoproteína P (Gp-P): ELIQUIS® puede administrarse con precaución en pacientes que están recibiendo tratamiento sistémico concomitante con inhibidores fuertes de Citocromo P450 (CYP3A4) y glicoproteína P (P-gp), como por ejemplo antimicóticos del tipo azol (ketoconazol, itraconazol, voriconazol y posaconazol), inhibidores de la proteasa del VIH (por ejemplo ritonavir). Estos medicamentos pueden aumentar al doble la exposición a apixaban (ver sección Interacción con otros medicamentos y otras formas de interacción).
— Interacción con inductores de CYP3A4 y Gp-P
Prevención de ETV: cirugía electiva de reemplazo de cadera o rodilla: La utilización concomitante de ELIQUIS® con inductores fuertes de CYP3A4 y Gp-P (p. ej., rifampina, fenitoína, carbamazepina, fenobarbital o la Hierba de San Juan) puede conllevar a un reducción aproximada del 50% en la exposición a apixaban. Debe tenerse precaución cuando se administre ELIQUIS® con inductores fuertes de CYP3A4 y de Gp-P (ver sección Interacción con otros medicamentos y otras formas de interacción).
Prevención de accidente cerebrovascular y embolia sistémica: FANV: La administración concomitante de ELIQUIS® con inductores fuertes de CYP3A4 y Gp-P (p.ej. rifampina, fenitoína, carbamazepina, fenobarbital o la hierba de San Juan) puede conllevar a una reducción aproximada del 50% en la exposición a apixaban. Debe tenerse precaución cuando se coadministre ELIQUIS® con inductores fuertes de CYP3A4 y de Gp-P (ver sección Interacción con otros medicamentos y otras formas de interacción).
Tratamiento de ETV: La administración concomitante de ELIQUIS® con inductores fuertes de CYP3A4 y Gp-P (p.ej. rifampina, fenitoína, carbamazepina, fenobarbital o la hierba de San Juan) puede conllevar a una reducción aproximada del 50% en la exposición a apixaban. Para el tratamiento de ETV o EP, ELIQUIS® no se recomienda en pacientes que reciben un tratamiento sistémico concomitante con inductores fuertes de CYP3A4 y de Gp-P (ver sección Interacción con otros medicamentos y otras formas de interacción). Para la prevención de TVP y EP recurrentes, se debe tener precaución al coadministrar ELIQUIS® con inductores fuertes de CYP3A4 y Gp-P (ver sección Interacción con otros medicamentos y otras formas de interacción).
Interacción con otros medicamentos que afectan la hemostasia: La utilización concomitante de ELIQUIS® con antiplaquetarios aumenta el riesgo de hemorragia.
Debe tenerse cuidado si los pacientes se tratan concomitantemente con medicamentos antiinflamatorios no esteroides (AINES), incluido el ácido acetilsalicílico. No se recomienda utilizar concomitantemente con ELIQUIS® otros inhibidores de la agregación de las plaquetas u otros antitrombóticos luego de cirugías. (Ver sección Interacción con otros medicamentos y otras formas de interacción).
En pacientes con fibrilación auricular y una condición que justifique monoterapia o terapia dual antiplaquetaria, deberá realizarse una cuidadosa evaluación de los posibles beneficios con relación a los posibles riesgos antes de combinar esta terapia con ELIQUIS®. En un estudio clínico de pacientes con fibrilación auricular la utilización concomitante de ASA aumentó el riesgo de hemorragia mayor por el tratamiento con apixaban de 1,8% por año a 3,4% por año y aumentó el riesgo de hemorragia bajo tratamiento con warfarina de 2,7% por año a 4,6% por año. En este ensayo clínico, la utilización de terapia antiplaquetaria dual concomitantemente con apixaban fue limitada (2,3%).
En un ensayo clínico con pacientes con síndrome coronario postagudo de alto riesgo, caracterizados por múltiples comorbilidades cardiacas y no cardiacas, que recibieron ácido acetilsalicílico o la combinación de ácido acetilsalicílico y clopidogrel, se reportó un aumento significativo en el riesgo de hemorragia para apixaban comparado con placebo.
— Anestesia o punción intradural/epidural
Prevención de ETV: Cirugía electiva de reemplazo de cadera o rodilla: Cuando se utiliza anestesia central (anestesia intradural/epidural) o punción intradural/epidural, los pacientes tratados con antitrombóticos para la prevención de complicaciones tromboembólicas están en riesgo de desarrollar un hematoma epidural o intradural que puede conllevar a parálisis prolongada o permanente. El riesgo de estos eventos puede aumentar por la utilización postoperatoria de catéteres epidurales permanentes o la utilización concomitante de medicamentos que afectan la hemostasia. Los catéteres epidurales o endotraqueales permanentes deben retirarse al menos 5 horas antes de la primera dosis de ELIQUIS®. El riesgo puede también aumentar con la punción traumática o repetida intradural o epidural. Los pacientes deben monitorearse frecuentemente para determinar la presencia de signos y síntomas de deterioro neurológico (por ejemplo adormecimiento o debilidad de las piernas, disfunción del intestino o la vejiga). Si se observa compromiso neurológico, se requiere diagnóstico y tratamiento urgente. Antes de la intervención central, el médico debe considerar el posible beneficio con relación al riesgo en pacientes anticoagulados o en pacientes que se van a anticoagular para tromboprofilaxis.
— Cirugía de fractura de cadera
Prevención de ETV: Cirugía electiva de reemplazo de cadera o rodilla: Apixaban no se ha estudiado en ensayos clínicos en pacientes sometidos a cirugía de fractura de cadera para evaluar la eficacia y seguridad en estos pacientes. Por lo tanto, el tratamiento con ELIQUIS® no se recomienda en estos pacientes.
POSOLOGÍA Y MÉTODO DE ADMINISTRACIÓN: ELIQUIS® puede tomarse con o sin alimento.
Si se olvida tomar una dosis, el paciente debe tomar ELIQUIS® inmediatamente y continuar tomando el medicamento dos veces al día como lo venía realizando.
— Dosis recomendada
Prevención de ETV: cirugía de artroscopia de cadera o rodilla: En pacientes quirúrgicos, la dosis recomendada de ELIQUIS® es 2,5 mg tomados vía oral dos veces al día. La dosis inicial debe tomarse 12 a 24 horas después de la cirugía.
En pacientes sometidos a cirugía de reemplazo de cadera, la duración recomendada del tratamiento es 32 a 38 días.
En pacientes sometidos a cirugía de reemplazo de rodilla, la duración recomendada del tratamiento es de 10 a 14 días.
Prevención de accidente cerebrovascular y embolia sistémica: FANV: La dosis recomendada de ELIQUIS® es 5 mg tomados dos veces al día vía oral.
Edad, peso corporal, creatinina sérica: En pacientes con al menos 2 de las siguientes características, edad mayor o igual 80 años, peso corporal menor o igual 60 kg o creatinina sérica mayor o igual 1,5 mg/dL (133 micromoles/L), la dosis recomendada de ELIQUIS® es 2,5 mg dos veces al día.
Tratamiento de TVP y EP: La dosis recomendada de ELIQUIS® es de 10 mg tomados dos veces al día por vía oral durante 7 días, seguidos de 5 mg tomados dos veces al día por vía oral.
Prevención de TVP y EP recurrentes: La dosis recomendada de ELIQUIS® es de 2,5 mg tomados dos veces al día por vía oral después de al menos 6 meses de tratamiento de la TVP o EP.
— Insuficiencia renal
Prevención de ETV: cirugía de artroscopia de cadera o rodilla: No es necesario ajuste de la dosis en pacientes con insuficiencia renal, leve, moderada o severa (depuración de creatinina de 15-29 mL/min) (ver sección Insuficiencia Renal). Debido a que la experiencia clínica existente en pacientes con depuración de creatinina <15 mL/min es limitada, y no existen datos en pacientes sometidos a diálisis, apixaban no se recomienda en estos pacientes (ver sección Advertencias y precauciones de utilización: Insuficiencia Renal y Propiedades farmacológicas: Insuficiencia Renal).
Prevención de accidente cerebrovascular y embolia sistémica: FANV: No se recomiendan ajustes en la dosis en pacientes con depuración de creatinina de 15 a 29 mL/min, excepto como se describe en la sección Prevención de accidente cerebrovascular y embolia sistémica: FANV. Debido a que no existe ninguna experiencia clínica en pacientes con depuración de creatinina <15 mL/min, no pueden proporcionarse recomendaciones posológicas.
No existen datos en pacientes sometidos a diálisis; por consiguiente, ELIQUIS® no se recomienda en estos pacientes (ver sección Propiedades farmacológicas: Insuficiencia Renal).
Tratamiento de ETV: No es necesario ningún ajuste de la dosis en pacientes con insuficiencia renal leve, moderada o severa (depuración de creatinina de 15 a 29 mL/min) (ver sección Insuficiencia Renal). Debido a que la experiencia clínica existente en pacientes con depuración de creatinina <15 mL/min es limitada, y que no hay datos en pacientes sometidos a diálisis, apixaban no se recomienda en estos pacientes (ver sección Propiedades farmacológicas: Insuficiencia Renal).
Insuficiencia hepática: ELIQUIS® puede utilizarse con precaución en pacientes con insuficiencia hepática leve a moderada (Child Pugh A o B). No es necesario realizar ajustes de la dosis en pacientes con insuficiencia hepática leve o moderada (ver secciones 5.4 y 9.3.5).
ELIQUIS® no se recomienda en pacientes con insuficiencia hepática severa (ver secciones Advertencias y precauciones de utilización: Insuficiencia hepática y Propiedades farmacológicas: Insuficiencia hepática).
Peso corporal
Prevención de ETV: Cirugía de artroscopia de cadera o rodilla: No se requiere ningún ajuste de la dosis (ver sección Farmacocinética).
Prevención de accidente cerebrovascular y embolia sistémica: FANV: Ver sección Posología y método de administración: Dosis recomendada - Prevención de accidente cerebrovascular y embolia sistémica: FANV).
Tratamiento de ETV: No se requiere ningún ajuste de la dosis (ver sección Propiedades farmacológicas: Farmacocinética).
Sexo: No se requiere ningún ajuste de la dosis (ver sección Propiedades farmacológicas: Farmacocinética).
Pacientes pediátricos y adolescentes: La eficacia y seguridad de ELIQUIS® en niños menores de 18 años aún no se ha establecido. No se encuentran datos disponibles.
— Pacientes ancianos
Prevención de ETV: Cirugía de artroscopia de cadera o rodilla: No se requiere ajuste de la dosis (ver sección Propiedades farmacológicas, Farmacocinética).
Prevención de accidente cerebrovascular y embolia sistémica: FANV: Ver sección Posología y método de administración, Prevención de accidente cerebrovascular y embolia sistémica: FANV.
Tratamiento de ETV: No se requiere ningún ajuste de la dosis (ver sección Propiedades farmacológicas, Farmacocinética).
Cambio desde o a anticoagulantes parenterales: En general, el cambio de tratamiento desde anticoagulantes parenterales a ELIQUIS® (y viceversa) puede realizarse a partir de la siguiente dosis programada.
Cambio desde o hacia warfarina u otros antagonistas de vitamina K (AVK): Cuando se cambian pacientes desde warfarina u otro tratamiento con AVK a ELIQUIS®, interrumpa el tratamiento con warfarina o el otro AVK e inicie ELIQUIS® cuando la razón nor-malizada internacional (RNI) sea menor de 2,0.
Cuando se cambia desde ELIQUIS® a tratamiento con warfarina u otro AVK, continúe ELIQUIS® durante 48 horas después de la primera dosis del tratamiento con warfarina u otro AVK.
Cirugía y procedimientos invasivos: ELIQUIS® debe ser descontinuado por lo menos 48 horas previamente a cirugía electiva o procedimientos invasivos que tengan un riesgo moderado o alto de sangrado aceptable o clínicamente significativo. ELIQUIS® se debe descontinuar por lo menos 24 horas antes de cirugía electiva o procedimientos invasivos con un bajo riesgo de sangrado o cuando el sangrado probablemente no sea crítico por su localización y pueda ser fácilmente controlable. Si la cirugía o los procedimientos invasivos no pueden aplazarse, tome las precauciones apropiadas considerando que existe mayor riesgo de hemorragia. Este riesgo de hemorragia debe evaluarse con relación a la urgencia de la intervención. En pacientes con fibrilación auricular no valvular, generalmente no se requiere la terapia puente anticoagulante durante las 24 a 48 horas después de discontinuar ELIQUIS® y previo a la intervención. ELIQUIS® debe ser reiniciado después del procedimiento quirúrgico u otros procedimientos tan pronto como sea establecida una hemostasia adecuada.
Los pacientes pueden continuar tomando ELIQUIS® mientras son cardiovertidos.
SEGURIDAD PRECLÍNICA: Los datos preclínicos no revelaron peligros especiales para los humanos con base en los estudios convencionales de farmacología de seguridad, toxicidad repetida de la dosis, genotoxicidad, potencial carcinogénico, fertilidad y desarrollo embriofetal. (Ver sección Advertencias y precauciones de utilización, Embarazo, lactancia y fertilidad). En las crías de las ratas preñadas tratadas con apixaban existieron disminuciones en el apareamiento y la fertilidad. Esos efectos fueron mínimos y observados solamente a exposiciones consideradas suficientemente mayores a la exposición máxima en humanos lo que indica poca relevancia para la utilización clínica.
Rotachrom® es una marca comercial registrada de Diagnostica Stago. Esta marca no está registrada en todos los países.
Es posible que la información de prescripción de este producto haya sido revisada y actualizada después de la fecha de impresión del PLM 2016. Para obtener información más actualizada comuníquese con la Dirección Médica de Pfizer S.A.S Teléfono: (1) 6002300 Ext. 2509 Bogotá – Colombia.
ELIQUIS® 2,5 mg Tabletas Recubiertas (Reg. San. INVIMA 2012M-0013353).
PFIZER S.A.S.
SOBREDOSIS: No existe antídoto para ELIQUIS®. Las sobredosis de ELIQUIS® pueden producir alto riesgo de hemorragia. En ensayos clínicos controlados, apixaban administrado oralmente en pacientes sanos en dosis de hasta 50 mg diarios durante 3 a 7 días (25 mg dos veces al día durante 7 días o 50 mg una vez al día durante 3 días) no presentó efectos adversos clínicamente relevantes.
La administración de carbón activado 2 y 6 horas después de la ingesta de una dosis de 20 mg de apixaban redujo un 50% y 27%, respectivamente, el AUC media de apixaban y no tuvo impacto sobre la Cmáx. La vida media de apixaban se redujo de 13.4 horas al administrar apixaban individualmente a 5.3 horas y 4.9 horas, respectivamente, cuando se administró carbón activado 2 y 6 horas después de apixaban. De este modo, la administración de carbón activado puede ser útil en el manejo de sobredosis o ingesta accidental de apixaban.
Es poco probable que la hemodiálisis sea un medio de manejo eficaz de la sobredosis de apixaban (ver sección Propiedades farmacológicas, Insuficiencia Renal).
DESCRIPCIÓN: Apixaban, un inhibidor selectivo del factor de coagulación Xa (FXa) se describe químicamente como 1-(4 Metoxifenil) -7-oxo-6-[4-(2-oxopiperidin-1-il)fenil]-4,5,6,7,-tetrahidro-1H-pirazolo[3,4-c]piridina-3-carboxamida. Su fórmula molecular es C25H25N5O4, que corresponde a un peso molecular de 459,5. Apixaban tiene la siguiente fórmula estructural:
Apixaban es un polvo blanco a amarillo pálido. A un pH fisiológico (1,2 – 6,8), apixaban no se ioniza; su solubilidad acuosa sobre el intervalo de pH fisiológico es ~0,04 mg/mL.
ELIQUIS® Tabletas recubiertas está disponible para administración oral a una concentración de 2,5 mg y 5 mg de apixaban con los siguientes excipientes: lactosa anhidra, celulosa microcristalina, croscarmelosa sódica, sulfato lauril sódico y estearato de magnesio. El recubrimiento pelicular contiene lactosa monohidratada, hipromelosa, dióxido de titanio, triacetina, óxido de hierro amarillo (tabletas 2,5 mg) u óxido de hierro rojo (tabletas 5 mg).