
IMPLANON NXT
ETONOGESTREL
Implante
, Caja,1 Implante subdérmico,
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: IMPLANON NXT® es un implante radiopaco, no biodegradable, de solo progestágeno, flexible, precargado en un aplicador desechable, estéril, listo para usar.
Cada implante radiopaco contiene 68 mg de etonogestrel; la tasa de liberación es de aproximadamente 60-70 mcg/día en la semana 5-6 y ha disminuido aproximadamente a 35-45 mcg/día al finalizar el primer año, aproximadamente a 30-40 mcg/día al finalizar el segundo año y aproximadamente a 25-30 mcg/día al finalizar el tercer año de uso. Su novedoso aplicador está diseñado para ser operado con una mano, y ayudar a la correcta inserción subdérmica del implante.
INDICACIÓN TERAPÉUTICA: Anticoncepción.
FORMA FARMACÉUTICA: Implante para uso subdérmico.
Varilla flexible radiopaca, no biodegradable, de color blanco a blanquecino, blanda, con una longitud de 4 cm. y un diámetro de 2 mm
PARTICULARIDADES FARMACÉUTICAS:
Lista de excipientes:
Implante:
Núcleo: Copolímero de etileno y acetato de vinilo (28% vinil acetato, 43 mg) sulfato de bario (15 mg).
Cubierta: Copolímero de etileno y acetato de vinilo (15% acetato de vinilo, 15 mg).
Incompatibilidades: No hay incompatibilidades conocidas para IMPLANON NXT®.
Precauciones especiales de almacenamiento: Conservar a una temperatura no mayor a 30°C en el envase original. Proteger de la luz y la humedad.
PROPIEDADES FARMACOLÓGICAS:
Propiedades Farmacodinámicas: (Grupo farmacoterapéutico: Progestágenos, clasificación ATC G03AC08): El IMPLANON NXT® es un implante no biodegradable, radiopaco, que contiene etonogestrel, para uso subdérmico, precargado en un aplicador estéril, desechable, novedoso. El etonogestrel es el metabolito biológicamente activo del desogestrel, un progestágeno ampliamente utilizado en los AOCs. Se deriva estructuralmente de la 19-nortestosterona y se une con gran afinidad a los receptores de progesterona de los órganos blanco. El efecto anticonceptivo del etonogestrel se logra principalmente por inhibición de la ovulación. No se observaron ovulaciones durante los primeros dos años de uso del implante y sólo raramente durante el tercer año. Además de la inhibición de la ovulación, el etonogestrel también produce cambios en el moco cervical, los cuales dificultan el paso de los espermatozoides. Se realizaron pruebas clínicas en mujeres de 18 a 40 años de edad. Aunque no se hizo una comparación directa, la eficacia anticonceptiva pareció ser por lo menos comparable a la conocida para los anticonceptivos orales combinados (más del 99%). El alto grado de protección contra el embarazo se logra, entre otras razones, porque la acción anticonceptiva de IMPLANON NXT® no depende de la adherencia a un régimen diario, semanal o mensual por parte de la mujer. La acción anticonceptiva del etonogestrel es reversible, lo cual se manifiesta por la rápida normalización del ciclo menstrual después de la extracción del implante. Aunque el etonogestrel inhibe la ovulación, la actividad ovárica no se suprime por completo. Las concentraciones medias de estradiol se mantienen por encima del nivel observado en la fase folicular temprana. En un estudio de dos años de duración, en el cual se comparó la densidad mineral ósea de 44 usuarias con la de un grupo de control de 29 usuarias de DIU, no se observaron efectos adversos sobre la masa ósea. No se observaron efectos clínicamente relevantes sobre el metabolismo de los lípidos. El uso de anticonceptivos que contienen progestágenos puede afectar la resistencia a la insulina y la tolerancia a la glucosa. Pruebas clínicas también han indicado que las usuarias de IMPLANON NXT® con frecuencia tienen un sangrado menstrual menos doloroso (dismenorrea).
Inserción del implante y características de la remoción: En un estudio clínico, IMPLANON NXT® fue insertado en 301 mujeres. El tiempo promedio de inserción (desde la remoción de la tapa de protección del aplicador hasta retracción de la aguja del brazo) fue 27.9 segundos (desviación estándar (SD) = 29.3, n=291). Después de la inserción, 300 de 301 (99.7%) implantes de IMPLANON NXT® fueron palpables. El implante sencillo, no palpable no fue insertado según las instrucciones. Para 293 de los
301 sujetos, los datos de palpabilidad fueron alcanzados antes de la remoción. El implante fue palpable para todos los 293 sujetos con datos de palpabilidad. Para cuatro sujetos, la palpabilidad no fue evaluada y otros cuatro sujetos se perdieron durante el seguimiento antes de la remoción.
En dos estudios clínicos con implantes de IMPLANON NXT®, un total de 116 sujetos sobrellevaron evaluaciones bi-dimensionales de rayos x en (después de) la inserción y/o (antes) de la remoción. Para 101 de 103 (98.1%) sujetos para los cuales las evaluaciones de rayos X fueron desarrolladas en la inserción y antes de la remoción, los implantes de IMPLANON NXT® fueron claramente visibles; para dos sujetos los implantes no fueron claramente visibles después de la inserción pero fueron claramente visibles antes de la remoción. Los implantes de 13 sujetos con evaluación de rayos x solo en la inserción (n=12) o solo antes de la remoción (n=1) fueron todos claramente visibles.
Propiedades farmacocinéticas:
Absorción: Después de la inserción del implante, el etonogestrel se absorbe rápidamente a la circulación. Las concentraciones que inhiben la ovulación se alcanzan durante el primer día. Las concentraciones séricas máximas (entre 472 y 1270 pg/ml) se alcanzan dentro de 1 a 13 días. La tasa de liberación del implante disminuye con el tiempo. En consecuencia, las concentraciones séricas disminuyen rápidamente durante los primeros meses. Hacia el final del primer año, se observa una concentración media de aproximadamente 200 pg/ml (rango 150-261 pg/ml), la cual disminuye lentamente a 156 pg/ml (rango 111-202 pg/ml) hacia el final del tercer año. Las variaciones observadas en las concentraciones séricas se pueden atribuir en parte a diferencias en el peso corporal.
Distribución: El 95,5-99% del etonogestrel se une a las proteínas séricas, predominantemente a la albúmina y en menor grado a la globulina transportadora de hormonas sexuales. El volumen de distribución central y total es de 27 l y 220 l, respectivamente, y apenas se modifica durante el uso de IMPLANON NXT®.
Metabolismo: El etonogestrel experimenta hidroxilación y reducción. Los metabolitos se conjugan en sulfatos y glucurónidos. Los estudios realizados en animales muestran que la circulación enterohepática probablemente no contribuye a la actividad progestagénica del etonogestrel.
Eliminación: Después de la administración intravenosa de etonogestrel, la vida media de eliminación es de aproximadamente 25 horas y el clearance sérico es de aproximadamente 7,5 l/hora. Tanto el clearance como la vida media de eliminación se mantienen constantes durante el período de tratamiento. La excreción del etonogestrel y sus metabolitos, tanto como esteroides libres o como conjugados, se realiza con la orina y con las heces (relación 1,5:1). En mujeres en período de lactancia, el etonogestrel se excreta en la leche materna con una relación leche/suero de 0,44-0,50 durante los primeros cuatro meses. En mujeres en período de lactancia, la transferencia media de etonogestrel al lactante es aproximadamente del 0,2% de la dosis diaria absoluta materna de etonogestrel (2,2% cuando los valores son normalizados por peso corporal en kg). Las concentraciones muestran una disminución gradual y estadísticamente significativa en el tiempo.
CONTRAINDICACIONES: No se deberán utilizar anticonceptivos de solo progestágeno en presencia de cualquiera de las condiciones enumeradas a continuación. En el caso de que cualquiera de las condiciones aparezca por primera vez durante el uso de IMPLANON NXT®, se deberá interrumpir de inmediato el uso del producto.
• Conocimiento o sospecha de embarazo.
• Tromboembolismo venoso activo.
• Presencia o sospecha de tumores malignos sensibles a los esteroides sexuales.
• Presencia o antecedentes de tumores hepáticos (benignos o malignos).
• Presencia o historia de enfermedad hepática severa siempre y cuando los valores de la función hepática no se hayan normalizado.
• Sangrado vaginal no diagnosticado.
• Hipersensibilidad a la sustancia activa o a cualquiera de los excipientes de IMPLANON NXT®.
EMBARAZO Y LACTANCIA: No se recomienda el uso de IMPLANON NXT® durante el embarazo. Si durante el uso de IMPLANON NXT® se produce un embarazo, el implante deberá ser extraído. Los estudios realizados en animales demostraron que las dosis muy elevadas de sustancias progestagénicas pueden causar masculinización en fetos femeninos. Estudios epidemiológicos extensos no han revelado mayor riesgo de defectos congénitos en niños de mujeres que utilizaron AOCs antes del embarazo, ni efectos teratogénicos cuando se utilizaron AOCs involuntariamente durante el embarazo. Si bien esto probablemente se aplica a todos los AOCs, no resulta claro si también corresponde a IMPLANON NXT®.
Los datos de farmacovigilancia obtenidos con varios productos que contienen etonogestrel y desogestrel (el etonogestrel es un metabolito del desogestrel) tampoco indican un riesgo elevado.
Datos clínicos indican que IMPLANON NXT® no afecta la producción ni la calidad (concentraciones de proteínas, lactosa o grasa) de la leche materna. Sin embargo, pequeñas cantidades de etonogestrel se excretan en la leche materna. Sobre la base de una ingesta diaria promedio de leche de 150 ml/kg, la dosis diaria media de etonogestrel en el lactante, calculada después de un mes de liberación de etonogestrel, es de alrededor de 27ng/kg/día. Esto corresponde aproximadamente al 2,2% de la dosis diaria materna ajustada al peso corporal y aproximadamente al 0,2% de la dosis materna diaria absoluta. Posteriormente, la concentración de etonogestrel en la leche disminuye con el tiempo durante el período de lactancia.
Hay datos a largo plazo disponibles obtenidos de 38 niños cuyas madres recibieron un implante durante las semanas 4 a 8 después del parto. Estos niños fueron amamantados durante un período medio de 14 meses y seguidos hasta los 36 meses de edad. La evaluación del crecimiento y el desarrollo físico y psicomotor no indicó diferencias en comparación con los lactantes cuyas madres utilizaban un DIU (n=33). No obstante, se deberá seguir cuidadosamente el desarrollo y el crecimiento del niño. Sobre la base de los datos disponibles, IMPLANON NXT® puede ser utilizado durante la lactancia y debe ser insertado después de la 4ª semana post-parto.
EFECTOS SOBRE LA CAPACIDAD DE CONDUCIR VEHÍCULOS Y OPERAR MAQUINARIA: Sin efectos observados.
EVENTOS ADVERSOS:
Eventos adversos serios: Ver Advertencias.
Otros posibles efectos adversos: Durante el uso de IMPLANON NXT®, es posible que las mujeres presenten cambios en el patrón de sangrado menstrual. Estos pueden incluir cambios en la frecuencia del sangrado (ausente, menor, más frecuente o continuo), intensidad (reducida o aumentada), o duración. Se reportó amenorrea en cerca de 1 en 5 mujeres, mientras otras 1 en 5 mujeres reportaron sangrado frecuente y/o prolongado. Ocasionalmente, se ha reportado sangrado abundante. En pruebas clínicas, los cambios en el sangrado fueron la causa más común para suspender el tratamiento (cerca del 11%). La dismenorrea tendió a mejorar mientras se usó IMPLANON NXT®. El patrón de sangrado experimentado durante los tres primeros meses es ampliamente predictivo de los patrones futuros de sangrado para muchas mujeres.
Los posibles efectos no deseados reportados en las pruebas clínicas fueron listados en la tabla siguiente. La asociación no ha sido confirmada ni refutada.
|
Sistema orgánico |
Reacción adversa según el término del MedDRA1 |
||
|
Muy comunes > 1/10 |
Comunes < 1/10, ≥ 1/100 |
Poco comunes < 1/100, ≥ 1/1000 |
|
|
Infecciones e infestaciones |
Infección vaginal |
Faringitis, rinitis, infección de las vías urinarias |
|
|
Trastornos del sistema inmune |
Hipersensibilidad |
||
|
Trastornos metabólicos y nutricionales |
Aumento del apetito |
||
|
Trastornos psiquiátricos |
Labilidad afectiva, estado de ánimo depresivo, nerviosismo, disminución de la libido |
Ansiedad, insomnio |
|
|
Trastornos del sistema nervioso |
Cefalea |
Mareos |
Migraña, somnolencia |
|
Trastornos vasculares |
Oleadas de calor |
||
|
Trastornos gastrointestinales |
Dolor abdominal, náuseas, flatulencia |
Vómitos, constipación, diarrea |
|
|
Trastornos de la piel y del tejido subcutáneo |
Acné |
Alopecia |
Hipertricosis, erupción, prurito |
|
Trastornos musculoesqueléticos y del tejido conectivo |
Dolor de espalda, artralgia, mialgia, dolor musculoesquelético |
||
|
Trastornos renales y urinarios |
Disuria |
||
|
Aparato reproductor y trastornos mamarios |
Sensibilidad en los senos, dolor en los senos, menstruación irregular |
Dismenorrea, quiste ovárico |
Secreción genital, molestia vulvovaginal, galactorrea, aumento de tamaño de los senos, prurito genital |
|
Trastornos generales y condiciones en el sitio de administración |
Dolor en el sitio del implante, reacción en el sitio del implante, fatiga, enfermedad similar a la gripe, dolor |
Pirexia, edema |
|
|
Investigaciones |
Aumento de peso |
Disminución de peso |
|
|
1 Se lista el término del MedDRA (versión 10.1) más apropiado para describir una determinada reacción adversa. No se listan sinónimos o condiciones relacionadas, aunque estos también se deberán tener en cuenta. |
|||
En un estudio clínico de IMPLANON NXT®, en el cual se pidió a los investigadores examinar el sitio del implante después de la inserción, fueron reportadas reacciones en el sitio del implante en el 8.6% de las mujeres. Eritema fue la complicación más frecuente en el sitio del implante reportada durante y/o muy poco después de la inserción, ocurriendo en 3.3% de los sujetos. Adicionalmente, fueron reportados hematoma (3.0%), moretones (2.0%), dolor (1.0%) e hinchazón (0.7%).
Durante la vigilancia post-mercadeo, se ha observado un aumento clínicamente relevante de la presión arterial en raros casos. También ha sido reportada seborrea. Puede ocurrir reacciones anafilácticas, urticaria, angioedema, (agravamiento del) angioedema y/o agravamiento del angioedema hereditario.
La inserción o la extracción del implante pueden causar cierta contusión, irritación, dolor o prurito local. Puede ocurrir fibrosis en el sitio de inserción, se puede formar una cicatriz o desarrollar un absceso. Pueden ocurrir parestesia o eventos similares a la parestesia. La expulsión o migración del implante fueron reportadas, incluyendo raramente la migración a la pared torácica. En casos raros, los implantes se han encontrado dentro de la vasculatura incluyendo la arteria pulmonar. Algunos casos de implantes se encuentran dentro de la arteria pulmonar reportando dolor de pecho y / o disnea; otros han sido reportados como asintomáticos (ver Advertencias). Podría ser necesaria una intervención quirúrgica para extraer el implante.
En raras ocasiones, se han reportado embarazos ectópicos (ver Advertencias).
Han sido reportados un número de efectos indeseables (graves) en mujeres que están utilizando anticonceptivos (combinados orales). Estos incluyen trastornos tromboembólicos venosos, trastornos tromboembólicos arteriales, tumores dependientes de hormonas (p.ej., tumores hepáticos, cáncer de seno) y cloasma, algunos de los cuales son discutidos con mayor detalle en la sección Advertencias y Precauciones especiales de uso).
INTERACCIONES FARMACOLÓGICAS:
Interacciones:
Nota: La información para prescribir de Medicamentos concomitantes debe ser consultada con el fin de identificar interacciones potenciales.
Influencia de otros medicamentos sobre IMPLANON NXT®: Las interacciones entre los anticonceptivos hormonales y otros productos medicinales pueden provocar hemorragia menstrual inesperada y/o falla del anticonceptivo. Las interacciones que se mencionan a continuación fueron publicadas en la literatura (principalmente con anticonceptivos combinados pero en ocasiones también con anticonceptivos que contienen progestágeno solo).
Metabolismo hepático: Pueden ocurrir interacciones con productos medicinales o herbales que inducen enzimas microsomales, específicamente las enzimas del citocromo P450 (CYP), las cuales pueden aumentar la depuración , reduciendo la concentración plasmática de las hormonas sexuales y pueden disminuir la efectividad de IMPLANON NXT®. Estos productos incluyen: fenitoina, fenobarbital, primidona, bosentan, carbamazepina, rifampicina y posiblemente también oxcarbazepina, topiramato, felbamato, griseofulvina, algunos inhibidores de la proteasa de VIH (por ejemplo ritonavir) e inhibidores de la transcriptasa reversa no nucleosida (por ejemplo efavirenz), y la medicación herbal hierba de San Juan.
La inducción enzimática puede ocurrir después de algunos días de tratamiento. La inducción enzimática máxima se observa generalmente dentro de unas pocas semanas. Después de la discontinuación de la terapia, la inducción enzimática puede durar cerca de 28 días.
Cuando son co-administradas con anticonceptivos hormonales, muchas combinaciones de inhibidores de la proteasa de VIH (por ejemplo nelfinavir) e inhibidores de la transcriptasa reversa no nucleósida (por ejemplo nevirapina), y/o combinaciones con medicamentos para el tratamiento contra el virus de Hepatitis C (por ejemplo boceprevir, telaprevir), pueden incrementar o disminuir las concentraciones plasmáticas de progestinas, incluyendo etonogestrel. El efecto neto de estos cambios puede ser clínicamente relevante en algunos casos.
Las mujeres que reciben cualquiera de los medicamentos que inducen enzimas hepáticas o productos herbales mencionados anteriormente deberán ser advertidas de que la eficacia de IMPLANON NXT® se pueda ver reducida. Si se decide continuar usando IMPLANON NXT®, las mujeres deben ser advertidas de usar un método anticonceptivo no hormonal además de IMPLANON NXT® durante el tiempo de administración concomitante del medicamento, y durante 28 días después de su discontinuación.
La administración concomitante de inhibidores fuertes de CYP3A4 por ejemplo ketoconazol, itraconzaol, claritromicina) o inhibidores o inhibidores moderados de CYP3A4 (por ejemplo fluconazo, ditiazem, eritromicina) pueden incrementar las concentraciones séricas de progestinas, incluyendo etonogestrel.
Influencia de IMPLANON NXT® sobre otros medicamentos: Los anticonceptivos hormonales pueden interferir en el metabolismo de otros medicamentos. En consecuencia, las concentraciones plasmáticas y tisulares pueden aumentar (ej. ciclosporina), o disminuir (ej. lamotrigina).
Parámetros de laboratorio: Los datos obtenidos con los AOCs combinados demostraron que los esteroides anticonceptivos pueden afectar algunos parámetros de laboratorio, incluyendo parámetros bioquímicos de pruebas de función hepática, tiroidea, suprarrenal y renal, niveles séricos de proteínas (transportadoras), por ej., globulina fijadora de corticoesteroides y fracciones de lípidos/lipoproteínas, parámetros del metabolismo de los carbohidratos y parámetros de coagulación y fibrinólisis. Los cambios generalmente se mantienen dentro del rango normal. Se desconoce en qué grado esto es aplicable también a los anticonceptivos con progestágeno solo.
DATOS DE SEGURIDAD PRE-CLÍNICA: Estudios toxicológicos no revelaron ningún efecto diferente a estos, los cuales son explicados en base a las propiedades hormonales del etonogestrel, relacionado a la ruta de administración.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE USO:
Advertencias: Si aparece cualquiera de las condiciones / factores de riesgo mencionados a continuación, los beneficios del uso de progestágenos deberán ser evaluados frente a los posibles riesgos para cada mujer en particular y considerados con la paciente antes de que decida utilizar IMPLANON NXT®. En el caso de agravamiento, exacerbación o aparición de cualquiera de estas condiciones, la paciente deberá comunicarse con su prestador de servicios de salud. Luego el prestador de servicios de salud deberá decidir la discontinuación o no del uso de IMPLANON NXT®.
Carcinoma de Seno:
• El riesgo de cáncer de seno aumenta en general con el avance de la edad. El uso de anticonceptivos orales combinados (AOCs) aumenta ligeramente el riesgo del diagnóstico de cáncer de seno. Este aumento del riesgo desaparece en forma gradual dentro de los 10 años siguientes a la discontinuación del uso del AOC y no está relacionado con la duración de su uso, sino con la edad de la mujer cuando utiliza el AOC. Para los respectivos grupos etarios, se calculó que la cantidad esperada de casos diagnosticados por cada 10.000 mujeres que utilizan AOCs combinados (hasta 10 años después de discontinuarlos) respecto de las que nunca los utilizaron, durante el mismo período, es de: 4,5/4 (16-19 años); 17,5/16 (20-24 años); 48,7/44 (25-29 años); 110/100 (30-34 años); 180/160 (35-39 años); y 260/230 (40-44 años). En usuarias de métodos anticonceptivos que sólo contienen progestágenos, el riesgo posiblemente sea de una magnitud similar al asociado con los AOCs combinados. Sin embargo, para estos métodos, la evidencia es menos concluyente. En comparación con el riesgo de tener cáncer de seno en algún momento de la vida, el mayor riesgo asociado con los AOCs es bajo. Los casos de cáncer de seno diagnosticado en usuarias de AOCs tienden a estar menos avanzados que en las que no utilizaron AOCs. El elevado riesgo observado en las usuarias de AOCs puede deberse a un diagnóstico más temprano, a efectos biológicos del AOC o a una combinación de ambos.
Enfermedad hepática:
• Cuando se presenten alteraciones agudas o crónicas de la función hepática, la mujer deberá ser referida a un especialista para examen y consulta.
Eventos trombóticos y otros eventos vasculares:
• Las investigaciones epidemiológicas asociaron el uso de AOCs combinados con una mayor incidencia de tromboembolismo venoso (TEV, trombosis de venas profundas y embolismo pulmonar). Si bien se desconoce la relevancia clínica de este hallazgo para el etonogestrel (el metabolito biológicamente activo del desogestrel) utilizado como anticonceptivo en ausencia de un componente estrogénico, el implante deberá ser extraído en el caso de una trombosis confirmada. También se deberá considerar la extracción del implante en el caso de inmovilización a largo plazo debida a cirugía o a enfermedad. Aunque IMPLANON NXT® es un anticonceptivo de solo progestágeno, se recomienda evaluar los factores de riesgo que se sabe aumentan el riesgo de tromboembolismo venoso y arterial. Las mujeres con antecedentes de trastornos tromboembólicos deberán ser informadas acerca de la posibilidad de una recurrencia.
• Ha habido reportes post mercadeo de eventos tromboembólicos serios venosos y arteriales, incluyendo casos de embolia pulmonar (algunos fatales), trombosis venosa profunda, infarto del miocardio, y apoplejías, en mujeres que están utilizando implantes de etonogestrel. IMPLANON NXT® debe ser removido en el caso de una trombosis.
Presión sanguínea elevada:
• Si durante el uso de IMPLANON NXT® se desarrolla hipertensión sostenida, o si un aumento significativo de la presión arterial no responde adecuadamente al tratamiento antihipertensivo, IMPLANON NXT® debe ser removido.
• Efecto en el metabolismo de carbohidratos y lípidosSi bien los progestágenos pueden afectar la resistencia periférica a la insulina y la tolerancia a la glucosa, no se ha demostrado la necesidad de alterar el régimen terapéutico en pacientes diabéticas que utilizan anticonceptivos con progestágeno solo. Sin embargo, las mujeres con diabetes deberán ser observadas cuidadosamente durante el uso de anticonceptivos con progestágeno solo.
• Las mujeres que están siendo tratadas por hiperlipidemia deben ser monitoreadas de cerca si ellas eligen utilizar IMPLANON NXT®. Algunos progestágenos pueden elevar los niveles de LDL y pueden hacer más difícil el control de la hiperlipidemia.
Cloasma
• Ocasionalmente puede presentarse cloasma, especialmente en mujeres con antecedentes de cloasma gravídico. Las mujeres con tendencia al cloasma deberán evitar la exposición al sol o a la radiación ultravioleta durante el uso de IMPLANON NXT®.
Peso corporal:
• El efecto anticonceptivo de IMPLANON NXT® está relacionado con los niveles plasmáticos de etonogestrel, los cuales están inversamente relacionados con el peso corporal, y disminuyen con el tiempo luego de la inserción. La experiencia clínica en mujeres de mayor peso durante el tercer año de uso es limitada. Por lo tanto, no puede excluirse que el efecto anticonceptivo en estas mujeres durante el tercer año de uso pueda ser inferior al observado en las mujeres de peso normal. En consecuencia, los prestadores de servicios de salud pueden considerar un reemplazo más temprano del implante en las mujeres de mayor peso.
Complicaciones de la inserción:
• Puede ocurrir expulsión del implante, especialmente si el mismo no se inserta de acuerdo con las instrucciones proporcionadas en el punto “Cómo insertar IMPLANON NXT® o como consecuencia de una inflamación local.
• Hay reportes de migración del implante dentro del brazo desde el sitio de inserción lo cual puede ser relacionado a una inserción profunda (ver Cómo insertar IMPLANON NXT®) o con fuerzas externas (por ej., manipulación del implante o deportes de contacto). En raros casos se han reportado en el post mercadeo implantes localizados en los vasos sanguíneos de los brazos y la arteria pulmonar, la cual podría estar relacionada a inserciones profundas o inserciones intravasculares. En casos donde el implante fue migrado dentro del brazo desde el sitio de inserción, la localización puede ser más difícil y la extracción puede requerir un procedimiento quirúrgico menor con una incisión larga o un procedimiento quirúrgico en una sala de cirugía. En casos donde el implante fue migrado a la arteria pulmonar, procedimientos quirúrgicos o endovasculares pueden ser necesarios (ver Cómo extraer IMPLANON NXT®). Si en algún momento el implante no puede ser palpado, su localización y remoción es recomendada. Si el implante no es removido, la anticoncepción y el riesgo de efectos no deseados relacionados con los progestágenos pueden perdurar más allá del tiempo deseado por la mujer.
Quistes ováricos:
• Con todos los anticonceptivos hormonales de dosis bajas puede ocurrir desarrollo folicular, y ocasionalmente el folículo puede crecer más allá del tamaño que alcanzaría en un ciclo normal. Generalmente, estos folículos aumentados de tamaño desaparecen espontáneamente. Frecuentemente, son asintomáticos; en algunos casos se asocian con dolor abdominal leve. Raramente requieren intervención quirúrgica.
Embarazos ectópicos:
• La protección que brindan los anticonceptivos tradicionales con progestágeno solo contra los embarazos ectópicos no es tan buena como la de los AOCs combinados, los cuales se han asociado con ovulaciones frecuentes durante el uso de estos métodos. A pesar de que IMPLANON NXT® inhibe la ovulación de manera consistente, en el diagnóstico diferencial se deberá tener en cuenta el embarazo ectópico si la mujer presenta amenorrea o dolor abdominal.
Otras condiciones:
• Las condiciones que se enumeran a continuación han sido reportadas tanto durante el embarazo como durante el uso de esteroides sexuales, pero no se ha establecido una asociación con el uso de progestágenos: ictericia y/o prurito relacionado con colestasis; formación de cálculos biliares; porfiria; lupus eritematoso sistémico; síndrome urémico hemolítico; corea de Sydenham; herpes gestacional; pérdida de la audición relacionada con otosclerosis y angioedema (hereditario).
Examen médico/consultas: Antes de iniciar o reinstituir IMPLANON NXT® se deberá elaborar una historia médica completa (incluyendo antecedentes médicos familiares) y excluir la posibilidad de embarazo. Se deberá medir la presión arterial y realizar un examen físico, orientado por las contraindicaciones (ver Contraindicaciones) y las advertencias (ver Advertencias). Se recomienda un nuevo control médico de la paciente tres meses después de la inserción de IMPLANON NXT®. En este control, se deberá medir la presión arterial y se deberá averiguar acerca de toda pregunta, molestias o aparición de efectos no deseados. La frecuencia y la naturaleza de los futuros controles periódicos deberán adaptarse a cada paciente, según el criterio clínico.
Se deberá advertir a las pacientes de que IMPLANON NXT® no brinda protección contra el VIH (SIDA) ni otras enfermedades de transmisión sexual.
Eficacia reducida con medicamentos concomitantes: La eficacia de IMPLANON NXT® puede disminuir cuando se utiliza concomitantemente con medicamentos que disminuyen la concentración plasmática de etonogestrel (ver Interacciones).
Cambios en el patrón de sangrado menstrual: Durante el uso de IMPLANON NXT® las mujeres pueden presentar cambios en el patrón de sangrado menstrual. Estos pueden incluir cambios en la frecuencia del sangrado (ausente, disminuido, más frecuente o continuo), intensidad (reducido o aumentado), o duración. Se ha reportado amenorrea en cerca de 1 en 5 mujeres, mientras que otras 1 de 5 mujeres reportaron sangrado frecuente y/o prolongado. La dismenorrea tendió a mejorar durante el uso de IMPLANON NXT®. El patrón de sangrado experimentado durante los primeros tres meses es ampliamente predictivo de los futuros patrones de sangrado para muchas mujeres. La información, el asesoramiento y el uso de un registro de sangrado diario pueden mejorar la aceptación de la mujer de un patrón de sangrado. Se deberá realizar una evaluación del sangrado vaginal sobre una base ad hoc, lo cual puede incluir un examen para excluir patología ginecológica o un embarazo.
Implante roto o doblado in situ: Ha habido reportes de implantes rotos o doblados remanentes en el brazo de la paciente. Según datos in vitro, cuando los implantes están rotos o doblados, la tasa de liberación del etonogestrel puede estar ligeramente aumentada. Este cambio no se espera que tenga efectos clínicamente significativos.
Cuando un implante es removido, es importante removerlo en su totalidad (ver la Cómo remover IMPLANON NXT®).
POSOLOGÍA Y MODO DE ADMINISTRACIÓN: Antes de la inserción de IMPLANON NXT® se deberá descartar la posibilidad de un embarazo
Se recomienda fuertemente a los profesionales de la salud participar en una sesión de entrenamiento para familiarizarse con el uso del aplicador de IMPLANON NXT®, y las técnicas para la inserción y retiro del IMPLANON NXT®, y en los casos en que se aplique, solicitar supervisión antes de insertar o remover el implante.
Antes de la inserción de IMPLANON se recomienda leer con cuidado las instrucciones de inserción y retiro del implante en el punto “Cómo se inserta IMPLANON NXT®” y el punto “Cómo se retira IMPLANON NXT®”.
Cómo se usa IMPLANON NXT®: IMPLANON NXT® es un anticonceptivo hormonal de acción prolongada. Se inserta un implante único por vía subdérmica, y puede ser dejado en su sitio de inserción hasta por 3 años. Se recomienda retirar el implante antes de pasados 3 años desde el momento de su inserción. Se deberá informar a la usuaria que puede solicitar la extracción de Implanon en cualquier momento. Los médicos pueden considerar reemplazar antes el implante en mujeres de mayor peso corporal (ver Advertencias). Luego de la extracción del implante, la inserción inmediata de otro implante proporcionará protección anticonceptiva continua. Si la mujer no desea continuar usando IMPLANON NXT® pero desea seguir evitando un embarazo, debe recomendarse otro método anticonceptivo.
Para asegurar la efectividad y la extracción de IMPLANON NXT® sin complicaciones, es necesario que IMPLANON NXT® sea insertado en forma correcta, directamente debajo de la piel, de acuerdo con las instrucciones. Un implante insertado a un nivel más profundo que subdérmicamente (inserción profunda) podría ser no palpable y la localización y/o remoción puede ser difícil (ver Cómo remover IMPLANON NXT ® y Advertencias). Si el implante no se inserta de acuerdo con las instrucciones (Cuando se inserta IMPLANON NXT® y Cómo insertar IMPLANON NXT®), y en el día correcto, esto puede resultar en un embarazo no deseado.
El implante de IMPLANON NXT® debe ser insertado subdérmicamente inmediatamente debajo de la piel, en la cara interna de la parte superior del brazo, evitando evitando el surco entre los músculos bíceps y tríceps y los grandes vasos sanguíneos y los nervios que se encuentran allí en el haz neurovascular más profundo en el tejido subcutáneo. Inmediatamente después de la inserción, la presencia del implante puede ser verificada por palpación. En el caso en que el implante no pueda ser palpado, o cuando su presencia sea dudosa (vea Cómo insertar IMPLANON NXT®). El envase de IMPLANON NXT® contiene una tarjeta para la usuaria que registra el número del lote del implante. Se solicita al personal de salud registrar en ésta tarjeta la fecha de inserción, el brazo en el que se realizó la inserción, y el día de retiro tentativo del implante. El envase también contiene etiquetas auto adhesivas para el personal de salud, mostrando el número del lote.
Cuándo se inserta IMPLANON NXT®:
IMPORTANTE: Descartar el embarazo antes de insertar el implante.
El momento de la inserción depende de la historia anticonceptiva reciente de la mujer, de la siguiente forma: Sin uso previo de anticoncepción hormonal en el último mes: El implante deberá ser insertado entre los días 1 y 5 del ciclo menstrual (el día 1 es el primer día de su menstruación), incluso si la mujer aún está sangrando.
Si se inserta según las recomendaciones, no es necesario un anticonceptivo de respaldo. Si se desvía de la fecha recomendada de la inserción, se debe aconsejar a la mujer el uso de un método de barrera hasta 7 días después de la inserción. Si ha mantenido relaciones sexuales, debe excluirse el embarazo.
Cambio de un método anticonceptivo a IMPLANON NXT®: Cambio de un anticonceptivo hormonal combinado (anticonceptivo oral combinado (AOC), anillo vaginal o parche transdérmico): El implante deberá ser insertado preferiblemente al día siguiente del último comprimido activo (el último comprimido que contenga las sustancias activas) del AOC anterior, pero como máximo el día posterior al período usual sin comprimidos, o luego del último comprimido placebo del AOC anterior. En el caso de haber utilizado un anillo vaginal o un parche transdérmico, el implante deberá ser insertado preferiblemente el día de su extracción, pero como máximo cuando debería realizarse la próxima aplicación.
Si se inserta según las recomendaciones, no es necesario un anticonceptivo de respaldo. Si se desvía de la fecha recomendada de la inserción, se debe aconsejar a la mujer el uso de un método de barrera hasta 7 días después de la inserción. Si ha mantenido relaciones sexuales, debe excluirse el embarazo.
Cambio de un método con progestágeno solo (píldora de solo progestágeno, inyectable, otro implante, o de un sistema intrauterino [SIU]): Como existen varios métodos anticonceptivos de solo progestágenos, la inserción del implante deberá ser realizada de la siguiente forma:
• Anticonceptivos inyectables: Insertar el implante el día que corresponda a la siguiente inyección.
• Píldoras de solo progestágeno: Una mujer puede cambiarse de una píldora de solo progestágeno a IMPLANON NXT® cualquier día del mes. El implante deberá ser insertado dentro de las 24 horas siguientes a la administración de la última tableta.
• Implante anticonceptivo/endoceptivo intrauterino: Insertar el implante el mismo día que el implante previo / Endoceptivo sea removido.
Si se inserta según las recomendaciones, no es necesario un anticonceptivo de respaldo. Si se desvía de la fecha recomendada de la inserción, se debe aconsejar a la mujer el uso de un método de barrera hasta 7 días después de la inserción. Si ha mantenido relaciones sexuales, debe excluirse el embarazo.
Luego de un aborto:
• Primer trimestre: El implante debe ser insertado dentro de los 5 días siguientes a un aborto en el primer trimestre.
• Segundo trimestre: Inserte el implante entre 21 y 28 días después del aborto en el segundo trimestre.
Si se inserta según las recomendaciones, no es necesario un anticonceptivo de respaldo. Si se desvía de la fecha recomendada de la inserción, se debe aconsejar a la mujer el uso de un método de barrera hasta 7 días después de la inserción. Si ha mantenido relaciones sexuales, debe excluirse el embarazo.
Post-parto:
• Lactancia: El implante deberá ser insertado después de la cuarta semana post- parto (ver Uso durante el embarazo y la lactancia). Se debe aconsejar a la mujer el uso de un método de barrera hasta 7 días después de la inserción. Si ha mantenido relaciones sexuales, debe excluirse el embarazo.
• Mujeres no lactantes: El implante deberá ser insertado entre los días 21 y 28 post- parto. Si se inserta según las recomendaciones, no es necesario un anticonceptivo de respaldo. Si el implante es insertado después de 28 días post parto, se debe aconsejar a la mujer el uso de un método de barrera hasta 7 días después de la inserción. Si ha mantenido relaciones sexuales, debe excluirse el embarazo.
Cómo insertar IMPLANON NXT®: La base para una inserción y posterior remoción exitosas de IMPLANON NXT® es una cuidadosa y correcta aplicación subdérmica del implante en el brazo no dominante, de acuerdo con las instrucciones. Ambos, el prestador del servicio de salud y la mujer, deberán ser capaces de sentir el implante debajo de la piel, luego de su inserción.
El implante debe ser insertado de forma subdérmica, debajo de la piel. Un implante insertado a un nivel más profundo que subdérmicamente (inserción profunda) podría ser no palpable y la localización y/o remoción puede ser difícil (ver Cómo remover IMPLANON NXT® y Advertencias). Si el implante es insertado profundamente, puede ocurrir daño vascular o nervioso. Las inserciones profundas o incorrectas se han asociado con parestesias (debidas a daño nervioso) y migración del implante (debido a inserción intramuscular o facial), y, en raros casos, con inserción intravascular.
La inserción de IMPLANON NXT® debe ser llevada a cabo bajo condiciones asépticas y solo por parte de un prestador de servicios de salud calificado, que esté familiarizado con el procedimiento. La inserción del implante solo debe ser realizada con el aplicador precargado.
Se recomienda que el prestador del servicio de salud se encuentre sentado durante todo el procedimiento de inserción, de manera que el sitio de inserción y el movimiento de la aguja bajo la piel puedan ser claramente visibles desde el lado.
• Haga que la mujer se coloque acostada en decúbito supino sobre la mesa de examen con su brazo no dominante flexionado a nivel del codo, y en rotación externa, de manera que su muñeca esté paralela a su oreja y su mano colocada cerca de su cabeza (figura 1).
Figura 1
• Identifique el sitio de inserción, que está en el lado interno del brazo no dominante, aproximadamente a 8-10 cm por encima del epicóndilo medial del húmero evitando el surco entre los músculos bíceps y tríceps y los grandes vasos sanguíneos y los nervios que se encuentran allí en el haz neurovascular más profundo en el tejido subcutáneo (Figura 2). El implante debe ser insertado de forma subdérmica, justo bajo la piel (ver Advertencias).
• Haga dos marcas con un marcador estéril: Primero, marque el punto donde el implante será insertado, y después, haga una marca unos pocos centímetros proximal a la primera marca (Figura 2). Esta segunda marca servirá como guía de dirección durante la inserción.
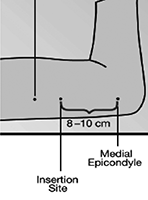
Figura 2
• Limpie el área de inserción con una solución antiséptica.
• Anestesie el área de inserción (por ejemplo, con spray anestésico, o inyectando 2 ml. de lidocaína al 1% debajo de la piel a lo largo del túnel de inserción planeado).
• Retire de su envase el aplicador estéril precargado que tiene el implante de IMPLANON NXT®. El aplicador no debe ser utilizado si la esterilidad está en duda.
• Sostenga el aplicador por encima de la aguja en el área de superficie texturizada. Retire el capuchón transparente de protección de la aguja deslizándolo horizontalmente en la dirección de la flecha lejos de la aguja (figura 3). Si éste capuchón no sale fácilmente, el aplicador no deberá ser usado. Usted podrá ver el implante de color blanco en la punta de la aguja. No toque el deslizador de color morado hasta que haya insertado completamente la aguja debajo de la piel, porque esto retraerá la aguja y liberará de forma prematura el implante del aplicador.
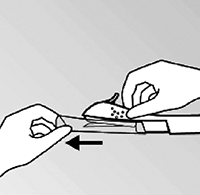
Figura 3
• Con su mano libre, estire la piel alrededor del sitio de inserción con los dedos pulgar e índice (figura 4).
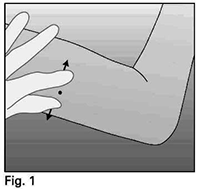
Figura 4
• Puncione la piel con la punta de la aguja suavemente angulada a menos de 30° (figura 5).
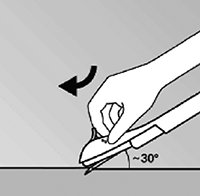
Figura 5
• Descienda el aplicador a una posición horizontal Mientras levanta la piel con la punta de la aguja (Figura 6), deslice la aguja en toda su longitud. Usted puede sentir una ligera resistencia, pero no aplique una fuerza excesiva. Si la aguja no es insertada en su totalidad, el implante no quedará correctamente colocado.
Usted puede ver mejor el movimiento de la aguja y éste puede ser insertado justo debajo de la piel, si usted está sentado y está mirando el aplicador desde el lado y NO desde arriba. En esta posición, usted puede ver claramente el sitio de inserción y el movimiento de la aguja justo bajo la piel.
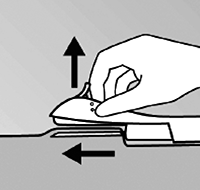
Figura 6
• Mantenga el aplicador en la misma posición, con la aguja insertada en su totalidad. De ser necesario, usted puede utilizar su mano libre para mantener el aplicador en la misma posición durante el siguiente procedimiento. Desbloquee el deslizador de color morado empujándolo ligeramente hacia abajo. Mueva el deslizador completamente hacia atrás hasta que se detenga (Figura 7). El implante está ahora en su posición subdérmica final y la aguja está bloqueada dentro del cuerpo del aplicador. El aplicador ahora puede ser removido. Si el aplicador no es mantenido en la misma posición durante este procedimiento o si el deslizador púrpura no es llevado completamente hacia atrás, el implante no será insertado de forma adecuada.
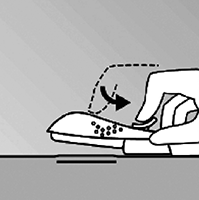
Figura 7
• Siempre verifique por palpación la presencia del implante en el brazo de la mujer inmediatamente después de la inserción. Palpando ambos extremos del implante, usted será capaz de confirmar la presencia de la varilla de 4 cm (Figura 8). Ver sección “Si la varilla no es palpable”.
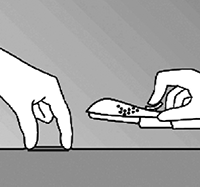
Figura 8
• Aplique un pequeño vendaje adhesivo sobre el sitio de inserción. Pida a la paciente que palpe el implante.
• Aplique un vendaje a presión con gasa estéril para minimizar la contusión. La paciente puede retirar el vendaje compresivo en 24 horas, y el vendaje pequeño sobre el sitio de inserción en 3-5 días.
• Complete la tarjeta de usuaria y entréguesela a la paciente para que la guarde. También complete las etiquetas adhesivas y adhiéralas a la historia médica de la paciente.
• El aplicador es para un solo uso y debe ser debidamente desechado acorde con las regulaciones locales para el manejo de desperdicios con riesgo biológico.
Si la varilla no es palpable: Si usted no puede palpar el implante, o duda acerca de su presencia, el implante puede no estar insertado o éste puede estar insertado profundamente:
• Revise el aplicador: La aguja debe estar totalmente retraída y solo la punta del obturador de color morado debe ser visible.
• Use otros métodos para confirmar la presencia del implante. Dado la naturaleza radio opaca del implante, los métodos adecuados para su localización son: Rayos X bidimensional y tomografía computarizada por rayos X (TAC). Ultrasonografía (ecografía) con un transductor linear de alta frecuencia (10 MHz o mayor), o resonancia magnética nuclear (RMN) pueden ser usadas. Antes del uso de rayos X, TAC, ecografía o RMN para la localización del implante, es recomendable consultar al distribuidor local de IMPLANON NXT® para recibir instrucciones. En el caso en que éstos métodos diagnósticos fallen, se recomienda verificar la presencia del implante midiendo el nivel de etonogestrel en una muestra de sangre de la mujer. En éste caso el proveedor le facilitará el procedimiento apropiado. Hasta que usted haya verificado la presencia del implante, un método anticonceptivo no hormonal deberá ser usado.
• Una vez el implante no palpable haya sido localizado, se recomienda la remoción (ver Advertencias).
Cómo extraer IMPLANON NXT®: Antes de iniciar el procedimiento de remoción, el profesional de la salud deberá consultar la tarjeta de usuaria para la localización del implante IMPLANON NXT®. Verifique la localización exacta del implante en el brazo por palpación. Ver sección abajo “localización y remoción del implante no palpable” si el implante no puede ser palpable.
Procedimiento para la remoción de un implante que es palpable: La remoción del implante solo debe ser llevada a cabo bajo condiciones asépticas, por un profesional de la salud familiarizado con la técnica de extracción.
• Limpie el sitio donde será practicada la incisión en el brazo de la mujer y aplique un antiséptico. Localice el implante por palpación y marque el sitio distal (el extremo más cercano al codo), con un marcador estéril (figura 9).
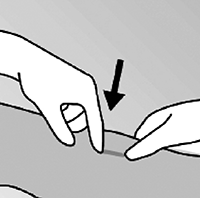
Figura 9
• Anestesie el brazo en el sitio marcado donde será hecha la incisión con, por ejemplo, 0.5 a 1.0 ml de lidocaína al 1% (figura 10). Asegúrese de inyectar el anestésico local debajo del implante, manteniéndolo cerca de la superficie de la piel.
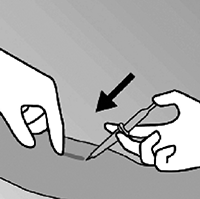
Figura 10
• Empuje hacia abajo el extremo proximal del implante (figura 11), para estabilizarlo; una protuberancia aparecerá indicando el extremo distal del implante. Iniciando en el extremo distal del implante, haga una incisión longitudinal de 2 mm hacia el codo.
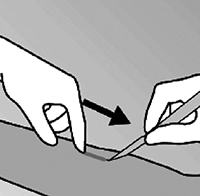
Figura 11
• Suavemente empuje el implante hacia la incisión, hasta que la punta sea visible. Tome el implante con pinzas (preferiblemente mosquito de punta curva), y extraiga el implante (figura 12).
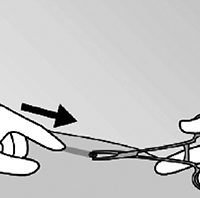
Figura 12
• Si el implante está encapsulado haga una incisión en la capa de tejido que lo cubre, y extraiga el implante con pinzas (figuras 13 y 14).
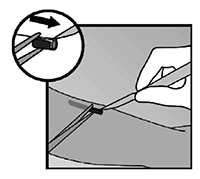
Figura 13
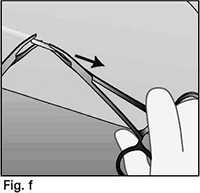
Figura 14
• Si la punta del implante no se hace visible al hacer la incisión, inserte cuidadosamente la pinza por la incisión (figura 15). Tome la pinza con su otra mano (figura 16). Con una segunda pinza diseque cuidadosamente el tejido alrededor del implante y sujete el implante (figura 17). El implante podrá ahora ser removido.
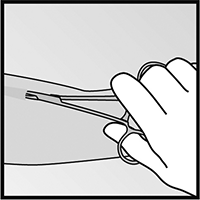
Figura 15
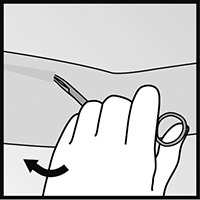
Figura 16
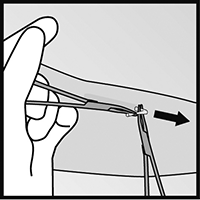
Figura 17
• Confirme que todo el implante de 4 cm haya sido removido midiendo su longitud. Ha habido reportes de implantes rotos que permanecen en el brazo de la paciente. En algunos casos, ha sido reportada una remoción difícil del implante roto. Si un implante parcial (menos de 4 cm) es removido, la pieza remanente debe ser removida siguiendo las instrucciones en la sección Cómo remover IMPLANON NXT®.
• Si la mujer desea continuar usando IMPLANON NXT®, un nuevo implante puede ser insertado inmediatamente después de remover el anterior, utilizando la misma incisión (ver la Como reemplazar IMPLANON NXT®).
• Después de extraer el implante, cierre la incisión con una banda estéril y coloque un vendaje compresivo.
• Aplique gasa estéril con vendas a presión, para evitar los hematomas. La mujer puede remover el vendaje compresivo después de 24 horas, y el vendaje pequeño luego de 3 a 5 días.
Localización y remoción de un implante no palpable: Ha habido informes ocasionales de la migración del implante; por lo general esto implica un movimiento menor relativo a la posición original (véase Advertencias), pero puede conducir a que el implante no sea inicialmente palpable en la ubicación en la que se colocó. Un implante que ha sido profundamente insertado o ha migrado puede no ser palpable y por lo tanto los procedimientos de escaneo, como se describe a continuación, puede ser necesarios para la localización.
Un implante no palpable siempre debe estar localizado antes de intentar la remoción. Dado la naturaleza radio opaca del implante, los métodos adecuados para su localización son: Rayos X bidimensional y Tomografía computarizada por rayos X (TAC). Ultrasonografía (ecografía) con un transductor linear de alta frecuencia (10 MHz o mayor), o Resonancia magnética nuclear (RMN) pueden ser usadas. Una vez que el implante se ha localizado en el brazo, el implante debe ser removido de acuerdo con las instrucciones en “Procedimiento para la eliminación de un implante que es palpable”, y el uso de la guía del ultrasonido durante la extracción debe ser considerado.
Si el implante no se puede encontrar en el brazo después de los intentos de localización compresivos, considere la aplicación de las técnicas de imagen en el pecho debido a que se han reportado eventos raros de la migración a la vasculatura pulmonar. Si el implante se encuentra en el pecho, pueden ser necesarios procedimientos quirúrgicos o endovasculares para la eliminación; los profesionales de la salud familiarizados con la anatomía del pecho deben ser consultados.
Si en cualquier momento estos métodos de imagen fallan para localizar el implante, la determinación del nivel de sangre de etonogestrel se puede utilizar para la verificación de la presencia del implante. Póngase en contacto con su distribuidor local para obtener más instrucciones.
La extracción del implante sólo debe realizarse en condiciones asépticas por un profesional de la salud que está familiarizado con la técnica de extracción. Si el implante migra dentro del brazo, la extracción puede requerir un procedimiento quirúrgico menor con una incisión más grande o un procedimiento quirúrgico en una sala de operaciones. La eliminación de los implantes insertados profundamente debe llevarse a cabo con precaución con el fin de evitar daños a las estructuras neurales o vasculares más profundas en el brazo y debe ser realizada por profesionales de la salud familiarizados con la anatomía del brazo.
La cirugía exploratoria y sin conocimiento de la ubicación exacta del implante no es en ningún caso aconsejado.
Si el implante no se puede remover, por favor póngase en contacto con su distribuidor local para obtener más instrucciones.
Cómo reemplazar IMPLANON NXT®: El reemplazo inmediato puede ser llevado a cabo después del retiro del implante previo y es similar al procedimiento descrito en la sección Como insertar IMPLANON NXT®.
El nuevo implante puede ser insertado en el mismo brazo, y a través de la misma incisión a partir de la cual fue removido el implante anterior. Si se va a usar la misma incisión para insertar un nuevo implante, anestesie el sitio de inserción por ej., con 2 ml de lidocaína al 1% aplicados debajo de la piel, comenzando en el sitio de la incisión de remoción, a lo largo del “canal de inserción”, y siga los mismos pasos descritos en las instrucciones de inserción.
SOBREDOSIS: Siempre se deberá extraer un implante antes de insertar uno nuevo. No se dispone de datos acerca de sobredosis con etonogestrel. No se han informado efectos nocivos serios de sobredosis con el uso de anticonceptivos en general.
PRESENTACIONES: Caja por 1 implante para uso subdérmico. (Reg. San. No. INVIMA 2006 M-0006318).
Fecha de revisión del documento: Este documento fue revisado por última vez en Marzo de 2016.
S-LPI-MK8415-IPTx-032016
MERCK SHARP & DOHME
Bogotá, D.C. - Colombia