
INVEGA SUSTENNA
PALIPERIDONA
Suspensión inyectable
Caja, 0 Jeringa(s) prellenada(s), Suspensión inyectable de liberación prolongada, 50 y 75 Miligramos
Caja, 0 Jeringa(s) prellenada(s), Suspensión inyectable de liberación prolongada, 100 y 150 Miligramos
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
FORMAS FARMACÉUTICAS Y CONCENTRACIONES: INVEGA SUSTENNA® contiene 75, 100 o 150 mg de paliperidona (en forma de 117, 156 o 234 mg de palmitato de paliperidona, respectivamente).
El nombre químico es (±)-3-[2-[4-(6-fluoro-1,2-benzisoxazol-3-il)-1-piperidinil]etil]-6,7,8,9-tetrahidro-2-metil-4-oxo-4H-pirido[1,2-a]pirimidin-9-il hexadecanoato.
Suspensión de liberación prolongada en jeringas precargadas. La suspensión es de color blanco o blanquecino.
Para los excipientes, ver Lista de excipientes.
INFORMACIÓN SOBRE LA ADMINISTRACIÓN: INVEGA SUSTENNA® está diseñado sólo para uso intramuscular. Inyectar lentamente y de forma profunda en el músculo. Se deben tomar precauciones para evitar inyectar inadvertidamente en un vaso sanguíneo. Cada inyección debe ser administrada por un profesional de la salud. La administración debe ser en una única inyección. No administrar la dosis en inyecciones divididas. No administrar por vía intravascular o subcutánea.
El tamaño recomendado de la aguja para la administración de INVEGA SUSTENNA® en el músculo deltoides está determinado por el peso del paciente. Para aquellos ≥ 90 kg (≥200 lb), se recomienda la aguja de calibre 22 de 1½ pulgadas. Para aquellos < 90 kg (< 200 lb), se recomienda la aguja de calibre 23 de 1 pulgada. Las inyecciones en el deltoides se deben alternar entre los dos músculos deltoides.
El tamaño recomendado de la aguja para la administración de INVEGA SUSTENNA® en el músculo glúteo es la aguja de calibre 22 de 1½ pulgadas. La administración se debe realizar en el cuadrante superior externo del glúteo. Las inyecciones en el glúteo se deben alternar entre los dos músculos glúteos.
Puesto que la paliperidona es el principal metabolito activo de la risperidona, se debe tener precaución cuando INVEGA SUSTENNA® se co-administra con risperidona o paliperidona oral durante períodos de tiempo extensos. Los datos de seguridad respecto a la administración concomitante de INVEGA SUSTENNA® con otros antipsicóticos son limitados.
POBLACIONES ESPECIALES:
Pacientes ancianos (65 años de edad y mayores): No se recomienda ajustar la dosis basados en la edad únicamente. Sin embargo, puede ser necesario ajustar la dosis si hubiera una reducción de la depuración de creatinina relacionada con la edad (ver secciones Insuficiencia renal, a continuación, y Dosis y administración).
Insuficiencia renal: La dosis de INVEGA SUSTENNA® se debe reducir en pacientes con insuficiencia renal leve; no se recomienda el uso de INVEGA SUSTENNA® en pacientes con insuficiencia renal moderada o severa (ver sección Dosis y administración). Se ha estudiado la eliminación de una dosis oral única del comprimido de liberación prolongada de 3 mg de paliperidona en sujetos con distintos grados de función renal. La eliminación de la paliperidona disminuyó con la reducción de la depuración estimada de creatinina. La depuración total de paliperidona se redujo en los sujetos con insuficiencia de la función renal, en un promedio de 32% en insuficiencia renal leve (CrCl = 50 a < 80 mL/min), en un 64% en insuficiencia renal moderada (CrCl = 30 a < 50 mL/min), y en un 71% en insuficiencia renal grave (CrCl = 10 a < 30 mL/min), lo que correspondería a un aumento promedio de la exposición (AUCinf) de 1.5, 2.6 y 4.8 veces, respectivamente, en comparación con sujetos sanos. En base a un número limitado de observaciones con INVEGA SUSTENNA® en sujetos con insuficiencia renal leve y simulaciones farmacocinéticas, la dosis de inicio recomendada de INVEGA SUSTENNA® es de 100 mg para los pacientes con insuficiencia renal leve en el primer día de tratamiento y de 75 mg una semana después; ambas administradas en el músculo deltoides; de allí en adelante, continuar con inyecciones mensuales (cada 4 semanas) de 50 mg, ya sea en el músculo deltoides o glúteo, ajustada dentro de un rango entre 25 mg a 100 mg basados en la tolerabilidad del paciente y/o la eficacia (ver sección Dosis y administración).
Insuficiencia hepática: La paliperidona no se metaboliza extensamente en el hígado. A pesar de que no se ha estudiado INVEGA SUSTENNA® en pacientes con insuficiencia hepática, no se requiere un ajuste de la dosis en pacientes con insuficiencia hepática leve o moderada. En un estudio con paliperidona oral en sujetos con insuficiencia hepática moderada (clase B de Child-Pugh), las concentraciones plasmáticas de paliperidona libre fueron similares a las de los sujetos sanos. No se ha estudiado la paliperidona en pacientes con insuficiencia hepática grave.
Raza: Los análisis de farmacocinética poblacional, según los datos de los estudios de paliperidona oral, no revelaron diferencias relacionadas a la raza en la farmacocinética de la paliperidona después de administrar INVEGA SUSTENNA®.
Género: No se observaron diferencias clínicamente significativas entre hombres y mujeres.
Tabaquismo: Según estudios in vitro con enzimas hepáticas humanas, la paliperidona no es un sustrato de CYP1A2; por lo tanto, el consumo de tabaco no debería tener efecto en la farmacocinética de la paliperidona. En consonancia con éstos resultados in vitro, no se revelaron diferencias entre fumadores y no fumadores en un análisis farmacocinético poblacional.
TITULAR DEL REGISTRO SANITARIO: JANSSEN CILAG S.A.
Carrera 11 A No.94-45, piso 10, Bogotá, D.C.
Fecha de la revisión del texto: Abril 2017.
Version del texto: CCDS 02 Febrero 2017.
INDICACIONES: INVEGA SUSTENNA® está indicado en el tratamiento de la esquizofrenia y en la prevención de la recurrencia de sus síntomas.
INVEGA SUSTENNA® está indicado para el tratamiento del trastorno esquizoafectivo como monoterapia y como complemento de los antidepresivos y estabilizadores del estado de ánimo.
PROPIEDADES FARMACOCINÉTICAS:
Absorción y distribución: Debido a su solubilidad acuosa extremadamente baja, el palmitato de paliperidona se disuelve lentamente después de la inyección intramuscular, antes de ser hidrolizado a paliperidona y ser absorbido en el sistema circulatorio. Después de una única dosis por vía intramuscular, las concentraciones plasmáticas de paliperidona aumentaron gradualmente hasta alcanzar concentraciones plasmáticas máximas a una Tmáx promedio de 13 días. La liberación del fármaco inicia tan pronto como en el día 1 y dura tanto como 126 días.
Después de la inyección intramuscular de dosis individuales (25 mg -150 mg) en el músculo deltoides, se observó una Cmáx un 28% mayor, en promedio, comparado con la inyección en el músculo glúteo. Las dos inyecciones intramusculares iniciales en el deltoides de 150 mg el día 1 y 100 mg el día 8, ayudaron a alcanzar las concentraciones terapéuticas con rapidez. El perfil de liberación y el régimen posológico de INVEGA SUSTENNA® da lugar a concentraciones terapéuticas sostenidas. La exposición total de la paliperidona tras la administración de INVEGA SUSTENNA® fue proporcional a la dosis en un rango de dosis de 25 mg a 150 mg; y fue inferior a la relación proporcional a la dosis para Cmáx para dosis superiores a 50 mg. La media del índice en estado de equilibrio del pico: valle para una dosis de INVEGA SUSTENNA® de 100 mg fue de 1.8 luego de la administración en el glúteo y de 2.2 tras la administración en el deltoides. La media de semivida aparente de la paliperidona, tras una administración de INVEGA SUSTENNA® dentro del rango de 25 mg -150 mg varió entre 25 - 49 días.
Tras la administración de palmitato de paliperidona, los enantiómeros (+) y (-) de la paliperidona se interconvierten hasta alcanzar un cociente de AUC (+) a (-) de aproximadamente 1.6-1.8.
De acuerdo con un análisis de la población, el volumen aparente de distribución de la paliperidona es de 391 L. La unión de la paliperidona racémica a las proteínas plasmáticas es del 74%.
Metabolismo y excreción: Una semana después de la administración de una dosis oral única de 1 mg de 14C-paliperidona de liberación inmediata, el 59% de la dosis se excretó inalterada en la orina, lo cual indica que la paliperidona no es intensamente metabolizada en el hígado. Aproximadamente el 80% de la radiactividad administrada se recuperó en la orina y el 11% en las heces. Se han identificado cuatro vías metabólicas in vivo, ninguna de las cuales considera en más del 6.5% de la dosis: Desalquilación, hidroxilación, deshidrogenación y escisión del benzisoxazol. A pesar de que los estudios in vitro sugieren un rol para CYP2D6 y CYP3A4 en el metabolismo de la paliperidona, no hay evidencia in vivo de que estas isoenzimas desempeñen un papel significativo en el metabolismo de la paliperidona. Los análisis farmacocinéticos de la población indican que no hay diferencias perceptibles en la depuración aparente de la paliperidona, tras la administración oral de paliperidona, entre los metabolizadores intensivos y metabolizadores pobres de sustratos de CYP2D6. En los estudios in vitro en microsomas hepáticos humanos se mostraron que la paliperidona no inhibe sustancialmente el metabolismo de los medicamentos metabolizados por las isoenzimas del citocromo P450, incluidas CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 y CYP3A5.
En los estudios in vitro se ha mostrado que la paliperidona es un sustrato de gp-P y un inhibidor débil de la gp-P en concentraciones elevadas. No existen datos in vivo disponibles y se desconoce la relevancia clínica.
Inyección de palmitato de paliperidona de acción prolongada versus paliperidona oral de liberación prolongada: INVEGA SUSTENNA® está diseñado para liberar paliperidona en periodos mensuales, mientras que la paliperidona oral se administra a diario. En la Figura 3, se presentan las medianas de los perfiles farmacocinéticos de la paliperidona durante las 5 semanas posteriores a la administración de INVEGA SUSTENNA® usando el régimen de inicio recomendado, en comparación con la administración de un comprimido oral de liberación prolongada (6 mg o 12 mg). El régimen inicial con INVEGA SUSTENNA® (150 mg/100 mg en el músculo deltoides en el Día 1 / Día 8) fue diseñado para alcanzar concentraciones estacionarias de paliperidona rápidamente, cuando se inicia la terapia sin utilizar un suplemento oral.
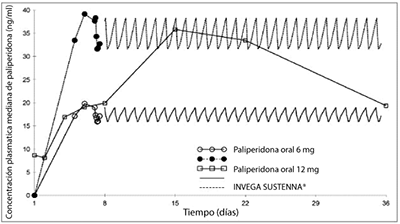
Figura 3.
Mediana de perfiles concentración plasmática – tiempo después de los perfiles farmacocinéticos medianos de paliperidona durante 5 semanas tras administrar INVEGA SUSTENNA® usando el régimen de inicio recomendado (iniciando con palmitato de paliperidona equivalente a 150 mg / 100 mg en el músculo deltoides en el Día 1 / Día 8) comparado con la administración diaria de un comprimido oral de liberación prolongada (6 mg o 12 mg).
En general, los niveles plasmáticos de inicio globales de INVEGA SUSTENNA® estuvieron dentro del rango de exposición observado con 6 mg -12 mg de paliperidona oral de liberación prolongada. El uso del régimen de inicio de INVEGA SUSTENNA® permitió a los pacientes permanecer dentro de este margen de exposición de 6 mg -12 mg de paliperidona oral de liberación prolongada, incluso en los días de concentración mínima previos a la administración de la dosis (Día 8 y Día 36). La variabilidad intersujetos en la farmacocinética de la paliperidona, tras la administración de INVEGA SUSTENNA® fue inferior en relación con la variabilidad determinada con los comprimidos de paliperidona oral de liberación prolongada. Debido a la diferencia en los perfiles farmacocinéticos medianos de los dos productos, se debe tener precaución al hacer una comparación directa de sus propiedades farmacocinéticas.
PROPIEDADES FARMACODINÁMICAS:
Grupo farmacoterapéutico: Otros antipsicóticos. Código ATC: N05AX13.
Mecanismo de acción: La paliperidona, el ingrediente activo de INVEGA SUSTENNA®, es un agente psicotrópico que pertenece a la clase química de los derivados del benzisoxazol (antipsicótico neuroléptico atípico). INVEGA SUSTENNA® contiene una mezcla racémica de paliperidona (+)- y (-)-.
El palmitato de paliperidona es hidrolizado a paliperidona (ver sección Información no clínica). La paliperidona es un antagonista dopaminérgico D2 de acción central, con actividad predominantemente antagonista serotoninérgica 5-HT2A. La paliperidona es también activa como un antagonista sobre los receptores adrenérgicos a1 y a2 y sobre los receptores histaminérgicos H1. La paliperidona no tiene afinidad por los receptores muscarínicos colinérgicos o por los receptores adrenérgicos ß1 y ß2. La actividad farmacológica de los enantiómeros de la paliperidona (+)- y (-)- es cualitativa y cuantitativamente similar.
El mecanismo de acción de la paliperidona, al igual que otros fármacos con eficacia en la esquizofrenia y trastorno esquizoafectivo, se desconoce. Sin embargo, se ha propuesto que la actividad terapéutica del fármaco en la esquizofrenia y el trastorno esquizoafectivo está mediada a través de una combinación antagonista sobre el receptor dopaminérgico de tipo 2 (D2) y sobre el receptor serotoninérgico de tipo 2 (5HT2A). El antagonismo sobre otros receptores distintos de D2 y 5HT2A puede explicar algunos de los otros efectos de la paliperidona.
Efecto sobre el intervalo QT/QTc y electrofisiología cardíaca: Los efectos de la paliperidona oral sobre el intervalo QT se evaluaron en dos estudios doble ciego, aleatorizados, multicéntricos, de fase 1 en adultos con esquizofrenia y trastorno esquizoafectivo, y en tres estudios de eficacia a dosis fija, controlados por placebo y activo, de 6 semanas en adultos con esquizofrenia.
En el primer estudio de fase 1 (n = 141), los sujetos fueron aleatorizados para recibir paliperidona oral de liberación inmediata una vez al día por 7 días (titulada de 4 a 8 mg), o una única dosis de moxifloxacino (400 mg). La dosis de paliperidona oral de liberación inmediata de 8 mg una vez al día (n = 50, Cmáx ss = 113 ng/mL) alcanzó una concentración plasmática máxima promedio en estado estacionario mayor a dos veces la exposición observada con la dosis máxima recomendada de 150 mg de INVEGA SUSTENNA® administrada en el músculo deltoides (mediana prevista de Cmáx ss = 50 ng/mL). En la corrección del QT derivado del promedio lineal diario ajustado al modelo (QTcLD), hubo un incremento promedio de 5.5 ms (IC del 90%: 3.66; 7.25) en el grupo tratado con INVEGA SUSTENNA® (n = 50).
En el segundo estudio de fase 1 (n = 109), los sujetos fueron aleatorizados para recibir el placebo, la dosis máxima recomendada de paliperidona oral de liberación prolongada (12 mg una vez al día), subsecuentemente titulada a una dosis por encima del rango recomendado (18 mg una vez al día), o un control activo de la misma clase farmacológica del fármaco (400 mg de quetiapina dos veces al día). La comparación principal en este estudio de no inferioridad de 10 días fue entre 12 mg de paliperidona de liberación prolongada y la quetiapina. El cambio promedio en los mínimos cuadrados desde el estado basal en la QTcLD del Tmáx observado de cada individuo se estimó ser 5.1 ms menor para 12 mg de paliperidona de liberación prolongada (Cmáx promedio 34 ng/mL), en comparación con 400 mg de quetiapina dos veces al día (Cmáx promedio 1183 ng/mL) (IC del 90%: -9,2; -0,9), cumpliendo el criterio de no inferioridad pre-especificado de 10 ms. El cambio promedio desde el estado basal en la QTcLD en el Tmáx observado de cada individuo se estimó ser 2.3 ms menor para 18 mg de paliperidona de liberación prolongada (Cmáx promedio 53 ng/mL) en comparación con 400 mg de quetiapina dos veces al día (Cmáx promedio 1183 ng/mL) (IC del 90%: -6.8; 2.3).
El cambio promedio desde el estado basal en la QTcLD para el Tmáx observado de cada individuo se estimó ser 1.5 ms mayor (IC del 90%: -3.3; 6.2) para 12 mg de paliperidona de liberación prolongada y 8.0 ms mayor (IC del 90%: 3.1; 12.9) para 400 mg de quetiapina dos veces al día en comparación con el cambio promedio desde el estado basal en la QTcLD para la mediana del Tmáx observado (del fármaco activo en la comparación) en el grupo placebo concurrente. El cambio promedio desde el estado basal en la QTcLD para el Tmáx observado para cada individuo fue estimado ser 4.9 ms mayor (IC del 90%: -0.5; 10.3) para 18 mg de paliperidona de liberación prolongada y 7.5 ms mayor (IC del 90%: 2.5; 12.5) para quetiapina 400 mg dos veces al día en comparación con el cambio promedio desde el estado basal en la QTcLD para la mediana del Tmáx observado (del fármaco activo en la comparación) en el grupo placebo concurrente.
Ninguno de los sujetos presentó un cambio desde el estado basal excediendo 60 ms o una QTcLD excediendo 500 ms en algún momento durante estos estudios.
Para los tres estudios de eficacia a dosis fija de la paliperidona oral de liberación prolongada en sujetos con esquizofrenia, se tomaron medidas electrocardiográficas (ECG) exhaustivas en 15 puntos de evaluación en días especificados (incluyendo los tiempos de la Cmáx esperada) utilizando una metodología estandarizada. El incremento promedio de la QTcLD no excedió 5 ms en ningún grupo de tratamiento en ningún momento, basado en los datos agrupados de 836 sujetos tratados con paliperidona de liberación prolongada, 357 sujetos tratados con olanzapina y 350 sujetos tratados con el placebo. Un sujeto en el grupo de 12 mg de paliperidona de liberación prolongada y olanzapina presentaron un cambio excediendo 60 ms en un punto de evaluación durante estos estudios (incrementos de 62 y 110 ms, respectivamente).
En los cuatro estudios de eficacia a dosis fija de INVEGA SUSTENNA® en sujetos con esquizofrenia y en el estudio a largo plazo en sujetos con trastorno esquizoafectivo, ningún sujeto experimentó un cambio en la QTcLD excediendo los 60 ms y ningún sujeto presentó un valor de la QTcLD > 500 ms en ningún momento de la evaluación. En el estudio a largo plazo de la prevención de la recurrencia en sujetos con esquizofrenia, ningún sujeto tuvo un cambio en la QTcLD > 60 ms, y solo un sujeto tuvo un valor de QTcLD de 507 ms (valor del intervalo corregido de QT de Bazett [QTcB] de 483 ms); este último paciente también presentó una frecuencia cardíaca de 45 latidos por minuto.
INFORMACIÓN FARMACÉUTICA:
Lista de excipientes: Los ingredientes inactivos de INVEGA SUSTENNA® son ácido cítrico monohidrato, disodio hidrogenofosfato anhidro, polietilenglicol 4000, polisorbato 20, sodio dihidrógeno fosfato monohidrato, hidróxido sódico y agua para inyección.
Incompatibilidades: INVEGA SUSTENNA® no se debe mezclar con ningún otro producto ni diluyente y se debe inyectar directamente por vía intramuscular con la jeringa en la que va envasado.
Período de validez: Verifique la fecha de caducidad en el envase exterior.
CONTRAINDICACIONES: INVEGA SUSTENNA® está contraindicado en pacientes con hipersensibilidad conocida a la paliperidona o a cualquier componente de la formulación. Debido a que la paliperidona es un metabolito activo de la risperidona, INVEGA SUSTENNA® está contraindicado en pacientes con hipersensibilidad conocida a la risperidona.
EMBARAZO Y LACTANCIA:
Embarazo: No se ha establecido la seguridad del uso de palmitato de paliperidona inyectado por vía intramuscular o la de la dosis de paliperidona por vía oral, durante el embarazo en humanos.
Un estudio de cohorte observacional retrospectivo basado en una base de datos de aseveraciones de EE.UU. comparó el riesgo de malformaciones congénitas para nacimientos vivos entre mujeres con y sin uso de antipsicóticos durante el primer trimestre del embarazo. La paliperidona, que es el metabolito activo de la risperidona, no fue evaluada específicamente en este estudio. El riesgo de malformaciones congénitas con risperidona, después de ajustar por las variables de confusión disponibles en la base de datos, se incrementó en comparación con la ausencia de exposición a antipsicóticos (riesgo relativo = 1.26, IC del 95%: 1.02-1.56). No se ha identificado el mecanismo biológico para explicar estos hallazgos y no se han observado efectos teratogénicos en estudios no-clínicos. Basado en los hallazgos de este único estudio observacional, no se ha establecido una relación causal entre la exposición a risperidona in utero y las malformaciones congénitas.
Los animales de laboratorio tratados con una dosis oral alta de paliperidona mostraron un ligero incremento de muertes fetales. Los parámetros del embarazo no fueron afectados en ratas que recibieron inyección intramuscular de palmitato de paliperidona. Las dosis altas fueron tóxicas para las madres. Las crías no fueron afectadas por exposiciones orales de 20 a 22 veces la exposición máxima humana, o por exposiciones intramusculares 6 veces la exposición máxima humana.
Los neonatos expuestos a fármacos antipsicóticos (incluyendo paliperidona) durante el tercer trimestre de embarazo presentan riesgo de síntomas extrapiramidales y/o de abstinencia que puede variar en severidad después del parto. Estos síntomas en los neonatos pueden incluir agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria o trastornos alimentarios.
INVEGA SUSTENNA® sólo se debe usar durante el embarazo si los beneficios superan a los riesgos. Se desconoce el efecto de INVEGA SUSTENNA® en el trabajo de parto y el parto en los humanos.
Lactancia: En los estudios en animales con paliperidona y estudios en humanos con risperidona, la paliperidona se excretó en la leche. Por tanto, las mujeres que reciben INVEGA SUSTENNA® no deben dar de lactar a los infantes.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS: INVEGA SUSTENNA® puede interferir con las actividades que requieran alerta mental y puede tener efectos en la visión (ver sección Reacciones adversas). Por lo tanto, se debe aconsejar a los pacientes que no conduzcan ni operen máquinas hasta conocer su sensibilidad individual.
REACCIONES ADVERSAS: En esta sección se presentarán las reacciones adversas. Las reacciones adversas son eventos adversos que se consideran estar razonablemente asociados con el uso de palmitato de paliperidona basado en la evaluación exhaustiva de la información disponible del evento adverso. No se puede establecer de manera fiable una relación causal con palmitato de paliperidona en casos individuales. Además, debido a que los estudios clínicos se realizan bajo condiciones muy variables, las tasas de la reacción adversa observada en los estudios clínicos de un fármaco no pueden ser directamente comparadas con las tasas en los estudios clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica clínica.
Datos de estudios clínicos: Los datos descritos en esta sección se derivan de la base de datos de estudios clínicos, que incluye un total de 3817 sujetos adultos (aproximadamente 1705 paciente-años de exposición) con esquizofrenia que recibieron al menos una dosis de INVEGA SUSTENNA® en el rango de dosis recomendado de 25 mg a 150 mg y un total de 510 sujetos con esquizofrenia que recibieron placebo. De los 3817 sujetos tratados con INVEGA SUSTENNA®, 1293 recibieron INVEGA SUSTENNA® en cuatro estudios doble ciego, a dosis fija, controlados por el placebo (un estudio de 9 semanas y tres estudios de 13 semanas); 849 recibieron INVEGA SUSTENNA® en un estudio a largo plazo para la prevención de la recurrencia (mediana de la exposición de 229 días durante la fase inicial abierta de 33 semanas de este estudio, de los cuales 205 continuaron recibiendo INVEGA SUSTENNA® durante la fase doble ciego, controlada por placebo de este estudio [mediana de la exposición 171 días]); y 1675 recibieron INVEGA SUSTENNA® en cinco estudios no controlados por placebo (tres estudios de no inferioridad con comparador activo, un estudio abierto de farmacocinética y seguridad a largo plazo y un estudio cruzado del lugar de la inyección [deltoides-glúteo]). Uno de los estudios de 13 semanas incluyó una dosis inicial de 150 mg de INVEGA SUSTENNA® seguida por el tratamiento con 25 mg, 100 mg o 150 mg cada 4 semanas.
También se evaluó la seguridad de INVEGA SUSTENNA® en sujetos adultos con trastorno esquizoafectivo que participaron en un estudio de prevención de la recaída a largo plazo. Se administró INVEGA SUSTENNA® a un total de 667 sujetos durante el período inicial abierto de 25 semanas de este estudio (mediana de exposición de 147 días); 164 sujetos continuaron para recibir INVEGA SUSTENNA® durante el período doble ciego, controlado por placebo, de 15 meses de este estudio (mediana de exposición de 446 días).
La mayoría de las reacciones adversas fueron de intensidad leve a moderada.
Datos doble ciego, controlado por placebo: Las reacciones adversas reportadas por ≥2% de los sujetos con esquizofrenia tratados con INVEGA SUSTENNA® en los cuatro estudios doble ciego, controlados por placebo, a dosis fija, se muestran en la tabla 3.
|
Tabla 3. Reacciones adversas en ≥2% de los sujetos con esquizofrenia tratados con INVEGA SUSTENNA® en los cuatro estudios doble ciego, controlados por placebo, a dosis fija. |
|||||||
|
INVEGA SUSTENNA® |
|||||||
|
Clase de sistema / órgano |
Placeboa |
25 mg |
50 mg |
100 mg |
150/25 mgb |
150/100 mgb |
150/150 mgb |
|
Reacción adversa |
(N = 510) |
(N = 130) |
(N = 302) |
(N = 312) |
(N = 160) |
(N = 165) |
(N = 163) |
|
Porcentaje total de sujetos con reacción adversa |
46 |
54 |
50 |
52 |
44 |
43 |
47 |
|
Infecciones e infestaciones |
|||||||
|
Infección de vías respiratorias altas |
2 |
2 |
2 |
2 |
1 |
2 |
4 |
|
Trastornos psiquiátricos |
|||||||
|
Agitación |
7 |
10 |
5 |
9 |
8 |
5 |
4 |
|
Insomnio |
15 |
15 |
15 |
13 |
12 |
10 |
13 |
|
Pesadillas |
< 1 |
2 |
0 |
0 |
0 |
0 |
0 |
|
Trastornos del sistema nervioso |
|||||||
|
Acatisia |
3 |
2 |
2 |
3 |
1 |
5 |
6 |
|
Mareos |
1 |
6 |
2 |
4 |
1 |
4 |
2 |
|
Trastorno extrapiramidal |
1 |
5 |
2 |
3 |
1 |
0 |
0 |
|
Cefalea |
12 |
11 |
11 |
15 |
11 |
7 |
6 |
|
Somnolencia/sedación |
3 |
5 |
7 |
4 |
1 |
5 |
5 |
|
Trastornos vasculares |
|||||||
|
Hipertensión |
1 |
2 |
1 |
1 |
1 |
1 |
0 |
|
Trastornos gastrointestinales |
|||||||
|
Dolor abdominal superior |
1 |
0 |
1 |
2 |
1 |
1 |
1 |
|
Estreñimiento |
5 |
3 |
5 |
5 |
2 |
4 |
1 |
|
Diarrea |
2 |
0 |
3 |
2 |
1 |
2 |
2 |
|
Sequedad bucal |
1 |
3 |
1 |
0 |
1 |
1 |
1 |
|
Náuseas |
3 |
4 |
4 |
3 |
2 |
2 |
2 |
|
Dolor de muelas |
1 |
1 |
1 |
3 |
1 |
2 |
3 |
|
Vómitos |
4 |
5 |
4 |
2 |
3 |
2 |
2 |
|
Trastornos musculoesqueléticos y del tejido conectivo |
|||||||
|
Dolor en las extremidades |
1 |
0 |
2 |
2 |
2 |
3 |
0 |
|
Trastornos generales y condiciones en el lugar de administración |
|||||||
|
Astenia |
0 |
2 |
1 |
< 1 |
0 |
1 |
1 |
|
Fatiga |
1 |
1 |
2 |
2 |
1 |
2 |
1 |
|
Dolor en el lugar de la inyecciónc |
2 |
0 |
3 |
5 |
9 |
7 |
8 |
|
Investigaciones |
|||||||
|
Aumento de peso |
1 |
4 |
4 |
1 |
1 |
1 |
2 |
|
a El grupo placebo es agrupado a partir de todos los estudios e incluyó inyecciones en el deltoides o el glúteo, dependiendo del diseño del estudio. b Inyección inicial de 150 mg en el deltoides, seguida de una inyección de 25 mg, 100 mg o 150 mg, en el deltoides o en el glúteo cada 4 semanas. Los otros grupos de dosificación (25 mg, 50 mg y 100 mg) corresponden a estudios realizados sólo con inyecciones en los glúteos. (Ver sección Propiedades farmacodinámicas). c El dolor en el lugar de la inyección incluye dolor en el sitio de inyección, prurito, nódulos e induración. |
|||||||
En el estudio a largo plazo de prevención de recurrencia, los tipos de reacción adversa, las frecuencias y la severidad durante las fases abiertas de este estudio fueron generalmente comparables a aquellas observadas en los cuatro estudios controlados por placebo, a dosis fija, de 13 semanas y 9 semanas mostradas en la Tabla 1. Las reacciones adversas reportadas durante la fase doble ciego de este estudio fueron generalmente similares en tipo y severidad a las que se observaron en las fases abiertas.
Datos de otros estudios clínicos: El palmitato de paliperidona es hidrolizado a paliperidona. La paliperidona es el metabolito activo de la risperidona, por lo tanto, los perfiles de la reacción adversa de estos compuestos (incluyendo formulaciones orales e inyectables) son relevantes entre sí. Esta subsección incluye reacciones adversas adicionales reportadas con paliperidona y/o risperidona, en los estudios clínicos.
La tabla 4 muestran las reacciones adversas reportadas con paliperidona y/o risperidona por ≥ 2% de los sujetos tratados con INVEGA SUSTENNA® en una base de datos agrupada de 4 estudios doble ciego, controlados con placebo en esquizofrenia,
|
Tabla 4. Reacciones adversas reportadas con paliperidona y/o risperidona por ≥ 2% de los sujetos tratados con INVEGA SUSTENNA® en una base de datos agrupada de 4 estudios doble ciego, controlados con placebo en esquizofrenia. Los términos dentro de cada clase de sistema/órgano están ordenados alfabéticamente. |
|
|
Clase de sistema/órgano |
Reacción adversa |
|
Trastornos psiquiátricos |
Ansiedad |
|
Trastornos del sistema nervioso |
Acatisia*, parkinsonismo* |
|
Trastornos gastrointestinales |
Malestar abdominal |
|
Trastornos musculoesqueléticos y del tejido conectivo |
Dolor musculoesquelético |
|
Trastornos generales y condiciones en el lugar de administración |
Reacción en el lugar de inyección |
|
* Acatisia incluye: hipercinesia, síndrome de piernas inquietas, agitación; parkinsonismo incluye: acinesia, bradicinesia, rigidez en rueda dentada, babeo, síntomas extrapiramidales, reflejo glabelar anormal, rigidez muscular, contractura muscular, rigidez musculoesquelética. |
|
La tabla 5 muestra las reacciones adversas con paliperidona y/o risperidona reportadas por < 2% de los sujetos tratados con INVEGA SUSTENNA® en una base de datos agrupada de 4 estudios doble ciego, controlados con placebo en esquizofrenia.
|
Tabla 5. Reacciones adversas reportadas con paliperidona y/o risperidona por < 2% de los sujetos tratados con INVEGA SUSTENNA® en una base de datos agrupada de 4 estudios doble ciego, controlados con placebo en esquizofrenia. Los términos dentro de cada clase de sistema/órgano están ordenados alfabéticamente. |
|
|
Clase de sistema / órgano |
Reacción adversa |
|
Infecciones e infestaciones |
Absceso subcutáneo, acarodermatitis, amigdalitis, bronquitis, celulitis, infección de oídos, infección del tracto respiratorio, infección del tracto urinario, infección ocular, influenza, neumonía, onicomicosis, sinusitis |
|
Trastornos de la sangre y del sistema linfático |
Disminución de recuento de glóbulos blancos, neutropenia |
|
Trastornos del sistema inmunológico |
Hipersensibilidad |
|
Trastornos del metabolismo y de la nutrición |
Anorexia, aumento del apetito, disminución del apetito, disminución del peso, hipercolesterolemia, hiperglucemia, hipertrigliceridemia, polidipsia |
|
Trastornos psiquiátricos |
Depresión, trastornos del sueño |
|
Trastornos del sistema nervioso |
Accidente cerebrovascular, convulsiones*, disartria, discinesia*, discinesia tardía, distonía*, hiperactividad psicomotora, hipoestesia, mareo postural, parestesia, síncope, temblor, trastornos de la atención, trastornos del equilibrio. |
|
Trastornos oculares |
Epífora, hiperemia ocular, revulsión ocular, visión borrosa, xeroftalmía |
|
Trastornos del oído y del laberinto |
Otalgia, vértigo |
|
Trastornos cardíacos |
Arritmia sinusal, bloqueo atrioventricular, bradicardia, electrocardiograma anormal, palpitaciones, QT prolongado en el electrocardiograma, síndrome de taquicardia postural ortostática, taquicardia, trastornos de la conducción. |
|
Trastornos vasculares |
Hipotensión ortostática |
|
Trastornos respiratorios, torácicos y mediastínicos |
Congestión del tracto respiratorio, congestión nasal, congestión pulmonar, disnea, dolor faringolaríngeo, epistaxis, sibilancias, tos |
|
Trastornos gastrointestinales |
Disfagia, dispepsia, flatulencia, gastroenteritis, incontinencia fecal, lengua hinchada |
|
Trastornos hepatobiliares |
Aumento de la gamma-glutamil transferasa, aumento de las enzimas hepáticas, aumento de las transaminasas |
|
Trastornos de la piel y del tejido subcutáneo |
Acné, eczema, eritema, exantema, hiperqueratosis, prurito, urticaria, xerodermia |
|
Trastornos musculoesqueléticos y del tejido conectivo |
Artralgia, cervicalgia, dolor de espalda, espasmos musculares, hinchazón de las articulaciones, rigidez de las articulaciones. |
|
Trastornos renales y urinarios |
Disuria, incontinencia urinaria, polaquiuria. |
|
Trastornos del aparato reproductor y de la mama |
Amenorrea, disfunción eréctil, disfunción sexual, galactorrea, ginecomastia, leucorrea, trastornos de la eyaculación. |
|
Trastornos generales y condiciones en el lugar de administración |
Alteraciones en la marcha, edema*, edema facial, escalofríos, induración, malestar, malestar torácico, pirexia, sed. |
|
Lesiones, intoxicación y complicaciones de procedimientos |
Caídas |
|
* Convulsiones incluyen: convulsión del gran mal; Discinesia incluye: atetosis, corea, coreoatetosis, trastornos del movimiento, espasmos musculares, mioclono; Distonía incluye: blefaroespasmo, espasmo cervical, emprostotonos, espasmo facial, hipertonía, laringoespasmo, contracciones musculares involuntarias, miotonía, oculógiros, opistótonos, espasmo orofaríngeo, pleurototono, risa sardónica, tetania, parálisis lingual, espasmo lingual, tortícolis, trismo; Edema incluye: edema generalizado, edema periférico, edema por fóvea. |
|
La tabla 6 muestra las reacciones adversas reportadas con paliperidona y/o risperidona en otros ensayos clínicos, pero no reportados por sujetos tratados con INVEGA SUSTENNA®, en una base de datos agrupada de 4 estudios doble ciego, controlados con placebo en esquizofrenia.
|
Tabla 6. Reacciones adversas reportadas con paliperidona y/o risperidona en otros estudios clínicos, pero no reportados por sujetos tratados con INVEGA SUSTENNA®, en una base de datos agrupada de 4 ensayos doble ciego, controlados con placebo en esquizofrenia. Los términos dentro de cada clase de sistema/órgano están ordenados alfabéticamente. |
|
|
Clase de sistema / órgano |
Reacción adversa |
|
Infecciones e infestaciones |
Cistitis |
|
Trastornos de la sangre y del sistema linfático |
Anemia, hematocrito reducido, recuento incrementado de eosinófilos |
|
Trastornos del sistema inmunológico |
Reacción anafiláctica |
|
Trastornos endocrinos |
Glucosuria, hiperprolactinemia |
|
Trastornos del metabolismo y de la nutrición |
Hiperinsulinemia |
|
Trastornos psiquiátricos |
Afecto embotado, anorgasmia, estado de confusión, libido disminuido |
|
Trastornos del sistema nervioso |
Coma diabético, coordinación anormal, falta de respuesta a estímulos, nivel de conciencia deprimido, pérdida de conciencia, síndrome neuroléptico maligno, titubeo de cabeza, trastorno cerebrovascular. |
|
Trastornos oculares |
Conjuntivitis, fotofobia, glaucoma, trastornos de los movimientos oculares |
|
Trastornos del oído y del laberinto |
Tinnitus |
|
Trastornos vasculares |
Hipotensión, isquemia, rubor |
|
Trastornos respiratorios, torácicos y mediastínicos |
Disfonía, hiperventilación, neumonía por aspiración, estertores |
|
Trastornos gastrointestinales |
Fecaloma, queilitis, obstrucción intestinal |
|
Trastornos de la piel y del tejido subcutáneo |
Dermatitis seborreica, discromías cutáneas, erupción por fármacos |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Debilidad muscular, incremento de la creatina fosfoquinasa en sangre, postura anormal, rabdomiólisis |
|
Trastornos del aparato reproductor y de la mama |
Aumento del tamaño de la mama, congestión mamaria, malestar mamario retraso en la menstruación, secreción mamaria, trastornos menstruales* |
|
Trastornos generales y condiciones en el lugar de administración |
Disminución de la temperatura corporal, incremento de la temperatura corporal, síndrome de abstinencia al fármaco |
|
*Trastornos menstruales incluyen: menstruación irregular, oligomenorrea. |
|
Trastorno esquizoafectivo: El perfil de seguridad de INVEGA SUSTENNA® en pacientes con trastorno esquizoafectivo es similar al observado en pacientes con esquizofrenia.
Eventos de particular interés a la clase:
Síntomas extrapiramidales (SEP): Los datos agrupados de los dos estudios doble ciego, controlados con placebo, a dosis fija en esquizofrenia de 13 semanas (ver sección Eficacia clínica) no mostraron diferencias en los SEP emergentes del tratamiento entre el placebo e INVEGA SUSTENNA®. La evaluación de los SEP incluyó un análisis agrupado de los siguientes grupos de SEP: discinesia, distonía, hipercinesia, parkinsonismo y temblores. Los resultados del estudio de esquizofrenia de 13 semanas incluyendo dosis de inicio de 150 mg, del estudio doble ciego, controlado con placebo, a dosis fija en esquizofrenia de 9 semanas, y de todas las fases del estudio de prevención de recurrencia a largo plazo en sujetos con esquizofrenia y trastorno esquizoafectivo exhibieron hallazgos comparables.
Aumento de peso: Las proporciones de sujetos que cumplieron con el criterio de aumento de peso de ≥7% del peso corporal en el estudio de 13 semanas en esquizofrenia incluyendo dosis de inicio de 150 mg, los incrementos de peso desde el valor basal ≥ 7% fue más común entre los sujetos de los grupos con INVEGA SUSTENNA® que en el grupo del placebo. La proporción de sujetos con incremento del peso anormal ≥ 7% mostró una tendencia relacionada con la dosis, con una tasa de incidencia del 5% en el grupo del placebo en comparación con las tasas de 6%, 8% y 13% en los grupos con 25 mg, 100 mg y 150 mg de INVEGA SUSTENNA®, respectivamente.
En los dos estudios doble ciego, controlados con placebo, a dosis fija de 13 semanas en esquizofrenia (datos agrupados), las proporciones de sujetos que cumplieron con un criterio de aumento de peso ≥7% del peso corporal fueron 6%, 9% y 10% en los grupos con 25 mg, 50 mg y 100 mg de INVEGA SUSTENNA® respectivamente, en comparación con el 2% del grupo con placebo. En el estudio, doble ciego, controlado con placebo, a dosis fija, de 9 semanas en esquizofrenia el 8% y 6% de los grupos con 50 mg y 100 mg de INVEGA SUSTENNA®, respectivamente, cumplieron este criterio en comparación con el 4% del grupo con el placebo.
Durante el período abierto de 33 semanas de transición/mantenimiento del estudio a largo plazo en prevención de recurrencia de la esquizofrenia, el 12% de los sujetos tratados con INVEGA SUSTENNA® cumplió este criterio (aumento de peso de ≥7% desde la fase doble ciego hasta el punto final); la media (DE) en el cambio de peso desde los niveles basales de la fase abierta fue de +0.7 (4.79) kg. En la fase doble ciego, de duración variable, este criterio se cumplió por el 6% de los sujetos tratados con INVEGA SUSTENNA® (mediana de la duración 171 días [rango 1-407 días]), en comparación con el 3% de los sujetos tratados con el placebo (mediana de la duración 105 días [rango 8-441 días]); la media (DE) del cambio de peso desde los niveles basales de la fase doble ciego fue +0.5 (3.83) kg para INVEGA SUSTENNA® en comparación con -1.0 kg (3.08) para el placebo. Se observaron resultados similares en la fase abierta de extensión de este estudio.
Durante el período inicial abierto de 25 semanas del estudio a largo plazo en sujetos con trastorno esquizoafectivo, INVEGA SUSTENNA® se asoció con un cambio de peso promedio de +2.2 kg y el 18.4% de los sujetos presentaron un incremento en el peso corporal de ≥ 7% (n=653). En el punto final del período subsiguiente doble ciego de 15 meses del estudio, INVEGA SUSTENNA® se asoció a con un cambio de peso promedio de -0.2 kg y el 13.0% de los sujetos presentó un incremento del peso corporal de ≥ 7% (n=161); el grupo con el placebo presentó un cambio de peso promedio de -0.8 kg y el 6.0% de los sujetos presentó un incremento del peso corporal de ≥ 7% (n=168).
Pruebas de laboratorio: Prolactina sérica. Basado en los datos agrupados de dos estudios doble ciego, controlados con placebo, a dosis fija de 13 semanas (ver sección Eficacia clínica), se observaron incrementos en la mediana de la prolactina sérica en sujetos de ambos géneros que recibieron INVEGA SUSTENNA®. Los resultados del estudio de 13 semanas incluyendo una dosis inicial de 150 mg, del estudio doble ciego, controlado con placebo, a dosis fija, de 9 semanas, y de la fase doble ciego del estudio en prevención de la recurrencia exhibieron hallazgos comparables.
Datos posteriores a la comercialización: Además de las reacciones adversas reportadas durante estudios clínicos y descritas anteriormente, se reportaron las siguientes reacciones adversas durante la experiencia posterior a la comercialización de paliperidona y/o risperidona (Tabla 7). En esta tabla, las frecuencias se presentan de acuerdo con la siguiente convención:
Muy frecuentes ≥1/10
Frecuentes ≥1/100 a < 1/10
Poco frecuentes ≥1/1000 a < 1/100
Raras ≥1/10000 a < 1/1000
Muy raras < 1/10000, incluso reportes aislados.
La tabla 7 presenta las reacciones adversas categorizadas por frecuencia, basado en las tasas de los reportes espontáneos.
|
Tabla 7. Reacciones adversas identificadas durante la experiencia posterior a la comercialización con paliperidona y/o risperidona, categorizadas por frecuencia estimadas a partir de tasas de reportes espontáneos de paliperidona |
|
|
Trastornos de la sangre y del sistema linfático |
|
|
Muy raras |
Agranulocitosis, trombocitopenia |
|
Trastornos endocrinos |
|
|
Desconocidas |
Secreción inapropiada de la hormona antidiurética |
|
Trastornos del metabolismo y de la nutrición |
|
|
Muy raras |
Diabetes mellitus, cetoacidosis diabética, hipoglucemia |
|
Desconocidas |
Intoxicación con agua |
|
Trastornos psiquiátricos |
|
|
Muy raras |
Manía |
|
Trastornos del sistema nervioso |
|
|
Muy raras |
Disgeusia |
|
Trastornos oculares |
|
|
Desconocidas |
Síndrome del iris flácido (intraoperatorio) |
|
Trastornos cardíacos |
|
|
Muy raras |
Fibrilación auricular |
|
Trastornos vasculares |
|
|
Muy raras |
Trombosis venosa profunda, embolismo pulmonar |
|
Trastornos respiratorios, torácicos y mediastínicos |
|
|
Muy raras |
Síndrome de apnea del sueño |
|
Trastornos gastrointestinales |
|
|
Muy raras Muy raras |
Pancreatitis Íleo |
|
Trastornos hepatobiliares |
|
|
Desconocidas |
Ictericia |
|
Trastornos de la piel y del tejido subcutáneo |
|
|
Raras |
Angioedema |
|
Muy raras |
Alopecia |
|
Trastornos renales y urinarios |
|
|
Muy raras |
Retención de orina |
|
Embarazo, puerperio y condiciones perinatales |
|
|
Muy raras |
Síndrome de abstinencia neonatal al fármaco |
|
Trastornos del aparato reproductor y de la mama |
|
|
Muy raras |
Priapismo |
|
Trastornos generales y condiciones en el lugar de administración |
|
|
Muy raras |
Hipotermia, absceso, celulitis y hematoma en el lugar de la inyección |
|
Desconocidas |
Quiste, necrosis y úlcera en el lugar de la inyección |
Se han reportado muy raramente, casos de reacción anafiláctica después de la inyección de INVEGA SUSTENNA® durante la experiencia posterior a la comercialización en pacientes que previamente han tolerado la risperidona oral o la paliperidona oral.
INTERACCIONES: Se recomienda precaución al prescribir INVEGA SUSTENNA® con fármacos conocidos por prolongar el intervalo QT.
Debido a que el palmitato de paliperidona es hidrolizado a paliperidona (ver sección Propiedades farmacocinéticas) se deben tomar en consideración los resultados de estudios con paliperidona oral al evaluar el potencial de interacción fármaco-fármaco.
Potencial de INVEGA SUSTENNA® para afectar a otros fármacos: No se espera que la paliperidona cause interacciones farmacocinéticas clínicamente importantes con fármacos que son metabolizados mediante isoenzimas del citocromo P-450. Estudios in vitro en microsomas hepáticos humanos mostraron que la paliperidona no inhibe sustancialmente el metabolismo de los fármacos metabolizados por las isoenzimas del citocromo P450, incluyendo CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 y CYP3A5. Por tanto, no se espera que la paliperidona inhiba la depuración de fármacos que son metabolizados por estas vías metabólicas de una forma clínicamente relevante. Tampoco se espera que la paliperidona tenga propiedades de inducción enzimática.
La paliperidona es un inhibidor débil de la glicoproteína-P (gp-P) en altas concentraciones. No existen datos in vivo disponibles y se desconoce la relevancia clínica.
Debido a los efectos principales de la paliperidona en el sistema nervioso central (SNC) (ver sección Reacciones adversas), INVEGA SUSTENNA® se debe utilizar con precaución en combinación con otros fármacos de acción central y el alcohol. La paliperidona puede antagonizar el efecto de la levodopa y otros agonistas de la dopamina.
Debido a su potencial para inducir hipotensión ortostática (ver sección Advertencias y precauciones - Hipotensión ortostática), se puede observar un efecto aditivo cuando se administra INVEGA SUSTENNA® con otros agentes terapéuticos que tengan este potencial.
La co-administración de paliperidona en comprimidos orales de liberación prolongada en el estado estacionario (12 mg una vez al día) con divalproex sódico en comprimidos de liberación prolongada (500 a 2000 mg una vez al día) no afectó la farmacocinética del valproato en el estado estacionario.
Es improbable la interacción farmacocinética entre INVEGA SUSTENNA® y el litio.
Potencial de otros fármacos para afectar INVEGA SUSTENNA®: La paliperidona no es un sustrato de la CYP1A2, CYP2A6, CYP2C9, CYP2C19 ni CYP3A5. Esto sugiere que es improbable una interacción con inhibidores o inductores de estas isoenzimas. Mientras que estudios in vitro indican que la CYP2D6 y CYP3A4 pueden estar mínimamente involucrados en el metabolismo de la paliperidona, no existen indicios in vitro ni in vivo, de que estas isoenzimas desempeñen un rol significativo en el metabolismo de la paliperidona. Los estudios in vitro han mostrado que la paliperidona es un sustrato de la gp-P.
La paliperidona es metabolizada en forma limitada por la CYP2D6 (ver sección Propiedades farmacocinéticas: Metabolismo y excreción). En un estudio de interacción en sujetos sanos, en el que se administró paliperidona oral concomitantemente con paroxetina, un potente inhibidor de la CYP2D6, no se observaron efectos clínicamente relevantes sobre la farmacocinética de la paliperidona.
La co-administración de paliperidona oral de liberación prolongada una vez al día con 200 mg de carbamazepina dos veces al día causó una disminución de aproximadamente el 37% en la Cmáx promedio en estado estacionario y el área bajo la curva (AUC) de paliperidona. Esta disminución se debió, en gran parte, a un incremento del 35% en la depuración renal de la paliperidona, probablemente como un resultado de la inducción de la gp-P renal por la carbamazepina. Una menor disminución en la cantidad de fármaco excretado inalterado en la orina sugiere que hubo un pequeño efecto sobre el metabolismo CYP o la biodisponibilidad de la paliperidona durante la co-administración con carbamazepina. Al iniciar con carbamazepina, se debe re-evaluar la dosis de INVEGA SUSTENNA® e incrementarla si fuera necesario. Por el contrario, al discontinuar la carbamazepina, la dosis de INVEGA SUSTENNA® debe ser re-evaluada y disminuida si es necesario.
La paliperidona, un catión a pH fisiológico, se excreta principalmente inalterada por los riñones, aproximadamente la mitad vía filtración y la otra mitad vía secreción activa. La administración concomitante de trimetoprima, un fármaco conocido por inhibir el transporte activo renal de fármacos catiónicos, no influenció en la farmacocinética de la paliperidona.
La co-administración de una única dosis de un comprimido oral de liberación prolongada de 12 mg de paliperidona con comprimidos de liberación prolongada de divalproex sódico (dos comprimidos de 500 mg una vez al día) produjo un incremento de aproximadamente 50% en la Cmáx y el AUC de paliperidona, probablemente el resultado de una absorción oral incrementada. Dado que no se observaron efectos significativos sobre la depuración sistémica, no se esperaría una interacción clínicamente significativa entre los comprimidos de liberación prolongada de divalproex sódico y la inyección intramuscular de INVEGA SUSTENNA®. Esta interacción con INVEGA SUSTENNA® no se ha estudiado.
La interacción farmacocinética entre INVEGA SUSTENNA® y el litio es improbable.
Uso concomitante de INVEGA SUSTENNA® con risperidona o paliperidona oral: Debido a que la paliperidona es el principal metabolito activo de la risperidona, se debe tener precaución al co-administrar INVEGA SUSTENNA® con risperidona o paliperidona oral durante períodos de tiempo extensos. Los datos de seguridad respecto al uso concomitante de INVEGA SUSTENNA® con otros antipsicóticos son limitados.
EFICACIA CLÍNICA:
Esquizofrenia: La eficacia de INVEGA SUSTENNA® en el tratamiento agudo de la esquizofrenia se evaluó en cuatro estudios doble ciego, aleatorizados, controlados con placebo, a dosis fija, a corto plazo (uno de 9 semanas y tres de 13 semanas) en pacientes adultos ingresados con recaídas agudas que cumplían el criterio DSM-IV para la esquizofrenia. En estos estudios, las dosis fijas de INVEGA SUSTENNA® se administraron los días 1, 8 y 36 en el estudio de 9 semanas, y adicionalmente, el día 64 en los estudios de 13 semanas; es decir, en intervalos semanales para las dos dosis iniciales, y luego cada 4 semanas para el mantenimiento.
La eficacia se evaluó usando la escala de síndrome positivo y negativo (PANSS), un inventario validado de múltiples elementos, compuesto por cinco factores para evaluar los síntomas positivos, los síntomas negativos, los pensamientos desorganizados, la hostilidad/excitación descontrolada y la ansiedad/depresión. La funcionalidad se evaluó usando la escala de comportamiento personal y social (PSP). La PSP es una escala clínica validada que mide el desempeño personal y social en el dominio de actividades útiles a la sociedad: Trabajo y estudio, relaciones personales y sociales, cuidado personal, y comportamientos disruptivos y agresivos. La severidad de la disfunción social, personal y del cuidado personal se midió según el nivel de dificultad (ausente, leve, manifiesta, pronunciada, severa) para la realización de tales actividades con y sin ayuda de otras personas. Del mismo modo, la severidad de la disfunción en los comportamientos agresivos se midió por la presencia o ausencia de conductas agresivas (por ejemplo, rudeza, insultar a otros en público, romper objetos, amenazas verbales, ataque físico) y la frecuencia con que estos comportamientos se presentan.
En un estudio de 13 semanas (n = 636) se compararon tres dosis fijas de INVEGA SUSTENNA® (una inyección inicial de 150 mg en el deltoides, seguida de 3 inyecciones en el deltoides o en el glúteo de dosis de 25 mg/4 semanas, 100 mg/4 semanas o 150 mg/4 semanas) con un placebo, las tres dosis de INVEGA SUSTENNA® fueron superiores al placebo mejorando la puntuación total del PANSS. En este estudio, los grupos tratados con 100 mg/4 semanas y 150 mg/4 semanas, pero no el grupo con 25 mg/4 semanas, demostraron superioridad estadística que el placebo en las puntuaciones PSP. Estos resultados soportaron la eficacia durante la completa duración del tratamiento y la mejoría en el PANSS y fue observado tempranamente en el día 4 con separación significativa a partir del placebo en los grupos con 25 mg y 150 mg de INVEGA SUSTENNA® en el día 8.
En otro estudio de 13 semanas (n = 349) que comparó tres dosis fijas de INVEGA SUSTENNA® (50 mg/4 semanas, 100 mg/4 semanas y 150 mg/4 semanas) con un placebo, sólo la dosis de 100 mg/4 semanas de INVEGA SUSTENNA® fue superior al placebo en la mejora de la puntuación PANSS total. En este estudio, las dosis de 50 mg/4 semanas y 100 mg/4 semanas fueron superiores al placebo en la mejora de la puntuación PSP. A pesar de que se incluyó una dosis de 150 mg en este estudio, no hubo suficiente número de sujetos que recibieron esta dosis para permitir conclusiones definitivas sobre la eficacia de esta dosis.
En un tercer estudio de 13 semanas (n = 513) se comparó tres dosis fijas de INVEGA SUSTENNA® (25 mg/4 semanas, 50 mg/4 semanas y 100 mg/4 semanas) con placebo, las tres dosis de INVEGA SUSTENNA® fueron superiores al placebo en la mejora de la puntuación PANSS total. En este estudio, ninguno de los grupos tratados con paliperidona alcanzó significancia estadística cuando se comparó con el placebo, con respecto a la puntuación PSP.
En el estudio de 9 semanas (n = 197) se comparó dos dosis fijas de INVEGA SUSTENNA® (50 mg/4 semanas y 100 mg/4 semanas) con un placebo, ambas dosis de INVEGA SUSTENNA® fueron superiores al placebo en la mejora de la puntuación PANSS total.
La eficacia de INVEGA SUSTENNA® para mantener el control sintomático y retrasar la recaída de la esquizofrenia se estableció en un estudio a largo plazo, de dosis flexibles, doble ciego y controlado con placebo, con 849 sujetos adultos no ancianos que cumplían con el criterio DSM-IV para esquizofrenia. Este estudio incluyó una fase abierta de 33 semanas de tratamiento agudo y estabilización, una fase aleatorizada, controlada con placebo para observar la recaída, y un período de extensión abierto de 52 semanas. En este estudio las dosis de INVEGA SUSTENNA® de 25 mg, 50 mg, 75 mg y 100 mg administradas mensualmente; la dosis de 75 mg fue permitida sólo en la extensión abierta de 52 semanas. Inicialmente, los sujetos recibieron dosis flexibles (25 mg-100 mg) de INVEGA SUSTENNA® durante un período de transición de 9 semanas. A fin de ingresar en el período de mantenimiento de 24 semanas, se solicitó que los sujetos tengan una puntuación PANSS ≤ 75. El ajuste de la dosis sólo se permitió durante las primeras 12 semanas del período de mantenimiento. En la fase doble ciego de duración variable, los pacientes fueron aleatorizados para recibir la misma dosis de INVEGA SUSTENNA® (mediana de duración de 171 días [rango de 1 día - 407 días]) que ellos recibían durante la fase de estabilización, administrada cada 4 semanas, o para recibir un placebo (mediana de duración de 105 días [rango de 8 días - 441 días]). Un total de 410 pacientes estabilizados fueron aleatorizados para recibir INVEGA SUSTENNA® o un placebo hasta que experimenten una recaída de los síntomas de esquizofrenia. La recaída fue pre-definida al momento de la primera presentación de uno o más de los siguientes: hospitalización psiquiátrica, incremento ≥25% (si la puntuación inicial era > 40) o un incremento de 10 puntos (si la puntuación basal era ≤ 40) de la puntuación PANSS total en dos evaluaciones consecutivas; autolesiones deliberadas; comportamiento violento; pensamientos suicidas/homicidas; o una puntuación ≥5 (si la puntuación inicial máxima era ≤3) o ≥ 6 (si la puntuación inicial máxima era de 4) en dos evaluaciones consecutivas del PANSS individual ítems P1 (delirios), P2 (desorganización conceptual), P3 (alucinaciones), P6 (desconfianza/manía persecutoria), P7 (hostilidad) o G8 (falta de cooperación). La principal variable de eficacia fue el tiempo hasta la recaída. En un análisis provisional planificado previamente (después de 68 episodios de recurrencia) se observó un tiempo significativamente mayor para recaídas en pacientes tratados con INVEGA SUSTENNA® comparados con el grupo placebo (figura 1), y el estudio fue detenido prematuramente porque se demostró que la eficacia se mantenía.
Figura 1:
Gráfico Kaplan-Meier de tiempo hasta la recurrencia - Análisis provisional
(Conjunto de análisis de intensión de tratar)
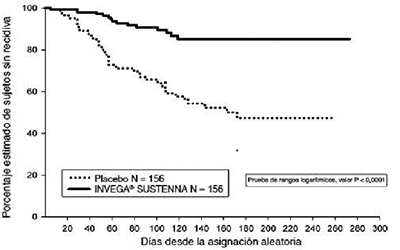
El resultado del análisis basado en los datos finales, incluyendo todos los datos hasta la fecha de finalización del estudio, fue consistente con el análisis de eficacia primaria basado en los datos provisionales.
Una evaluación de los subgrupos de población no reveló diferencias clínicamente significativas en la capacidad de respuesta en base al género, edad ni raza.
Trastorno esquizoafectivo: La eficacia de INVEGA SUSTENNA® en el tratamiento de sujetos con trastorno esquizoafectivo se estableció en un estudio de prevención de recaídas de dosis flexible, doble ciego y controlado con placebo, a largo plazo, que incluyó sujetos adultos que cumplían con el criterio del DSM-IV para el trastorno esquizoafectivo, confirmados por la Entrevista Clínica Estructurada para los Trastornos del DSM-IV. La población incluyó sujetos con los tipos esquizoafectivo bipolar y depresivo. Los sujetos recibieron INVEGA SUSTENNA® como monoterapia o como complemento a las dosis estables de antidepresivos o estabilizadores del estado de ánimo.
Este estudio incluyó un período inicial abierto, de dosis flexible (INVEGA SUSTENNA® 50 mg, 75 mg, 100 mg o 150 mg) de 13 semanas de duración, en el cual se inscribieron un total de 667 sujetos que tenían 1) exacerbación aguda de síntomas psicóticos; 2) puntuación ≥ 4 en ≥ 3 elementos de la PANSS de delirios, desorganización conceptual, alucinaciones, excitación, sospecha/manía persecutoria, hostilidad, falta de cooperación, tensión y control pobre de los impulsos; y 3) síntomas de estado de ánimo prominentes ≥ 16 en la escala de Young para la clasificación de la manía (YMRS) y/o la escala de Hamilton para la clasificación de la depresión, versión de 21 elementos (HAM-D-21). Los sujetos tenían entre 19 a 66 años de edad (media de 39.5 años) y el 53.5% eran hombres. La puntuación media en la inscripción abierta de la PANSS total fue de 85.8 (rango de 42 a 128), la HAM-D-21 fue de 20.4 (rango de 3 a 43), la YMRS fue de 18.6 (rango de 0 a 50) y la escala de impresión de gravedad clínica global para el trastorno esquizoafectivo (CGI-S-SCA) fue de 4.4 (rango de 2 a 6).
Después del tratamiento con INVEGA SUSTENNA® abierto, de dosis flexible, de 13 semanas de duración, 432 sujetos cumplieron con los criterios de estabilización (puntuación total de la PANSS ≤ 70, YMRS ≤ 12 y HAM-D-21 ≤ 12) y continuaron con el período de estabilización abierto, de dosis flexible, de 12 semanas de duración.
Un total de 334 sujetos que cumplieron con los criterios de estabilización durante 12 semanas consecutivas se aleatorizaron (1:1) para continuar con la misma dosis de INVEGA SUSTENNA® o con placebo en el período de prevención de recaída doble ciego, de 15 meses de duración. Para los 164 sujetos que fueron aleatorizados al grupo con INVEGA SUSTENNA®, la distribución de la dosis fue de 50 mg (4.9%), 75 mg (9.8%), 100 mg (47.0%) y 150 mg (38.4%). La principal variable de eficacia fue el tiempo hasta la recaída. La recaída se definió como la primera ocurrencia de uno o más de los siguientes: 1) hospitalización psiquiátrica; 2) intervención utilizada para evitar la hospitalización; 3) autolesión de importancia clínica, pensamientos suicidas u homicidas o comportamiento violento; 4) una puntuación ≥6 (si la puntuación era ≤4 en la aleatorización) de cualquiera de los elementos de PANSS individuales: delirios, desorganización conceptual, alucinaciones, excitación, sospecha/manía persecutoria, hostilidad, falta de cooperación o control pobre de los impulsos; 5) en dos evaluaciones consecutivas dentro de 7 días: aumento ≥ 25% (si la puntuación en la aleatorización era > 45) o aumento de ≥10 puntos (si la puntuación en la aleatorización era ≤ 45) en la puntuación total de la PANSS; una puntuación ≥5 (si la puntuación era ≤ 3 en la aleatorización) de cualquiera de los elementos de PANSS individuales: delirios, desorganización conceptual, alucinaciones, excitación, sospecha/manía persecutoria, hostilidad, falta de cooperación o control pobre de los impulsos; un aumento de ≥ 2 puntos (si la puntuación era de 1 [no enfermo] a 3 [levemente enfermo] en la aleatorización) o un aumento de ≥ 1 punto (si la puntuación era de ≥ 4 [enfermedad moderada o peor] en la aleatorización) en la puntuación general de CGI-S-SCA.
El mantenimiento de la eficacia también se evaluó mediante la escala de comportamiento social y personal (PSP). La PSP es una escala clínica validada, que mide la funcionalidad personal y social en el dominio de actividades útiles a la sociedad (p. ej., trabajo y estudio), las relaciones sociales y personales, el cuidado personal y los comportamientos disruptivos y agresivos.
Hubo una diferencia significativa en el tiempo hasta la recaída (valor p < 0.001) entre los grupos de tratamiento, en favor de INVEGA SUSTENNA®. En la figura 2, se muestra el gráfico de Kaplan-Meier del tiempo hasta la recaída por grupo de tratamiento. El porcentaje de sujetos que cumplieron con los criterios de recaída fue estadística y significativamente menor en sujetos del grupo con INVEGA SUSTENNA® (15.2%) que en el grupo de placebo (33.5%). El riesgo (peligro) de recaída de los síntomas esquizoafectivos para un sujeto tratado con placebo fue 2.49 veces mayor que de los sujetos tratados con INVEGA SUSTENNA®.
Figura 2.
Gráfico de Kaplan-Meier de tiempo hasta la recaída
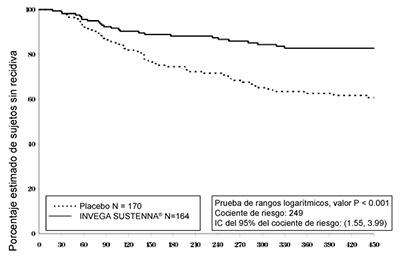
La tabla 9 resume las tasas de recaída y el riesgo de recaída de la población general, el análisis de los subgrupos (grupos de monoterapia y de tratamiento complementario), recaída con síntomas psicóticos y recaída con síntomas de estado de ánimo. El análisis del subgrupo de sujetos mostró que el riesgo de recaída fue 3.38 o 2.03 veces mayor con el grupo de placebo en monoterapia o en complemento con antidepresivos o estabilizadores del estado de ánimo, respectivamente. Además, se evaluó la recaída de los síntomas psicóticos y de los síntomas de estado de ánimo (maníaco, depresivo o mixto). El riesgo de recaída debido a síntomas psicóticos, síntomas de estado de ánimo maníaco y depresivo fue significativamente mayor en sujetos del grupo placebo en comparación con los sujetos que continuaron el tratamiento con INVEGA SUSTENNA®.
|
Tabla 9. Resumen de las tasas de recaída y riesgo de recaída (relación de riesgo). |
|||||
|
Número (porcentaje) de sujetos que presentaron recaída |
Riesgo de recaída (Placebo vs INVEGA SUSTENNA®)a |
IC del 95% del riesgo de recaídaa |
valor pa |
||
|
Placebo N=170 |
INVEGA SUSTENNA® N=164 |
||||
|
Todos los pacientes |
57 (33.5%) |
25 (15.2%) |
2.49 |
(1.55; 3.99) |
<0.001 |
|
Subgrupo con monoterapia |
N=73 24 (32.9%) |
N=78 9 (11.5%) |
3.38 |
(1.57; 7.28) |
0.002 |
|
Complemento a antidepresivos o estabilizadores del estado de ánimo |
N=97 33 (34.0%) |
N=86 16 (18.6%) |
2.03 |
(1.11; 3.68) |
0.021 |
|
Síntomas psicóticosb |
53 (31.2%) |
21 (12.8%) |
2.82 |
(1.70; 4.67) |
<0.001 |
|
Síntomas de estado de ánimoc |
|||||
|
Cualquier síntoma del estado de ánimo |
48 (28.2%) |
18 (11.0%) |
2.93 |
(1.70; 5.04) |
<0.001 |
|
Maníaco |
16 (9.4%) |
5 (3.0%) |
3.62 |
(1.32; 9.89) |
0.012 |
|
Depresivo |
23 (13.5%) |
8 (4.9%) |
3.12 |
(1.39; 6.98) |
0.006 |
|
Mixto |
9 (5.3%) |
5 (3.0%) |
1.93 |
(0.65; 5.78) |
0.238 |
|
a El riesgo instantáneo (peligro) de recaída para sujetos tratados con placebo en comparación con sujetos tratados con INVEGA SUSTENNA®. El riesgo de recaída, los valores p correspondientes y los IC del 95% provienen de modelos de regresión de riesgo proporcional de Cox separados. b 8 sujetos presentaron recaída sin síntomas psicóticos. C 16 sujetos presentaron recaída sin síntomas de estado de ánimo. |
|||||
INVEGA SUSTENNA® resultó ser superior al placebo en el mantenimiento del desempeño, medido con la escala de PSP.
INFORMACIÓN NO CLÍNICA:
Toxicología: Al igual que con otros fármacos antagonistas de los receptores dopaminérgicos D2, el palmitato de paliperidona inyectado por vía intramuscular, así como la paliperidona oral aumentaron los niveles de prolactina sérica en estudios de toxicidad con dosis repetidas.
En un estudio de toxicidad juvenil de 7 semanas de duración, realizado en ratas, con dosis orales de paliperidona de 0.16, 0.63 y 2.5 mg/kg/día, los cuales son 0.12, 0.5 y 1.8 veces la dosis oral máxima recomendada en humanos de 12 mg/día para adolescentes, calculadas según los mg/m2, no se observaron efectos sobre el crecimiento, la madurez sexual y la función reproductiva. Dosis orales de hasta 2.5 mg/kg/día no dañaron el desarrollo neuroconductual en machos y hembras, excepto por un efecto sobre el aprendizaje y la memoria en las ratas hembra tratadas con 2.5 mg/kg/día. Este efecto no se observó tras discontinuar el tratamiento.
En un estudio de 40 semanas, realizado en perros jóvenes, tratados con risperidona oral (el cual es extensamente convertido a paliperidona) a dosis de 0.31, 1.25 y 5 mg/kg/día, no se observaron efectos adversos sobre la madurez sexual con las dosis de 0.31 y 1.25 mg/kg/día. El crecimiento de los huesos largos no se vio afectado con la dosis de 0.31 mg/kg/día; sí se observaron efectos con las dosis de 1.25 y 5 mg/kg/día.
Carcinogenicidad: Se evaluó el potencial carcinogénico del palmitato de paliperidona inyectado por vía intramuscular en ratas. Hubo aumento estadísticamente significativo en los adenocarcinomas en la glándula mamaria en ratas hembra con 10, 30 y 60 mg/kg/mes. En ratas macho se mostró un aumento estadísticamente significativo de adenomas de la glándula mamaria y carcinomas con dosis de 30 y 60 mg/kg/mes el cual es 1.2 y 2.2 veces el nivel de exposición con la dosis máxima recomendada en humanos de 150 mg de INVEGA SUSTENNA®.
El potencial carcinogénico de la paliperidona oral, que es un metabolito activo de la risperidona, se evaluó sobre la base de estudios realizados en ratones y ratas. Se administró risperidona en dosis de hasta 10 mg/kg/día, durante 18 meses a los ratones y durante 25 meses a las ratas. Hubo aumentos estadísticamente significativos de adenomas de la glándula pituitaria, adenomas de páncreas endocrino y adenocarcinomas de la glándula mamaria. Se encontró un incremento de los tumores mamarios, pituitarios y páncreas endocrino en roedores tras la administración crónica de otros fármacos antipsicóticos, y se considera que son mediados por antagonismo dopaminérgico D2 prolongado. Se desconoce la relevancia de estos hallazgos tumorales en roedores, en cuanto al riesgo para los humanos.
Mutagenicidad: No se encontrado evidencia de potencial mutagénico de la paliperidona en la prueba Ames de mutación inversa, en el ensayo de linfomas en ratones, ni en la prueba de micronúcleos en ratas. No se mostró propiedades genotóxicas con el palmitato de paliperidona en la prueba de mutación inversa Ames ni en el ensayo sobre linfomas en ratones.
Fertilidad: A pesar de que el tratamiento con paliperidona oral provocó efectos mediados por la prolactina y el SNC, la fertilidad de las ratas macho y hembra no se vio afectada. Con una dosis tóxica para la madre, las ratas hembra mostraron un número ligeramente inferior de embriones vivos.
ADVERTENCIAS Y PRECAUCIONES:
Síndrome neuroléptico maligno: Se ha reportado síndrome neuroléptico maligno (SNM), caracterizado por hipertermia, rigidez muscular, inestabilidad autonómica, alteración de la conciencia y niveles séricos elevados de creatina fosfoquinasa, con los fármacos antipsicóticos, incluyendo paliperidona. Signos clínicos adicionales pueden incluir mioglobinuria (rabdomiólisis) e insuficiencia renal aguda. Si un paciente desarrolla signos o síntomas que indiquen SMN, se deben discontinuar todos los fármacos antipsicóticos, incluyendo INVEGA SUSTENNA®.
Discinesia tardía: Los fármacos con propiedades antagonistas de los receptores dopaminérgicos se han asociado con la inducción de discinesia tardía caracterizada por movimientos rítmicos, involuntarios, predominantemente de la lengua y/o la cara. Si aparecen signos y síntomas de discinesia tardía, se debe considerar la discontinuación de todos los fármacos antipsicóticos, incluyendo INVEGA SUSTENNA®.
Intervalo QT: Al igual que con otros antipsicóticos, se debe tener precaución al prescribir INVEGA SUSTENNA® en pacientes con antecedente de arritmias cardíacas, en pacientes con síndrome del QT largo congénito y con uso concomitante de fármacos conocidos por prolongar el intervalo QT (ver sección Propiedades farmacodinámicas - Efecto sobre el intervalo QT/QTc y electrofisiología cardíaca).
Reacciones de hipersensibilidad: Aunque se debe establecer la tolerabilidad con paliperidona o risperidona oral previo al inicio del tratamiento con INVEGA SUSTENNA®, se han reportado casos muy raros de reacciones anafilácticas durante la experiencia posterior a la comercialización en pacientes que han tolerado previamente risperidona oral o paliperidona oral (ver sección Dosis y administración y Reacciones adversas).
Si ocurren reacciones de hipersensibilidad, discontinuar el uso de INVEGA SUSTENNA®; iniciar medidas de soporte general según sea clínicamente apropiado y monitorear al paciente hasta que se resuelvan los signos y los síntomas (ver sección Contraindicaciones y Reacciones adversas).
Hiperglucemia y diabetes mellitus: Se han reportado casos de hiperglucemia, diabetes mellitus y exacerbación de diabetes pre-existente durante el tratamiento con INVEGA SUSTENNA®. La evaluación de la relación entre el uso de antipsicóticos atípicos y las alteraciones en la glucosa es complicada por la posibilidad del incremento del riesgo intrínseco de diabetes mellitus en pacientes con esquizofrenia o trastorno esquizoafectivo y la incidencia incrementada de diabetes mellitus en la población general. Debido a estos factores de confusión, la relación entre el uso de antipsicóticos atípicos y los eventos adversos relacionados con la hiperglucemia no se comprende completamente. Se debe monitorear a cualquier paciente tratado con antipsicóticos atípicos, incluyendo INVEGA SUSTENNA®, para síntomas de hiperglucemia y diabetes mellitus (ver sección Reacciones adversas).
Aumento de peso: Se ha observado aumento de peso con el uso de antipsicóticos atípicos. Se recomienda el monitoreo clínico del peso.
Hipotensión ortostática: La paliperidona puede inducir hipotensión ortostática en algunos pacientes según su su actividad alfa bloqueante. INVEGA SUSTENNA® se debe usar con precaución en pacientes con enfermedad cardiovascular conocida (por ejemplo, insuficiencia cardíaca, infarto de miocardio o isquemia, anomalías en la conducción), enfermedad cerebrovascular o condiciones que predispongan al paciente a la hipotensión (por ejemplo, deshidratación, hipovolemia y tratamiento con medicamentos antihipertensivos).
Convulsiones: Al igual que con otros fármacos antipsicóticos, INVEGA SUSTENNA® se debe utilizar con precaución en pacientes con antecedente de convulsiones u otras condiciones que potencialmente reducen el umbral de la convulsión.
Pacientes ancianos con demencia: INVEGA SUSTENNA® no se ha estudiado en pacientes ancianos con demencia.
Mortalidad general: En un meta-análisis de 17 estudios clínicos controlados, los pacientes ancianos con demencia tratados con otros fármacos antipsicóticos atípicos, incluyendo risperidona, aripiprazol, olanzapina y quetiapina, presentaron un mayor riesgo de mortalidad en comparación con el placebo. Entre los tratados con risperidona, la mortalidad fue 4% en comparación con 3.1% con el placebo.
Eventos adversos cerebrovasculares: En los estudios controlados con placebo en pacientes ancianos con demencia tratados con algún fármaco antipsicótico atípico como risperidona, aripiprazol y olanzapina, hubo una mayor incidencia de eventos adversos cerebrovasculares (accidentes cerebrovasculares y ataques isquémicos transitorios), incluyendo fatalidades, en comparación con el placebo.
Leucopenia, neutropenia y agranulocitosis: Se han reportado eventos de leucopenia, neutropenia y agranulocitosis con agentes antipsicóticos, incluyendo INVEGA SUSTENNA®. Se han reportado agranulocitosis muy raramente (< 1/10 000 pacientes) durante la farmacovigilancia posterior a la comercialización.
Se debe monitorear a los pacientes con antecedente de recuento bajo de glóbulos blancos (GB) clínicamente significativo o leucopenia/neutropenia inducida por fármacos durante los primeros meses de terapia y se debe considerar la discontinuación de INVEGA SUSTENNA® al primer signo de una disminución clínicamente significativa en el recuento de glóbulos blancos en ausencia de otros factores causales.
Se debe monitorear cuidadosamente a los pacientes con neutropenia clínicamente significativa por fiebre u otros síntomas o signos de infección y deben ser tratarlos inmediatamente si tales signos o síntomas ocurren. Los pacientes con neutropenia severa (recuento absoluto de neutrófilos < 1 × 109/L) deben discontinuar INVEGA SUSTENNA® y se debe seguir su recuento de glóbulos blancos hasta su recuperación.
Tromboembolismo venoso: Se han reportado casos de tromboembolismo venoso (TEV) con los fármacos antipsicóticos. Dado que los pacientes tratados con antipsicóticos a menudo presentan factores de riesgo adquiridos para TEV, se deben identificar todos los factores de riesgo posible para TEV antes y durante el tratamiento con INVEGA SUSTENNA® y tomar medidas preventivas.
Enfermedad de Parkinson y demencia con cuerpos de Lewy: El médico debe sopesar los riesgos frente a los beneficios al prescribir fármacos antipsicóticos, incluyendo INVEGA SUSTENNA®, a los pacientes con enfermedad de Parkinson o demencia con cuerpos de Lewy (DCL) ya que ambos grupos pueden presentar riesgo incrementado de síndrome neuroléptico maligno, así como presentar una sensibilidad incrementada a los medicamentos antipsicóticos. Las manifestaciones de esta sensibilidad incrementada pueden incluir confusión, obnubilación, inestabilidad postural con caídas frecuentes, además de síntomas extrapiramidales.
Priapismo: Se ha reportado que los fármacos con efecto bloqueante alfa-adrenérgico inducen priapismo. Se han reportado priapismo con paliperidona durante la farmacovigilancia posterior a la comercialización (ver sección Reacciones adversas).
Regulación de la temperatura corporal: Se ha atribuido a agentes antipsicóticos, la alteración de la capacidad del organismo de reducir la temperatura corporal central. Se recomienda tomar las precauciones adecuadas al prescribir INVEGA SUSTENNA® a pacientes que experimentarán condiciones que pueden contribuir a una elevación de la temperatura corporal central, por ejemplo, ejercicio extenuante, exposición a calor extremo, medicación concomitante con fármacos con actividad anticolinérgica, o que estén sujetos a deshidratación.
Efecto antiemético: Se ha observado un efecto antiemético en los estudios preclínicos con paliperidona. Si ocurre este efecto en humanos, puede enmascarar los signos y síntomas de sobredosis con ciertos fármacos o de condiciones como obstrucción intestinal, síndrome de Reye o tumor cerebral.
ADMINISTRACIÓN: Se debe tener precaución para evitar inyectar inadvertidamente INVEGA SUSTENNA® en un vaso sanguíneo.
Síndrome del iris flácido intraoperatorio: Se ha observado síndrome del iris flácido intraoperatorio (IFIS) durante cirugía de catarata en pacientes tratados con medicamentos con efecto antagonista alfa 1a-adrenérgico, como INVEGA SUSTENNA® (ver sección Reacciones Adversas).
El IFIS puede incrementar el riesgo de complicaciones oculares durante y después de la cirugía. Se debe comunicar al cirujano oftalmólogo del uso actual o pasado de medicamentos con efecto antagonista alfa 1a-adrenérgico antes de la cirugía. No se ha establecido el beneficio potencial de suspender la terapia con bloqueadores alfa 1 previo a la cirugía de catarata y se debe sopesar contra el riesgo de suspender la terapia antipsicótica.
DOSIS Y ADMINISTRACIÓN: En aquellos pacientes que nunca hayan recibido paliperidona oral, ni risperidona oral o inyectable, se recomienda establecer la tolerabilidad con paliperidona oral o risperidona oral antes de iniciar el tratamiento con INVEGA SUSTENNA®.
Dosis:
Esquizofrenia: Se recomienda iniciar el tratamiento con INVEGA SUSTENNA® con una dosis de 150 mg el primer día de tratamiento, y 100 mg una semana después, ambos administrados en el músculo deltoides. La dosis de mantenimiento mensual recomendada es de 75 mg; algunos pacientes pueden beneficiarse de uso de dosis inferiores o superiores, dentro del rango recomendado de 25 a 150 mg, en función de la tolerabilidad y/o la eficacia en cada paciente. A partir de la segunda dosis de inicio, las dosis mensuales de mantenimiento se pueden administrar en el músculo deltoides o en el glúteo.
Trastorno esquizoafectivo: Se recomienda iniciar con INVEGA SUSTENNA® con una dosis de 150 mg el primer día de tratamiento y de 100 mg una semana después, ambas administradas en el músculo deltoides. La dosis de mantenimiento mensual recomendada es de 50 a 150 mg, la cual se ajusta en función de la tolerabilidad y/o eficacia utilizando las concentraciones disponibles. La concentración de 25 mg no se ha estudiado para el trastorno esquizoafectivo. A partir de la segunda dosis de inicio, las dosis mensuales de mantenimiento se pueden administrar en el músculo deltoides o en el glúteo.
La dosis de mantenimiento se puede ajustar mensualmente. Cuando se realicen ajustes en la dosis, se deben considerar las características de liberación prolongada de INVEGA SUSTENNA® (ver sección Propiedades farmacocinéticas) ya que el efecto completo de tales ajustes puede tardar varios meses en manifestarse.
Dosis omitida(s):
Evitar la omisión de las dosis: Se recomienda administrar la segunda dosis de inicio de INVEGA SUSTENNA® una semana después de la primera dosis. Para evitar omitir una dosis, se puede administrar la segunda dosis 2 días antes o después del plazo establecido de una semana. Del mismo modo, se recomienda que la tercera y las subsiguientes inyecciones después del regimen de inicio se administren mensualmente. Para evitar omitir una dosis mensualmente, se puede administrar a los pacientes la inyección hasta 7 días antes o después del plazo mensual establecido.
Si se olvida administrar la segunda inyección de INVEGA SUSTENNA® en la fecha establecida (una semana ± 2 días), la recomendación de reiniciar el tratamiento depende del tiempo que haya transcurrido desde la primera inyección del paciente.
Segunda dosis de inicio omitida (< 4 semanas desde la primera inyección). Si han transcurrido menos de 4 semanas desde la primera inyección, se debe administrar al paciente la segunda inyección de 100 mg en el músculo deltoides lo más antes posible. Se debe administrar una tercera inyección de 75 mg de INVEGA SUSTENNA®, en el músculo deltoides o en el glúteo, 5 semanas después de la primera inyección (independientemente de la fecha de la segunda inyección). Posteriormente se seguirá el ciclo normal de inyecciones mensuales, en el músculo deltoides o en el glúteo, de 25 a 150 mg, según la tolerabilidad y/o la eficacia en cada paciente.
Segunda dosis de inicio omitida (4-7 semanas desde la primera inyección): Si han transcurrido de 4 a 7 semanas desde la primera inyección de INVEGA SUSTENNA®, reiniciar la dosis con dos inyecciones de 100 mg de la siguiente manera: Una inyección en el deltoides lo más pronto posible, seguida de otra inyección en el deltoides una semana después; luego reanuda el ciclo normal mensualmente de las inyecciones en el músculo deltoides o en el glúteo de 25 mg a 150 mg, según la tolerabilidad y/o la eficacia de cada paciente.
Segunda dosis de inicio omitida (> 7 semanas desde la primera inyección): Si han transcurrido más de 7 semanas desde la primera inyección de INVEGA SUSTENNA®, iniciar la dosis según las recomendaciones de dosis iniciales con INVEGA SUSTENNA® descritas previamente.
Dosis de mantenimiento omitida (de 1 mes a 6 semanas): Después del inicio, el ciclo de inyección recomendado de INVEGA SUSTENNA® es mensualmente. Si han transcurrido menos de 6 semanas desde la última inyección, se debe administrar la dosis previamente estabilizada, lo más antes posible, seguida de las inyecciones en intervalos mensuales.
Dosis de mantenimiento omitida (> 6 semanas a 6 meses): Si han transcurrido más de 6 semanas desde la última inyección de INVEGA SUSTENNA®, se recomienda lo siguiente:
En pacientes estabilizados con dosis de 25 a 100 mg:
• Una inyección en el deltoides lo más antes posible con la misma dosis con la que el paciente fue previamente estabilizado.
• Otra inyección en el deltoides (misma dosis) una semana después (día 8).
• Reanudar el ciclo normal de las inyecciones mensualmente, en el músculo deltoides o el glúteo, de 25 mg a 150 mg según la tolerabilidad y/o la eficacia en cada paciente.
En pacientes estabilizados con 150 mg:
• Una inyección en el deltoides lo más antes posible, con una dosis de 100 mg.
• Otra inyección en el deltoides, una semana después (día 8) con una dosis de 100 mg.
• Reanudar del ciclo normal de las inyecciones mensualmente, en el músculo deltoides o el glúteo, de 25 mg a 150 mg, según la tolerabilidad y/o la eficacia en cada paciente.
Dosis de mantenimiento omitida (> 6 meses): Si han transcurrido más de 6 meses desde la última inyección de INVEGA SUSTENNA®, iniciar la dosis según las recomendaciones de dosis iniciales con INVEGA SUSTENNA® descritas previamente.
INSTRUCCIONES DE USO, MANIPULACIÓN Y ELIMINACIÓN: El envase contiene una aguja precargada y 2 agujas de seguridad (una aguja de 1 ½ pulgadas calibre 22, y una aguja de 1 pulgada calibre 23) para inyección intramuscular.
a. Cono gris 22G x 1½?;
b. Cono azul 23G x1?;
c. Jeringa precargada; D. Cono; E. Tapón.
INVEGA SUSTENNA® es de un solo uso.
1. Agitar vigorosamente la jeringa durante al menos 10 segundos para asegurar una suspensión homogénea.
2. Seleccionar la aguja adecuada.
Para la inyección en el DELTOIDES, si el paciente pesa < 200 lb (< 90 kg), utilice la aguja de 1 pulgada calibre 23 (la aguja con el cono azul); si el paciente pesa ≥200 lb (≥90 kg), utilice la aguja de 1½ pulgadas calibre 22 (la aguja con el cono gris).
Para la inyección en el GLÚTEO, utilice la aguja de 1 ½ pulgadas calibre 22 (la aguja con el cono gris).
3. Mientras sujeta la jeringa en posición vertical, quite el tapón de goma de la punta, girándolo suavemente en el sentido de las agujas del reloj.
4. Abra el envoltorio de la aguja de seguridad hasta la mitad. Sujete la funda de la aguja utilizando el envoltorio de plástico. Acople la aguja de seguridad a la conexión Luer de la jeringa girándola suavemente en el sentido de las agujas del reloj.
5. Retire la funda de la aguja tirando de forma recta. No retuerza la funda ya que la aguja se podría aflojar de la jeringa.
6. Coloque la jeringa con la aguja hacia arriba para eliminar el aire. Elimine el aire de la jeringa moviendo el émbolo lentamente hacia arriba.
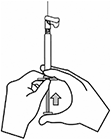
7. Inyecte todo el contenido por vía intramuscular lentamente y en profundidad en el músculo deltoides o en el músculo glúteo del paciente. No administre por vía intravascular ni subcutánea.
8. Una vez puesta la inyección, utilice el pulgar u otro dedo de la mano (8a, 8b), o bien una superficie plana (8c), para activar el sistema de protección de la aguja. El sistema de protección de la aguja estará totalmente activado cuando se oiga un “clic”. Deseche la jeringa con la aguja de manera adecuada.
8a.
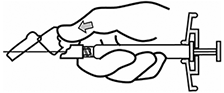
8b.
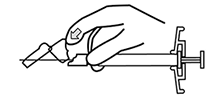
8c.
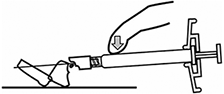
POBLACIONES ESPECIALES:
Población pediátrica (menores de 18 años de edad): La seguridad y eficacia de INVEGA SUSTENNA® no se han estudiado en pacientes < 18 años de edad.
Ancianos (65 años de edad y mayores): En general, la dosis de INVEGA SUSTENNA® recomendada para pacientes ancianos con función renal normal es la misma que para los pacientes adultos más jóvenes con una función renal normal. Debido a que los pacientes ancianos pueden tener función renal reducida, ver sección Insuficiencia renal a continuación, para las recomendaciones de la dosificación en pacientes con insuficiencia renal.
Insuficiencia renal: INVEGA SUSTENNA® no se ha estudiado sistemáticamente en pacientes con insuficiencia renal (ver sección Propiedades farmacocinéticas). En pacientes con insuficiencia renal leve (aclaramiento de creatinina de ≥ 50 a < 80 mL/min), se recomienda iniciar INVEGA SUSTENNA® con dosis de 100 mg el primer día del tratamiento y de 75 mg una semana después, ambas administradas en el deltoides. Posteriormente, seguir con inyecciones mensuales de 50 mg en el músculo deltoides o en los glúteos, ajustadas dentro de un rango de 25 mg a 100 mg, según la tolerabilidad y/o la eficacia en cada paciente.
No se recomienda INVEGA SUSTENNA® en pacientes con insuficiencia renal moderada o severa (aclaramiento de creatinina < 50 mL/min).
Insuficiencia hepática: INVEGA SUSTENNA® no se ha estudiado en pacientes con insuficiencia hepática. Según un estudio con paliperidona oral, no se necesita ajustar la dosis en pacientes con insuficiencia hepática leve o moderada. No se ha estudiado la paliperidona en pacientes con insuficiencia hepática severa (ver sección Propiedades farmacocinéticas).
Otras poblaciones: No se recomienda ajustar la dosis de INVEGA SUSTENNA® según el género, la raza o el consumo de tabaco. (Para mujeres embarazadas o madres en período de lactancia, ver sección Embarazo y lactancia).
Sustitución de otros agentes antipsicóticos: No existen datos recopilados sistemáticamente para tratar específicamente la sustitución en pacientes con esquizofrenia o trastorno esquizoafectivo de otros antipsicóticos a INVEGA SUSTENNA®, o respecto a la administración concomitante con otros antipsicóticos. Para los pacientes que no hayan tomado nunca paliperidona oral o risperidona oral o inyectable, se debe establecer la tolerabilidad con paliperidona oral o risperidona oral antes de iniciar el tratamiento con INVEGA SUSTENNA® (ver sección Dosis y administración).
Los antipsicóticos orales previos pueden ser discontinuados inmediatamente o gradualmente al momento de iniciar el tratamiento con INVEGA SUSTENNA®. Se debe iniciar INVEGA SUSTENNA® según lo descrito al inicio de la sección Dosis y administración.
Cuando la sustitución es en pacientes actualmente en estado estacionario con un antipsicótico inyectable de acción prolongada, iniciar la terapia con INVEGA SUSTENNA® en lugar de la siguiente inyección programada. Luego, se debe continuar con INVEGA SUSTENNA® en intervalos mensuales. No es necesario el régimen de dosificación inicial de una semana descrito al inicio de la sección Dosis y administración.
Los pacientes estabilizados previamente con diferentes dosis de paliperidona en comprimidos de liberación prolongada pueden alcanzar exposición similar a paliperidona en el estado estacionario durante el tratamiento de mantenimiento con INVEGA SUSTENNA® en dosis mensuales según lo descrito en la Tabla 1.
|
Tabla 1. Dosis de paliperidona en comprimidos de liberación prolongada e INVEGA SUSTENNA® necesarias para alcanzar exposición similar a paliperidona en estado estacionario durante el tratamiento de mantenimiento |
||
|
Formulación |
Dosis previa de paliperidona en comprimido de liberación prolongada |
INVEGA SUSTENNA® Inyección |
|
Frecuencia de la dosis |
Una vez al día |
Una vez cada 4 semanas |
|
Dosis (mg) |
3 mg 6 mg 9 mg 12 mg |
Eq. a 25 mg – 50 mg Eq. a 75 mg Eq. a 100 mg Eq. a 150 mg |
Los pacientes estabilizados previamente con diferentes dosis de inyección de risperidona pueden alcanzar exposición similar a la fracción activa en estado estacionario durante el tratamiento de mantenimiento de dosis mensuales de INVEGA SUSTENNA® como se describe en la Tabla 2.
|
Tabla 2. Dosis de inyección de risperidona e INVEGA SUSTENNA® necesarias para alcanzar exposición similar a la fracción activa en estado estacionario |
|
|
Dosis previa de inyección de risperidona |
Inyección de INVEGA SUSTENNA® |
|
25 mg cada 2 semanas |
Eq. a 50 mg mensuales |
|
37.5 mg cada 2 semanas |
Eq. a 75 mg mensuales |
|
50 mg cada 2 semanas |
Eq. a 100 mg mensuales |
La discontinuación del tratamiento antipsicótico previo se debe realizar de acuerdo con la información para prescribir apropiada. Si se discontinua INVEGA SUSTENNA®, se deben considerar sus características de liberación prolongada. Al igual que se recomienda con otros medicamentos antipsicóticos, se debe re-evaluar periódicamente la necesidad de continuar con la medicación para los síntomas extrapiramidales (SEP) existentes.
SOBREDOSIS: Debido a que INVEGA SUSTENNA® debe ser administrado por profesionales de la salud, el potencial de sobredosis del paciente es bajo.
Síntomas y signos: En general, los signos y síntomas esperados son los que resultan de una exageración de los efectos farmacológicos conocidos de la paliperidona, es decir, somnolencia y sedación, taquicardia e hipotensión, prolongación QT y síntomas extrapiramidales. Se ha reportado Torsade de pointes y fibrilación ventricular en el contexto de la sobredosis con paliperidona oral. En caso de sobredosis aguda, se debe considerar la posibilidad de involucrar a múltiples fármacos.
Tratamiento: Se debe tener en cuenta la naturaleza de la liberación prolongada de INVEGA SUSTENNA® y la vida media aparente larga de la paliperidona cuando se evalúe las necesidades de tratamiento y la recuperación. No existe antídoto específico para la paliperidona. Se deben emplear medidas generales de soporte. Establecer y mantener despejada la vía respiratoria y asegurar la oxigenación y ventilación adecuada. El monitoreo cardiovascular debe comenzar inmediatamente y debe incluir monitoreo electrocardiográfico continuo por posibles arritmias. La hipotensión y el colapso circulatorio se debe tratar con las medidas apropiadas, tales como líquidos intravenosos y/o agentes simpaticomiméticos. En caso de síntomas extrapiramidales severos, se debe administrar agentes anticolinérgicos. La supervisión estrecha y el monitoreo debe continuar hasta la recuperación del paciente.
PRESENTACIÓN:
INVEGA® SUSTENNA® Suspensión de liberación prolongada de 150 mg caja con jeringa prellenada y dos agujas (Reg. San. INVIMA 2016M-0011737-R1).
INVEGA® SUSTENNA® Suspensión de liberación prolongada de 100 mg, caja con jeringa prellenada y dos agujas (Reg. San. INVIMA 2016M-0012015-R1).
INVEGA® SUSTENNA® Suspensión de liberación prolongada de 75 mg, caja con jeringa prellenada y dos agujas (Reg. San. INVIMA 2017M-0012012-R1).
JANSSEN-CILAG, S. A.
Av. Calle 26 No. 69-76 - Edificio Elemento
Torre 2, Piso 11 - PBX: +57 1 927 1200 - Bogotá, D. C.
CONDICIONES DE CONSERVACIÓN: Verifique las condiciones de conservación en el envase exterior. Mantener fuera de la vista y del alcance de los niños.
CARACTERÍSTICAS Y CONTENIDOS DEL ENVASE: El envase contiene una jeringa (copolímero de olefina cíclica) precargada con una suspensión de 75 mg (0.75 mL), 100 mg (1.0 mL) o 150 mg (1.5 mL) de paliperidona (en forma de 117 mg, 156 mg o 234 mg de palmitato de paliperidona), con un retén para el émbolo y un tapón para la punta de la aguja (goma bromobutílica), tope trasero, una aguja de seguridad de 1 ½ pulgadas calibre 22 y una aguja de seguridad de 1 pulgada calibre 23.
INVEGA SUSTENNA® 75 mg: (Reg. San. INVIMA 2011M-0012012).
INVEGA SUSTENNA® 100 mg: (Reg. San. INVIMA 2016M-0012015-R1).
INVEGA SUSTENNA® 150 mg: (Reg. San. INVIMA 2016M-0011737-R1).