
INVEGA
PALIPERIDONA
Tabletas de liberación prolongada
Caja, 14 Tabletas de liberación prolongada, 3,6 y 9 Miligramos
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN: Cada COMPRIMIDO de liberación prolongada contiene 3, 6 o 9 mg de paliperidona.
INSTRUCCIONES DE USO Y MANIPULACIÓN Y ELIMINACIÓN: Ninguna en especial.
INDICACIONES: INVEGA® está indicado para el tratamiento de la esquizofrenia en adultos, incluido el tratamiento agudo y la prevención de recurrencias.
INVEGA® está indicado para el tratamiento de la esquizofrenia en adolescentes entre 12 y 17 años de edad.
INVEGA® está indicado para el tratamiento del trastorno esquizoafectivo como monoterapia y en combinación con antidepresivos y/o estabilizadores del estado de ánimo en adultos.
PROPIEDADES FARMACOCINÉTICAS: A menos que se establezca lo contrario, la información farmacocinética presentada en esta sección se basa en los datos de los estudios en adultos.
La farmacocinética de la paliperidona después de la administración de INVEGA® es proporcional a la dosis dentro del rango de dosis clínicas recomendadas (3 a 12 mg).
Absorción: Después de la administración de una dosis única de INVEGA®, las concentraciones plasmáticas de paliperidona se incrementan constantemente hasta alcanzar la concentración plasmática máxima (Cmáx) en aproximadamente 24 horas después de la dosificación. Con la dosificación de una vez al día de INVEGA®, las concentraciones de paliperidona en el estado estacionario se alcanzan dentro de 4-5 días de dosificación en la mayoría de los sujetos.
Las características de liberación de INVEGA® producen fluctuaciones pico-valle mínimas en comparación con las observadas con risperidona de liberación inmediata. En un estudio que comparó la farmacocinética en el estado estacionario después de la administración una vez al día de 12 mg de paliperidona (administrada como comprimidos de liberación prolongada) con de 4 mg de risperidona de liberación inmediata en sujetos con esquizofrenia, los índices de fluctuación fueron 38% para paliperidona de liberación prolongada en comparación al 125% para risperidona de liberación inmediata (véase Figura 1).
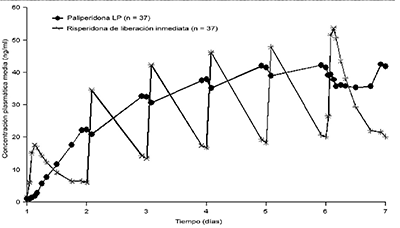
Figura 1.
Perfil de la concentración en el estado estacionario después de la administración de 12 mg de paliperidona administrada como 6 comprimidos de liberación prolongada de 2 mg una vez al día por 6 días (las concentraciones de paliperidona están representadas) en comparación con risperidona de liberación inmediata administrada como 2 mg una vez al día el día 1 y 4 mg una vez al día los días 2 al 6 (las concentraciones de paliperidona + risperidona están representadas).
Después de la administración de INVEGA®, los enantiómeros (+) y (-) de paliperidona se interconvierten, alcanzando una proporción AUC (+) a (-) de aproximadamente 1.6 en el estado estacionario. La biodisponibilidad oral absoluta de la paliperidona después de la administración de INVEGA™ es 28%.
Después de la administración de un único comprimido de liberación prolongada de 15 mg de paliperidona a sujetos sanos, confinados a la cama durante 36 horas, con una comida con alto contenido graso/alto contenido calórico estándar, los valores de la Cmáx y el AUC se incrementaron en 42% y 46%, respectivamente, en comparación con la administración en condiciones de ayuno. En otro estudio que involucró sujetos ambulatorios sanos, la Cmáx y el AUC de la paliperidona después de la administración de un único comprimido de liberación prolongada de 12 mg de paliperidona con una comida con alto contenido graso/alto contenido calórico estándar produjeron incrementos del 60% y 54%, respectivamente, en comparación con la administración bajo condiciones de ayuno. Aunque la presencia o ausencia de alimentos en el momento de la administración de INVEGA® puede incrementar o reducir la exposición a la paliperidona, estos cambios no se consideran clínicamente relevantes. Los ensayos clínicos que establecen la seguridad y la eficacia de INVEGA® se realizaron en sujetos sin tomar en cuenta el momento de las comidas (ver sección Posología y Administración.)
Distribución: La paliperidona se distribuye rápidamente. El volumen de distribución aparente es 487 L. La unión a la proteína plasmática de paliperidona es 74%. Se une principalmente a la glucoproteína a1-ácida y a la albúmina. In vitro, las altas concentraciones terapéuticas de diazepam (3 mcg/mL), sulfametacina (100 mcg/ml), warfarina (10 mcg/ml) y carbamazepina (10 mcg/ml) causaron un ligero incremento de la fracción libre de la paliperidona a 50 ng/mL. No se espera que estos cambios sean de significancia clínica.
Metabolismo y Eliminación: Una semana después de la administración de una dosis única oral de 1 mg de 14C-paliperidona de liberación inmediata, el 59% de la dosis se excretó inalterada en la orina, indicando que la paliperidona no se metaboliza extensamente en el hígado. Aproximadamente el 80% de la radioactividad administrada se recuperó en la orina y el 11% en las heces. Se han identificado cuatro vías metabólicas in vivo, ninguna de las cuales representó más del 6.5% de la dosis: Desalquilación, hidroxilación, deshidrogenación y escisión del benzisoxazol. Aunque estudios in vitro sugieren un rol para la CYP2D6 y la CYP3A4 en el metabolismo de la paliperidona, no existen evidencia in vivo de que estas isoenzimas desempeñen un rol significativo en el metabolismo de la paliperidona. A pesar de la gran variación en la población general respecto a la capacidad para metabolizar los sustratos de la CYP2D6, los análisis farmacocinéticos poblacionales no indicaron diferencia apreciable en el aclaramiento aparente de la paliperidona después de la administración de INVEGA® entre metabolizadores extensos y metabolizadores pobres de los sustratos de la CYP2D6. Estudios in vitro utilizando preparaciones microsomales de sistemas heterólogos indican que la CYP1A2, CYP2A6, CYP2C9, CYP2C19 y CYP3A5 no están involucrados en el metabolismo de la paliperidona. La vida media de eliminación terminal de la paliperidona es alrededor de 23 horas.
Poblaciones especiales:
Adolescentes: La exposición sistémica a la paliperidona en sujetos adolescentes fue comparable a la de los adultos. En adolescentes que pesan < 51 kg (< 112 lbs), se observó una exposición del 23% mayor que en adolescentes que pesan ≥ 51 kg (≥ 112 lbs.); esto no se considera clínicamente significativo. La edad por sí sola no influenció en la exposición a la paliperidona.
Ancianos: Los datos de un estudio farmacocinético en sujetos ancianos (≥ 65 años de edad, n = 26) indicaron que el aclaramiento aparente en el estado estacionario de paliperidona después de la administración de INVEGA® fue 20% menor en comparación a la de los sujetos adultos (18-45 años de edad, n = 28). Sin embargo, no hubo efecto apreciable de la edad en el análisis farmacocinético poblacional involucrando a sujetos con esquizofrenia después de corregir las disminuciones del CrCl relacionadas con la edad.
Insuficiencia renal: Se debe reducir la dosis en los pacientes con insuficiencia renal moderada y severa (ver sección Posología y Administración). La disposición de la paliperidona se estudió en sujetos con diversos grados de función renal. La eliminación de la paliperidona disminuyó con la disminución del aclaramiento de la creatinina (CrCl). El aclaramiento total de la paliperidona se redujo en un 32% en los sujetos con insuficiencia renal leve (CrCl de 50 a < 80 ml/min), en un 64% en los sujetos con insuficiencia renal moderada (CrCl de 30 a < 50 ml/min) y en un 71% en los sujetos con insuficiencia renal severa (CrCl = 10 a < 30 mL/min). La vida media de eliminación terminal promedio de la paliperidona fue 24, 40 y 51 horas en los sujetos con insuficiencia renal leve, moderada y severa, respectivamente, en comparación con 23 horas en los sujetos con función renal normal (CrCl ≥ 80 mL/min).
Insuficiencia hepática: La paliperidona no se metaboliza extensamente en el hígado. En un estudio en sujetos con insuficiencia hepática moderada (clase B de Child-Pugh), las concentraciones plasmáticas de la paliperidona libre fueron similares a la de los sujetos sanos. No se ha estudiado paliperidona en pacientes con insuficiencia hepática severa.
Raza: No se recomienda ajustar la dosis basado en la raza. El análisis farmacocinético poblacional no reveló evidencia de diferencias relacionadas a la raza en la farmacocinética de la paliperidona después de la administración de INVEGA®. No se observaron diferencias en la farmacocinética en un estudio farmacocinético realizado en sujetos japoneses y Caucásicos.
Género: El aclaramiento aparente de la paliperidona después de la administración de INVEGA® es aproximadamente 19% menor en las mujeres que en los varones. Esta diferencia se explica principalmente por las diferencias en la masa corporal magra y en el aclaramiento de la creatinina entre los varones y las mujeres, ya que una evaluación farmacocinética poblacional no reveló evidencia de diferencias clínicamente significativas relacionadas con el género en la farmacocinética de la paliperidona después de la administración de INVEGA® después de la corrección de la masa corporal magra y el aclaramiento de la creatinina.
Tabaquismo: Basado en estudios in vitro utilizando enzimas hepáticas humanas, la paliperidona no es un sustrato de la CYP1A2; por tanto, el tabaquismo no tiene un efecto en la farmacocinética de la paliperidona. Consistente con estos resultados in vitro, la evaluación farmacocinética poblacional no ha revelado ninguna diferencia entre los fumadores y no fumadores.
PROPIEDADES FARMACODINÁMICAS:
Grupo farmacoterapéutico: Antipsicóticos, otros antipsicóticos, código ATC: N05AX13.
Mecanismo de acción: La paliperidona, el ingrediente activo de INVEGA®, es un agente psicotrópico que pertenece a la clase química de los derivados del benzisoxazol (antipsicóticos neurolépticos atípicos). INVEGA® contiene una mezcla racémica de (+) paliperidona y (-) paliperidona.
La paliperidona es un antagonista centralmente activo de la dopamina D2 con una actividad antagonista serotoninérgica 5-HT2A predominante. La paliperidona también es activo como un antagonista de los receptores adrenérgicos a1 y a2 y de los receptores histaminérgicos H1. La paliperidona no tiene afinidad por los receptores colinérgicos muscarínicos o por los receptores adrenérgicos ß1 y ß2. La actividad farmacológica de los enantiómeros (+) y (-) de la paliperidona es cualitativa y cuantitativamente similar.
Se desconoce el mecanismo de acción de la paliperidona al igual que otros fármacos que tienen eficacia en la esquizofrenia. Sin embargo, se ha propuesto que la actividad terapéutica del fármaco en la esquizofrenia es mediada a través de una combinación del antagonismo del receptor tipo 2 de la dopamina (D2) y del receptor tipo 2 de la serotonina (5HT2A). El antagonismo en otros receptores distintos de D2 y 5HT2A podría explicar algunos de los otros efectos de la paliperidona.
Polisomnografía: Los medicamentos de acción central a través de su mecanismo de acción, el perfil de liberación del fármaco y/o el momento de la administración de la dosis pueden afectar el sueño. Para evaluar el impacto de la dosis matutina de INVEGA® sobre la continuidad y la estructura del sueño, se realizó un estudio controlado con placebo en 36 sujetos con esquizofrenia en el cual se administró INVEGA® 9 mg o el placebo una vez al día por 14 días. Se realizaron las siguientes observaciones (datos promedio en comparación con el placebo): Reducción de la latencia a sueño persistente en 41.0 (SE 18.70) minutos; disminución de la latencia del inicio del sueño en 35,2 (SE 14,99) minutos; disminución del número de despertares después el inicio del sueño en 7.0 (SE 3.88) eventos, incremento del tiempo total de sueño en 52.8 (SE 24.01) minutos; incremento del tiempo de los períodos de sueño en 41.7 (SE 18.75) minutos y el incremento del índice de eficiencia del sueño en 11.0% (SE 5.00). También hubo una disminución estadísticamente significativa (respecto al placebo) en la etapa 1 del sueño de 11.9 (SE 4.44) minutos un incremento en la etapa 2 del sueño de 50.7 (SE 17.67) minutos. No se observó efecto clínicamente relevante sobre el sueño REM.
Efecto sobre el intervalo QT/QTc y electrofisiología cardiaca: Los efectos de la paliperidona sobre el intervalo QT fueron evaluaron en dos estudios en fase 1, aleatorizados, doble ciego, multicéntricos, en adultos con esquizofrenia y trastorno esquizoafectivo, y en tres ensayos de eficacia controlados con placebo y con control activo, a dosis fijas, de 6 semanas en adultos con esquizofrenia.
En el primer estudio en fase 1 (n = 141), los sujetos fueron aleatorizados para recibir siete días de paliperidona oral de liberación inmediata una vez al día (titulada de 4 a 8 mg) o una dosis única de moxifloxacino (400 mg). La dosis de 8 mg una vez al día de paliperidona oral de liberación inmediata (n = 44) alcanzó una concentración plasmática máxima promedio en el estado estacionario mayor a dos veces la exposición observada con la dosis máxima recomendada de INVEGA® de 12 mg (Cmáx ss = 113 y 45 ng/ml, respectivamente). En la corrección del QT derivado del promedio lineal diario ajustado al modelo (QTcLD), hubo un incremento promedio de 5.5 mseg (IC del 90%: 3.66; 7.25) en el grupo de tratamiento con INVEGA® (n = 44).
En el segundo estudio en fase 1 (n = 109), los sujetos fueron aleatorizados para recibir el placebo, la dosis máxima recomendada de INVEGA® (12 mg una vez al día), posteriormente titulada a una dosis por encima del rango recomendado (18 mg una vez al día), o un control activo de la misma clase farmacológica de los fármacos (400 mg de quetiapina dos veces al día). La comparación primaria en este estudio de no inferioridad de 10 días fue entre INVEGA® 12 mg y quetiapina. El cambio promedio en los mínimos cuadrados desde el estado basal en la QTcLD del Tmáx observado de cada individuo se estimó ser 5.1 ms menor para INVEGA® 12 mg (Cmáx promedio 34 ng/ml), en comparación con 400 mg de quetiapina dos veces al día (Cmáx promedio 1183 ng/mL) (IC del 90%: -9,2; -0,9), cumpliendo el criterio de no inferioridad pre-especificado de 10 ms. El cambio promedio desde el estado basal en la QTcLD en el Tmáx observado de cada individuo se estimó ser 2.3 ms menor para INVEGA® 18 mg (Cmáx promedio 53 ng/mL) en comparación con 400 mg de quetiapina dos veces al día (Cmáx promedio 1183 ng/ml) (IC del 90%: -6.8; 2.3).
El cambio promedio desde el estado basal en la QTcLD para el Tmáx observado de cada individuo se estimó ser 1.5 ms mayor (IC del 90%: -3,1; 6,2) para INVEGA® 12 mg y 8,0 ms mayor (IC del 90%: 3.1; 12.9) para 400 mg de quetiapina dos veces al día en comparación con el cambio promedio desde el estado basal en la QTcLD para la mediana del Tmáx observado (del fármaco activo en la comparación) en el grupo placebo concurrente. El cambio promedio desde el estado basal en la QTcLD para el Tmáx observado para cada individuo fue estimado ser 4.9 ms mayor (IC del 90%: -0,5; 10,3) para 18 mg de paliperidona de liberación prolongada y 7.5 ms mayor (IC del 90%: 2.5; 12.5) para quetiapina 400 mg dos veces al día en comparación con el cambio promedio desde el estado basal en la QTcLD para la mediana del Tmáx observado (del fármaco activo en la comparación) en el grupo placebo concurrente.
Ninguno de los sujetos presentó un cambio desde el estado basal excediendo 60 mseg o una QTcLD excediendo 500 mseg en algún momento durante estos estudios.
Para los tres estudios de eficacia a dosis fija, se tomaron medidas electrocardiográficas (ECG) exhaustivas en 15 puntos de evaluación en días especificados (incluyendo las horas de Cmáx esperadas) utilizando una metodología estandarizada. El incremento promedio de la QTcLD no excedió 5 mseg en ningún grupo de tratamiento en ningún momento, basado en los datos agrupados de 836 sujetos tratados con INVEGA®, 357 sujetos tratados con olanzapina y 350 sujetos tratados con el placebo. Un sujeto en el grupo de 12 mg de INVEGA® y olanzapina presentaron un cambio excediendo 60 mseg en un punto de evaluación durante estos estudios (incrementos de 62 y 110 mseg, respectivamente).
DATOS FARMACÉUTICOS:
Lista de excipientes: Butilhidroxitolueno (E321), cera carnauba, acetato de celulosa, hidroxietilcelulosa, hipromelosa, óxidos de hierro (E172), polietilenglicol, óxidos de polietilenglicol, povidona, propilenglicol, cloruro de sodio, ácido esteárico y dióxido de titanio (E171). Los comprimidos de 3 mg también contienen lactosa monohidrato y triactein.
Incompatibilidades: Ninguna.
Período de validez: Ver la fecha de caducidad en el envase externo.
FORMA FARMACÉUTICA Y CONCENTRACIONES:
INVEGA® contiene 3, 6 o 9 mg de paliperidona.
• 3 mg: Comprimido blanco en forma de cápsula con el texto “PAL 3” impreso.
• 6 mg: Comprimido beige en forma de cápsula con el texto “PAL 6” impreso.
• 9 mg: Comprimido rosa en forma de cápsula con el texto “PAL 9” impreso.
El nombre químico es (±)-3-[2-[4-(6-fluoro-1,2-benzisoxazol-3-il)-1-piperidinil]etil]-6,7,8,9-tetrahidro-9-hidroxil-2-metil-4H-pirido[1,2 a]pirimidin-4-ona.
Para los excipientes, ver sección Lista de excipientes.
INVEGA® utiliza una tecnología de liberación de fármaco por ósmosis, mediante la cual la presión osmótica libera la paliperidona de la forma farmacéutica a una velocidad controlada. El sistema, que tiene el aspecto de un comprimido en forma de cápsula, está compuesto de un núcleo de tres capas osmóticamente activo rodeado por una sub-cubierta y la membrana semipermeable. El núcleo de tres capas está compuesto de dos capas de fármaco que contienen el fármaco y los excipientes y de una capa de empuje que contiene los componentes osmóticamente activos. En la cúpula de la capa de fármaco del comprimido hay dos orificios horadados con un láser de precisión. Cada concentración está identificada por un color único de la cubierta externa y marcas de impresión. En un medio acuoso, como el del tracto gastrointestinal, la cubierta externa de color dispersable en agua, se degrada rápidamente. Luego se embebe el agua a través de la membrana semipermeable que controla la velocidad. La membrana controla la velocidad a la que el agua entra en el núcleo del comprimido, la cual, a su vez, controla la liberación del fármaco. Los polímeros hidrófilos del núcleo se hidratan y se hinchan, creando un gel que contiene paliperidona que es luego expulsado a través de los orificios del comprimido. Los componentes biológicamente inertes del comprimido permanecen intactos durante el tránsito gastrointestinal y son eliminados en las heces como una cubierta de la tableta junto con los componentes insolubles del núcleo.
CONTRAINDICACIONES: INVEGA® está contraindicado en pacientes con una hipersensibilidad conocida a paliperidona o a cualquiera de los excipientes de la formulación. Debido a que paliperidona es un metabolito activo de la risperidona, INVEGA® está contraindicado en pacientes con hipersensibilidad conocida a la risperidona.
EMBARAZO Y LACTANCIA:
Embarazo: No se ha establecido la seguridad del uso de paliperidona durante el embarazo en humanos
En un estudio de cohortes observacional retrospectivo basado en una base de datos de aseveraciones de EE. UU. se comparó el riesgo de malformaciones congénitas en niños nacidos vivos entre mujeres con y sin uso de antipsicóticos durante el primer trimestre del embarazo. La paliperidona, el metabolito activo de la risperidona, no se evaluó específicamente en este estudio. El riesgo de malformaciones congénitas con la risperidona, después de ajustar las variables de confusión disponibles en la base de datos, fue elevada en comparación con la ausencia de exposición a antipsicóticos (riesgo relativo = 1.26, IC del 95%: 1.02-1.56). No se ha identificado el mecanismo biológico para explicar estos hallazgos y no se han observado efectos teratogénicos en estudios preclínicos. Basado en los hallazgos de este estudio observacional aislado, no se ha establecido una relación causal entre la exposición a risperidona in utero y las malformaciones congénitas.
Se observó un ligero incremento de las muertes fetales en animales de laboratorio tratados con una dosis alta de paliperidona. Esta dosis alta fue tóxica para las madres. Exposiciones de 20 a 34 veces la dosis máxima en humanos no afectó a las crías.
Los neonatos expuestos a fármacos antipsicóticos (incluyendo paliperidona) durante el tercer trimestre del embarazo están de riesgo de presentar síntomas extrapiramidales y/o síndrome de abstinencia que pueden variar en severidad después del parto. Estos síntomas en los neonatos pueden incluir agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria o desórdenes de la alimentación.
INVEGA® sólo debe usarse durante el embarazo si los beneficios superan los riesgos. Se desconoce el efecto de INVEGA® sobre el trabajo del parto y el parto en humanos.
Lactancia: En estudios con paliperidona en animales y en estudios con risperidona en humanos, la paliperidona se excretó en la leche. Por tanto, las mujeres que reciben INVEGA® no deben amamantar a los infantes.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS: INVEGA® puede interferir con las actividades que requieran alerta mental y puede tener efectos visuales (ver sección Reacciones adversas). Por tanto, se debe aconsejar a los pacientes no conducir u operar máquinas hasta que se conozca su sensibilidad individual.
REACCIONES ADVERSAS: A largo de esta sección, se presentan las reacciones adversas. Las reacciones adversas son eventos adversos que se consideraron estar razonablemente asociados con el uso de la paliperidona basado en la evaluación exhaustiva de la información disponible del evento adverso. No puede establecerse de manera confiable una relación causal con la paliperidona en casos individuales. Además, debido a que los estudios clínicos se realizan bajo condiciones muy variables, las tasas de la reacción adversa observada en los estudios clínicos de un fármaco no pueden ser comparados directamente con las tasas en estudios clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica clínica.
Datos de los estudios clínicos: La seguridad de INVEGA® en el tratamiento de esquizofrenia se evaluó en 1205 sujetos adultos con esquizofrenia que participaron en 3 estudios doble ciego, controlados con placebo, de 6 semanas, de los cuales 850 sujetos recibieron INVEGA® a dosis fijas en un rango de 3 mg a 12 mg una vez al día.
La seguridad de INVEGA® se evaluó en 314 sujetos adolescentes de 12 - 17 años de edad con esquizofrenia quienes recibieron INVEGA® en el rango de dosis de 1.5 mg a 12 mg/día en dos estudios Fase 3, incluyendo 201 sujetos en un estudio doble ciego, controlado con placebo, de 6 semanas, y sujetos tratados por hasta 2 años en un estudio de seguridad abierto, de grupo único.
La seguridad de INVEGA® también se evaluó en 622 sujetos adultos con trastorno esquizoafectivo que participaron en dos estudios doble ciego, controlados con placebo, de 6 semanas. En uno de estos estudios, 206 sujetos fueron asignados a uno de los dos niveles de dosis de INVEGA®: 6 mg con la opción de reducir a 3 mg (n = 108) o 12 mg con la opción de reducir a 9 mg (n = 98) una vez al día. En el otro estudio, 214 sujetos recibieron dosis flexibles de INVEGA® (3-12 mg una vez al día). Ambos ensayos incluyeron sujetos que recibieron INVEGA® como monoterapia o en combinación con antidepresivos y / o estabilizadores del estado de ánimo.
La información en esta sección se deriva de los datos agrupados.
La mayoría de las reacciones adversas fueron de severidad leve a moderada.
Datos doble ciego, controlado con placebo – Esquizofrenia – Adultos: Las reacciones adversas reportadas por ≥2% de los sujetos tratados con INVEGA® en los 3 ensayos doble ciego, controlados con placebo, a dosis fija, de 6 semanas, y en adultos se muestran en la Tabla 1.
|
Tabla 1. Reacciones adversas reportadas por ≥ 2% de los sujetos con esquizofrenia tratados con INVEGA® en los 3 ensayos clínicos, doble ciego, controlados con placebo, a dosis fija, de 6 semanas en adultos |
|||||
|
Porcentaje de pacientes |
|||||
|
INVEGA® 3 mg Una vez al día |
INVEGA® 6 mg Una vez al día |
INVEGA® 9 mg Una vez al día |
INVEGA® 12 mg Una vez al día |
Placebo |
|
|
Clase de sistema/ órgano |
(N=127) |
(N=235) |
(N=246) |
(N=242) |
(N=355) |
|
Reacción adversa |
% |
% |
% |
% |
% |
|
Trastornos del sistema nervioso |
|||||
|
Dolor de cabeza |
11 |
12 |
14 |
14 |
12 |
|
Mareos |
6 |
5 |
4 |
5 |
4 |
|
Trastorno extrapiramidal |
5 |
2 |
7 |
7 |
2 |
|
Somnolencia |
5 |
3 |
7 |
5 |
3 |
|
Acatisia |
4 |
3 |
8 |
10 |
4 |
|
Temblor |
3 |
3 |
4 |
3 |
3 |
|
Hipertonía |
2 |
1 |
4 |
3 |
1 |
|
Distonía |
1 |
1 |
4 |
4 |
1 |
|
Sedación |
1 |
5 |
3 |
6 |
4 |
|
Parkinsonismo |
0 |
<1 |
2 |
1 |
0 |
|
Trastornos oculares |
|||||
|
Crisis oculogírica |
0 |
0 |
2 |
0 |
0 |
|
Trastornos cardíacos |
|||||
|
Taquicardia sinusal |
9 |
4 |
4 |
7 |
4 |
|
Taquicardia |
2 |
7 |
7 |
7 |
3 |
|
Bloqueo de rama |
3 |
1 |
3 |
<1 |
2 |
|
Bloqueo atrioventricular de primer grado |
2 |
0 |
2 |
1 |
1 |
|
Arritmia sinusal |
2 |
1 |
1 |
<1 |
0 |
|
Trastorno vascular |
|||||
|
Hipotensión Ortostática |
2 |
1 |
2 |
4 |
1 |
|
Trastorno gastrointestinal |
|||||
|
Vómito |
2 |
3 |
4 |
5 |
5 |
|
Boca seca |
2 |
3 |
1 |
3 |
1 |
|
Dolor abdominal superior |
1 |
3 |
2 |
2 |
1 |
|
Hipersecreción salival |
0 |
<1 |
1 |
4 |
<1 |
|
Trastornos generales |
|||||
|
Astenia |
2 |
<1 |
2 |
2 |
1 |
|
Fatiga |
2 |
1 |
2 |
2 |
1 |
Datos doble ciego, placebo controlado - esquizofrenia – adolescentes: Las reacciones adversas reportadas por ≥ 2% de los sujetos adolescentes de 12 - 17 años de edad con esquizofrenia tratados con INVEGA® en un estudio a dosis fija, controlado con placebo se muestran en la Tabla 2.
|
Tabla 2. Reacciones adversas reportadas por ≥ 2% de sujetos con esquizofrenia tratados con INVEGA® en un ensayo clínico a dosis fija, controlado con placebo en adolescentes |
|||||
|
Porcentaje de pacientes |
|||||
|
INVEGA® 1.5 mg Una vez al día |
INVEGA® 3 mg Una vez al día |
INVEGA® 6 mg Una vez al día |
INVEGA® 12 mg Una vez al día |
Placebo |
|
|
Clase de sistema/órgano Reacción Adversa |
(N=54) |
(N=16) |
(N=45) |
(N=35) |
(N=51) |
|
Infecciones e infestaciones |
|||||
|
Nasofaringitis |
4 |
0 |
4 |
0 |
2 |
|
Trastornos psiquiátricos |
|||||
|
Insomnio |
9 |
6 |
7 |
14 |
22 |
|
Ansiedad |
0 |
0 |
2 |
9 |
4 |
|
Trastornos del sistema nervioso |
|||||
|
Somnolencia |
6 |
13 |
13 |
26 |
2 |
|
Acatisia |
4 |
6 |
11 |
17 |
0 |
|
Dolor de cabeza |
9 |
6 |
4 |
14 |
4 |
|
Temblor |
2 |
6 |
7 |
11 |
0 |
|
Distonía |
2 |
0 |
4 |
9 |
0 |
|
Rigidez de rueda dentada |
0 |
0 |
0 |
11 |
0 |
|
Mareos |
2 |
6 |
2 |
3 |
0 |
|
Disquinesia |
2 |
6 |
2 |
3 |
0 |
|
Sedación |
4 |
0 |
2 |
0 |
2 |
|
Hipersomnia |
0 |
0 |
4 |
0 |
0 |
|
Trastorno extrapiramidal |
0 |
6 |
0 |
0 |
0 |
|
Letargo |
0 |
0 |
0 |
3 |
0 |
|
Contracciones musculares involuntarias |
0 |
0 |
0 |
3 |
0 |
|
Parálisis de la lengua |
0 |
0 |
0 |
3 |
0 |
|
Trastornos oculares |
|||||
|
Crisis oculogírica |
0 |
0 |
4 |
3 |
0 |
|
Visión borrosa |
0 |
0 |
0 |
3 |
0 |
|
Trastornos cardíacos |
|||||
|
Taquicardia |
0 |
6 |
7 |
6 |
0 |
|
Taquicardia sinusal |
0 |
0 |
2 |
0 |
0 |
|
Trastornos respiratorios, torácicos y mediastínicos |
|||||
|
Epistaxis |
0 |
0 |
2 |
0 |
0 |
|
Trastornos gastrointestinales |
|||||
|
Vómitos |
0 |
6 |
11 |
3 |
10 |
|
Náuseas |
0 |
0 |
2 |
9 |
12 |
|
Hipersecreción salival |
2 |
6 |
2 |
0 |
0 |
|
Dolor abdominal superior |
2 |
0 |
2 |
0 |
2 |
|
Boca seca |
0 |
0 |
0 |
3 |
2 |
|
Lengua hinchada |
0 |
0 |
0 |
3 |
0 |
|
Trastornos musculoesqueléticos y del tejido conectivo |
|||||
|
Rigidez muscular |
0 |
0 |
2 |
3 |
0 |
|
Contractura muscular |
0 |
0 |
0 |
3 |
0 |
|
Tortícolis |
0 |
0 |
2 |
0 |
0 |
|
Trastornos del sistema reproductivo y de la mama |
|||||
|
Galactorrea |
0 |
0 |
4 |
0 |
0 |
|
Amenorrea |
0 |
6 |
0 |
0 |
0 |
|
Inflamación mamaria |
0 |
0 |
0 |
3 |
0 |
|
Trastornos generales |
|||||
|
Fatiga |
4 |
0 |
2 |
3 |
0 |
|
Astenia |
0 |
0 |
2 |
3 |
0 |
|
Análisis |
|||||
|
Aumento de peso |
7 |
6 |
2 |
3 |
0 |
Datos doble ciego, controlado con placebo - trastorno esquizoafectivo – adultos: Las reacciones adversas reportadas por ≥2% de los sujetos tratados con INVEGA® para el trastorno esquizoafectivo en 2 ensayos controlados con placebo en adultos se muestran en la Tabla 3.
|
Tabla 3. Reacciones adversas reportadas por ≥ 2% de los sujetos con trastorno esquizoafectivo tratados con INVEGA® en 2 ensayos clínicos doble ciego, controlados con placebo en adultos |
||
|
Clase de sistema/ órgano Reacción adversa |
Porcentaje de pacientes |
|
|
INVEGA® 3-12 mg Una vez al día % |
Placebo (N=202) % |
|
|
Infecciones e Infestaciones |
||
|
Nasofaringitis |
3 |
1 |
|
Trastornos metabólicos y de la nutrición |
||
|
Incremento del apetito |
2 |
<1 |
|
Trastornos del sistema nervioso |
||
|
Temblor |
8 |
3 |
|
Acatisia |
5 |
4 |
|
Sedación |
5 |
3 |
|
Somnolencia |
5 |
2 |
|
Hipertonía |
5 |
2 |
|
Babeo |
2 |
0 |
|
Disartria |
2 |
0 |
|
Trastornos gastrointestinales |
||
|
Nauseas |
6 |
6 |
|
Dispepsia |
5 |
2 |
|
Estreñimiento |
4 |
2 |
|
Trastornos musculoesqueléticos y del tejido conectivo |
||
|
Mialgia |
2 |
<1 |
|
Análisis |
||
|
Aumento de peso |
4 |
1 |
|
* Entre los 420 pacientes tratados con INVEGA®, 230 (55%) recibieron INVEGA® como monoterapia y 190 (45%) recibieron INVEGA® en combinación con antidepresivos y/o estabilizantes del estado de ánimo. |
||
Monoterapia versus terapia combinada: Los diseños de los dos estudios doble ciego, controlado con placebo, de 6 semanas en sujetos adultos con trastorno esquizoafectivo incluyó la opción para los sujetos de recibir antidepresivos (excepto, inhibidores de la monoaminooxidasa) y/o estabilizadores del estado de ánimo (litio, valproato o lamotrigina). En la población de sujetos evaluados por seguridad, 230 (55%) sujetos recibieron INVEGA® como monoterapia y 190 (45%) sujetos recibieron INVEGA® en combinación con antidepresivos y/o estabilizadores del estado de ánimo. Cuando se comparó estas 2 subpoblaciones, solo las náuseas ocurrieron a una mayor frecuencia (≥ 3% de diferencia) en sujetos que recibieron INVEGA® como monoterapia.
Reacciones adversas relacionada a la dosis: En el estudio controlado con placebo-, con dosis altas y bajas, de 6 semanas en pacientes adultos con trastorno esquizoafectivo, ocurrieron más frecuentemente, distonía, disartria y nasofaringitis (es decir, una diferencia de al menos 3%) en sujetos que recibieron dosis más altas de INVEGA® en comparación con los sujetos que recibieron dosis más bajas. La hipertonía ocurrió más frecuentemente en sujetos que recibieron dosis más bajas de INVEGA® en comparación con los sujetos que recibieron dosis más altas.
Otros datos de estudios clínicos: Paliperidona es el metabolito activo de la risperidona, por lo tanto, los perfiles de reacción adversa de estos compuestos (incluyendo las formulaciones orales e inyectables) son relevantes entre sí. Esta subsección incluye reacciones adversas adicionales reportadas con paliperidona y/o risperidona en los ensayos clínicos.
Las reacciones adversas reportadas con paliperidona y/o risperidona por ≥ 2% de los sujetos tratados con INVEGA® en un conjunto de datos agrupados de 9 ensayos doble ciego, controlados con placebo, en esquizofrenia y trastorno esquizoafectivo (8 en adultos y uno en sujetos adolescentes) son mostradas en la Tabla 4.
|
Tabla 4. Reacciones adversas reportadas con paliperidona y/ risperidona por ≥ 2% de los sujetos tratados con INVEGA® en un conjunto de datos agrupado de 9 ensayos doble ciego, controlados con placebo en esquizofrenia y en trastorno esquizoafectivo (8 en adultos y 1 en sujetos adolescentes). Los términos dentro de cada Clase de Sistema/Órgano están ordenados alfabéticamente. |
|
|
Clase sistema/órgano |
Reacción Adversa |
|
Infecciones e infestaciones |
Infección del trato respiratorio superior |
|
Trastornos psiquiátricos |
Insomnio* |
|
Trastornos del sistema nervioso |
Acatisia*, Distonía*, Parkinsonismo* |
|
Trastornos gastrointestinales |
Malestar estomacal, diarreas |
|
Trastornos musculoesquelético y del tejido conectivo |
Dolor musculoesquelético |
|
* Insomnio incluye: Insomnio inicial, insomnio medio; Acatisia incluye: hiperquinesia, síndrome de las piernas inquietas, inquietud; Distonía incluye: blefaroespasmo, espasmo cervical, emprostótonos, espasmo facial, hipertonía, laringospasmo, contracciones musculares involuntarias, miotonía, oculogiración, opistótonos, espasmo orofaríngeo, pleurotótonos, risa sardónica, tetania, parálisis de la lengua, espasmo de la lengua, tortícolis, trismus; Parkinsonismo incluye: aquinesia, bradiquinesia, rigidez de rueda dentada, babeo, síntomas extrapiramidales, reflejo glabelar anormal, rigidez muscular, opresión muscular, rigidez musculoesqulética. |
|
Las reacciones adversas reportadas con paliperidona y/o risperidona por < 2% de los sujetos tratados con INVEGA® en un conjunto de datos agrupados de 9 ensayos doble ciego, controlados con placebo, en esquizofrenia y trastorno esquizoafectivo (8 en adultos y uno en sujetos adolescentes) son mostradas en la Tabla 5.
|
Tabla 5. Reacciones adversas reportadas con paliperidona y/ risperidona por ≥ 2% de los sujetos tratados con INVEGA® en un conjunto de datos agrupados de 9 ensayos doble ciego, controlados con placebo, en esquizofrenia y en trastorno esquizoafectivo (8 en adultos y 1 en sujetos adolescentes). Los términos dentro de cada clase de sistema/órgano están ordenados alfabéticamente. |
|
|
Clase de sistema/órgano |
Reacción Adversa |
|
Infecciones e infestaciones |
Acarodermatitis, bronquitis, cistitis, infección del oído, influenza, onicomicosis, neumonía, infección del tracto respiratorio, sinusitis, tonsilitis, infección del tracto urinario. |
|
Trastornos de la sangre y del sistema linfático |
Anemia, disminución del hematocrito, neutropenia, disminución del recuento de los glóbulos blancos |
|
Trastornos del sistema inmune |
Reacción anafiláctica, hipersensibilidad |
|
Trastornos endocrinos |
Hiperprolactinemia |
|
Trastornos del metabolismo y la nutrición |
Anorexia, incremento del colesterol en sangre, incremento de los triglicéridos en sangre, disminución del apetito, hiperglucemia, disminución de peso |
|
Trastornos psiquiátricos |
Anorgasmia, depresión, disminución de la libido, pesadillas, trastornos del sueño |
|
Trastornos del sistema nervioso |
Accidente cerebrovascular, convulsión*, alteración en la atención, mareo postural, disquinesia*, hipoestesia, pérdida de la conciencia, parestesia, hiperactividad psicomotora, síncope, disquinesia tardía |
|
Trastornos oculares |
Conjuntivitis, ojo seco, incremento del lagrimeo, fotofobia |
|
Trastornos del laberinto y del oído |
Dolor de oído, tinitus, vértigo |
|
Trastornos cardiacos |
Bloqueo atrioventricular, bradicardia, trastorno de la conducción, electrocardiograma anormal, prolongación QT en el electrocardiograma, palpitaciones |
|
Trastornos vasculares |
Sofoco, hipertensión, hipotensión, isquemia |
|
Trastornos respiratorios, torácicos y mediastínicos |
Tos, dispnea, hiperventilación, congestión nasal, dolor faringolaríngeo, sibilancias |
|
Trastornos gastrointestinales |
Queilitis, disfagia, incontinencia fecal, flatulencia, gastroenteritis, obstrucción intestinal, hinchazón de la lengua, dolor dental |
|
Trastornos hepatobiliares |
Incremento de la gama-glutamiltransferasa, incremento de la enzima hepática, incremento de las transaminasas. |
|
Trastornos de la piel y del tejido subcutáneo |
Acné, piel seca, Eczema, eritema, prurito, erupción, dermatitis seborréica, decoloración de la piel. |
|
Trastornos musculoesqueléticos y del tejido conectivo |
Artralgia, dolor de espalda, incremento de la creatinfosfoquinasa, rigidez de las articulaciones, hinchazón de las articulaciones, espasmos musculares, debilidad muscular, dolor del cuello |
|
Trastornos renales y urinarios |
Disuria, poliaquiuria, incontinencia urinaria |
|
Trastornos del sistema reproductivo y de Mama |
Secreción mamaria, malestar en las mamas, congestión mamaria, trastornos en la eyaculación, disfunción eréctil, ginecomastia, trastorno menstrual*, disfunción sexual, secreción vaginal |
|
Trastornos generales |
Incremento de la temperatura corporal, malestar en el pecho, escalofríos, edema facial, trastornos de la marcha, edema*, pirexia, sed |
|
Lesiones, intoxicación y complicaciones en el procedimiento |
Caídas |
|
*Convulsión incluye: Convulsión de grand mal; Disquinesia incluye: atetosis, corea, coreoatetosis, trastorno del movimiento, contracciones musculares, mioclonía, Trastornos menstruales incluyen: menstruación irregular, oligomenorrea, Edema incluye: edema generalizado, edema periférico, edema por picaduras. |
|
Las reacciones adversas reportadas con risperidona paliperidona y/o en otros estudios clínicos, pero no reportados por sujetos tratados con INVEGA® (3-12 mg) en un conjunto de datos agrupados de 9 ensayos doble ciego, controlados con placebo en esquizofrenia y trastorno esquizoafectivo (8 en adultos y 1 en sujetos adolescentes) son mostradas en la Tabla 6.
|
Tabla 6. Reacciones adversas reportadas con paliperidona y/o risperidona en otros ensayos clínicos, pero no reportados por sujetos tratados con INVEGA® (3-12 mg) en un conjunto de datos agrupados de 9 ensayos doble ciego, controlados con placebo, en esquizofrenia y trastorno esquizoafectivo (8 en adultos y 1 en sujetos adolescentes). Los términos dentro de cada Clase de sistema/órgano están ordenados alfabéticamente |
|
|
Clase de sistema/ órgano |
Reacción Adversa |
|
Infecciones e infestaciones |
Infección ocular |
|
Trastornos de la sangre y del sistema linfático |
Incremento del recuento de eosinófilos |
|
Trastornos Endocrinos |
Glucosa en orina |
|
Trastornos del metabolismo y la nutrición |
Hiperinsulinemia, polidipsia |
|
Trastornos psiquiátricos |
Afecto embotado, estado de confusión |
|
Trastornos del sistema nervioso |
Trastorno del equilibrio, trastorno cerebro-vascular, anomalías de la coordinación, disminución del nivel de conciencia, coma diabético, titubeo de la cabeza, síndrome neuroléptico maligno, sin respuesta a los estímulos. |
|
Trastornos oculares |
Trastorno del movimiento ocular, movimiento de los ojos, glaucoma, hiperemia ocular |
|
Trastornos cardiacos |
Síndrome de taquicardia postural ortostática |
|
Trastornos respiratorios, torácicos y mediastínicos |
Disfonía, neumonía por aspiración, congestión pulmonar, rales, congestión del tracto respiratorio |
|
Trastornos gastrointestinales |
Fecaloma |
|
Trastornos de la piel y del tejido subcutáneo |
Erupción por el fármaco, hiperqueratosis, urticaria |
|
Trastornos musculoesqueléticos y del tejido conectivo |
Postura anormal, rabdomiólisis |
|
Trastornos del sistema reproductivo y de la mama |
Incremento de las mamas, retraso menstrual |
|
Trastornos generales |
Incremento de la temperatura, síndrome de abstinencia del fármaco, endurecimiento, malestar general |
Ancianos: La seguridad de INVEGA® se evaluó en 81 sujetos ancianos con esquizofrenia (65 años de edad y mayores) que recibieron dosis flexibles (n = 76) o dosis fijas (n = 5) de INVEGA® en un rango de 3 a 12 mg una vez al día durante con una duración de hasta 6 semanas durante ensayos doble ciego, controlados con placebo.
Aunque este conjunto de datos no permite una comparación sistemática directa entre los sujetos ancianos y los sujetos no ancianos, el perfil de seguridad fue similar en las dos poblaciones. Sin embargo, basado en estos datos limitados y consistentes con la práctica clínica general, no se puede descartar una mayor sensibilidad de los individuos mayores a las reacciones adversas.
Eventos de especial interés para la clase: Síntomas extrapiramidales (SEP). Los datos agrupados de 3 estudios doble ciego, controlados con placebo, a dosis fija, de 6 semanas en esquizofrenia (ver sección Propiedades farmacodinámicas: Eficacia clínica), no mostraron diferencias en los SEP emergentes del tratamiento entre el placebo (11%) e INVEGA® a dosis de 3 y 6 mg (13% y 10%, respectivamente). Se observó SEP relacionada a la dosis con las dos dosis más altas de INVEGA® (25% y 26% con la dosis de 9 y 12 mg, respectivamente). Los SEP incluyeron un análisis agrupado de los siguientes términos: Disquinesia, distonía, hiperquinesia, parkinsonismo y temblor. Los datos agrupados de 2 estudios doble ciego, controlados con placebo, de 6 semanas en sujetos con trastorno esquizoafectivo (ver sección Propiedades Farmacodinámicas- Eficacia clínica) mostraron resultados similares.
Incremento de peso: En los datos agrupados de 3 estudios controlados con placebo, a dosis fija, de 6 semanas en adultos (ver sección Propiedades farmacodinámicas – Eficacia clínica) se compararon las proporciones de sujetos que cumplieron un criterio de incremento de peso de ≥7% del peso corporal; revelando una incidencia similar del incremento de peso para INVEGA® 3 y 6 mg (7% y 6%, respectivamente) en comparación con el placebo (5%) y una mayor incidencia del incremento de peso para INVEGA® 9 mg y 12 mg (9% y 9%, respectivamente).
Se evaluó el incremento de peso en sujetos adolescentes con esquizofrenia en un estudio doble ciego, controlado con placebo, de 6 semanas y en un estudio de extensión abierta con una mediana de la duración de la exposición a INVEGA® de 182 días. En el estudio doble ciego, controlado con placebo, un mayor porcentaje de sujetos tratados con INVEGA® a dosis baja (6%), dosis media (13%) y dosis alta (13%) (ver sección Propiedades farmacológicas) presentó un incremento en el peso corporal de ≥ 7% desde el estado basal en comparación con los sujetos tratados con el placebo (2%). En el estudio abierto, a largo plazo la proporción del total de sujetos tratados con INVEGA® con un incremento en el peso corporal de ≥ 7% desde el estado basal fue 33%. Cuando se trata a los pacientes adolescentes con INVEGA®, se debe evaluar el incremento de peso respecto al esperado con el crecimiento normal. Cuando se toma en consideración la mediana de la duración de la exposición a INVEGA® en el estudio abierto (182 días) junto con el crecimiento normal esperado en esta población, una evaluación de las puntuaciones estandarizadas respecto a los datos normativos proporciona una medición clínicamente más relevante de los cambios en el peso. El cambio promedio desde el estado basal abierto hasta el punto final en la puntuación estandarizada para el peso fue 0.1 (4% por encima de la mediana de los datos normativos). Basado en la comparación con los datos normativos, estos cambios no se consideran ser clínicamente significativos.
En los datos agrupados de los dos estudios controlados con placebo, de 6 semanas en sujetos adultos con trastorno esquizoafectivo (ver sección Propiedades farmacodinámicas- Eficacia clínica), un porcentaje mayor de sujetos tratados con INVEGA® (5%) presentó un incremento en el peso corporal de ≥7% en comparación con los sujetos tratados con el placebo (1%). En el estudio que analizó los grupos con dosis altas y dosis bajas, el incremento del peso corporal de ≥7% fue de 3% en el grupo con dosis baja, 7% en el grupo con dosis alta y 1% en el grupo con el placebo.
Pruebas de laboratorio: Prolactina sérica. Basado en los datos agrupados de los 3 estudios doble ciego, controlados con placebo, a dosis fijas, de 6 semanas (ver sección Propiedades farmacodinámicas - Eficacia clínica), se observaron incrementos de la prolactina sérica en sujetos de ambos géneros que recibieron INVEGA®. Los incrementos máximos promedio de las concentraciones de prolactina sérica se observaron generalmente el día 15 del tratamiento, pero permanecieron por encima de los niveles basales en el punto final del estudio.
Ensayos clínicos:
Reacciones adversas en un estudio controlado con placebo a largo plazo: La seguridad de INVEGA® también se evaluó en un ensayo a largo plazo diseñado para evaluar el mantenimiento del efecto con INVEGA® en adultos con esquizofrenia (ver sección Propiedades farmacodinámicas - Eficacia clínica). En general, los tipos, las frecuencias y las severidades de las reacciones adversas reportadas durante la fase inicial abierta de 14 semanas de este estudio fueron comparables a las reportadas en los estudios controlados con placebo, a dosis fijas, de 6 semanas. Las reacciones adversas reportadas durante la fase doble ciego a largo plazo de este estudio fueron similares en tipo y severidad a las observadas en la fase inicial abierta de 14 semanas, pero ocurrieron en frecuencias generalmente más bajas.
Datos posteriores a la comercialización: Adicionalmente a las reacciones adversas reportadas durante ensayos clínicos y descritos anteriormente, las siguientes reacciones adversas se han reportado durante la experiencia posterior a la comercialización con paliperidona y/o risperidona (Tabla 7). En la tabla las frecuencias se proporcionan de acuerdo a la siguiente convención:
Muy frecuente ≥1/10
Frecuente ≥1/100 a <1/10
Poco frecuente ≥1/1000 a <1/100
Raro ≥1/10000 a <1/1000
Muy raro <1/10000, incluyendo casos aislados
En la tabla 7 se presentan las reacciones adversas por categoría de frecuencia basada en tasas de reportes espontáneos.
|
Tabla 7. Reacciones adversas identificadas durante la experiencia posterior a la comercialización con INVEGA® y/o risperidona por categoría de frecuencia estimada de tasas de reportes espontáneos con paliperidona |
|
|
Trastornos del sistema linfático y de la sangre |
|
|
Muy raro |
Agranulocitosis, trombocitopenia |
|
Trastornos endocrinos |
|
|
Desconocida |
Secreción inapropiada de la hormona antidiurética |
|
Trastornos del metabolismo y la nutrición |
|
|
Muy raro |
Diabetes mellitus, cetoacidosis diabética, hipoglucemia |
|
Desconocida |
Intoxicación hídrica |
|
Trastornos psiquiátricos |
|
|
Muy raro |
Manía |
|
Trastornos del sistema nervioso |
|
|
Muy raro |
Disgeusia |
|
Trastornos oculares |
|
|
Desconocido |
Síndrome del iris flácido (intraoperatorio) |
|
Trastornos cardiacos |
|
|
Muy raro |
Fibrilación atrial |
|
Trastorno vascular |
|
|
Muy raro |
Trombosis venosa profunda, embolismo pulmonar |
|
Trastornos respiratorios, torácicos y mediastínicos |
|
|
Muy raro |
Síndrome de apnea del sueño |
|
Trastornos gastrointestinales |
|
|
Muy raro |
Pancreatitis |
|
Muy raro |
Íleo |
|
Trastornos hepatobiliares |
|
|
Desconocido |
Ictericia |
|
Trastornos de la piel y del tejido subcutáneo |
|
|
Raro |
Angioedema |
|
Muy raro |
Alopecia |
|
Trastorno renal y urinario |
|
|
Muy raro |
Retención urinaria |
|
Condiciones en el embarazo, puerperio y perinatal |
|
|
Muy raro |
Síndrome de abstinencia al fármaco neonatal |
|
Trastornos del aparato reproductivo y de la mama |
|
|
Muy raro |
Priapismo |
|
Trastornos generales |
|
|
Muy raro |
Hipotermia |
INTERACCIONES: Se aconseja precaución cuando se prescriba INVEGA® con otros fármacos conocidos por prolongar el intervalo QT.
Potencial de INVEGA® para afectar a otros fármacos: No se espera que la paliperidona cause interacciones farmacocinéticas clínicamente importantes con fármacos que son metabolizados por las isoenzimas del citocromo P450. Estudios in vitro con microsomas hepáticos humanos mostraron que la paliperidona no inhibe sustancialmente el metabolismo de los fármacos metabolizados por las isoenzimas del citocromo P450, incluyendo CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 y CYP3A5. Por tanto, no se espera que la paliperidona inhiba el aclaramiento de fármacos que son metabolizados por estas vías metabólicas de una manera clínicamente relevante. Los estudios in vitro indicaron que la paliperidona no es un inductor de la actividad de la CYP1A2, 2C19 o 3A4.
A altas concentraciones, la paliperidona es un inhibidor débil de la glicoproteína-P (gp-P). No existen datos in vivo y se desconoce la relevancia clínica.
Dado a los principales efectos de paliperidona en el SNC (ver sección Reacciones adversas), INVEGA® se debe utilizar con precaución en combinación con otros fármacos que actúan a nivel central y con alcohol. La paliperidona puede antagonizar el efecto de la levodopa y de otros agonistas de la dopamina.
Debido a su potencial para inducir hipotensión ortostática (ver sección Advertencias y precauciones- Hipotensión ortostática), se puede observar un efecto aditivo cuando INVEGA® se administra con otros agentes terapéuticos que tienen este potencial.
La interacción farmacocinética entre INVEGA® y el litio es improbable.
La co-administración de INVEGA® en estado estacionario (12 mg una vez al día) con tabletas de liberación prolongada de divalproex sódico (500 mg y 2000 mg una vez al día) no afectó la farmacocinética del valproato en estado estacionario.
Potencial de otros fármacos para afectar a INVEGA®: Paliperidona no es un sustrato de la CYP1A2, CYP2A6, CYP2C9, CYP2C19 y CYP3A5. Esto sugiere que una interacción con inhibidores o inductores de estas isoenzimas es improbable. Aunque estudios in vitro indican que la CYP2D6 y la CYP3A4 pueden estar mínimamente involucrados en el metabolismo de la paliperidona, no existen indicaciones in vitro ni in vivo que estas isoenzimas desempeñen un rol significativo en el metabolismo de la paliperidona. Los estudios in vitro han demostrado que paliperidona es un sustrato de la gp-P.
La paliperidona es metabolizada en grado limitado por la CYP2D6 (ver sección Propiedades farmacocinéticas- Metabolismo y eliminación). En un estudio de interacción en sujetos sanos, en el que se administró INVEGA® concomitantemente con paroxetina, un inhibidor potente de la CYP2D6, no se observaron efectos clínicamente relevantes sobre la farmacocinética de la paliperidona.
La co-administración de INVEGA® una vez al día con carbamazepina 200 mg dos veces al día causó una disminución de aproximadamente el 37% en el promedio de la Cmáx en estado estacionario y el AUC de paliperidona. Esta disminución es causada, en gran parte, por un incremento del 35% en el aclaramiento renal de paliperidona, probablemente como resultado de la inducción renal de la gp-P por la carbamazepina. Una disminución menor en la cantidad de fármaco inalterado excretado en la orina sugiere que hubo poco efecto sobre el metabolismo del CYP o la biodisponibilidad de la paliperidona durante la co-administración con la carbamazepina. Al iniciarse la carbamazepina, la dosis de INVEGA® debe ser reevaluada e incrementada si es necesario. De forma contraria, al discontinuar la carbamazepina, la dosis de INVEGA® debe ser reevaluada y reducida si es necesario.
La paliperidona, un catión bajo pH fisiológico, se excreta inalterada principalmente por los riñones, aproximadamente la mitad por filtración y la otra mitad por secreción activa. La administración concomitante de trimetoprima, un fármaco conocido por inhibir el transporte activo renal de fármacos catiónicos, no influenció en la farmacocinética de la paliperidona.
La co-administración de una dosis única de 12 mg de INVEGA® con divalproex sódico tabletas de liberación prolongada (dos tabletas de 500 mg una vez al día) produjo un incremento de aproximadamente el 50% en la Cmáx y el AUC de la paliperidona. Se debe considerar la reducción de la dosificación de INVEGA® cuando INVEGA® es co-administrado con valproato después de la evaluación clínica.
Uso concomitante de INVEGA® y risperidona: No se ha estudiado el uso concomitante de INVEGA® con risperidona. Debido a que la paliperidona es un metabolito activo de la risperidona, se debe tomar en consideración la exposición adicional a paliperidona si risperidona es co-administrada con INVEGA®.
EFICACIA CLÍNICA:
Esquizofrenia – Adultos: La eficacia de INVEGA® se estableció en 3 ensayos doble ciego, controlados con placebo, de 6 semanas en sujetos que cumplieron el criterio DSM-IV para esquizofrenia. Se incluyó un control activo (olanzapina) para propósitos de la sensibilidad del ensayo. Las dosis de INVEGA®, las cuales variaron entre los tres estudios, fueron de entre 3 y 15 mg una vez al día. La eficacia se evaluó utilizando la escala del síndrome positivo y negativo (PANSS); el criterio de valoración principal fue la disminución de la puntuación total de la PANSS. Un examen de los subgrupos de la población no reveló ninguna evidencia de respuesta diferencial basado en la edad, raza o género. Los criterios de valoración secundarios también fueron evaluados, incluyendo la escala del rendimiento personal y social (PSP) y la escala de impresión clínica global – severidad (CGI-S). La PSP es una escala valorada por el médico validada que mide cuatro áreas de la función personal y social (las actividades sociales útiles incluyendo el trabajo y el estudio, las relaciones personales y sociales, cuidarse a sí mismo y los comportamientos perturbadores y agresivos). La CGI-S es una evaluación independiente valorada por el investigador de la severidad global de la enfermedad. En un análisis agrupado de estos tres estudios, cada dosis de INVEGA® fue superior al placebo en la PSP y la CGI-S. Además, el efecto en la PSP fue distinto al de la mejoría de los síntomas medida según el criterio de valoración principal, PANSS total. La evaluación adicional de las extensiones abiertas de estos tres estudios mostró que la dosificación de INVEGA® de forma flexible (de 3 a 15 mg una vez al día) hasta por 52 semanas se asoció el mejoramiento continuo de la PSP.
En un ensayo a largo plazo diseñado para evaluar el mantenimiento del efecto, INVEGA® fue significativamente más eficaz que el placebo para mantener el control de los síntomas y retrasar la recurrencia de la esquizofrenia. En este estudio, los adultos que cumplieron el criterio DSM-IV para esquizofrenia y que permanecieron clínicamente estables con una dosis establecida de INVEGA® durante un período de tratamiento abierto de 8 semanas (rango de dosis de 3 a 15 mg una vez al día) después de haber sido tratados por un episodio agudo durante las 6 semanas anteriores con INVEGA® (rango de dosis de 3 a 15 mg una vez al día) fueron luego aleatorizados en una manera doble ciego para continuar con INVEGA® a su dosis estable alcanzada o el placebo hasta que experimentaron una recurrencia de los síntomas de la esquizofrenia. El ensayo se interrumpió tempranamente por razones de eficacia basado en un análisis intermedio que alcanzó el criterio predefinido mostrando un tiempo significativamente más largo a la recurrencia en los pacientes tratados con INVEGA® en comparación con el placebo (p = 0.0053). Basado en el análisis final (incluyendo también a los pacientes incluidos después del punto de corte del análisis intermedio), las tasas de los eventos de recurrencia fue 22.1% en el grupo de INVEGA® comparado con el 51.5% en el grupo del placebo. Una significante mejoría de los síntomas se alcanzó al final de la fase de estabilización abierta (disminución de la puntuación total de la PANSS de 38 [DE ± 16.03] puntos), pero después de la aleatorización al tratamiento doble ciego, los pacientes que recibieron el placebo empeoraron significativamente más que los con INVEGA® (p < 0.001). INVEGA® también fue significativamente más efictivo que el placebo para mantener el rendimiento personal y social. Durante la fase doble ciego de este estudio, medida por la escala CGI-S, hubo un empeoramiento de la severidad general de la psicosis en el grupo del placebo, mientras que los pacientes tratados con INVEGA® permanecieron clínicamente estables.
Esquizofrenia – Adolescentes: La eficacia de INVEGA® en sujetos adolescentes con esquizofrenia se estableció en un estudio aleatorizado, doble ciego, de grupo paralelo, controlado con placebo, de 6 semanas usando un diseño de grupo de tratamiento a dosis fija basado en el peso en el rango de dosis de 1.5 a 12 mg/día. Los sujetos tenían 12 - 17 años de edad y cumplían el criterio DSM-IV para la esquizofrenia, con confirmación del diagnóstico usando el Inventario Kiddie para los trastornos afectivos y la Esquizofrenia – versión actual y a lo largo de la vida (K-SADS-PL).
Los sujetos elegibles fueron asignados de forma aleatoria a 1 de los 4 grupos de tratamiento: Un grupo con el placebo o grupos a dosis baja, media o alta de INVEGA®. Las dosis se administraron en base al peso corporal para minimizar el riesgo de exponer a adolescentes de peso más bajo a dosis altas de INVEGA®. Los sujetos que pesaban entre 29 kg y menos de 51 kg en la visita inicial fueron asignados de forma aleatoria para recibir el placebo o 1.5 mg (dosis baja), 3 mg (dosis media) o 6 mg (dosis alta) de INVEGA® diarios, y los sujetos que pesaban al menos 51 kg en la visita inicial fueron asignados de forma aleatoria para recibir el placebo o 1.5 mg (dosis baja), 6 mg (dosis media) o 12 mg (dosis alta) de INVEGA® diarios. La dosificación fue en la mañana sin tener en cuenta los alimentos.
Se evaluó la eficacia usando la PANSS. Este estudio demostró la eficacia de INVEGA® en sujetos adolescentes con esquizofrenia cuando recibieron dosis diarias de 3, 6 y 12 mg en los grupos de tratamiento basados en el peso corporal. La dosis efectiva mínima para INVEGA® en esta población fue 3 mg/día.
Trastorno esquizoafectivo: La eficacia de INVEGA® (3 mg a 12 mg una vez al día) en el tratamiento del trastorno esquizoafectivo se estableció en dos ensayos controlados con placebo, de 6 semanas en sujetos adultos no ancianos que cumplieron el criterio DSM-IV para el trastorno esquizoafectivo confirmado por la Entrevista Clínica Estructurada para los Trastornos DSM-IV. En uno de estos ensayos, la eficacia se evaluó en 203 sujetos que fueron asignados a uno de los dos niveles de dosis de INVEGA®: 6 mg con la opción a reducir a 3 mg (n = 105) o 12 mg con la opción a reducir a 9 mg (n = 98) una vez al día. En el otro estudio, la eficacia se evaluó en 211 pacientes que recibieron dosis flexibles de INVEGA® (3-12 mg una vez al día). Ambos estudios incluyeron sujetos que recibieron INVEGA® como monoterapia o en combinación con antidepresivos y/o estabilizadores del estado de ánimo. La dosis fue en la mañana sin tener en cuenta los alimentos. Los estudios se llevaron a cabo en Estados Unidos, Europa del Este, Rusia y Asia.
La eficacia fue evaluada usando la escala del Síndrome Positivo y Negativo (PANSS), un inventario de múltiples ítems validado compuesto de cinco factores para evaluar los síntomas positivos, síntomas negativos, pensamientos desorganizados, hostilidad/excitación incontrolada y ansiedad / depresión
El grupo con la dosis mayor de INVEGA® en el estudio de nivel de dosis 2 (12 mg/día con la opción a reducir a 9 mg/día), y el grupo con INVEGA® en el estudio a dosis flexible (dosis de entre 3 y 12 mg/día, dosis modal promedio de 8.6 mg/día) fue cada uno superior al placebo en la PANSS. En el grupo con la dosis menor del estudio de nivel de dosis 2 (6 mg/día con la opción a reducir a 3 mg/día), INVEGA® no fue significativamente diferente del placebo medido por la PANSS.
Tomando los resultados de ambos estudios en conjunto, INVEGA® mejoró los síntomas del trastorno esquizoafectivo, en el punto final de evaluación respecto al placebo cuando se administró como monoterapia o en combinación con antidepresivos y/o estabilizadores del estado de ánimo. Un examen de los subgrupos de la población no reveló ninguna evidencia de respuesta diferencial basado en el género, edad o región geográfica. No hubo datos suficientes para explorar los efectos diferenciales basados en la raza.
INFORMACIÓN NO CLÍNICA:
Toxicología: Al igual que otros fármacos que antagonizan los receptores D2 de la dopamina, la paliperidona incrementó los niveles séricos de la prolactina en estudios de toxicidad a dosis repetidas.
En un estudio de toxicidad juvenil de 7 semanas con dosis orales de paliperidona de 0.16, 0.63 y 2.5 mg/kg/día, que son 0.12, 0.5 y 1.8 veces la dosis máxima recomendada en humanos de 12 mg/día para adolescentes sobre una base de mg/m2, no se observaron efectos en el crecimiento, maduración sexual y rendimiento reproductivo. Las dosis de hasta 2.5 mg/kg/día no perjudicaron el desarrollo neuroconductual en machos y hembras, excepto por un efecto en el aprendizaje y la memoria en ratas hembra tratadas con 2.5 mg/kg/día. No se observó este efecto después de la discontinuación del tratamiento.
En un estudio de 40 semanas en perros jóvenes tratados con risperidona oral (que se convierte extensamente a paliperidona) con dosis de 0.31, 1.25 y 5 mg/kg/día, la maduración sexual no fue afectada de manera adversa con 0.31 y 1.25 mg/kg/día. El crecimiento del hueso largo no se afectó con 0.31 mg/kg/día; los efectos se observaron con 1.25 y 5 mg/kg/día.
Carcinogenicidad: El potencial carcinogénico de la paliperidona, un metabolito activo de la risperidona, se evaluó en base a estudios con risperidona conducido en ratones y ratas. La risperidona se administró en dosis de hasta 10 mg/kg/día durante 18 meses a ratones y durante 25 meses a ratas. Se presentaron incrementos estadísticamente significativos de adenomas en la glándula pituitaria, adenomas en el páncreas endocrino y adenocarcinomas en la glándula mamaria. Se ha encontrado un incremento de los tumores mamarios, pituitarios y en el páncreas endocrino en roedores después de la administración crónica de otros fármacos antipsicóticos y se considera que está mediada por el antagonismo prolongado de la dopamina D2. Se desconoce la relevancia de estos tumores encontrados en roedores en términos de riesgo para el humano.
Mutagenicidad: No se encontró evidencia de potencial mutagénico de la paliperidona en la prueba de mutaciones inversas de Ames, en el ensayo de linfoma de ratón o en la prueba de micronúcleos de rata.
Fertilidad: Aunque el tratamiento con la paliperidona produjo efectos mediados por la prolactina y el SNC, no se afectó la fertilidad de las ratas macho y hembra. A una dosis tóxica materna, las ratas hembra mostraron un número ligeramente menor de embriones vivos
ADVERTENCIAS Y PRECAUCIONES:
Síndrome neuroléptico maligno: Se ha reportado que ocurre síndrome neuroléptico maligno (SNM), caracterizado por hipertermia, rigidez muscular, inestabilidad autónoma, alteración de la consciencia y niveles elevados de creatina fosfoquinasa sérica con fármacos antipsicóticos, incluyendo paliperidona. Signos clínicos adicionales pueden incluir mioglobinuria (rabdomiolisis) e insuficiencia renal aguda. Si un paciente desarrolla signos o síntomas que indican SNM, se debe discontinuar todos los fármacos antipsicóticos, incluyendo INVEGA®.
Disquinesia tardía: Los fármacos con propiedades antagonistas del receptor de la dopamina se han asociado con la inducción de disquinesia tardía caracterizada por movimientos rítmicos involuntarios, predominantemente de la lengua y/o de la cara. Si aparecen signos o síntomas de disquinesia tardía, se debe considerar la discontinuación de todos los fármacos antipsicóticos, incluyendo INVEGA®.
Intervalo QT: Al igual que con otros antipsicóticos, se debe tener precaución cuando INVEGA® es prescrito a pacientes con antecedente de arritmias cardíacas, pacientes con síndrome de QT largo congénito y en el uso concomitante con fármacos conocidos por prolongar el intervalo QT (ver sección Propiedades farmacodinámicas: Efecto sobre el intervalo QT/QTc y electrofisiología cardiaca).
Hiperglucemia y diabetes mellitus: Se ha reportado hiperglucemia, diabetes mellitus, y la exacerbación de diabetes preexistente durante el tratamiento con INVEGA®. La evaluación de la relación entre el uso de antipsicóticos atípicos y las alteraciones en la glucosa es complicada debido a la posibilidad de un incremento del riesgo intrínseco de diabetes mellitus en pacientes con esquizofrenia y el incremento en la incidencia de diabetes mellitus en la población general. Dado a estas variables de confusión, la relación entre el uso de antipsicóticos atípicos y los eventos adversos relacionados con la hiperglucemia no se entienden completamente. Cualquier paciente tratado con antipsicóticos atípicos, incluyendo INVEGA® debe ser monitorizado por los síntomas de hiperglucemia y diabetes mellitus (ver sección Reacciones adversas).
Aumento de peso: Se ha observado aumento de peso con el uso de antipsicóticos atípicos. Se recomienda la monitorización clínica del peso.
Hipotensión ortostática: La paliperidona puede inducir hipotensión ortostática en algunos pacientes basado en su actividad alfa bloqueante. INVEGA® se debe utilizar con precaución en los pacientes con enfermedades cardiovasculares conocidas (por ejemplo, insuficiencia cardíaca, isquemia o infarto de miocardio, anomalías en la conducción), enfermedad cerebrovasculares o condiciones que predisponen al paciente a la hipotensión (por ejemplo, deshidratación, hipovolemia y tratamiento con medicamentos antihipertensivos).
Convulsiones: Al igual que con otros fármacos antipsicóticos, INVEGA® se debe utilizar con precaución en los pacientes con antecedente de convulsiones u otras condiciones que potencialmente reducen el umbral de las convulsiones.
Potencial para la obstrucción gastrointestinal: Debido a que INVEGA® comprimido es indeformable y su forma no cambia apreciablemente en el tracto gastrointestinal, INVEGA® no debe administrarse normalmente a pacientes con estrechamiento gastrointestinal grave preexistente (patológico o iatrogénico) o a pacientes con disfagia o dificultad significativa para ingerir comprimidos. Ha habido reportes raros de síntomas obstructivos en pacientes con estenosis conocida asociado con la ingestión de fármacos en formulaciones de liberación controlada no deformables. Debido al diseño de liberación controlada de la forma farmacéutica, INVEGA® sólo se debe utilizar en pacientes que con capaces de ingerir el comprimido entero (ver Posología y Administración - Administración).
Pacientes ancianos con demencia: INVEGA® no se ha estudiado en pacientes ancianos con demencia.
Mortalidad global: En un meta-análisis de 17 estudios clínicos controlados, los pacientes ancianos con demencia tratados con otros fármacos antipsicóticos atípicos, incluyendo risperidona, aripiprazol, olanzapina y quetiapina, tuvieron un incremento en el riesgo de mortalidad en comparación con el placebo. Entre los tratados con risperidona, la mortalidad fue 4% en comparación con 3.1% con el placebo.
Eventos adversos cerebrovasculares: En estudios controlados con placebo en pacientes ancianos con demencia tratados con fármacos antipsicóticos atípicos, incluyendo risperidona, aripiprazol y olanzapina, hubo una mayor incidencia de eventos adversos cerebrovasculares (accidentes cerebrovasculares y ataques isquémicos transitorios) incluyendo muertes, en comparación con el placebo.
Leucopenia, neutropenia y agranulocitosis: Se han reportado eventos de leucopenia, neutropenia y agranulocitosis con agentes antipsicóticos, incluyendo INVEGA®. Se ha reportado muy raramente agranulocitosis (< 1/10000 pacientes) durante la farmacovigilancia posterior a la comercialización.
Los pacientes con antecedente de un recuento bajo de glóbulos blancos (GB) clínicamente significativo o leucopenia/neutropenia inducida por el fármaco deben ser monitorizados durante los primeros meses de la terapia y se debe considerar la discontinuación de INVEGA® ante el primer signo de una disminución clínicamente significativa de los glóbulos blancos en ausencia de otros factores causales.
Los pacientes con neutropenia clínicamente significativa deben ser monitorizados cuidadosamente por fiebre u otros síntomas o signos de infección y deben ser tratados inmediatamente si ocurren tales síntomas o signos. Los pacientes con neutropenia severa (recuento absoluto de neutrófilos < 1 X 109/L) deben discontinuar INVEGA® y monitorizar sus glóbulos blancos hasta la recuperación.
Tromboembolismo venoso: Se han informado casos de tromboembolismo venoso (TEV) con fármacos antipsicóticos. Debido a que los pacientes tratados con antipsicóticos a menudo presentan factores de riesgo adquiridos para TEV, todos los posibles factores de riesgo para TEV se deben identificar antes y durante el tratamiento con INVEGA® y se deben establecer las medidas preventivas.
Enfermedad de Parkinson y demencia con cuerpos de Lewy: Los médicos deben sopesar los riesgos frente a los beneficios cuando prescriben fármacos antipsicóticos, incluyendo INVEGA®, a pacientes con enfermedad de Parkinson o demencia con cuerpos de Lewy (DCL) ya que ambos grupos pueden tener riesgo incrementado de síndrome neuroléptico maligno, así como una sensibilidad incrementada a los medicamentos antipsicóticos. Las manifestaciones de esta sensibilidad incrementada pueden incluir confusión, obnubilación, inestabilidad postural con caídas frecuentes, además de síntomas extrapiramidales.
Priapismo: Se ha reportado que fármacos con efectos bloqueantes alfa-adrenérgicos inducen priapismo. Se ha reportado priapismo con paliperidona durante la farmacovigilancia posterior a la comercialización (ver sección Reacciones adversas).
Regulación de la temperatura corporal: Se ha atribuido a los agentes antipsicóticos la alteración de la capacidad del cuerpo para reducir la temperatura corporal central. Se aconseja cuidado apropiado cuando se prescriba INVEGA® a pacientes que experimentarán condiciones que pueden contribuir a la elevación la temperatura corporal central, por ejemplo, ejercicios extenuantes, exposición a calor extremo, recibir medicamentos concomitantes con actividad anticolinérgica, o estén sujetos a deshidratación.
Efecto antiemético: En estudios preclínicos con paliperidona se observó un efecto antiemético. Este efecto, si ocurre en humanos, puede enmascarar los signos y síntomas de sobredosis con ciertos fármacos o condiciones como obstrucción intestinal, síndrome de Reye y tumor cerebral.
Síndrome de iris flácido Intraoperatorio: Se ha observado síndrome de iris flácido intraoperatorio (SIFI) durante cirugía de catarata en pacientes tratados con medicamentos con efecto antagonista adrenérgico alfa 1a, como INVEGA® (ver sección Reacciones adversas).
SIFI puede incrementar el riesgo de complicaciones en el ojo durante y después de la operación. El uso actual o pasado de medicamentos con efecto antagonista adrenérgico alfa 1a debe ser comunicado al cirujano oftálmico antes de la cirugía. No se ha establecido el beneficio potencial de detener la terapia del bloqueo alfa1 previo a la cirugía de catarata y se debe sopesar contra el riesgo de detener la terapia antipsicótica.
PRECAUCIONES ESPECIALES DE CONSERVACIÓN: No conservar a una temperatura superior a 30 ºC.
Proteger de la humedad.
Mantener fuera de la vista y del alcance de los niños.
POSOLOGÍA Y ADMINISTRACIÓN:
Posología:
Esquizofrenia:
Adultos (≥ 18 años de edad): La dosis recomendada de INVEGA® para el tratamiento de esquizofrenia en adultos es de 6 mg una vez al día, administrado en la mañana. No es necesario titular la dosis inicial. Algunos pacientes pueden beneficiarse de dosis más bajas o más altas dentro del rango recomendado de 3 a 12 mg una vez al día. El ajuste de la dosificación, si está indicado, sólo debe realizarse después de la reevaluación clínica. Cuando esté indicado incrementar la dosis, se recomiendan incrementos de 3 mg/día y generalmente deben realizarse a intervalos de más de 5 días.
Adolescentes (12-17 años de edad): La dosis recomendada de INVEGA® para el tratamiento de la esquizofrenia en adolescentes de 12-17 años de edad es 3 mg, una vez por día, administrado en la mañana. No es necesario titular la dosis inicial. Algunos pacientes pueden beneficiarse de una dosis más alta de 6 mg a 12 mg/día. Los incrementos de la dosis sólo deben realizarse después de la reevaluación clínica y se deben realizar en incrementos de 3 mg/día a intervalos de más de 5 días.
Trastorno esquizoafectivo:
Adultos (≥ 18 años de edad): La dosis recomendada de INVEGA® para el tratamiento del trastorno esquizoafectivo en adultos es 6 mg una vez al día, administrada en la mañana. No es necesario titular la dosis inicial. Algunos pacientes pueden beneficiarse de dosis más bajas o más altas dentro del rango recomendado de 3 a 12 mg una vez al día. Una tendencia general hacia efectos mayores, se observó con dosis más altas El ajuste de la dosificación, si está indicado, sólo debe realizarse después de la reevaluación clínica. Cuando está indicado incrementar la dosis, se recomiendan incrementos de 3 mg/día y generalmente deben realizarse a intervalos de más de 4 días.
Poblaciones especiales:
Adolescentes y niños: No se ha establecido la seguridad y la eficacia de INVEGA® para el tratamiento de la esquizofrenia en pacientes < 12 años de edad. No se han estudiado la seguridad y la eficacia de INVEGA® para el tratamiento del trastorno esquizoafectivo en pacientes de < 18 años de edad.
Ancianos: Las recomendaciones de dosificación para los pacientes ancianos con función renal normal (≥ 80 mL/min) son las mismas que para los adultos con función renal normal (ver sección Posología). Sin embargo, debido a que los pacientes ancianos pueden tener la función renal disminuida, puede ser necesario ajustar la dosis de acuerdo al estado de su función renal (ver sección Insuficiencia renal).
Insuficiencia renal: Para los pacientes con insuficiencia renal leve (aclaramiento de creatinina de ≥ 50 a < 80 mL/min), la dosis inicial recomendada es 3 mg una vez al día. La dosis puede incrementarse hasta 6 mg una vez al día, basada en la respuesta clínica y en la tolerancia.
Para los pacientes con insuficiencia renal moderada a severa (aclaramiento de creatinina ≥ 10 a < 50 mL/min), la dosis recomendada de INVEGA® es 3 mg cada dos días, que luego puede incrementarse a 3 mg una vez al día después de la reevaluación clínica. Dado que INVEGA® no se ha estudiado en pacientes con aclaramiento de creatinina < 10 mL/min, no se recomienda su uso en estos pacientes.
Insuficiencia hepática: No es necesario ajustar la dosis en pacientes con insuficiencia hepática leve a moderada. INVEGA® no se ha estudiado en pacientes con insuficiencia hepática severa.
Otras poblaciones: No se recomienda ajustar la dosis de INVEGA® basado en el género, la raza o el hábito de fumar. (Para las mujeres embarazadas y madres en período de lactancia, ver sección Embarazo y lactancia).
Cambio a otros agentes antipsicóticos: No existen datos recolectados sistemáticamente para manejar específicamente el cambio de los pacientes a partir de INVEGA® a otros agentes antipsicóticos. Debido a los diferentes perfiles farmacodinámicos y farmacocinéticos entre los productos antipsicóticos, es necesaria la supervisión de un médico cuando el cambio a otro producto antipsicótico se considera médicamente apropiado.
ADMINISTRACIÓN: INVEGA® es para administración oral y se puede administrar con sin los alimentos.
INVEGA® debe ser ingerido entero, con la ayuda de líquidos y no debe masticarse, dividirse o triturarse. La medicación está contenida dentro de una cubierta no absorbible diseñada para liberar el fármaco a una velocidad controlada. La cubierta del comprimido, junto con los componentes insolubles del núcleo, son eliminados del organismo; los pacientes no deben preocuparse si ocasionalmente observan algo que se parece a un comprimido en las heces.
SOBREDOSIS:
Signos y síntomas: En general, los signos y síntomas esperados son los resultantes de una exageración de los efectos farmacológicos conocidos de la paliperidona manifestados; es decir, somnolencia y sedación, taquicardia e hipotensión, prolongación QT y síntomas extrapiramidales. Se ha reportado Torsade de pointes y fibrilación ventricular en el contexto de sobredosis con paliperidona oral. En caso de sobredosis aguda, se debe considerar la posibilidad de involucrar a múltiples fármacos.
Tratamiento: Se debe considerar la naturaleza de liberación prolongada del producto cuando se evalúa las necesidades del tratamiento y la recuperación. No existe antídoto específico para la paliperidona. Se deben emplear medidas generales de soporte. Establecer y mantener despejada una vía respiratoria y asegurar la adecuada oxigenación y ventilación. El monitoreo cardiovascular debe iniciarse inmediatamente y debe incluir un monitoreo continuo del electrocardiograma por posibles arritmias. La hipotensión y el colapso circulatorio se deben trata con medidas apropiadas como líquidos intravenosos y/o agentes simpaticomiméticos. Se debe considerara la administración de carbón activado junto con un laxante. En caso de síntomas extrapiramidales severos, se deben administrar agentes anticolinérgicos. Se debe continuar con el monitoreo y la supervisión estrecha hasta que el paciente se recupere.
PRESENTACIÓN: Caja por 14 tabletas de liberación prolongada por 3 mg (Reg. San. INVIMA 2007M-0007572). Caja por 14 tabletas de liberación prolongada por 6 mg (Reg. San. INVIMA 2007M-0007546). Caja por 14 tabletas de liberación prolongada por 9 mg (Reg. San. INVIMA 2007M-0007545).
JANSSEN-CILAG, S. A.
Av. Calle 26 No. 69-76 - Edificio Elemento
Torre 2, Piso 11 - PBX: +57 1 927 1200 - Bogotá, D. C.
NATURALEZA Y CONTENIDO DEL ENVASE: INVEGA® está disponible en forma de comprimidos de liberación prolongada en las siguientes presentaciones:
INVEGA® 3 mg, caja por 14 comprimidos, (Reg. San. INVIMA 2007M-0007572).
INVEGA® 6 mg, caja por 14 comprimidos, (Reg. San. INVIMA 2007M-0007546).
INVEGA® 9 mg, caja por 14 comprimidos, (Reg. San. INVIMA 2007M-0007545).