
MICROFEMIN CD
ETINILESTRADIOL, LEVONORGESTREL
Tabletas recubiertas
1 Caja, 28 Tabletas recubiertas,
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: 150 microgramos de levonorgestrel y 30 microgramos de etinilestradiol en cada tableta recubierta. Excipientes con efecto conocido: Mono hidrato de lactosa y sacarosa.
En busca de una lista completa de excipientes, véase la Sección 6.1.
LISTA DE EXCIPIENTES:
Tableta núcleo: Sílica anhidra coloidal, estearato de magnesio, talco, almidón de maíz, lactosa monohidrato (33 mg).
Recubrimiento: Carmelosa de sodio, povidona K-30, macrogol 6000, copovidona, dióxido de titanio (E171), carbonato de calcio, sacarosa (22.459 mg), sílica anhidra coloidal, talco.
Incompatibilidades: No aplica.
Vida útil: No use MICROFEMIN después de la fecha de vencimiento indicada en el envase. La fecha de vencimiento se refiere al último día de ese mes.
Precauciones especiales para almacenamiento
Almacenar a temperaturas inferiores a 30°C.
Mantenga este medicamento fuera de la vista y del alcance de los niños.
FORMA FARMACÉUTICA:
Tabletas recubiertas.
Tableta recubierta con azúcar, blanca, brillante, redonda, biconvexa.
INDICACIONES TERAPÉUTICAS:
Anticoncepción oral.
La decisión de prescribir MICROFEMIN debe tener en cuenta los factores de riesgo actuales de cada mujer, en particular los de tromboembolismo venoso (TEV), y cómo se compara el riesgo de TEV con MICROFEMIN con otros anticonceptivos hormonales combinados (AHC) (ver secciones 4.3 y 4.4).
PROPIEDADES FARMACOLÓGICAS:
Propiedades farmacodinámicas:
Grupo farmacoterapéutico: Hormonas sexuales y moduladores del sistema genital; anticonceptivos hormonales para uso sistémico; progestágenos y estrógenos, combinaciones fijas.
Código ATC: G03A A07
Minipíldora combinada de estrógeno y progestágeno. Índice de Pearl: 0,1 por ciento mujer años.
La eficacia anticonceptiva de MICROFEMIN surge de 3 acciones complementarias: En el eje hipotalámico-hipofisario mediante inhibición de la ovulación, en el moco cervical que se vuelve impermeable a la migración de los espermatozoides,
en el endometrio, que se vuelve inadecuado para la implantación
Propiedades farmacocinéticas:
Etinilestradiol:
Absorción: El etinilestradiol se absorbe rápida y completamente, y el pico plasmático se alcanza en 60 a 180 minutos. A continuación de la conjugación pre sistémica y el metabolismo de primer paso, la biodisponibilidad media es del 40 al 45%. El área bajo la curva y Cmax puede esperarse que aumente ligeramente con el tiempo.
Distribución: El etinilestradiol está unido a proteínas plasmáticas hasta un 98.8%, casi completamente a albúmina.
Metabolismo: El etinilestradiol sufre una conjugación pre sistémica tanto en la mucosa del intestino delgado como en el hígado. La hidrólisis de los conjugados directos del etinilestradiol por parte de la flora intestinal suministra etinilestradiol, el cual puede reabsorberse, creando por lo tanto una circulación enterohepática. La ruta primaria de metabolismo del etinilestradiol es la hidroxilación mediada por el citocromo P-450 donde los metabolitos primarios son 2-OH-etinil estradiol y 2-metoxi-etinil estradiol. El 2-OH-etinil estradiol se metaboliza adicionalmente hacia metabolitos químicamente reactivos.
Eliminación: El etinilestradiol desaparece del plasma con un T½ de aproximadamente 29 horas (26 - 33 horas); la depuración plasmática varía entre 10 - 30 l/hora. La excreción de los conjugados de etinilestradiol y sus metabolitos toma lugar vía orina y heces (relación 1:1).
Levonorgestrel
Absorción: Levonorgestrel se absorbe rápida y completamente desde el tracto gastrointestinal después de la administración oral. Después de la administración oral, el pico plasmático de levonorgestrel se alcanza en 30 a 120 minutos. La biodisponibilidad es aproximadamente de 100% y el levonorgestrel no está sujeto al metabolismo de primer paso.
Distribución: Levonorgestrel está, en una gran extensión, unida a albúmina y SHBG (globulina de unión a la hormona sexual) en el plasma.
Metabolismo: El metabolismo es principalmente por reducción del grupo D4-3-oxo e hidroxilación en las posiciones 2a, 1b y 16b, seguida por conjugación. La mayoría de los metabolitos que circulan en la sangre son sulfatos de 3a, 5b-tetrahidro-levonorgestrel, mientras que la excreción principalmente toma lugar como glucurónidos. Algo del levonorgestrel original está también circulando como 17b-sulfato. La depuración metabólica está sujeta a una marcada variación entre los individuos, la cual puede explicar parcialmente la amplia variación en las concentraciones de levonorgestrel observadas entre los pacientes.
Eliminación: Levonorgestrel se elimina con un T½ promedio de aproximadamente 36 horas en estado estable. Levonorgestrel y sus metabolitos se excretan principalmente en la orina (40% - 68%) y aproximadamente 16% - 48% se excretan en las heces.
CONTRAINDICACIONES: Los anticonceptivos orales combinados no deben utilizarse en presencia de las enfermedades y condiciones mencionadas a continuación. Si ocurriera una enfermedad o condición tal por primera vez durante el uso de anticonceptivos orales, el uso de la preparación debe descontinuarse inmediatamente:
— Presencia o riesgo de tromboembolismo venoso (TEV):
• Tromboembolismo venoso: TEV actual (con anticoagulantes) o antecedentes de trombosis venosa (por ejemplo, trombosis venosa profunda [TVP] o embolia pulmonar [EP])
• Predisposición hereditaria o adquirida conocida para tromboembolismo venoso (incluido el factor V Leiden), deficiencia de antitrombina III, deficiencia de proteína C, deficiencia de proteína S
• Cirugía mayor con inmovilización prolongada.
• Alto riesgo de tromboembolismo venoso debido a la presencia de múltiples factores de riesgo (ver sección 4.4).
— Presencia o riesgo de tromboembolismo arterial (TEA):
• Tromboembolismo arterial - tromboembolismo arterial actual, antecedentes de tromboembolismo arterial (p. Ej., Infarto de miocardio) o enfermedad prodrómica (p. Ej., Angina de pecho)
• Enfermedad cerebrovascular: ictus actual, antecedentes de ictus o afección prodrómica (por ejemplo, ataque isquémico transitorio, AIT)
• Predisposición hereditaria o adquirida conocida a tromboembolismo arterial, como hiperhomocisteinemia y anticuerpos an.pngosfolípidos (anticuerpos anticardiolipina, anticoagulante lúpico)
• Historia de migraña con síntomas neurológicos focales (migraña con aura)
• Un alto riesgo de tromboembolismo arterial debido a múltiples factores de riesgo (ver sección 4.4) o a la presencia de un factor de riesgo grave como:
• diabetes mellitus con síntomas vasculares
• hipertensión severa
• dislipoproteinemia grave.
— Tumores malignos, que se conoce o se sospeche dependen de hormona sexual, (ejemplo en los senos y órganos genitales);
— Presencia o historia de tumores hepáticos (benignos o malignos);
— Pancreatitis o antecedentes de pancreatitis asociada con hipertrigliceridemia severa;
— Enfermedad hepática grave, actual o previa, siempre que los valores de la función hepática no hayan vuelto a la normalidad;
— Hipersensibilidad a las sustancias activas (levonorgestrel, etinilestradiol) o a cualquiera de los excipientes.
— MICROFEMIN está contraindicado en asociación con la hierba de San Juan (Hypericum perforatum) (ver sección 4.5).
— MICROFEMIN está contraindicado para uso concomitante con los medicamentos que contienen ombitasvir / paritaprevir / ritonavir, dasabuvir, lecaprevir/pibrentasvir y sofosbuvir/velpatasvir/voxilaprevir (ver secciones 4.4 y 4.5).
FERTILIDAD, EMBARAZO Y LACTANCIA:
Embarazo: MICROFEMIN® tabletas recubiertas, no se indican durante el embarazo. Si ocurre el embarazo durante la terapia con MICROFEMIN®, el tratamiento debería retirarse inmediatamente.
Los resultados de la mayoría de los estudios epidemiológicos hasta la fecha no muestran un riesgo incrementado de defectos de nacimiento en niños nacidos de mujeres que tomaban píldoras anticonceptivas antes del embarazo, ni ningún efecto teratogénico en caso de exposición inadvertida de píldoras anticonceptivas al principio del embarazo. Se debe considerar el aumento del riesgo de TEV durante el período posparto al reiniciar los comprimidos de MICROFEMIN.
Lactancia: La lactancia puede verse influenciada por ACOs ya que pueden reducir la cantidad y cambiar la composición de la leche humana. Por lo tanto, el uso de anticonceptivos orales no puede recomendarse generalmente, hasta que la madre lactante destete completamente al niño. Pequeñas cantidades de esteroides anticonceptivos y/o sus metabolitos pueden excretarse con la leche.
EFECTOS SOBRE LA HABILIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS: MICROFEMIN® tabletas, no tiene ninguna influencia sobre la capacidad para conducir y utilizar máquinas.
EFECTOS NO DESEABLES: Los siguientes efectos adversos han sido reportados durante el uso de MICROFEMIN:
|
Clase de órganos del sistema |
Eventos adversos comunes (≥ 1/100 a < 1/10) |
Poco comunes (≥ 1/1,000 a < 1/100) |
Raros (≥1/10,000 a <1/1,000 |
Muy raros (<1/10,000) |
Desconocidos (Frecuencia no puede ser estimada desde la fecha disponible) |
|
Trastornos generales y condiciones del sitio de administración |
Alteración de peso (incremento o reducción) Retención de fluidos/edema |
||||
|
Neoplasmas benignos, malignos o no especificados (que incluye quistes y pólipos) |
Tumores benignos hepáticos (ejemplo, hiperplasia nodular focal, Adenoma hepático), |
||||
|
Trastornos del sistema inmune |
Hipersensibilidad, Reacciones anafilácticas con casos muy raros de urticaria, angioedema, desordenes respiratorios y circulatorios severos |
Exacerbación de lupus eritematoso diseminado |
|||
|
Trastornos del metabolismo y la nutrición |
Apetito alterado (incremento o reducción) |
Intolerancia a la Glucosa |
Exacerbación de porfiria |
||
|
Trastornos psiquiátricos |
Cambios en la libido Cambios de humor incluido depresión |
||||
|
Trastornos del sistema nervioso |
Dolor de cabeza Nerviosismo Mareo |
Migraña |
Corea exacerbada |
||
|
Trastornos oculares |
Intolerancia a utilizar lentes de contacto |
Neuritis óptica, Trombosis retinal vascular |
|||
|
Trastornos vasculares |
Hipertensión |
Trombo embolismo venoso (TEV) Trastornos trombo embólicos arteriales(TEA) |
Venas varicosas agravados |
||
|
Trastornos gastrointestinales |
Nausea Vómito Dolor abdominal |
Diarrea Calambres abdominales Hinchazón |
Colitis isquémica |
Enfermedad intestinal inflamatoria (enfermedad de Crohn, colitis ulcerativa) |
|
|
Trastornos del tejido subcutáneo y la piel |
Acné |
Rash, Cloasma (Melasma) con riesgo de persistencia, hirsutismo, pérdida de cabello |
Eritema nodoso |
Eritema mul.pngorme |
|
|
Trastornos de los senos y sistema reproductivo |
Dolor en los senos, sensibilidad, agrandamiento y secreción, Dismenorrea Sangrado irregular Cambio en el ectropión cervical y la secreción vaginal, Amenorrea |
||||
|
Trastornos hepatobiliares |
Ictericia colestática |
Pancreatitis Litiasis biliar, Colestasis |
Condición hepatocelular (ejemplo hepatitis, función hepática anormal) |
||
|
Trastorno renal y urinario |
Síndrome urémico hemolítico |
||||
|
Investigaciones |
Lípidos plasmáticos modificados, incluyendo hipertrigliceridemia, |
Folatos séricos reducidos. |
|||
|
Infecciones e Infestaciones |
Vaginitis incluido candidiasis vaginal |
Descripción de reacciones adversas seleccionadas: Se ha observado un aumento del riesgo de episodios trombóticos y tromboembólicos arteriales y venosos, incluidos infarto de miocardio, ictus, ataques isquémicos transitorios, trombosis venosa y embolia pulmonar en mujeres que utilizan AHC, que se comentan con más detalle en la sección 4.4.
Los siguientes eventos adversos graves se han reportado en mujeres que utilizan ACOs:
Trombo embolismo venoso:
• Trastornos trombo embólicos arteriales
• Hipertensión
• Tumores hepáticos
• Enfermedad de Crohn, colitis ulcerosa, porfiria, lupus eritematoso sistémico, herpes gestacional, corea de Sydenham, síndrome urémico hemolítico, ictericia colestática
La frecuencia de diagnóstico de cáncer de mama aumenta ligeramente entre los usuarios de COC. Como el cáncer de mama es raro en mujeres menores de 40 años, el número excesivo es pequeño en relación con el riesgo general de cáncer de mama. La causa del uso de COC es desconocida. .
Los estrógenos exógenos pueden inducir o exacerbar los síntomas del angioedema hereditario y adquirido.
INTERACCIONES: Las interacciones de otras drogas (inductores de enzimas) con los anticonceptivos orales pueden resultar en un sangrado importante y / o falla anticonceptiva (ver sección 4.5).
No.pngicación de sospechas de reacciones adversas.
La no.pngicación de sospechas de reacciones adversas después de la autorización del medicamento es importante. Permite un seguimiento continuo del balance riesgo/beneficio del medicamento.
INTERACCIÓN CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN:
Nota: ¡La información de prescripción de cualquier medicamento concomitante debería siempre consultarse para iden.pngicar interacciones potenciales!
Interacciones farmacodinámicas: El uso concomitante con medicamentos que contienen ombitasvir/paritaprevir/ritonavir, dasabuvir, glecaprevir/pibrentasvir y sofosbuvir/velpatasvir/voxilaprevir con o sin ribavirina puede aumentar el riesgo de elevaciones de ALT. Por lo tanto, los usuarios de MICROFEMIN deben cambiar a un método anticonceptivo alternativo (por ejemplo, métodos anticonceptivos de progestágeno solo o métodos no hormonales) antes de comenzar la terapia con este régimen de medicamento. MICROFEMIN puede reiniciarse 2 semanas después de completar el tratamiento con este régimen de combinación de medicamentos.
Interacciones farmacocinéticas:
Efectos de otros medicamentos en combinación con MICROFEMIN: Las interacciones pueden ocurrir con medicamentos inductoras de las enzimas microsomales que pueden resultar en una depuración incrementada de hormonas sexuales pueden llevar al sangrado intermenstrual y falla de la anticoncepción.
Administración: La inducción enzimática puede ser observada después de pocos días de tratamiento. La inducción enzimática máxima generalmente no se observa dentro de pocas semanas. Después del cese del tratamiento, la inducción enzimática puede ser sostenida alrededor de 4 semanas.
Tratamiento corto plazo: Mujeres en tratamiento con medicamentos inductores de enzimas hepáticas deberán usar temporalmente un método de barrera u otro método anticonceptivo adicional al ACOs. Si estas precauciones adicionales sobrepasan el fin del empaque de MICROFEMIN® tabletas, debería iniciarse el siguiente empaque sin interrupción
Tratamiento largo plazo: Para usuarias a largo plazo de tratamiento de estos medicamentos inductores enzimáticos, el uso de otras medidas anticonceptivas confiables, no hormonales es recomendado.
Las siguientes interacciones serán reportadas en la literatura:
Sustancias que aumentan el aclaramiento de los AOC (eficacia disminuida de los AOC por inducción de enzimas): ejemplo, barbitúricos, bosentan, carbamazepina, fenitoína, primidona, rifampicina y medicación para VIH ritonavir, nevirapina y efavirenz y posiblemente también felbamato, griseofulvina, oxcarbazepina, topiramato y productos que contiene Hierba de San Juan (Hypericum perforatum).
Sustancias con efectos variables sobre el aclaramiento de los ACO: cuando se coadministran con ACO, muchas combinaciones de inhibidores de la proteasa del VIH (virus de la inmunodeficiencia humana (VIH)) e inhibidores no nucleosídicos de la transcriptasa inversa, incluidas las combinaciones con el VHC (virus de la hepatitis C (VHC) los inhibidores pueden aumentar o disminuir las concentraciones plasmáticas de estrógeno o progestágenos. El efecto neto de estos cambios puede ser clínicamente relevante en algunos casos.
Por lo tanto, se debe consultar la información de prescripción de los medicamentos concomitantes contra el VIH / VHC para iden.pngicar posibles interacciones y recomendaciones relacionadas. En caso de duda, las mujeres deben utilizar un método anticonceptivo de barrera adicional en la terapia con inhibidores de la proteasa o inhibidores de la transcriptasa inversa no análogos de los nucleósidos.
Efectos de MICROFEMIN® sobre otros medicamentos:
Los anticonceptivos orales pueden afectar el metabolismo de ciertos principios activos. Por consiguiente, las concentraciones plasmáticas y tisulares pueden aumentar (por ejemplo, ciclosporina) o disminuir (por ejemplo, lamotrigina).
Otras formas de interacción:
Troleandomicina: La troleandomicina puede aumentar el riesgo de colestasis intrahepática durante la administración conjunta con AOC.
Modafinilo: Riesgo de reducción de la eficacia anticonceptiva durante el tratamiento y un ciclo después de la interrupción del tratamiento con modafinilo, debido a su potencial inductor de enzimas.
Use anticonceptivos orales normodosados u otro método anticonceptivo.
Vemurafenib: Riesgo de reducción de las concentraciones de estrógeno y progestágeno, con el consiguiente riesgo de falta de eficacia.
Perampanel: Para dosis de perampanel mayores o iguales a 12 mg/día: riesgo de eficacia anticonceptiva reducida. Preferiblemente use otro método anticonceptivo, especialmente mecánico.
Rufinamida: Reducción moderada de las concentraciones de etinilestradiol. Preferiblemente use otro método anticonceptivo, especialmente mecánico.
Ulipristal: Riesgo de antagonismo de los efectos del progestágeno. No reanude la anticoncepción combinada durante al menos 12 días después de la interrupción del ulipristal.
Etoricoxib: Aumento de las concentraciones de etinilestradiol con etoricoxib.
DATOS DE SEGURIDAD PRECLÍNICA: La toxicidad aguda del etinilestradiol y levonorgestrel es baja. Debido a las diferencias marcadas entre las especies, los resultados preclínicos poseen un valor predictivo limitado para la aplicación de estrógenos en humanos.
En animales experimentales los estrógenos desplegaron un efecto letal a los embriones incluso a dosis relativamente bajas; se observaron malformaciones del tracto urogenital y feminización de fetos masculinos. Estudios de toxicología de reproducción en ratas, ratones y conejos no revelaron ninguna pista en cuanto a teratogenicidad más allá del efecto sobre la diferenciación sexual.
Datos preclínicos basados en estudios convencionales de toxicidad de dosis repetida, genotoxicidad y potencial carcinogénico no revelaron ningún riesgo particular para humanos más allá del discutido en otras secciones del SmPC.
PRUEBAS DE LABORATORIO: El uso de esteroides anticonceptivos puede tener una influencia sobre resultados de ciertas pruebas de laboratorio, incluyendo parámetros bioquímicos para el hígado, tiroides, función renal y adrenal; en los niveles plasmáticos para proteínas de transporte, es decir la globulina de unión a corticosteroides, y fracciones de lípido / lipoproteínas; en los parámetros para metabolismo de carbohidratos y parámetros para coagulación y fibrinólisis. Los cambios usualmente permanecen dentro del rango de referencia normal de laboratorio.
ADVERTENCIAS ESPECIALES Y PRECAUCIONES PARA USO:
Advertencias:
Si cualquiera de las condiciones / factores de riesgo a continuación está presente en alguna mujer, los beneficios de la anticoncepción oral combinada deben sopesarse contra posibles riesgos en cada caso individual y discutirse con la mujer antes de comenzar la anticoncepción oral combinada. En el caso de agravamiento, exacerbación o primera aparición de cualquiera de estas condiciones o factores de riesgo, debería aconsejarse a la mujer entrar en contacto con su médico. El médico debe decidir entonces, si debería descontinuarse el uso de ACOs.
Trastornos circulatorios:
Riesgo de tromboembolismo venoso (TEV):
El uso de cualquier anticonceptivo hormonal combinado (AHCs) aumenta el riesgo de tromboembolismo venoso (TEV) (como trombosis venosa profunda y tromboembolismo pulmonar TEP) en comparación con el no uso.
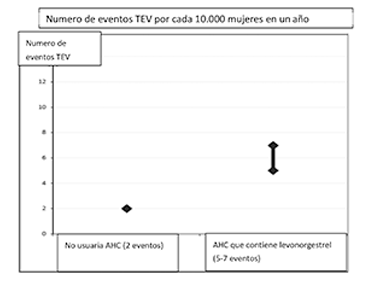
Los productos que contienen levonorgestrel, norgestimato o noretisterona se asocian con el riesgo más bajo de TEV. La decisión de usar tabletas de MICROFEMIN debe tomarse después de conversar con la mujer para asegurarse de que comprende el riesgo de TEV con las tabletas de MICROFEMIN, cómo sus factores de riesgo actuales influyen en este riesgo y que su riesgo de TEV es mayor en el primer año de uso. También hay alguna evidencia de que el riesgo aumenta cuando se reinicia un AHC después de una interrupción en el uso de 4 semanas o más. En las mujeres que no usan un AHC y que no están embarazadas, aproximadamente 2 de cada 10,000 desarrollarán un TEV durante el período de un año. Sin embargo, en cualquier mujer, el riesgo puede ser mucho mayor, dependiendo de sus factores de riesgo subyacentes (ver más abajo).
De cada 10,000 mujeres que usan un levonorgestrel que contiene un anticonceptivo oral combinado (ACO), aproximadamente 6 desarrollarán TEV en un año. La cantidad de TEV por año es menor que la esperada en mujeres durante el embarazo o en el período posparto. La TEV puede ser mortal en el 1% al 2% de los casos.
De manera muy rara, se ha informado que ocurre trombosis en otros vasos sanguíneos, p. Ej. venas y arterias hepáticas, mesentéricas, renales, cerebrales o retinianas, en usuarias de píldoras anticonceptivas.
Factores de riesgo de TEV: El riesgo de complicaciones tromboembólicas venosas en usuarias de AHC puede aumentar sustancialmente en una mujer con factores de riesgo adicionales, particularmente si existen múltiples factores de riesgo (ver tabla).
MICROFEMIN está contraindicado si una mujer tiene múltiples factores de riesgo que la ponen en una situación de alto riesgo de trombosis venosa (ver sección 4.3). Si una mujer tiene más de un factor de riesgo, es posible que el aumento del riesgo sea mayor que la suma de los factores individuales; en este caso, se debe considerar su riesgo total de TEV. Si el balance de beneficios y riesgos se considera negativo, no se debe prescribir un AHC.
|
Tabla: Factores de riesgo de TEV |
|
|
Factor de riesgo |
Comentario |
|
Obesidad (índice de masa corporal superior a 30 kg/m2) |
El riesgo aumenta sustancialmente a medida que aumenta el IMC. Es particularmente importante considerar si también se presentan otros factores de riesgo. |
|
Inmovilización prolongada, cirugía mayor, cualquier cirugía en las piernas o la pelvis, neurocirugía o trauma mayor Nota: la inmovilización temporal, incluidos los viajes en avión > 4 horas, también puede ser un factor de riesgo de TEV, especialmente en mujeres con otros factores de riesgo. |
En estas situaciones, es aconsejable interrumpir el uso del parche / píldora / anillo (en el caso de una cirugía electiva con al menos cuatro semanas de antelación) y no reanudarlo hasta dos semanas después de la re-movilización completa. Se debe utilizar otro método anticonceptivo para evitar un embarazo no intencionado. Se debe considerar el tratamiento antitrombótico si MICROFEMIN no se ha descontinuado con anticipación. |
|
Antecedentes familiares positivos (alguna vez tromboembolismo venoso en un hermano o padre, especialmente a una edad relativamente temprana, por ejemplo, antes de los 50). |
Si se sospecha una predisposición hereditaria, se debe derivar a la mujer a un especialista antes de decidir sobre el uso de AHC. |
|
Otras condiciones médicas asociadas con la TEV |
Cáncer, lupus eritematoso sistémico, síndrome urémico hemolítico, enfermedad intestinal inflamatoria crónica (enfermedad de Crohn o colitis ulcerosa) y drepanocitosis |
|
Aumento de edad |
Particularmente sobre los 35 años |
No hay consenso sobre el posible papel de las venas varicosas y la tromboflebitis superficial en la aparición o progresión de la trombosis venosa.
Debe tenerse en cuenta el aumento del riesgo de tromboembolismo durante el embarazo y, en particular, durante el período de 6 semanas del puerperio (para obtener información sobre “Embarazo y lactancia”, ver sección 4.6).
Síntomas de TEV (trombosis venosa profunda y embolia pulmonar):
En caso de síntomas, se debe aconsejar a la mujer que busque atención médica urgente e informe al profesional sanitario que está tomando un AHC.
Los síntomas de la trombosis venosa profunda (TVP) pueden incluir:
— hinchazón unilateral de la pierna y / o pie o a lo largo de una vena de la pierna;
— dolor o sensibilidad en la pierna que solo se puede sentir al pararse o caminar,
— aumento de calor en la pierna afectada; piel enrojecida o descolorida en la pierna.
Los síntomas del tromboembolismo pulmonar (TEP) pueden incluir:
— aparición repentina de falta de aire inexplicable o respiración rápida;
— tos repentina que puede estar asociada con presencia de sangre (hemoptisis);
— dolor agudo en el pecho;
— aturdimiento o mareo severo;
— latidos cardíacos rápidos o irregulares.
Algunos de estos síntomas (como: “falta de aire”, “tos”) no son específicos y pueden malinterpretarse como eventos más comunes o menos graves (por ejemplo, infecciones del tracto respiratorio).
Otros signos de oclusión vascular pueden incluir: dolor repentino, hinchazón y una ligera decoloración azul de una extremidad (cianosis).
Si la oclusión ocurre en el ojo, los síntomas pueden variar desde visión borrosa indolora que puede progresar hasta pérdida de la visión. A veces, la pérdida de la visión puede ocurrir casi de inmediato.
Riesgo de tromboembolismo arterial (ATE): Los estudios epidemiológicos han asociado el uso de AHCs con un mayor riesgo de tromboembolismo arterial (infarto de miocardio) o de accidente cerebrovascular (p. Ej., Accidente isquémico transitorio, accidente cerebrovascular). Los acontecimientos tromboembólicos arteriales pueden ser mortales.
Factores de riesgo de ATE: El riesgo de complicaciones tromboembólicas arteriales o de accidente cerebrovascular en usuarias de AHC aumenta en mujeres con factores de riesgo (ver tabla). MICROFEMIN está contraindicado si una mujer tiene uno o varios factores de riesgo graves de TEA que la ponen en una situación de alto riesgo de trombosis arterial (ver sección 4.3). Si una mujer tiene más de un factor de riesgo, es posible que el aumento del riesgo sea mayor que la suma de los factores individuales; en este caso, se debe considerar su riesgo total. Si el balance de beneficios y riesgos se considera negativo, no se debe prescribir un AHC.
|
Tabla: Factores de riesgo para ATE |
|
|
Factor de riesgo |
Comentario |
|
Aumento de edad |
Particularmente sobre los 35 años |
|
Fumadoras |
Se debe advertir a las mujeres que no fumen si desean utilizar un AHC. Se debe recomendar encarecidamente a las mujeres mayores de 35 años que sigan fumando, que utilicen un método anticonceptivo diferente. |
|
Hipertensión sobre todo si no está controlada |
|
|
Obesidad (índice de masa corporal superior a 30 kg / m2) |
El riesgo aumenta sustancialmente a medida que aumenta el IMC. Es particularmente importante considerar si también se presentan otros factores de riesgo. |
|
Antecedentes familiares positivos (alguna vez tromboembolismo arterial en un hermano o padre, especialmente a una edad relativamente temprana, por ejemplo, por debajo de los 50). |
Si se sospecha una predisposición hereditaria, se debe derivar a la mujer a un especialista para que la asesore antes de decidir sobre el uso de AHC. |
|
Migraña |
Un aumento en la frecuencia o gravedad de la migraña durante el uso de AHC (que puede ser prodrómico de un evento cerebrovascular) puede ser una razón para la interrupción inmediata. |
|
Otras condiciones médicas asociadas con eventos vasculares adversos |
Diabetes mellitus, hiperhomocisteinemia, valvulopatía cardiaca y fibrilación auricular, dislipoproteinemia y lupus eritematoso sistémico. |
Síntomas de Trombo Embolismo Arterial (TEA): En caso de síntomas, se debe aconsejar a la mujer que busque atención médica urgente e informe al profesional sanitario que está tomando un AHC.
Los síntomas de un accidente cerebrovascular (ACV) pueden incluir:
— entumecimiento o debilidad repentinos de la cara, brazo o pierna, especialmente en un lado del cuerpo;
— dificultad repentina para caminar, mareos, pérdida del equilibrio o la coordinación;
— confusión repentina, dificultad para hablar o comprender;
— dificultad repentina para ver con uno o ambos ojos;
— dolor de cabeza repentino, intenso o prolongado sin causa conocida;
— pérdida del conocimiento o desmayos con o sin convulsiones.
Los síntomas temporales sugieren que el evento es un ataque isquémico transitorio (AIT).
Los síntomas del infarto de miocardio (IM) pueden incluir:
— dolor, malestar, presión, pesadez, sensación de opresión o plenitud en el pecho, brazo o debajo del esternón;
— malestar que se irradia a la espalda, mandíbula, garganta, brazo, estómago;
— sensación de estar lleno, tener indigestión o asfixia;
— sudoración, náuseas, vómitos o mareos;
— debilidad extrema, ansiedad o dificultad para respirar;
— latidos cardíacos rápidos o irregulares.
Tumores:
Cáncer cervical: En algunos estudios epidemiológicos un riesgo incrementado de cáncer cervical se reportó en usuarios de largo plazo de ACOs (>5 años), pero aún no es claro en qué extensión este hallazgo puede estar influenciado por el impacto del comportamiento sexual y otros factores, tales como el virus del papiloma humano (VPH).
Cáncer de seno: Un metaanálisis de 54 estudios epidemiológicos mostró que las mujeres que utilizan anticonceptivos orales combinados tienen un riesgo relativo ligeramente incrementado (RR = 1.24) de diagnóstico de cáncer de seno. Este riesgo incrementado disminuyó gradualmente durante los 10 años después de detener el uso de ACO. Puesto que el cáncer de seno es una condición rara en mujeres por debajo de 40 años, el incremento en el número de casos diagnosticados de cáncer de seno en usuarios actuales y previos de ACOs es pequeño en comparación con el riesgo de cáncer de seno durante toda su vida. Estos estudios no presentan evidencias de una relación causal. El patrón observado de un riesgo incrementado puede ser causado por un diagnóstico temprano de cáncer de seno en usuarios de ACO, los efectos biológicos de ACOs o una combinación de ambos.
Los casos diagnosticados de cáncer de seno en usuarias de anticonceptivos orales tienen una tendencia a ser clínicamente menos avanzados, en comparación con los casos diagnosticados de cáncer de seno en no usuarias.
Tumores de hígado: En casos raros, se han no.pngicado tumores hepáticos benignos (p. ej., Adenoma hepático, hiperplasia nodular focal) e incluso más raramente, tumores hepáticos malignos en usuarias de AOC.
Estos tumores han llevado, en casos aislados, a hemorragia intraabdominal con peligro para la vida. Un tumor hepático debe tomarse en consideración como un diagnóstico diferencial cuando ocurre dolor severo en el abdomen superior, si existe hepatomegalia, o si hay signos de hemorragia intraabdominal en mujeres que toman ACOs.
El uso de AHC en dosis altas (50 µg de etinilestradiol) reduce el riesgo de cáncer de endometrio y ovario. Esto debe confirmarse con AHC a dosis más bajas
Otras condiciones:
Depresión: El estado de ánimo depresivo y la depresión son reacciones adversas bien conocidas del uso de anticonceptivos hormonales. La depresión puede ser grave y es un factor de riesgo bien conocido de comportamiento suicida y suicidio. Se debe advertir a las mujeres que se pongan en contacto con su médico en caso de cambios de humor y síntomas depresivos, incluso poco después de iniciar el tratamiento.
Hipertrigliceridemia: Mujeres con hipertrigliceridemia, o historia familiar del mismo, pueden estar en riesgo incrementado de pancreatitis cuando toman ACOs.
Hipertensión: Aun cuando se han informado incrementos ligeros en la presión sanguínea en muchas mujeres que toman ACOs, son raros los incrementos clínicamente importantes en la presión sanguínea. Si se desarrolla hipertensión clínica persistente durante el uso de ACOs, debería descontinuarse la toma y tratarse la hipertensión. El uso de ACOs puede asumirse nuevamente, si es apropiado, cuando se alcancen valores de tensión normal con la terapia antihipertensiva.
Angioedema: Los estrógenos exógenos pueden inducir o exacerbar los síntomas de angioedema hereditario y adquirido.
Condiciones del hígado: La aparición de anomalías hepáticas agudas o crónicas puede requerir la interrupción del ACO hasta que los parámetros hepáticos vuelvan a la normalidad.
Intolerancia a la glucosa/Diabetes: Los ACOs pueden tener influencia sobre la resistencia a la insulina periférica y tolerancia de glucosa, no hay evidencia de la necesidad de alterar el régimen terapéutico en diabéticos que usan AOC de dosis bajas (que contienen menos de 0.05 mg de etinilestradiol). Por lo tanto, las mujeres diabéticas deberían monitorearse de cerca durante el uso de ACOs.
Otros: Se ha informado que las siguientes condiciones ocurren o se deterioran durante el embarazo y el uso de ACO, pero la evidencia de una asociación con el uso de ACO no es concluyente: ictericia y / o prurito relacionado con la colestasis; cálculos biliares; porfiria; lupus eritematoso sistémico; síndrome urémico hemolítico; Corea de Sydenham; herpes gestacional; pérdida de audición relacionada con la otosclerosis.
La recurrencia de ictericia colestásica y / o prurito relacionado con colestasis que ocurrió durante el embarazo o el uso previo de esteroides sexuales requiere la interrupción de los ACO:
— Durante el uso de ACO se han no.pngicado algunos casos de empeoramiento de la depresión endógena, epilepsia, enfermedad de Crohn y colitis ulcerativa.
— Puede ocurrir cloasma, especialmente en mujeres con historia de cloasma gravídico. Mujeres con una tendencia a cloasma deberían evitar la exposición al sol o a la radiación ultravioleta mientras que toman ACOs.
— Se debe prestar especial atención a los pacientes con hiperprolactinemia.
— No tomar concomitantemente medicamentos o hierbas medicinales que sean inductores enzimáticos del citocromo P450 (CYP3A4), debido a que pueden disminuir los niveles sanguíneos de levonorgestrel y etinilestradiol, pudiendo reducir la eficacia anticonceptiva del mismo.
— Los medicamentos inductores enzimáticos del citocromo P450 (CYP3A4), que pueden disminuir los niveles sanguíneos de levonorgestrel y etinilestradiol, pudiendo reducir la eficacia anticonceptiva del mismo.
— Los niveles elevados de enzimas CYP3A4 pueden persistir hasta por 4 semanas después de la interrupción del medicamento inductor enzimático.
— La exposición durante el embarazo para algunos de los medicamentos inductores enzimáticos se ha asociado con un mayor riesgo de defectos de nacimiento
Examen / consulta médica: Antes de iniciar o reiniciar el tratamiento con MICROFEMIN, se debe realizar historia clínica completa (incluidos los antecedentes familiares) y se debe descartar embarazo. Se debe medir la presión arterial y realizar un examen físico guiado por las contraindicaciones (ver sección 4.3) y las advertencias (ver sección 4.4). Es importante llamar la atención de la mujer sobre la información sobre trombosis arterial y venosa, incluido el riesgo de MICROFEMIN en comparación con otros AHC, los síntomas de TEV y TEA, los factores de riesgo conocidos y qué hacer en caso de sospecha de trombosis.
También se debe indicar a la mujer que lea atentamente el prospecto y que siga los consejos dados. La frecuencia y la naturaleza de los exámenes deben basarse en las pautas de práctica establecidas y adaptarse a cada mujer.
Se debe advertir a las mujeres que los anticonceptivos orales no protegen contra las infecciones por VIH (SIDA) y otras enfermedades de transmisión sexual (ETS).
Eficacia reducida: La eficacia de los anticonceptivos orales puede reducirse en el caso de tabletas olvidadas, vómito o diarrea o el uso concomitante de otro medicamento.
Control del ciclo reducido:
Con todos los anticonceptivos orales combinados, puede ocurrir sangrado irregular (manchado o sangrado intermenstrual), especialmente durante los primeros meses. Por lo tanto, la evaluación de cualquier sangrado irregular debería considerarse después de un periodo de adaptación de aproximadamente 3 ciclos.
Si las irregularidades de sangrado ocurren después de ciclos previamente regulares, entonces causas no hormonales deberían considerarse, y se indican medidas diagnósticas adecuadas para descartar cáncer o embarazo. Estos pueden incluir legrado.
En algunas mujeres, puede que no se produzca hemorragia por deprivación durante el intervalo sin comprimidos activos. Si el ACO se ha tomado de acuerdo con las instrucciones descritas en la sección 4.2, es poco probable que la mujer esté embarazada. Sin embargo, si las tabletas no se tomaron de acuerdo con las instrucciones antes del primer sangrado por deprivación ausente, o si dos sangrados por deprivación están atrasados, debería descartarse el embarazo antes de continuar el uso de ACOs.
Elevaciones de enzimas hepáticas (ALT): Durante los ensayos clínicos con pacientes tratados por infecciones por el virus de la hepatitis C (VHC) con medicamentos que contienen ombitasvir / paritaprevir / ritonavir y dasabuvir con o sin ribavirina, las elevaciones de transaminasas (ALT) superiores a 5 veces el límite superior de lo normal (ULN) se produjeron significativamente más frecuente en mujeres que usan medicamentos que contienen etinilestradiol, como los anticonceptivos hormonales combinados (CHC). También se han observado elevaciones de ALT con medicamentos antivirales contra el VHC que contienen glecaprevir / pibrentasvir y sofosbuvir / velpatasvir / voxilaprevir).
Excipientes con efectos conocidos: Este medicamento contiene lactosa monohidrato. Los pacientes con problemas hereditarios raros de intolerancia a la galactosa, deficiencia total de lactasa o malabsorción de glucosa-galactosa no deben tomar este medicamento. Este medicamento contiene sacarosa. Los pacientes con problemas hereditarios raros de intolerancia a la fructosa, mala absorción de glucosa-galactosa o insuficiencia de sacarosa-isomaltosa no deben tomar este medicamento.
Este medicamento contiene carmelosa sódica. Este medicamento contiene menos de 1 mmol de sodio (23 mg) por comprimido recubierto, es decir, esencialmente «exento de sodio».
MÉTODO DE ADMINISTRACIÓN: Para administración oral.
POSOLOGÍA Y MÉTODO DE ADMINISTRACIÓN:
Posología:
Cómo tomar MICROFEMIN® tabletas recubiertas: Las tabletas deben tomarse vía oral, en el orden suministrado en el empaque blíster, cada día aproximadamente a la misma hora.
Una tableta se toma diariamente por 21 días consecutivos. Cada empaque blíster subsiguiente se inicia después de un intervalo libre de tabletas de 7 días, tiempo durante el cual usualmente ocurre un sangrado por privación. Ese sangrado usualmente iniciará en el segundo o tercer día después de que se tomó la última tableta y puede no haberse detenido, antes de que se inicie el siguiente empaque blíster.
Cómo iniciar MICROFEMIN® tabletas recubiertas: Sin uso previo de anticonceptivos hormonales en el último mes:
Las tabletas deberían iniciarse en el primer día del ciclo natural de la mujer (ejemplo, el primer día de su sangrado menstrual).
Al cambiar desde otro anticonceptivo hormonal combinado (píldoras orales combinadas, anillo vaginal o parche transdérmico):
La mujer debería iniciar con MICROFEMIN® en el día después de que tomó la última tableta activa en su anterior empaque blíster de píldoras anticonceptivas o más tardar, el día siguiente al intervalo habitual de libre de tableta o intervalo de tableta inactiva del anticonceptivo anterior.
En caso de anillo vaginal o el parche transdérmico, tomar la primera tableta el día de retiro o más tardar el día programado para la aplicación del nuevo dispositivo o anillo.
Al cambiar desde un método solamente con progestágeno (solo progestágeno o mini píldoras, inyección, implante o dispositivo intrauterino):
La mujer puede cambiar desde las minipíldoras en cualquier día, desde un implante o un dispositivo intrauterino en el día en que el implante o dispositivo intrauterino se retira, o desde la inyección, cuando debería suministrarse la siguiente inyección. En todos estos casos se debería aconsejar a la mujer el uso de un método de barrera concomitante por los primeros 7 días de la toma de las tabletas.
Después de aborto en el primer trimestre:
La mujer puede iniciar la toma de MICROFEMIN® tabletas, inmediatamente. En este caso, no es necesario tomar precauciones anticonceptivas adicionales.
Después del parto o aborto en el segundo trimestre: Debería aconsejarse a la mujer iniciar MICROFEMIN® tabletas, el día 21 - 28 después del parto en mujeres no lactantes o con aborto en el segundo trimestre, porque hay un riesgo aumentado de trastornos tromboembólicos durante el periodo postparto. Si ella inicia MICROFEMIN® tabletas, después de esto, se debería aconsejar el uso de un método de barrera concomitante durante los primeros 7 días de la toma de la tableta. Sin embargo, si ella ya tuvo relaciones sexuales, debe descartarse embarazo, antes de que inicie las tabletas, o debería esperar hasta su primer sangrado menstrual.
Qué hacer en caso de tabletas olvidadas: Eficacia anticonceptiva puede ser reducida en caso de dosis olvidadas especialmente si se incrementa el tiempo entre la última tableta en el empaque actual y la primera table del siguiente empaque.
Si la mujer olvida la toma de una tableta por menos de 12 horas, la protección anticonceptiva no se reduce. La mujer debería tomar la tableta olvidada tan pronto como lo recuerde, y las tabletas restantes deberían tomarse a la hora habitual.
Si el retraso excede 12 horas, la protección anticonceptiva puede reducirse.
El manejo de tabletas olvidadas puede regirse por las siguientes dos reglas básicas:
1. Las tabletas nunca deberían retrasarse por más de 7 días.
2. Siete días de toma de la tableta ininterrumpida se requieren para mantener la supresión adecuada del eje hipotálamo - pituitaria - ovario.
Así, el siguiente consejo debería suministrarse en la práctica diaria:
Semana 1: La mujer debería tomar la última tableta olvidada tan pronto como lo recuerde, aún si esto significa que ella deba tomar dos tabletas al mismo tiempo. De allí en adelante, se continúa tomando las tabletas en el horario habitual. Se debería utilizar un método de barrera (por ejemplo, un condón) de forma concomitante por los siguientes 7 días. Si hubo relaciones sexuales durante los 7 días previos, la posibilidad de embarazo debe considerarse. Mientras más tabletas se olviden, y mientras esto tenga lugar más cerca del intervalo libre de tabletas, mayor será el riesgo de embarazo.
Semana 2: La mujer debería tomar la última tableta olvidada tan rápido como lo recuerde, aun si esto significa que deba tomar dos tabletas al mismo tiempo. De aquí en adelante, continúa tomando las tabletas en el horario habitual. Siempre que MICROFEMIN® tabletas, se haya tomado correctamente durante los 7 días precedentes a la primera tableta olvidada, no es necesario tomar precauciones anticonceptivas adicionales. Sin embargo, si éste no es el caso, o si más de 1 tableta se olvidó, debería aconsejarse a la mujer utilizar adicionalmente un método de barrera (ejemplo condón) por 7 días.
Semana 3: El riesgo de falla en la anticoncepción es inminente debido al siguiente intervalo libre de tabletas. La protección anticonceptiva reducida puede, sin embargo, prevenirse ajustando la toma de tabletas. Por lo tanto, escogiendo una de las siguientes dos alternativas, no es necesario tomar precauciones anticonceptivas adicionales, siempre que todas las tabletas se hayan tomado correctamente durante los 7 días precedentes a la primera tableta olvidada. Si éste no es el caso, debería aconsejarse a la mujer seguir la primera de las dos alternativas. Adicionalmente un método de barrera (ejemplo condón) debería utilizarse de forma concomitante por los siguientes 7 días.
1. La mujer debería tomar la última tableta olvidada tan pronto como lo recuerde, aún si esto significa que debe tomar 2 tabletas al mismo tiempo. De ahí en adelante debería continuar tomando las tabletas en el horario habitual. Ella debería comenzar el siguiente empaque blíster inmediatamente después de tomar la última tableta, es decir no habría un intervalo libre de tabletas entre los empaques blíster. Un sangrado por privación es poco probable hasta el final del segundo empaque blíster, pero ella puede experimentar manchado o sangrado intermenstrual en los días en que esté tomando las tabletas.
2. Debería también aconsejarse a la mujer dejar de tomar las tabletas del actual empaque blíster. En este caso, ella debería mantener un intervalo libre de tabletas de hasta 7 días, incluyendo los días que olvidó tomar sus tabletas, y de allí en adelante continuar con el siguiente empaque blíster de MICROFEMIN®.
Si la mujer olvidó tabletas y no tuvo un sangrado por deprivación durante el primer intervalo libre de tabletas normal, debe considerarse la posibilidad de embarazo.
Consejo en caso de molestias gastrointestinales
En caso de síntomas gastrointestinales severos (ejemplo: vomito o diarrea), la absorción de los ingredientes activos puede no estar completa y deben tomarse medidas anticonceptivas adicionales.
Si ocurre vómito o diarrea severa durante las siguientes 3 - 4 horas después de la toma de la tableta, una nueva tableta deberá ser tomada como reemplazo, tan pronto como sea posible. Una nueva tableta debe ser tomada si es posible dentro de las 12 horas del tiempo de la dosis usual.
Si el lapso es mayor a las 12 horas, debería seguirse el consejo con respecto a las tabletas olvidadas, descrito anteriormente.
Si la mujer no desea cambiar su toma de tableta usual, ella debería tomar la tableta extra requerida de otro empaque blíster.
Cómo retrasar o cambiar un periodo: Con el fin de retrasar un período, la mujer debería continuar el siguiente empaque blíster de MICROFEMIN®, después de tomar la última tableta en el empaque actual, sin el intervalo libre de tabletas. La extensión puede continuarse por tanto tiempo como se desee hasta el final del segundo empaque blíster. Durante la extensión la mujer puede experimentar sangrado intermenstrual o manchado. La toma regular de MICROFEMIN® tabletas, se asume nuevamente después del intervalo usual libre de tabletas de 7 días.
Para cambiar el periodo a otro día de la semana, en lugar del día en que la mujer está acostumbrada con la actual toma de tabletas, se le puede aconsejar acortar el intervalo libre de tabletas en tantos días como lo desee. Mientras más corto sea el intervalo, mayor el riesgo de que ella no tenga un sangrado por privación y ella puede tener sangrado intermenstrual o manchado durante el segundo empaque blíster (el cual es también el caso cuando se retrasa un periodo). Es importante enfatizar que el intervalo libre de tabletas no debería extenderse.
SOBREDOSIS: Síntomas de sobredosis de anticonceptivo oral ha sido reportado en adultos, adolescentes y niñas mayores de 12 años de edad. Los síntomas que pueden ocurrir son nausea, vómito, dolores en los senos, mareos, dolores abdominales, somnolencia / fatiga y en mujeres jóvenes un ligero sangrado vaginal. No hay ningún antídoto, y el tratamiento posterior debería ser sintomático.
PRESENTACIÓN:
Naturaleza y contenido del recipiente: 21 tabletas recubiertas se empacan en un blíster de PVC/PVDC/Al.
1 blíster + 1 funda de almacenamiento, se empacan en una caja de cartón plegable (21 tabletas recubiertas).
3 blíster + 1 funda de almacenamiento, se empacan en una caja de cartón plegable (3x 21 tabletas recubiertas).
Puede que no todas las presentaciones se encuentren comercializadas. (Reg. San. INVIMA 2016 M-14414-R2).
Precauciones especiales para desecho y otra manipulación: Este medicamento solo debe ser usado bajo prescripción médica.
Cualquier producto no utilizado o material de desecho debería eliminarse de acuerdo con los requerimientos locales.
Titular del registro sanitario
Gedeón Richter Plc. H-1103 Budapest Hungría
Importador: GRÜNENTHAL COLOMBIANA S.A.
Calle 93 No 16-20 - Bogotá, D. C.
Fecha de la revisión del texto: versión 8.0 del 25 de marzo de 2020