
NOXAFIL
POSACONAZOL
Tabletas recubiertas
Caja , 24 y 96 Tabletas recubiertas de liberación prolongada , 100 Miligramos
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA:
Sustancia activa: El nombre químico de posaconazol es 4-[4-[4-[4-[[(3R,5R)-5-(2,4- difluorofenil) tetrahidro-5-(1H-1,2,4-triazol-1-ylmetil)-3-furanil] metoxi] fenil]-1-piperazinil] fenil] -2-[(1S,2S)-1-etil- 2-hidroxipropil]- 2,4-dihidro- 3H-1,2,4-triazol-3-ona, con una fórmula empírica de C37H42F2N8O4 y un peso molecular de 700,8. La fórmula estructural es:
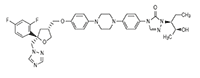
Figura 1. Fórmula estructural del posaconazol.
Lista de excipientes:
NOXAFIL® tableta recubierta de liberación retardada: Hipromelosa acetato succinato, celulosa microcristalina, hidroxipropilcelulosa, silica tipo dental, croscarmelosa sódica, estearato de magnesio y Opadryl® II Amarillo (consiste de los siguientes ingredientes: Alcohol polivinilico parcialmente hidrolizado, macrogol/PEG3350 (polietilenglicol 3350), dióxido de titanio (E171), talco y óxido de hierro amarillo (E172)).
NOXAFIL® suspensión oral: Sabor artificial a cereza, agua purificada, ácido cítrico monohidrato, glicerol, glucosa líquida, polisorbato 80, simeticona, benzoato de sodio (E211), citrato de sodio deshidratado, dióxido de titanio (E171), goma xantan.
NOMBRE DEL PRODUCTO Y FORMA FARMACÉUTICA: NOXAFIL® (posaconazol) tableta recubierta de liberación retardada, 100 mg. Tableta recubierta amarilla con “100” marcado en una cara y con forma de cápsula. NOXAFIL® (posaconazol) suspensión oral, 40 mg/mL suspensión blanca, sabor cereza, de liberación inmediata.
INDICACIONES TERAPÉUTICAS: NOXAFIL® tabletas recubiertas de liberación retardada y suspensión oral están indicadas para la profilaxis de las infecciones fúngicas invasivas, incluyendo levaduras y mohos, en pacientes de 13 años de edad o mayores, que están en alto riesgo de desarrollar estas infecciones, tales como pacientes con neutropenia prolongada o con trasplante de células madre Hematopoyéticas (HSCT, por sus siglas en inglés).
NOXAFIL® tabletas recubiertas de liberación retardada y suspensión oral están indicados para el uso en el tratamiento de las siguientes infecciones fúngicas en pacientes de 13 años o mayores:
• Aspergilosis invasiva en pacientes con enfermedad que sea refractaria a la anfotericina B, itraconazol o al voriconazol; o en pacientes que no toleren estos medicamentos. La refractariedad se define como progresión de la infección o falla en la mejoría después de al menos 7 días de dosis terapéuticas previas de tratamiento antimicótico efectivo.
• Candidiasis esofágica o candidemia en pacientes con enfermedad refractaria a la anfotericina B, fluconazol o itraconazol, o en pacientes que no toleren estos productos. La refractariedad se define como la progresión de la infección o la falla de la mejoría después de un período mínimo de tratamiento (fungemia persistente: 3 días; infecciones no fungémicas: 7 días; candidiasis esofágica: 14 días) de dosis terapéuticas previas de tratamiento antimicótico efectivo.
• Fusariosis, zygomicosis, criptococosis, cromoblastomicosis y micetoma en pacientes con enfermedad refractaria a otro tratamiento, o en pacientes que no toleren otros tratamientos.
• Coccidioidomicosis.
NOXAFIL® suspensión oral también está indicado para el uso en el tratamiento de las siguientes infecciones fúngicas en pacientes de 13 años de edad o mayores:
• Candidiasis orofaríngea, incluyendo a pacientes con enfermedad refractaria a itraconazol y a fluconazol. Refractariedad se define como la progresión de la infección o falla en la mejoría después de un mínimo de 7 días de las dosis terapéuticas previas o terapia antimicótica efectiva.
PROPIEDADES FARMACOCINÉTICAS:
Introducción general: Los hallazgos farmacocinéticos generales a través del programa clínico en ambos, voluntarios sanos y pacientes, fueron consistentes en que el posaconazol fue ligeramente absorbido y ligeramente eliminado con un volumen de distribución extenso.
La exposición después de la administración múltiple de tabletas recubiertas de liberación retardada de posaconazol (200 o 300 mg) una vez al día fue 1,3 veces más alta en voluntarios sanos que en pacientes. La exposición a posaconazol tras la administración de 400 mg de suspensión oral dos veces al día fue ~ 3 veces mayor en voluntarios sanos que en pacientes, sin hallazgos adicionales de seguridad en las concentraciones más altas.
Absorción: Posaconazol tabletas recubiertas de liberación retardada es absorbido con una mediana de Tmáx de 4 a 5 horas y exhibe una dosis proporcional a la farmacocinética después de administración única y múltiple de hasta 300 mg.
La disponibilidad absoluta de la tableta oral es de aproximadamente 54%. Posaconazol tabletas puede administrarse una vez al día después de una dosis de dos veces al día en el Día 1.
Posaconazol suspensión oral se absorbe con una mediana de Tmáx de 3 horas (pacientes) y 5 horas (voluntarios sanos). La farmacocinética de la suspensión oral de posaconazol es lineal tras la administración de dosis únicas y múltiples de hasta 800 mg. No se observaron nuevos aumentos de la exposición cuando fueron administradas a pacientes y voluntarios sanos dosis de suspensión oral por encima de 800 mg al día. No hay efecto de pH alterado sobre la absorción de la suspensión oral de posaconazol.
La división de la dosis total diaria de posaconazol suspensión oral (800 mg) como 400 mg dos veces al día, da como resultado una exposición 184% mayor en relación con la administración de una vez al día en pacientes.
Efecto de los alimentos sobre la absorción oral en voluntarios sanos: Posaconazol tabletas recubiertas de liberación retardada se puede administrar con o sin alimentos.
El AUC de posaconazol suspensión oral es aproximadamente 2,6 veces mayor cuando se administra con una comida sin grasa o un suplemento alimenticio (14 gramos de grasa) y 4 veces mayor cuando se administra con una comida rica en grasa (~ 50 gramos de grasa) en relación con el estado basal. Posaconazol suspensión oral debe administrarse con una comida o un suplemento nutricional.
Distribución: Después de la administración de la tableta, posaconazol tiene un volumen medio de distribución aparente de 394 L (42%), fluctuando entre 294-583 L entre los estudios en voluntarios sanos.
Posaconazol suspensión oral tiene un volumen de distribución aparente extenso (1.774 L) que sugiere una penetración extensa en los tejidos periféricos.
Posaconazol presenta alta unión a proteínas (>98.0%), predominantemente a albúmina sérica.
Metabolismo: Posaconazol no tiene ningún metabolito principal circulante y es improbable que sus concentraciones sean alteradas por los inhibidores de las enzimas del CYP450. De los metabolitos circulantes, la mayoría son conjugados glucurónidos de posaconazol con solo cantidades menores observadas de metabolitos oxidativos (mediados por CYP450). Los metabolitos excretados en orina y heces cuentan por aproximadamente el 17% de la dosis radiomarcada administrada.
Excreción: Posaconazol se elimina predominantemente en las heces (77% de la dosis radiomarcada) con el componente principal eliminado como el fármaco de origen (66% de la dosis radio marcada). La depuración renal es una vía de eliminación menor, con un 14% de la dosis radio marcada excretada en orina (<0.2% de la dosis radio marcada es el fármaco de origen).
La tableta recubierta de liberación retardada de posaconazol es eliminada con una vida media (t1/2) fluctuando entre 26 y 31 horas y una depuración media aparente fluctuando de 7.5 a 11 L/h.
Posaconazol suspensión oral es ligeramente eliminado con una vida media (t1/2) de 35 horas (intervalo de 20 a 66 horas) y una depuración total corporal aparente (CI/F) de 32 L/h. El estado de equilibrio se alcanza después de 7-10 días de administración de dosis múltiples.
PROPIEDADES FARMACODINÁMICAS:
Grupo farmacoterapéutico: Antiinfecciosos para uso sistémico, derivado del triazol, J02AC04.
Mecanismo de acción: El posaconazol es un inhibidor potente de la enzima lanosterol 14a- demetilasa, que cataliza un paso esencial en la biosíntesis del ergosterol.
• Efectos farmacodinámicos (p. ej., subsecciones: resistencia, datos de susceptibilidad in vitro):
— Microbiología:
Posaconazol ha demostrado, tanto in vitro como en infecciones clínicas, ser activo contra los siguientes microorganismos: Especies de Aspergillus (A. fumigatus, A. flavus, A. terreus, A. nidulans, A. Níger, A. ustus, A. ochraceus), especies de Candida (C. albicans, C. glabrata, C. krusei, C. parapsilosis), Cryptococo neoformans, Coccidioides immitis, Fonsecaea pedrosoi, Histoplasma capsulatum, Pseudallescheria boydii y especies de Alternaria, Exophiala, Fusarium, Ramichloridium, Rhizomucor, Mucor y Rhizopus.
Posaconazol también ha demostrado actividad in vitro contra las siguientes levaduras y mohos: Candida dubliniensis, C. famata, C. guilliermondii, C. lusitaniae, C. kefyr, C. rugosa, C. tropicales, C. zeylanoides, C. inconspicua, C. lipolytica, C. norvegensis, C. pseudotropicalis, Cryptococcus laurentii, Kluyveromyces marxianus, Saccharomyces cerevisiae, Yarrowia lipolytica, especies de Pichia y Trichosporon, Aspergillus Sydowii, Bjerkandera adusta, Blastomyces dermatitidis, Epidermophyton floccosum, Paracoccidioides brasiliensis, Scedosporium apiospermum, Psorothrix schenckii, Wangiella dermatitidis y especies de Absidia, Apophysomyces, Bipolaris, Curvularia, Microsporum, Paecilomyces, Penicillium y Trichophyton. Sin embargo, la seguridad y efectividad de posaconazol para el tratamiento de infecciones clínicas debido a estos microorganismos no ha sido establecida en estudios clínicos.
• Posaconazol muestra actividad antimicótica de amplio espectro contra algunas levaduras y mohos que generalmente no responden a azoles o son resistentes a otros azoles:
— Especies de Candida (incluyendo C. albicans aislada resistente a fluconazol, voriconazol e itraconazol):
— C. krusei y C. glabrata las cuales son inherentemente menos susceptibles a fluconazol.
— C. lusitaniae que es inherentemente menos susceptible a amfotericina B.
— Aspergillus (incluyendo cepas aisladas resistentes a fluconazol, voriconazol, itraconazol y amfotericina B).
— Organismos que no habían sido previamente relacionados como susceptibles a azoles como los zigomicetos (ej: especies de Absidia, Mucor, Rhizopus y Rhizomucor).
• In vitro posaconazol muestra actividad antimicótica contra especies de:
— Aspergillus.
— Hongos dismórficos (Blastomyces dermatitidis, Histoplasma capsulatum, Penicillium marneffei,Coccidioides immitis).
— Algunas especies de Candida.
En modelos animales de infección, posaconazol fue activo contra una amplia variedad de infecciones micóticas causadas por levaduras o mohos. Sin embargo, no hubo correlación consistente entre la concentración mínima inhibitoria y la eficacia.
Las muestras para cultivo de hongos y otros estudios de laboratorio relevantes (incluyendo histopatología), deben obtenerse antes de la terapia para aislar e identificar el o los organismos causantes. La terapia podrá establecerse antes de que se conozcan los resultados de los cultivos y otros estudios de laboratorio. Sin embargo, una vez que estos resultados estén disponibles se debe ajustar el tratamiento antifúngico en consecuencia.
Resistencia a medicamentos: Las cepas de C. albicans resistentes al posaconazol no pudieron ser generadas en el laboratorio; los mutantes espontáneos de laboratorio de Aspergillus fumigatus que demostraron una disminución de la susceptibilidad al posaconazol aparecieron con una frecuencia de 1 x 10-8 hasta 1 x 10-9. Las muestras clínicas aisladas de Candida albicans y Aspergillus fumigatus que muestran disminución significativa de la susceptibilidad al posaconazol son raras. En estos raros casos en donde se observó baja susceptibilidad al posaconazol, no hubo una correlación clara entre la disminución de la susceptibilidad y la falla clínica. El éxito clínico se ha observado en pacientes infectados con organismos resistentes a otros azoles; de acuerdo con estas observaciones, posaconazol fue activo in vitro contra muchas cepas de Aspergillus y de Candida que desarrollaron resistencia a otros azoles y/o a la anfotericina B. No se han establecido los puntos de ruptura del posaconazol para ningún hongo.
Combinaciones de medicamentos antifúngicos: Cuando combinaciones de posaconazol, ya sea con anfotericina B o caspofungina se probaron in vitro e in vivo había poco o ningún antagonismo y en algunos casos no había un efecto aditivo. La importancia clínica de estos resultados es desconocida.
PARTICULARIDADES FARMACÉUTICAS:
Lista de excipientes de interés especial: Ninguno.
Incompatibilidades: Ninguna.
Precauciones especiales de almacenamiento:
• NOXAFIL® tableta recubierta de liberación retardada: Almacenar a una temperatura no mayor a 30 °C.
• NOXAFIL® suspensión oral: Almacenar a una temperatura no mayor a 30 °C. Se recomienda que la cuchara dosificadora sea lavada con agua después de cada administración y antes de almacenar.
Instrucciones de uso, manejo y disposición: No hay requerimientos especiales.
CONTRAINDICACIONES:
• En pacientes con hipersensibilidad conocida al posaconazol o a cualquier componente del producto.
• Aunque no se ha estudiado in vitro o in vivo, la administración concomitante de los sustratos CYP3A4 terfenadina, astemizol, cisapride, pimozida o quinidina con posaconazol está contraindicada, ya que las concentraciones plasmáticas altas de estos medicamentos pueden causar prolongación del intervalo QT y en raras ocasiones “torsade de pointes”.
• La co-administración con inhibidores de HMG-CoA reductasa que son metabolizados en primer lugar por el CYP3A4 está contraindicado puesto que el incremento en la concentración plasmática de estos medicamentos puede llevar a rabdomiólisis.
• Aunque no se ha estudiado in vitro ni in vivo, posaconazol puede aumentar las concentraciones plasmáticas de los alcaloides del ergot que pueden causar ergotismo. La administración concomitante de posaconazol y alcaloides ergot está contraindicada.
EMBARAZO Y LACTANCIA:
No existe suficiente información acerca del uso de posaconazol en mujeres embarazadas. Estudios en animales han demostrado toxicidad reproductiva. Posaconazol ha demostrado causar malformaciones esqueléticas en ratas expuestas a dosis menores que las obtenidas con dosis terapéuticas en humanos. En conejos, posaconazol fue embriotóxico con exposiciones mayores que las obtenidas con dosis terapéuticas. El riesgo potencial en humanos es desconocido. Posaconazol debe ser utilizado durante el embarazo solamente si el potencial de beneficio justifica los posibles riesgos para el feto.
Posaconazol es excretado en la leche de las ratas lactantes. La excreción del posaconazol en leche humana no ha sido investigada. Posaconazol no debe ser utilizado por madres lactantes a menos que el beneficio claramente sobrepase el riesgo para el hijo.
EVENTOS ADVERSOS:
Experiencia de estudios clínicos:
Seguridad de posaconazol tabletas recubiertas de liberación retardada: La seguridad de los comprimidos de posaconazol se ha evaluado en 230 pacientes incluidos en el estudio clínico pivotal. Los pacientes fueron incluidos en un estudio farmacocinético y de seguridad no comparativo de posaconazol tabletas recubiertas de liberación retardada cuando se administra como profilaxis antifúngica. Los pacientes estaban inmunocomprometidos con enfermedades subyacentes como cáncer hematológico, neutropenia posterior a la quimioterapia, enfermedad injerto contra huésped (GVHD, por sus siglas en inglés), y después de un HSCT (por sus siglas en inglés). El tratamiento con posaconazol fue dado para una duración media de 28 días. Veinte pacientes recibieron
200 mg diarios y 210 pacientes recibieron 300 mg de dosis diaria (después de la dosificación dos veces al día en el día 1 de cada cohorte).
Las reacciones adversas relacionadas con el tratamiento más frecuentemente notificadas (≥ 5%) con posaconazol tabletas recubiertas de liberación retardada (300 mg una vez al día), fueron náuseas y diarrea.
La reacción adversa más frecuentemente reportada que lleva a la interrupción de las tabletas de posaconazol 300 mg una vez al día fueron las náuseas.
Seguridad de posaconazol suspensión oral: La seguridad de posaconazol suspensión oral ha sido evaluada en 2.400 pacientes y voluntarios sanos incluidos en los ensayos clínicos y la experiencia post-comercialización. Ciento setenta y dos pacientes recibieron tratamiento con posaconazol durante ≥ 6 meses, 58 de ellos recibieron tratamiento con posaconazol durante ≥ 12 meses.
Los eventos adversos graves relacionados con el tratamiento reportados en 428 pacientes tratados con posaconazol suspensión oral con infecciones fúngicas invasivas (1% cada uno) incluyeron la concentración alterada de otros medicamentos, aumento de las enzimas hepáticas, náuseas, erupción cutánea y vómito. Eventos adversos graves relacionados con el tratamiento y reportados en 605 pacientes tratados con posaconazol suspensión oral para la profilaxis (1% cada uno) incluyeron bilirrubinemia, aumento de las enzimas hepáticas, daño hepatocelular, náuseas y vómito.
Eventos adversos poco comunes y raros, medicamente relevantes relacionados con el tratamiento durante los ensayos clínicos con posaconazol suspensión oral han incluido la insuficiencia suprarrenal, reacciones alérgicas y/o de hipersensibilidad.
Además, se han notificado casos raros de torsades de pointes en pacientes tratados con posaconazol suspensión oral.
Adicionalmente, se han reportado casos raros de síndrome urémico hemolítico y púrpura trombótica trombocitopénica principalmente entre los pacientes que habían estado recibiendo ciclosporina o tacrolimus de forma concomitante con posaconazol suspensión oral para el manejo del rechazo del trasplante o enfermedad injerto contra huésped (GVHD).
Reacciones Adversas Relacionadas con el Tratamiento (TRAEs, por sus siglas en inglés), reportadas en estudios de posaconazol tabletas recubiertas de liberación retardada y suspensión oral: Las reacciones adversas más comunes relacionadas con el tratamiento, reportadas en estudios de posaconazol tabletas recubiertas de liberación retardada y suspensión oral a través de toda la población de voluntarios sanos y pacientes se muestran en la Tabla 3.
|
Tabla 3. Reacciones adversas relacionadas con el tratamiento (TRAEs), reportadas en pacientes tratados con posaconazol tabletas recubiertas de liberación retardada y suspensión oral por sistema corporal Incluye todas las TRAEs con incidencia de igual o mayor al 1% común (>1/100, <1/10) |
|
|
Alteraciones sanguíneas y del sistema linfático Común: |
Neutropenia |
|
Alteraciones del metabolismo y la nutrición Común: |
Anorexia, alteración electrolítica, hipokalemia |
|
Alteraciones del sistema nervioso Común: |
Mareo, cefalea, parestesias, somnolencia |
|
Alteraciones gastrointestinales Común: |
Dolor abdominal, diarrea, dispepsia, flatulencia, boca seca, náuseas, vómito, constipación |
|
Alteraciones hepatobiliares Común: |
Elevación de pruebas de función hepática (incluyendo AST, ALT, fosfatasa alcalina, GGT, bilirrubina) |
|
Alteraciones de la piel y el tejido celular subcutáneo Común: |
Rash, prurito |
|
Alteraciones generales y relacionadas con el sitio de administración Común: |
Astenia, fatiga, pirexia (fiebre) |
Interferencia con pruebas de laboratorio: Ninguna conocida.
Abuso y dependencia: No se conoce el potencial de abuso para posaconazol.
INTERACCIONES CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN: Las interacciones descritas en las siguientes sub-secciones aplican a posaconazol tabletas recubiertas de liberación retardada y suspensión oral a menos que se indique lo contrario.
Efectos de otros medicamentos sobre posaconazol tabletas recubiertas de liberación retardada y suspensión oral: Posaconazol es metabolizado por la vía de la glucuronidación del UDP (enzimas fase 2) y es un sustrato del flujo de la glicoproteína-p (P-gp). Por lo tanto, los inhibidores o inductores de estas vías de depuración pueden afectar las concentraciones plasmáticas de posaconazol.
Rifabutina: (300 mg al día) disminuyó la Cmáx (concentración plasmática máxima) y el AUC (área bajo la curva de concentración plasmática - tiempo) del posaconazol en 43% y 49%, respectivamente. El uso concomitante de posaconazol y rifabutina debe ser evitado a menos que el beneficio para el paciente sobrepase el riesgo.
Fenitoína: (200 mg al día) disminuyó la Cmáx y el AUC de posaconazol en 41% y 50%, respectivamente. El uso concomitante de posaconazol y fenitoína debe evitarse a menos que el beneficio para el paciente sobrepase el riesgo.
• Los antagonistas del receptor H2, los inhibidores de la bomba de protones (PPIs, por sus siglas en inglés) y los antiácidos:
— Posaconazol tabletas recubiertas de liberación retardada:
No se observó ningún efecto clínicamente relevante cuando se administró posaconazol tabletas recubiertas de liberación retardada de forma concomitante con antiácidos, antagonistas del receptor H2, o con inhibidores de la bomba de protones. No se requiere ajuste de dosis cuando se administre posaconazol tabletas recubiertas de liberación retardada concomitantemente con antiácidos, antagonistas del receptor H2, o con inhibidores de la bomba de protones.
— Posaconazol suspensión oral:
Las concentraciones plasmáticas de posaconazol (Cmáx y AUC) fueron reducidas en un 39% cuando posaconazol suspensión oral fue administrado con cimetidina (400 mg dos veces al día) debido a la absorción reducida posiblemente secundaria a una disminución de la producción de ácido gástrico. La administración concomitante de posaconazol suspensión oral con los antagonistas del receptor de H2 debe ser evitada, si es posible.
De forma similar, la administración de 400 mg de posaconazol suspensión oral con esomeprazol (40 mg al día) disminuyó el promedio de Cmáx y AUC en un 46% y 32%, respectivamente, comparado con la dosificación de 400 mg de posaconazol solo. La administración concomitante de posaconazol suspensión oral con inhibidores de la bomba de protones debe ser evitada, si es posible.
• Agentes de motilidad gastrointestinal:
— Posaconazol tabletas recubiertas de liberación retardada:
No se observó un efecto clínicamente significativo en la farmacocinética de posaconazol cuando posaconazol tabletas recubiertas de liberación retardada fue administrado concomitantemente con metoclopramida. No se requiere ajuste de la dosis de posaconazol tabletas recubiertas de liberación retardada cuando es administrado de forma concomitante con metoclopramida.
— Posaconazol suspensión oral:
Cuando se administró metoclopramida con posaconazol suspensión oral, disminuyó las concentraciones plasmáticas de posaconazol. Si la metoclopramida es administrada de forma concomitante con posaconazol suspensión oral, se recomienda hacer un monitoreo estricto del avance de las infecciones fúngicas.
La loperamida no afecta las concentraciones plasmáticas del posaconazol. No se requiere ajuste de dosis cuando se administra posaconazol y loperamida de forma concomitante.
Glipizida: (dosis única de 10 mg) no tuvo ningún efecto clínicamente significativo sobre la Cmáx o el AUC del posaconazol.
Efavirenz: (400 mg una vez al día) disminuyó la Cmáx y el AUC de posaconazol en un 45% y 50%, respectivamente. El uso concomitante de posaconazol con efavirenz se debe evitar a menos que el beneficio para el paciente supere el riesgo.
Fosamprenavir: La combinación de fosamprenavir con posaconazol puede conducir a la disminución de las concentraciones plasmáticas de posaconazol. Si se requiere la administración concomitante, se recomienda una estrecha vigilancia del progreso de las infecciones fúngicas. Repetir la administración de dosis de fosamprenavir (700 mg dos veces al día x 10 días) disminuyó la Cmáx y el AUC de posaconazol (200 mg suspensión oral una vez al día en el 1er día, 200 mg suspensión oral dos veces al día en el segundo día, luego 400 mg suspensión oral dos veces al día x 8 días) por 21% y 23%, respectivamente.
Efectos de posaconazol tabletas recubiertas de liberación retardada y suspensión oral sobre otros medicamentos: Posaconazol no es metabolizado en niveles clínicamente significativos a través del sistema del citocromo P450. Sin embargo, el posaconazol es un inhibidor de la CYP3A4 y por lo tanto los niveles plasmáticos de los medicamentos que son metabolizados a través de esta vía, pueden aumentar cuando se administran con posaconazol.
Alcaloides del ergot: Aunque no se ha estudiado in vitro o in vivo, posaconazol puede aumentar la concentración plasmática de los alcaloides del ergot (ergotamina y dihidroergotamina) lo que puede producir ergotismo. La administración concomitante de posaconazol y alcaloides del ergot está contraindicada.
Alcaloides de la vinca: La mayoría de alcaloides de la vinca (p. ej., vincristina y vinblastina) son sustratos del CYP3A4. La administración concomitante de antifúngicos azólicos, incluyendo posaconazol, con vincristina ha sido asociado con reacciones adversas serias (ver Advertencias especiales y precauciones especiales de uso). Posaconazol puede incrementar las concentraciones plasmáticas de los alcaloides de la vinca lo cual puede llevar a neurotoxicidad y otras reacciones adversas serias. Por lo tanto, reserve los antifúngicos azólicos, incluyendo posaconazol, para los pacientes que reciben un alcaloide de la vinca, incluyendo vincristina que no tengan otra opción alternativa de tratamiento antifúngico.
Ciclosporina: En los pacientes con trasplante cardiaco que reciben dosis estables de ciclosporina, una dosis diaria de 200 mg de posaconazol suspensión oral aumentó las concentraciones de ciclosporina requiriéndose reducción de dosis. Cuando se inicie el tratamiento con posaconazol en pacientes que ya reciben ciclosporina, la dosis de ciclosporina debe ser reducida (p. ej., a tres cuartas partes de la dosis actual). Por lo tanto los niveles sanguíneos de la ciclosporina deben ser monitoreados cuidadosamente durante la administración concomitante y hasta la interrupción del tratamiento con posaconazol, la dosis de ciclosporina debe ser ajustada según necesidad.
Tacrolimus: El posaconazol aumentó la Cmáx y el AUC de tacrolimus (dosis única de 0,05 mg/kg) en 121% y 358%, respectivamente, Cuando se inicie el tratamiento con posaconazol en pacientes que ya estén recibiendo tacrolimus, la dosis de este debe ser reducida (p. ej., aproximadamente hasta un tercio de la dosis actual). Por lo tanto los niveles sanguíneos del tacrolimus deben ser monitoreados cuidadosamente durante la administración concomitante, y hasta la interrupción del posaconazol, y se debe realizar ajuste de dosis de tacrolimus según necesidad.
Sirolimus: La administración de dosis repetidas de Posaconazol oral (400 mg de suspensión oral dos veces al día por 16 días) aumentó la Cmáx y AUC del sirolimus (2 mg dosis única) un promedio de 6.7 veces y 8.9 veces, respectivamente, en sujetos sanos. Cuando se inicia la terapia en pacientes que ya están tomando sirolimus, la dosis de sirolimus debe ser reducida (p. ej., cerca de 1/10 de la dosis actual) con monitoreo frecuente de las concentraciones mínimas de sirolimus en sangre total. Las concentraciones de sirolimus deben ser determinadas al iniciar, durante la administración concomitante, y en la interrupción del tratamiento con posaconazol, con dosis ajustadas de sirolimus en consecuencia.
Rifabutina: El posaconazol aumentó la Cmáx y el AUC de rifabutina en 31% y 72%, respectivamente. El uso concomitante de posaconazol y rifabutina debe ser evitado a menos que el beneficio para el paciente sobrepase el riesgo. Si los medicamentos son administrados concomitantemente, se recomienda monitorear cuidadosamente el cuadro hemático y los efectos adversos relacionados con niveles incrementados de rifabutina (p. ej., uveitis).
Midazolam: La administración de dosis repetidas de posaconazol oral (200 mg de suspensión oral dos veces al día por 7 días) aumentó el Cmáx y el AUC del midazolam IV (0.4 mg dosis única) en un promedio de 1.3 y 4.6 veces, respectivamente. Posaconazol suspensión oral 400 mg dos veces al día por 7 días, incrementó el Cmáx y AUC del midazolam IV en 1.6 y 6.2 veces, respectivamente. Ambas dosis de posaconazol incrementaron el Cmáx y el AUC de midazolam oral (2 mg de dosis única oral) en 2.2 y 4.5 veces, respectivamente. Adicionalmente, el posaconazol oral (200 mg o 400 mg suspensión oral) prolongó la vida media terminal promedio del midazolam de aproximadamente 3-4 horas a 8-10 horas durante la administración concomitante.
Se recomienda, que sean considerados los ajustes en la dosis de benzodiacepinas, metabolizadas por el CYP3A4 durante la administración concomitante de posaconazol.
Zidovudina (AZT), lamivudina (3TC), indinavir: Los estudios clínicos no demostraron ningún efecto clínicamente significativo sobre la zidovudina, lamivudina o indinavir cuando se administraron con posaconazol; por lo tanto no se requieren ajustes de la dosis durante la administración concomitante.
Inhibidores de la proteasa del VIH: Como los inhibidores de la proteasa del VIH son sustratos de CYP3A4, se espera que posaconazol incremente los niveles plasmáticos de estos agentes antirretrovirales. Repetir la administración de dosis de posaconazol oral (400 mg suspensión oral dos veces al día durante 7 días) aumentó la Cmáx y el AUC de atazanavir (300 mg una vez al día durante 7 días) un promedio de 2,6 veces y 3,7 veces, respectivamente, en sujetos sanos.
Repetir la administración de dosis de posaconazol oral (400 mg de suspensión oral dos veces al día durante 7 días) aumentó la Cmáx y el AUC de atazanavir en menor medida cuando se administra como un régimen potenciado con ritonavir (300 mg de atazanavir más ritonavir 100 mg una vez al día durante 7 días) con un promedio de 1,5 veces y 2,5 veces, respectivamente, en sujetos sanos. Se recomienda un monitoreo frecuente de eventos adversos y la toxicidad relacionados con los agentes antiretrovirales que son sustratos de CYP3A4 durante la administración concomitante con posaconazol.
Inhibidores de la HMG-CoA reductasa metabolizados principalmente a través de la CYP3A4: La administración de dosis repetidas de posaconazol oral (50, 100 y 200 mg suspensión oral una vez al día por 13 días) aumentó la Cmáx y el AUC de la simvastatina (40 mg dosis única) en un promedio de 7,4 a 11,4 veces y 5,7 a 10,6 veces respectivamente. Las concentraciones elevadas de inhibidor de la HMG- CoA reductasa en el plasma pueden asociarse con rabdomiólisis. La administración concomitante de posaconazol con inhibidores de la HMG- CoA reductasa que son metabolizados principalmente por la CYP3A4 está contraindicada.
Bloqueadores de los canales de calcio metabolizados a través de la CYP3A4: Aunque no se ha estudiado in vitro o in vivo, se recomienda un monitoreo frecuente de efectos adversos y toxicidad relacionada con bloqueadores de canales de calcio durante la coadministración con posaconazol. Puede ser necesario ajustar la dosis de los bloqueadores de canales de calcio.
ADVERTENCIAS ESPECIALES Y PRECAUCIONES ESPECIALES DE USO:
Hipersensibilidad: No existe información acerca de sensibilidad cruzada entre posaconazol y otros agentes antimicóticos azoles. Se debe tener precaución cuando se prescriba posaconazol a pacientes con hipersensibilidad a otros azoles.
Toxicidad hepática: En estudios clínicos, se presentaron casos infrecuentes de reacciones hepáticas (p. ej., elevación leve a moderada de la ALT, la AST, la fosfatasa alcalina, la bilirrubina total y/o hepatitis clínica). La elevación de las pruebas de función hepática generalmente fue reversible al suspender el tratamiento, y en algunos casos estas pruebas se normalizaron sin interrumpir el medicamento y rara vez requirieron la interrupción del medicamento. En casos raros, se reportaron reacciones hepáticas más severas (incluyendo casos que han resultado en desenlaces fatales) en pacientes con enfermedades subyacentes (p. ej., neoplasias hematológicas) durante el tratamiento con posaconazol.
Prolongación del intervalo QT: Algunos azoles se han asociado con prolongación del intervalo QT. Los resultados de un análisis múltiple con tiempo pareado de ECG en voluntarios sanos no demostraron ningún aumento en el promedio del intervalo QTc. De todas formas, posaconazol no debe administrarse con medicamentos que produzcan prolongación del intervalo QTc y que sean metabolizados a través de la CYP3A4.
Alteraciones electrolíticas: Las alteraciones electrolíticas, especialmente las que involucren los niveles de potasio, magnesio o calcio, deben ser monitoreadas y corregidas si es necesario antes y durante el tratamiento con posaconazol.
Toxicidad de vincristina: La administración concomitante de antifúngicos azólicos, incluyendo posaconazol, con vincristina ha sido asociado con neurotoxicidad y otras reacciones adversas serias, incluyendo convulsiones, neuropatía periférica, síndrome de secreción inapropiada de la hormona antidiurética e íleo paralitico. Reserve los antifúngicos azólicos, incluyendo el posaconazol, para los pacientes que reciben un alcaloide de la vinca, incluyendo vincristina, que no tienen opciones alternativas de tratamiento antifúngico (ver Interacciones con otros medicamentos y otras formas de interacción).
POBLACIONES ESPECIALES:
Pediátrica: El uso de posaconazol tabletas recubiertas de liberación retardada en pacientes entre 13 y 17 años de edad esta soportado por evidencia adecuada que proviene de estudios bien controlados realizados para la suspensión oral de posaconazol.
Luego de la administración de 800 mg por día de la suspensión oral de posaconazol en dosis fraccionadas para el tratamiento de las infecciones fúngicas invasivas, las concentraciones medias plasmáticas mínimas de 12 pacientes de 8 - 17 años de edad (776 ng/mL) fueron similares a las concentraciones de 194 pacientes de 18-64 años de edad (817 ng/mL). No hay datos farmacocinéticos disponibles en pacientes pediátricos menores de 8 años de edad. Asimismo, en los estudios de profilaxis, la concentración media en estado de reposo de posaconazol promedio (Cav) fue comparable en diez adolescentes (13-17 años de edad) en relación con el Cav obtenidos en adultos (≥ 18 años de edad).
En un estudio de 136 pacientes pediátricos neutropénicos de 11 meses - 17 años tratados con posaconazol suspensión oral, a dosis de hasta 18 mg/kg/día dividido 3 veces al día, aproximadamente el 50% logró el objetivo pre-especificado (día 7 Cav g entre 500 ng/mL-2500 ng/mL).
En general, la exposición tendió a ser más alta en los pacientes mayores (7 a <18 años) que en los pacientes más jóvenes (2 a <7 años).
Género: La farmacocinética de posaconazol es comparable en hombres y mujeres. No se requiere un ajuste de la dosis de NOXAFIL® basado en el género.
Geriátricos: De los 230 pacientes tratados con posaconazol tabletas recubiertas de liberación retardada, 38 (17%) fueron mayores de 65 años de edad. La farmacocinética de las tabletas recubiertas de liberación retardada de posaconazol es comparable en sujetos jóvenes y ancianos. No se observaron diferencias en seguridad entre los pacientes ancianos y los pacientes más jóvenes, por lo tanto, no se recomienda un ajuste de dosis en pacientes geriátricos.
Se observó un aumento de la Cmáx (26%) y ABC (29%) en pacientes ancianos (24 sujetos ≥ 65 años de edad) que recibieron la suspensión oral de posaconazol con relación con los sujetos más jóvenes (24 sujetos de 18 - 45 años de edad). Sin embargo, en un análisis farmacocinético de la población (Estudio 1899) la edad no influyó en la farmacocinética de la suspensión oral de posaconazol. Además, en los ensayos clínicos de eficacia, el perfil de seguridad de posaconazol suspensión oral entre los pacientes jóvenes y de edad avanzada fue similar. Por lo tanto, no se requiere ajuste de la dosis para la edad.
Raza: No hay suficientes datos entre diferentes razas con tabletas de posaconazol.
Los resultados de un estudio de dosis múltiples en voluntarios sanos (n = 56) indicaron que sólo hubo una ligera disminución (16%) en el AUC y la Cmáx de posaconazol suspensión oral en sujetos de raza negra con respecto a sujetos caucásicos, por lo tanto, no se requiere un ajuste de dosis con base en la raza.
Peso: El modelo farmacocinético de posaconazol sugiere que los pacientes que pesan más de 120 kg pueden tener una inferior exposición a posaconazol. Esto, por lo tanto, sugirió que se debe monitorear de cerca el progreso de las infecciones fúngicas en pacientes que pesan más de 120 kg.
Insuficiencia renal: Tras la administración de dosis única, no hubo efecto de la insuficiencia renal leve y moderada (n = 18, Clcr ≥ 20 mL/min/1.73 m2) sobre la farmacocinética de posaconazol, por lo tanto, no se requiere ajuste de dosis. En sujetos con insuficiencia renal grave (n = 6, Clcr < 20 mL/min/1.73 m2), la exposición de posaconazol fue muy variable (CV 96%) en comparación con la exposición en los otros grupos renales (< 40% CV). Sin embargo, dado que posaconazol no se elimina significativamente por vía renal, no se espera un efecto de la insuficiencia renal grave sobre la farmacocinética de posaconazol y no se recomienda un ajuste de dosis. Posaconazol no se elimina por hemodiálisis. Debido a la variabilidad en la exposición, el progreso de infecciones fúngicas debe ser estrechamente monitoreado en pacientes con insuficiencia renal grave.
Recomendaciones similares se aplican a las tabletas recubiertas de liberación retardada de posaconazol, sin embargo, un estudio específico no se ha llevado a cabo con tabletas recubiertas de liberación retardada de posaconazol.
Insuficiencia hepática: En un pequeño número de individuos estudiados (n = 12) con insuficiencia hepática (Child-Pugh clase A, B o C), los valores Cmáx generalmente disminuyeron con la severidad de la disfunción hepática (545, 414 y 347 ng/mL para los grupos de leve, moderada y severa, respectivamente), a pesar de que los valores de Cmáx (promedio 508 ng /mL) para los sujetos normales fueron consistentes con estudios previos realizados en voluntarios sanos. Además, un aumento en la vida media también se asoció con una disminución de la función hepática (26,6, 35,3, y 46,1 horas para los grupos leve, moderada y grave, respectivamente), todos los grupos tuvieron valores de vida media más larga que los sujetos con la función hepática normal (22,1 horas). Debido a los limitados datos farmacocinéticos en pacientes con insuficiencia hepática, ninguna recomendación de ajuste de dosis se puede realizar.
Recomendaciones similares se aplican a las tabletas recubiertas de liberación retardada de posaconazol, sin embargo, un estudio específico no se ha llevado a cabo con tabletas recubiertas de liberación retardada de posaconazol.
POSOLOGÍA Y MÉTODO DE ADMINISTRACIÓN:
General: NOXAFIL® tabletas recubiertas de liberación retardada puede ser administrado sin tener en cuenta el consumo de un alimento. NOXAFIL® suspensión oral debe ser administrado con una comida, o con 240 mL de un suplemento nutricional. La suspensión oral debe mezclarse bien antes de utilizarse.
Instrucciones importantes de administración para NOXAFIL® tabletas recubiertas de liberación retardada y NOXAFIL® suspensión oral: El médico prescriptor debe seguir las instrucciones específicas de dosificación para cada formulación. Las tabletas recubiertas de liberación retardada y la Suspensión Oral no son para ser utilizadas de forma intercambiable debido a las diferencias en la dosificación de cada formulación.
DOSIS Y DURACIÓN:
|
Tabla 1. Dosis recomendada para NOXAFIL® tabletas recubiertas de liberación retardada de acuerdo a la indicación |
|
|
Indicación |
Dosis y duración del tratamiento |
|
Profilaxis de infecciones fúngicas invasivas |
Dosis de carga de 300 mg (tres tabletas recubiertas de liberación retardada de 100 mg) dos veces al día el primer día, luego 300 mg (tres tabletas recubiertas de liberación retardada de 100 mg) una vez al día, a partir de ahí. Cada dosis debe ser tomada sin tener en cuenta el consumo de alimentos. La duración del tratamiento está basada en la recuperación de la neutropenia o la inmunosupresión. Para pacientes con leucemia mielogénica aguda o síndromes mielodisplásicos, la profilaxis con NOXAFIL® debe iniciar muchos días antes del inicio anticipado de la neutropenia y continuar por 7 días después de que el conteo de neutrófilos aumente por encima de 500 células por mm3. |
|
Infecciones Fúngicas Invasivas Refractarias (IFI, por sus siglas en inglés)/Pacientes con IFI intolerantes a la terapia de primera línea |
Dosis de carga de 300 mg (tres tabletas recubiertas de liberación retardada de 100 mg) dos veces al día el primer día, luego 300 mg (tres tabletas recubiertas de liberación retardada de 100 mg) una vez al día, a partir de ahí. La duración del tratamiento debe estar basada en la severidad de la enfermedad subyacente, la recuperación de la inmunosupresión y la respuesta clínica. |
|
Coccidioidomicosis |
|
|
Candidiasis esofágica refractaria |
Dosis de carga de 300 mg (tres tabletas recubiertas de liberación retardada de 100 mg) dos veces al día el primer día, luego 300 mg (tres tabletas recubiertas de liberación retardada de 100 mg) una vez al día, a partir de ahí. Cada dosis debe ser tomada sin tener en cuenta el consumo de alimentos. La duración del tratamiento debe estar basada en la severidad de la enfermedad subyacente, la recuperación de la inmunosupresión y la respuesta clínica. |
|
Tabla 2. Dosis recomendada para NOXAFIL® suspensión oral de acuerdo a la indicación |
|
|
Indicación |
Dosis y duración del tratamiento |
|
Profilaxis de infecciones fúngicas invasivas |
200 mg (5 mL) tres veces al día. La duración del tratamiento está basada en la recuperación de la neutropenia o inmunosupresión. |
|
Infecciones Micóticas Invasivas (IFI) refractarias/Pacientes no tolerantes con IFI |
400 mg (10 mL) dos veces al día*. En pacientes que no pueden tolerar una comida o un suplemento nutricional, NOXAFIL® se debe administrar en dosis de 200 mg (5 mL) cuatro veces al día. La duración del tratamiento se debe basar en la severidad de la enfermedad subyacente, la recuperación de la inmunosupresión y la respuesta clínica. |
|
Coccidioidomicosis |
400 mg (10 mL) dos veces al día*. En pacientes que no pueden tolerar una comida o un suplemento nutricional, NOXAFIL® se debe administrar en dosis de 200 mg (5 mL) cuatro veces al día. La duración del tratamiento se debe basar en la severidad de la enfermedad subyacente, la recuperación de la inmunosupresión y la respuesta clínica. |
|
Candidiasis orofaríngea |
Dosis de carga de 200 mg (5 mL) una vez al día durante el primer día, luego 100 mg (2,5 mL) una vez al día por 13 días. |
|
Candidiasis esofágica y orofaríngea refractaria |
400 mg (10 mL) dos veces al día*. La duración del tratamiento debe basarse en la severidad de la enfermedad subyacente del paciente y en la respuesta clínica. |
|
*Aumentar la dosis diaria total de la suspensión oral por encima de 800 mg no mejora la exposición al NOXAFIL®. |
|
Uso en pacientes con enfermedad renal: No se requiere ajuste de dosis en disfunción renal, pues posaconazol no tiene eliminación renal significativa y no se espera que la insuficiencia renal severa cause algún efecto sobre la farmacocinética de este.
Uso en pacientes con enfermedad hepática: Existen datos limitados acerca de la farmacocinética en pacientes con insuficiencia hepática; por lo tanto, no se puede hacer ninguna recomendación de ajuste de dosis. En el escaso número de pacientes estudiados que tenían insuficiencia hepática, hubo un incremento de la vida media en relación con la disminución de la función hepática.
Uso en pediatría: La seguridad y la eficacia en adolescentes y niños por debajo de los 13 años de edad no han sido establecidas.
Método de administración: No intercambiabilidad entre NOXAFIL® tabletas recubiertas de liberación retardada y NOXAFIL® suspensión oral. NOXAFIL® tabletas recubiertas de liberación retardada y NOXAFIL® suspensión oral no se deben usar intercambiablemente debido a las diferencias en la dosificación de cada formulación. Por lo tanto siga las recomendaciones de dosificación específicas para cada una de las formulaciones. NOXAFIL® tabletas recubiertas de liberación retardada y suspensión oral están previstos solamente para administración oral. NOXAFIL® tabletas recubiertas de liberación retardada debe ser tragado entero, y no ser dividido, triturado o masticado. Agitar bien NOXAFIL® suspensión oral antes de su uso.
SOBREDOSIS: No hay experiencia de sobredosis de posaconazol tabletas recubiertas de liberación retardada.
Durante los estudios clínicos algunos pacientes recibieron posaconazol suspensión oral hasta 1600 mg/día sin evidencia de eventos adversos diferentes a los reportados con dosis bajas. Adicionalmente, se presentó una sobredosis accidental en un paciente que tomó 1200 mg de posaconazol suspensión oral dos veces al día por 3 días. No se reportó ningún evento adverso relacionado por el investigador.
Posaconazol no es removido mediante hemodiálisis.
Otra información de seguridad relevante: Ninguna.
PRESENTACIONES: NOXAFIL® suspensión oral 40 mg/mL. Frasco ámbar por 105 mL (Reg. No. INVIMA 2008M-0008347). NOXAFIL® tabletas recubiertas de liberación retardada por 100 mg. (Reg. No. INVIMA 2015 M-0015948). Caja por 24 tabletas, caja por 96 tabletas.
Fecha de revisión del documento: Este documento fue revisado por última vez en Noviembre de 2016.
LPI-MK5592-OS-T-112016
MERCK SHARP & DOHME
Bogotá, D.C. - Colombia