
OLMETECANLO
AMLODIPINO, OLMESARTÁN
Tabletas recubiertas
Caja , 30 Tabletas recubiertas , 20 / 5 mg/mg
Caja , 30 Tabletas recubiertas , 40 / 5 mg/mg
Caja , 30 Tabletas recubiertas , 40 / 10 mg/mg
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
OLMETECANLO® 40 mg/10 mg: Cada tableta recubierta contiene Olmesartán Medoxomil 40 mg y Amlodipino besilato equivalente a Amlodipino base 10 mg.
OLMETECANLO® 20 mg/5 mg: Cada tableta recubierta contiene Olmesartán Medoxomil 20 mg y Amlodipino besilato equivalente a Amlodipino base 5 mg
OLMETECANLO® 40 mg/ 5 mg: Cada tableta recubierta contiene Olmesartán Medoxomil 40 mg y Amlodipino besilato equivalente a Amlodipino base 5 mg.
INDICACIONES: Tratamiento de hipertensión solo o en combinación con otros agentes antihipertensivos. Tratamiento inicial en los pacientes que tienen probabilidades de necesitar varios agentes antihipertensivos para lograr sus objetivos de la presión arterial.
PROPIEDADES FARMACODINÁMICAS: OLMETECANLO® es una combinación de un antagonista del receptor de angiotensina II, Olmesartán Medoxomil, y un bloqueador del canal de calcio, besilato de Amlodipino. La combinación de estos ingredientes activos tiene un efecto antihipertensivo acumulativo, reduciendo la presión sanguínea en mayor medida que cualquier de los componentes por sí solos.
Con la administración crónica oral una vez al día, la efectividad anti-hipertensiva se mantiene durante al menos 24 horas.
El efecto anti-hipertensivo del OLMETECANLO® fue similar independientemente de la edad y el género y fue similar en pacientes con y sin diabetes.
En estudios de seguimiento, el efecto anti-hipertensivo del OLMETECANLO® fue continuo durante al tratamiento a largo-plazo. Cuando fue necesario la adición de un diurético (hidroclorotiazida) se presento aumentó del efecto antihipertensivo del OLMETECANLO®.
Olmesartán medoxomil: El componente Olmesartán Medoxomil de OLMETECANLO® es un antagonista selectivo del receptor de angiotensina II tipo 1 (AT1). Olmesartán Medoxomil es rápidamente convertido al metabolito farmacológicamente activo, Olmesartán. La angiotensina II es la hormona vasoactiva primaria del sistema renina-angiotensina-aldosterona, y juega un papel importante en la patofisiología de la hipertensión. Los efectos de la angiotensina II incluyen vasoconstricción, estimulación de la síntesis y liberación de aldosterona, estimulación cardiaca, y reabsorción renal de sodio. Olmesartán bloquea los efectos vasoconstrictores y secretores de la aldosterona de angiotensina II bloqueando su unión al receptor AT1 en los tejidos, incluyendo en músculo liso vascular y la glándula adrenal. La acción de Olmesartán es independiente de la fuente o vía de síntesis de angiotensina II. El antagonismo selectivo de los receptores de angiotensina II (AT1) por Olmesartán resulta en aumentos en los niveles de renina en el plasma y en las concentraciones de angiotensina I y II, y cierta disminución en las concentraciones de aldosterona en el plasma.
En hipertensión, Olmesartán Medoxomil produce una reducción de la presión sanguínea arterial dependiente de la dosis y de larga duración. No se ha reportado evidencia de hipotensión en la primera dosis, de taquifilaxia durante el tratamiento a largo-plazo, o de hipertensión de rebote después de suspender el tratamiento abruptamente.
Después de la administración una vez al día a pacientes con hipertensión, Olmesartán Medoxomil produce una reducción efectiva y uniforme en la presión sanguínea durante el intervalo de la dosis de 24-horas. Una dosis al día produjo disminuciones similares en la presión que una dosis dos veces al día con la misma dosis total diaria.
Con el tratamiento continuo, se alcanzan disminuciones máximas en la presión sanguínea a las 8 semanas después del inicio del tratamiento; aunque, una parte sustancial del efecto de disminución en la presión sanguínea se observa desde las dos semanas de tratamiento.
El efecto de Olmesartán Medoxomil en la mortalidad y morbilidad no se conoce aún.
Besilato de amlodipino: El componente Amlodipino de OLMETECANLO® es un bloqueador del canal de calcio que inhibe la entrada de iones calcio a la membrana a través de los canales tipo-L dependientes del voltaje en el corazón y el músculo liso. Datos experimentales indican que Amlodipino se une a los sitios de unión de dihidropiridina y no-dihidropiridina. Amlodipino es relativamente vaso-selectivo, con mayor efecto en las células del músculo liso vascular que en las células del músculo cardiaco. El efecto anti-hipertensivo de Amlodipino se deriva de un efecto relajante directo en el músculo liso arterial, que produce una disminución de la resistencia periférica y consecuentemente de la presión sanguínea.
En pacientes hipertensos, Amlodipino causa una disminución prolongada, en la presión sanguínea arterial. No se ha reportado evidencia de hipotensión en la primera dosis, de taquifilaxia durante el tratamiento a largo-plazo, o hipertensión de rebote después de suspender el tratamiento abruptamente.
Después de la administración de dosis terapéuticas a pacientes con hipertensión, Amlodipino produce una disminución efectiva de la presión sanguínea en las posiciones supina, sentado, y de pie. El uso crónico de Amlodipino no se asocia con cambios importantes en la frecuencia cardiaca ni en los niveles de catecolamina en el plasma. En pacientes hipertensos con función renal normal, dosis terapéuticas de Amlodipino reducen la resistencia vascular renal y aumentan la tasa de filtración glomerular y el flujo plasmático renal efectivo, sin cambiar la fracción de filtración o proteinuria.
Estudios epidemiológicos han demostrado que el tratamiento a largo-plazo con la monoterapia de Amlodipino reduce el riesgo de mortalidad y morbilidad cardiovascular.
Farmacocinética: Después de la administración oral de OLMETECANLO®, se alcanzaron concentraciones máximas de Olmesartán y Amlodipino en el plasma a las 1.5 horas a las 2 horas y a las 6 a 8 horas, respectivamente.
La tasa y grado de absorción de las dos sustancias activas de OLMETECANLO® son equivalentes a la tasa y grado de absorción después de la ingestión de los dos componentes como tabletas separadas. El alimento no afecta la biodisponibilidad de Olmesartán y Amlodipino de OLMETECANLO®.
Absorción y distribución
OLMETECANLO®: La farmacocinética de Amlodipino y Olmesartán de OLMETECANLO® es equivalente a la farmacocinética de Amlodipino y Olmesartán cuando se administran por separado. El alimento no afectó la farmacocinética de Amlodipino ni de Olmesartán cuando se administraron como OLMETECANLO® en sujetos sanos.
Olmesartán medoxomil: Olmesartán Medoxomil es una profarmaco. Es convertido rápidamente al metabolito farmacológicamente activo, Olmesartán, por las esterasas en la mucosa del intestino y en la sangre portal durante la absorción desde tracto gastrointestinal. No se ha detectado Olmesartán Medoxomil intacto ni fracción molecular de Medoxomil de cadena lateral sin metabolizar en el plasma o en las heces. La biodisponibilidad absoluta promedio de Olmesartán de la formulación en tabletas fue 25.6%.
La concentración pico promedio (Cmax) de Olmesartán en el plasma se alcanza dentro de aproximadamente dos horas después de la administración oral con Olmesartán Medoxomil, y las concentraciones de Olmesartán en el plasma aumentan aproximadamente linealmente al aumentar la dosis única vía oral hasta aproximadamente 80 mg.
El alimento tuvo un efecto mínimo en la biodisponibilidad de Olmesartán; por lo tanto, Olmesartán Medoxomil puede ser administrado con o sin alimento.
No se han observado diferencias clínicamente relevantes en términos de género en la farmacocinética de Olmesartán.
Olmesartán se une con gran afinidad a la proteína del plasma (99.7%), pero el potencial de interacciones por desplazamiento de la unión a proteínas clínicamente significativo entre Olmesartán y otras sustancias activas con gran afinidad de unión administradas concomitantemente es bajo (como lo ha confirmado la ausencia de interacción clínicamente significativa entre Olmesartán Medoxomil y warfarina). La unión de Olmesartán a las células sanguíneas es insignificante. El volumen promedio de distribución después de la administración intravenosa es bajo (16 L a 29 L).
Besilato de amlodipino: Después de la administración oral de dosis terapéuticas, Amlodipino se absorbe lentamente del tracto gastrointestinal. La absorción de Amlodipino no es afectada por la ingestión concomitante de alimento. Se estima que la biodisponibilidad absoluta del compuesto intacto es de 64% a 80%. Los niveles pico en el plasma se alcanzan de 6 a 12 horas post-dosis. El volumen de distribución es aproximadamente 20 L/kg. El pKa de Amlodipino es 8.6. La unión a proteínas plasmáticas in vitro es aproximadamente 98%.
Metabolismo y excreción
Olmesartán medoxomil: La depuración total de Olmesartán del plasma fue típicamente 1.3 L/h (CV, 19%) y fue relativamente lenta en comparación con el flujo sanguíneo hepático (ca 90 L/h). Con base en la disponibilidad sistémica de 25.6%, se puede calcular que el Olmesartán absorbido es depurado por excreción renal y excreción hepatobiliar. La vida media de eliminación terminal de Olmesartán es entre 10 horas y 15 horas después de dosis múltiples vía oral. El estado estable se alcanza después de las primeras dosis y no hay acumulación posterior aparente después de 14 días de administración repetida. La depuración renal es aproximadamente 0.5 L/h– 0.7 L/h y es independiente de la dosis.
Besilato de amlodipino: La vida media de eliminación en el plasma (t1/2) varía de 35 horas a 50 horas. Los niveles estables en el plasma se alcanzan después de 7 a 8 días consecutivos. Amlodipino es extensamente metabolizado a metabolitos activos. Cerca del 60% de la dosis administrada es excretada en la orina, cerca del 10% del cual es en forma de Amlodipino intacto.
Farmacocinética en Poblaciones especiales
Ancianos: Los análisis indicaron que la edad no es un factor de predicción importante de la depuración de Olmesartán. Debido a que la edad está correlacionada con la depuración de creatinina, cualquier efecto aparente de la edad en la depuración de Olmesartán puede explicarse por los cambios en la depuración de creatinina. Sin embargo, los pacientes ancianos reportan una menor depuración de Amlodipino. En pacientes hipertensos, la concentración plásmatica de Olmesartán en el área bajo la curva (AUC) aumenta en pacientes ancianos (65 años a 75 años de edad) y en pacientes muy ancianos (=75 años de edad) en comparación con el grupo de menor edad. Después de la ingestión oral de Amlodipino, el tiempo de concentración pico en el plasma es comparable en pacientes jóvenes y ancianos. En pacientes ancianos, la depuración de Amlodipino tiende a declinar, resultando en aumentos en el AUC y en la t1/2 de eliminación.
Pediátrico: No existen datos farmacocinéticos disponibles de Olmesartán Medoxomil en pacientes pediátricos (menores de 18 años de edad).
Insuficiencia renal: En pacientes con insuficiencia renal en estado estable, el AUC de Olmesartán fue aproximadamente el triple que en pacientes con insuficiencia renal severa, en comparación con los controles sanos. Los cambios en la concentración de Amlodipino en el plasma no se correlacionan con el nivel de insuficiencia renal. En estos pacientes, Amlodipino puede ser administrada al nivel de la dosis normal. Amlodipino no es dializable.
Insuficiencia hepática: Los aumentos en los valores AUC de Olmesartán son mayores en pacientes con daño hepático que en los controles sanos correspondientes. Los valores Cmax promedio de Olmesartán son similares en pacientes con daño hepático y en sujetos sanos. Olmesartán Medoxomil no ha sido evaluado en pacientes con insuficiencia hepática severa.
La depuración de Amlodipino disminuye y el t1/2 se prolonga en pacientes con función hepática alterada, resultando en un aumento en el AUC de cerca del 60%.
Interacciones farmacocinéticas de Olmesartán
Interacción medicamentosa con el agente secuestrante del ácido biliar colesevalam
La administración concomitante de 40 mg de Olmesartán Medoxomil y 3750 mg de clorhidrato de colesevelam en sujetos sanos dio como resultado una reducción del 28% en la Cmax y una reducción del 39% en la ABC de Olmesartán. Se observaron menores efectos, 4% y 15% de reducción en el Cmax y la ABC, respectivamente, cuando se administró Olmesartán Medoxomil 4 horas antes del clorhidrato de colesevelam (ver Interacciones).
CONTRAINDICACIONES: Contraindicado en personas con hipersensibilidad conocida a los principios activos, dihidropiridina o cualquier otro componente de esta formulación. Embarazo, lactancia y niños menores de 18 años.
Las pacientes que quedan embarazadas deben suspender el uso de OLMETECANLO® lo antes posible (ver Embarazo y lactancia).
No coadministrar aliskireno con OLMETECANLO® en pacientes con diabetes (ver Interacciones) y/o en pacientes con insuficiencia renal moderada a severa.
EMBARAZO Y LACTANCIA
Embarazo: OLMETECANLO® puede causar daño fetal cuando se administra a mujeres embarazadas. Como precaución, no debe usarse durante el primer trimestre de embarazo. La paciente debe cambiar a una forma alternativa de medicación antes de un embarazo planeado. Si el embarazo ocurre durante el tratamiento, OLMETECANLO® debe ser descontinuado tan pronto como sea posible.
No existe experiencia del uso de OLMETECANLO® en mujeres embarazadas.
Olmesartán Medoxomil está contraindicado en el segundo y tercer trimestre de embarazo.
Durante el segundo y tercer trimestre de embarazo, las sustancias que actúan en el sistema renina-angiotensina pueden causar daño (hipotensión, daño en la función renal, oliguria y/o anuria, oligohidramnia, hipoplasia craneal, retardo del crecimiento intrauterino) y muerte de fetos y neonatos. También se reportaron casos de hipoplasia pulmonar, anomalías faciales y contracciones de extremidades. Estudios experimentales en animales usando Olmesartán Medoxomil han demostrado además que puede ocurrir daño renal en la fase final fetal y neonatal.
Datos de un número limitado de embarazos expuestos no indican que Amlodipino u otros antagonistas de receptores de calcio tengan un efecto dañino en la salud del feto. Sin embargo, puede haber riesgo de parto prolongado.
Si OLMETECANLO® es usado durante el embarazo, o si la paciente queda embarazada mientras está tomando OLMETECANLO®, la paciente debe ser advertida del daño potencial al feto. Si ha ocurrido exposición al OLMETECANLO® a partir del segundo trimestre en adelante, se recomienda realizar ultrasonidos de la función renal y del cráneo. Los recién nacidos expuestos a antagonistas de angiotensina II in útero deben ser monitoreados muy de cerca para detectar la ocurrencia de hipotensión, oliguria, e hipercalemia.
Lactancia: No se sabe si Olmesartán Medoxomil o si Amlodipino, componentes de OLMETECANLO®, son excretados en la leche humana, pero Olmesartán es secretado en baja concentración en la leche de ratas en etapa de lactancia. Debido al potencial de eventos adversos en el infante lactando, se debe tomar la decisión de descontinuar o la lactancia o el medicamento.
EFECTOS NO DESEADOS
OLMETECANLO®: La incidencia total de eventos adversos en el tratamiento con OLMETECANLO® no fue diferente a la observada con el placebo. La mayoría de los eventos adversos fueron leves.
Los efectos no deseados más comunes fueron mareos, cefalea, edema y fatiga.
Edema: Edema es un conocido efecto no deseado dependiente de la dosis de Amlodipino. La incidencia de edema fue significativamente menor en pacientes que recibieron OLMETECANLO® que en los que recibieron únicamente Amlodipino 10 mg. En todos los grupos de tratamiento, la frecuencia de edema fue generalmente mayor en mujeres que en hombres.
Los efectos no deseados menos comunes incluyeron hipotensión, hipotensión ortostática, rash, palpitación, y polaquiuria.
Los eventos adversos previamente reportados con uno de los componentes individuales pueden ser eventos adversos potenciales con OLMETECANLO®, incluso si no han sido observados en estudios clínicos con este producto.
Olmesartán medoxomil: En estudios clínicos, el tratamiento con Olmesartán Medoxomil fue bien tolerado, con una incidencia de eventos adversos similar a la observada con el placebo. Los eventos fueron generalmente leves, pasajeros y no se relacionaron con las dosis de Olmesartán Medoxomil. La frecuencia total de eventos adversos no estuvo relacionada con la dosis. Los análisis de los grupos de género, edad, y raza no reportaron diferencias entre los pacientes tratados con Olmesartán Medoxomil y los pacientes con placebo. Mareo ha sido reportado comúnmente (incidencia =1% - <10%) en estudios clínicos con Olmesartán Medoxomil.
En la experiencia post-lanzamiento, las reacciones adversas que han sido reportadas muy raramente (incidencia < 0.01%) fueron edema periférico, cefalea, tos, dolor abdominal, náusea, vómito, diarrea, enteropatía tipo esprúe, reacción anafiláctica, rash, prurito, angioedema, insuficiencia renal aguda, aumento de enzimas hepáticas, aumento en la creatinina de la sangre, hipercalemia, mialgia y condiciones asténicas como astenia, fatigua, letargo, malestar.
Besilato de amlodipino: La mayor parte de las reacciones adversas reportadas durante el tratamiento con Amlodipino fueron leves a moderadas en términos de severidad. Los efectos no deseados más comunes fueron cefalea, edema, mareo, rubor facial y palpitación.
En la experiencia post-lanzamiento, se ha reportado ginecomastia infrecuentemente como una reacción adversa donde la relación causal es incierta. En la experiencia post-comercialización, ictericia y elevaciones de la enzima hepática (principalmente consistente con colestasis o hepatitis), en algunos casos lo suficientemente severos como para requerir hospitalización, han sido reportados en asociación con el uso de Amlodipino.
INTERACCIONES
OLMETECANLO®: El efecto de disminución en la presión sanguínea de OLMETECANLO® puede aumentar por el uso concomitante de otros productos medicinales anti-hipertensivos (ejemplo: bloqueadores alfa, diuréticos). No se han realizado estudios de interacción con OLMETECANLO® y otros fármacos; aunque se han realizado estudios con los componentes individuales Olmesartán Medoxomil y Amlodipino, como se describe a continuación.
El uso con litio: Los aumentos en las concentraciones séricas de litio y toxicidad del litio se han reportado durante la administración concomitante de litio con antagonistas de los receptores de la angiotensina II, incluyendo olmesartán. Monitorear los niveles séricos de litio durante el uso concomitante.
Bloqueo dual del sistema renina-angiotensina (RAS): Bloqueo dual del RAS con antagonistas de los receptores de angiotensina, inhibidores de la ECA o aliskiren se asocia con un mayor riesgo de hipotensión, hiperpotasemia y cambios en la función renal (incluyendo fallo renal agudo) en comparación con la monoterapia. Controle la presión arterial, la función renal y los electrolitos en pacientes en olmesartán y otros agentes que afectan el RAS.
Los aumentos en las concentraciones séricas y en la toxicidad del litio se han reportado durante la administración concomitante de litio con antagonistas de los receptores de la angiotensina II, incluyendo olmesartán. Se debe monitorear los niveles séricos de litio durante el uso concomitante.
Bloqueo dual del sistema renina-angiotensina (SRA): Bloqueo dual del RAS con antagonistas de los receptores de angiotensina inhibidores de la ECA o aliskiren se asocia con un mayor riesgo de hipotensión, hiperpotasemia y cambios en la función renal (incluyendo fallo renal agudo) en comparación con la monoterapia. Se debe monitorear la presión arterial, la función renal y los electrolitos en pacientes con Olmesartán y otros agentes que afectan el RAS.
El uso con litio: Los aumentos en las concentraciones séricas de litio y toxicidad del litio se han reportado durante la administración concomitante de litio con antagonistas de los receptores de la angiotensina II, incluyendo olmesartán. Monitorear los niveles séricos de litio durante el uso concomitante.
Bloqueo dual del sistema renina-angiotensina (RAS): Bloqueo dual del RAS con antagonistas de los receptores de angiotensina, inhibidores de la ECA o aliskiren se asocia con un mayor riesgo de hipotensión, hiperpotasemia y cambios en la función renal (incluyendo fallo renal agudo) en comparación con la monoterapia. Controle la presión arterial, la función renal y los electrolitos en pacientes en olmesartán y otros agentes que afectan el RAS.
Olmesartán medoxomil
Medoxomil
Uso con aliskireno: No coadministre aliskireno con Olmesartán Medoxomil en pacientes con diabetes debido a que el uso dual está asociado con aumentos en el riesgo de hipotensión, hipercalemia y cambios en la función renal (incluida insuficiencia renal aguda) en comparación con la monoterapia.
Medicamentos antiinflamatorios no esteroides (AINE): Los AINE y los bloqueadores del receptor de la angiotensina (BRA) pueden actuar de manera sinérgica disminuyendo la filtración glomerular. El uso concomitante de AINE y BRA puede aumentar el riesgo de un empeoramiento de la función renal. Adicionalmente, el efecto antihipertensivo de los BRA, incluido Olmesartán, puede verse atenuado por los AINE, incluidos los inhibidores de cox2 selectivos.
Uso con clorhidrato de colesevalam: La administración concurrente del agente secuestrante del ácido biliar clorhidrato de colesevalam reduce la exposición sistémica y la concentración pico en plasma de Olmesartán. La administración de Olmesartán al menos 4 horas antes del clorhidrato de colesevalam disminuyó el efecto de interacción medicamentosa (ver Farmacología clínica).
Besilato de amlodipino
Uso concomitante que requiere precaución
• Inhibidores CYP3A4 (ejemplo: ketoconazol, itraconazol, ritonavir): Un estudio en pacientes ancianos mostró que diltiazem inhibe el metabolismo de Amlodipino, probablemente vía CYP3A4, ya que las concentraciones de Amlodipino en el plasma aumentaron aproximadamente 50% y por lo tanto su efecto aumentó. No se puede excluir la posibilidad de que inhibidores más potentes de CYP3A4 (ejemplo: ketoconazol, itraconazol, ritonavir) sean capaces de aumentar la concentración de Amlodipino en el plasma en mayor medida que diltiazem.
• Inductores CYP3A4 (ejemplo: anticonvulsivos [como carbamazepina, fenobarbital, fenitoina, fosfenitoina, primidona], rifampicina, hierba de San Juan [Hypericum perforatum]): la administración concomitante de CYP3A4 puede disminuir la concentración de Amlodipino en el plasma. Se recomienda el monitoreo clínico, con posible ajuste de la dosis de Amlodipino durante el tratamiento con un inductor de CYP3A4 y después de descontinuarlo.
• Simvastatina: La coadministración de múltiples dosis de 10 mg de Amlodipino con 80 mg de simvastatina dio como resultado un aumento del 77% en la exposición a la simvastatina en comparación con solo simvastatina. Limite la dosis de simvastatina a 20 mg diarios en pacientes tratados con Amlodipino.
DATOS PRECLÍNICOS DE SEGURIDAD
Carcinogenicidad, mutagénesis, deterioro de la fertilidad: El modo de acción anti-hipertensivo de Amlodipino (un efecto relajante directo en el músculo liso vascular) difiere del Olmesartán Medoxomil y es complementario al mismo (un antagonista de larga acción del receptor de angiotensina II). Además, con base en el perfil tóxico no-clínico de cada sustancia, no se espera exacerbación de las toxicidades de la combinación, porque cada sustancia tiene distintos blancos, i.e., los riñones en el caso de Olmesartán Medoxomil y el corazón en el caso de Amlodipino. Un estudio de toxicidad de dosis repetidas, de 3-meses en ratas demostró que la administración combinada de Olmesartán Medoxomil y Amlodipino no aumentó ninguna de las toxicidades reportadas previamente con los agentes individuales, ni indujo alguna nueva toxicidad, y no se observaron efectos toxicológicamente sinérgicos.
No se han realizado estudios adicionales de mutagenicidad, carcinogenicidad, y toxicidad reproductiva de OLMETECANLO® con base en el bien conocido perfil de seguridad de los componentes individuales.
ENSAYOS CLÍNICOS: El Estudio Clínico Aleatorizado de Olmesartán y Prevención de Diabetes microalbuminuria (ROADMAP por sus siglas en inglés) incluyó 4.447 pacientes con diabetes tipo 2, normoalbuminuria y al menos un factor de riesgo cardiovascular adicional. Los pacientes fueron asignados al azar a olmesartán 40 mg al día o placebo. El ensayo alcanzó su objetivo primario, retraso en la aparición de microalbuminuria. Para las variables secundarias, para las cuales el estudio no fue diseñado para evaluarlas formalmente, los eventos cardiovasculares ocurrieron en 96 pacientes (4,3%) con olmesartán y en 94 pacientes (4,2%) con placebo. La incidencia de la mortalidad cardiovascular fue mayor con olmesartán en comparación con el tratamiento con placebo (15 pacientes [0,67%] frente a 3 pacientes [0,14%] [HR = 4,94; IC del 95% = 1,43 - 17,06]), pero el riesgo de infarto de miocardio no fatal fue menor con olmesartán (HR 0,64, IC del 95%: 0,35-1,18).
Es posible que la información de prescripción de este producto haya sido revisada y actualizada después de la fecha de impresión del PLM 2016. Para obtener información más actualizada comuníquese con la Dirección Médica de Pfizer S.A.S Teléfono: (1) 6002300 Ext. 2509 Bogotá, D.C., Colombia.
ADVERTENCIAS Y PRECAUCIONES
Pacientes con hipovolemia o reducción drástica de sodio: Puede ocurrir hipotensión sintomática en pacientes con reducción drástica de volumen y/o de sodio debido a tratamiento diurético intenso, restricción de sal en la dieta, diarrea, o vómito, especialmente después de recibir la primera dosis. Se recomienda la corrección de esta condición antes de administrar OLMETECANLO®, o supervisión médica cercana al inicio del tratamiento.
Otras condiciones con estimulación del sistema renina-angiotensina-aldosterona: En pacientes cuyo tono vascular y función renal dependen predominantemente de la actividad del sistema renina-angiotensina-aldosterona (ejemplo: pacientes con insuficiencia cardiaca severa o enfermedad renal subyacente, incluyendo estenosis arterial renal), el tratamiento con otros productos médicos que afecten este sistema, como los antagonistas del receptor de angiotensina,II, ha sido asociado con hipotensión aguda, azotemia, oliguria, o raramente con insuficiencia renal aguda.
Hipertensión renovascular: Existe mayor riesgo de hipotensión severa e insuficiencia renal cuando los pacientes con estenosis arterial renal bilateral o estenosis de la arteria a un solo riñón funcional son tratados con productos medicinales que afectan el sistema renina-angiotensina-aldosterona.
Enteropatía tipo esprúe: Se ha informado diarrea severa, crónica con pérdida de peso sustancial en pacientes que toman Olmesartán Medoxomil, meses o años después del inicio del medicamento. Las biopsias intestinales de los pacientes a menudo demostraron atrofia vellositaria. Si un paciente desarrolla estos síntomas durante el tratamiento con Olmesartán Medoxomil, descarte otras etiologías. Considere interrumpir OLMETECANLO® en casos donde no se identifique otra etiología.
Insuficiencia renal y trasplante de riñón: No existe experiencia sobre la administración de OLMETECANLO® en pacientes con trasplante de riñón reciente o en pacientes con insuficiencia renal en etapa terminal (es decir, depuración de creatinina <12 mL/min).
Insuficiencia hepática: Debido a que Amlodipino es extensamente metabolizado por el hígado, la exposición a Amlodipino y Olmesartán Medoxomil aumenta en pacientes con insuficiencia hepática. Se debe tener cuidado al administrar OLMETECANLO® a pacientes con insuficiencia hepática leve a moderada. No se recomienda el uso de OLMETECANLO® en pacientes con insuficiencia hepática severa.
Enfermedad coronaria obstructiva severa: Igual que con todos los vasodilatadores, se debe tener precaución especial en pacientes que padecen estenosis de la válvula mitral o aórtica, o cardiomiopatía hipertrófica obstructiva.
DOSIFICACIÓN Y ADMINISTRACIÓN
Dosis común en adultos: La dosis recomendada de OLMETECANLO® es 1 tableta al día, con o sin alimento.
Por razones de conveniencia, los pacientes que toman Olmesartán Medoxomil y Amlodipino en tabletas separadas pueden cambiar a tabletas de OLMETECANLO® que contienen las mismas dosis del componente.
Cuando sea clínicamente apropiado, se puede considerar el cambio directo de la monoterapia a la combinación fija. Se recomienda el ajuste de la dosis por pasos.
En caso necesario, se puede agregar un diurético del grupo tiazida al tratamiento con OLMETECANLO®.
Ancianos: Generalmente no se requiere ajuste de la dosis recomendada en pacientes ancianos.
Insuficiencia renal: No se requiere ajustar la dosis recomendada en pacientes con insuficiencia renal leve a moderada. No se recomienda el uso de OLMETECANLO® en pacientes con disfunción renal severa (depuración de creatinina <20 mL/min).
Insuficiencia hepática: OLMETECANLO® debe ser usado con precaución en pacientes con disfunción hepática leve a moderada. No se recomienda el uso de OLMETECANLO® en pacientes con disfunción hepática severa.
Niños: No se recomienda el uso de OLMETECANLO® en niños y adolescentes menores de 18 años de edad, debido a falta de información sobre seguridad y eficiencia.
SOBREDOSIS
Síntomas: La dosis máxima de OLMETECANLO® es 40/10 mg una vez al día. No existe información acerca de sobredosis con OLMETECANLO® en humanos. El efecto más probable de la sobredosis de Olmesartán Medoxomil es hipotensión. Podemos esperar que la sobredosis de Amlodipino produzca vasodilatación periférica excesiva con hipotensión marcada y posiblemente taquicardia refleja. Se ha reportado hipotensión sistémica marcada y potencialmente prolongada, hasta e incluyendo choque con resultado fatal.
Tratamiento: En caso de sobredosis con OLMETECANLO®, se debe proporcionar tratamiento de soporte. Debido a que Amlodipino se une a proteínas con gran afinidad, es probable que la diálisis no brinde ningún beneficio. Se desconoce la dializabilidad de Olmesartán.
DESCRIPCION: OLMETECANLO® es una combinación de un receptor antagonista de angiotensina II (Olmesartán Medoxomil) y un bloqueador del canal de calcio (Amlodipino besilato).
Olmesartán Medoxomil, un profarmaco, es hidrolizado a Olmesartán durante la absorción del tracto gastrointestinal.
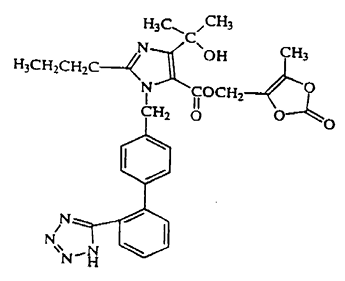
Olmesartán Medoxomil es descrito químicamente como 2,3-dihidroxi-2-butenil 4-(1-hidroxi-1-metiletil)-2-propil-1-[p-(o-1H-tetrazol-5-ilfenil)bencil]imidazol-5-carboxilato, 2,3-carbonato cíclico. Su fórmula empírica es C29H3N6O6.
La fórmula estructural de Olmesartán Medoxomil es:
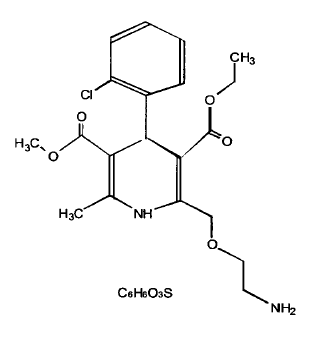
Amlodipino besilato se describe químicamente como 3-Etil-5-metil (+)-2-[(2-aminoetoxi)metil]-4-(2-clorofenil)-1,4-dihidro-6-metil-3,5-piridinedicarboxilato, monobencenosulfonato. Su fórmula empírica es C20H25CIN2O5•C6H6O3S.
La fórmula estructural de amlodipino besilato es:
PRESENTACIÓN: OLMETECANLO 20 mg/5 mg (Reg. San. INVIMA 2011M-0012216). OLMETECANLO 40 mg/10 mg (Reg. San. INVIMA 2011M-0011872). OLMETECANLO 40 mg/5 mg (Reg. San. INVIMA 2011M-0011974).
Titulo del documento: Olmesartán Medoxomil / Amlodipino besilato combinación
Fecha última revisión: Septiembre de 2013
Fecha efectiva: Octubre 15 de 2014
CDS versión: 7.0
LLD_Col_CDSv7.0_15Oct2014_v1.0_Cambio 1_CR Acta 05_2014
PFIZER S.A.S.