
PRADAXA
DABIGATRÁN
Cápsulas
Caja, 10, 30, 60 Cápsulas, 150 Miligramos
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN: 1 CÁPSULA contiene: 86,48 mg, 126,83 mg o 172,95 mg de beta-alanino, N-[[2-[[[4(hexiloxi)carbonil]amino]iminometil] fenil]amino]metil]-1-metil-1H-benzimidazol-5-il]carbonil]-N-2-piridinil-,etil éster, metano-sulfonato, como la sal del ácido metano sulfónico (correspondiente a la forma base de dabigatrán etexilato 75 mg, 110 mg o 150 mg)
USO EN POBLACIONES ESPECÍFICAS:
• Embarazo, lactancia y fertilidad:
Embarazo: No se dispone de datos clínicos sobre embarazos con exposición a este fármaco. Se desconoce cuál es el riesgo potencial para los seres humanos.
Las mujeres con capacidad para procrear deben evitar el embarazo durante el tratamiento con PRADAXA®; asimismo, las mujeres embarazadas no deben ser tratadas con PRADAXA® a menos que el beneficio esperado sea mayor que el riesgo.
Lactancia: No se dispone de datos clínicos. Como medida de precaución, debe suspenderse la lactancia.
Fertilidad: No existen datos clínicos disponibles. Los estudios preclínicos de reproducción en animales no indicaron ningún efecto adverso sobre la fertilidad ni sobre el desarrollo posnatal del neonato.
PROPIEDADES FARMACOLÓGICAS: Grupo farmacoterapéutico: Inhibidor directo de la trombina para administración por vía oral
Código ATC: B01AE07 - dabigatrán etexilato.
Modo de acción: El dabigatrán etexilato es un profármaco conformado por una molécula pequeña que no presenta actividad farmacológica. Luego de la administración por vía oral, el dabigatrán etexilato es rápidamente absorbido y convertido en dabigatrán mediante un mecanismo de hidrólisis catalizado por esterasas en el plasma y en el hígado. El dabigatrán es un inhibidor directo potente, competitivo y reversible de la trombina y constituye el principal principio activo en el plasma.
Farmacodinamia: Dado que la trombina (serina proteasa) hace posible la conversión del fibrinógeno en fibrina durante la cascada de coagulación, su inhibición impide la formación de trombos. El dabigatrán también inhibe la trombina libre, la trombina unida a fibrina y la agregación plaquetaria inducida por la trombina.
Los estudios en animales in vivo y ex vivo han demostrado la eficacia antitrombótica y la actividad anticoagulante del dabigatrán tras la administración intravenosa y del dabigatrán etexilato luego de la administración por vía oral en diversos modelos animales de trombosis.
Existe una estrecha correlación entre la concentración plasmática del dabigatrán y la magnitud del efecto anticoagulante.
Dabigatrán prolonga el aPTT, el ECT y el TT.
• Estudios clínicos:
Estudios clínicos en la prevención primaria de la TEV luego de una cirugía mayor de reemplazo articular: En 2 estudios aleatorizados, doble ciego, de grupos paralelos, de confirmación de dosis, a gran escala, pacientes que serían sometidos a una cirugía ortopédica mayor programada (en un caso, para una cirugía de reemplazo de rodilla; en el otro, para una cirugía de reemplazo de cadera) recibieron dabigatrán etexilato en dosis de 75 mg o 110 mg dentro de un lapso de 1-4 horas respecto de la cirugía, seguido de 150 mg o 220 mg una vez al día a partir de ese momento, luego de haberse asegurado la hemostasia, o bien recibieron enoxaparina 40 mg en el día previo a la cirugía, y a partir de ese momento en un régimen de una toma diaria.
En el estudio RE-MODEL (reemplazo de rodilla) el tratamiento se administró durante 6-10 días y en el estudio RE-NOVATE (reemplazo de cadera) el tratamiento tuvo una duración de 28-35 días. Un total de 2076 pacientes (rodilla) y 3494 pacientes (cadera), respectivamente, fueron tratados en dichos estudios.
Los resultados del estudio del uso de este fármaco en la cirugía de rodilla (RE-MODEL) en lo que respecta al criterio de valoración primario total, el cual incluye la tromboembolia venosa asintomática más la mortalidad por cualquier causa, indicaron que el efecto antitrombótico de ambas dosis de dabigatrán etexilato fue estadísticamente no inferior a aquel de la enoxaparina.
De la misma manera, el criterio de valoración TEV total, que incluye la TEV asintomática y la mortalidad por cualquier causa, constituyó el criterio de valoración primario para el estudio del uso del fármaco en la cirugía de cadera (RE-NOVATE). También en este caso, ambas dosis de dabigatrán etexilato en un régimen de una toma diaria fueron estadísticamente no inferiores a un régimen de enoxaparina de 40 mg diarios.
Asimismo, en un tercer estudio aleatorizado, doble ciego, de grupos paralelos (RE-MOBILIZE), pacientes sometidos a una cirugía programada de reemplazo total de rodilla recibieron dabigatrán etexilato 75 mg o 110 mg dentro de las 6-12 horas de la cirugía, seguido de dosis de 150 mg y 220 mg una vez al día a partir de ese momento. La duración del tratamiento fue de 12-15 días. En total, 2615 pacientes fueron aleatorizados y 2596 recibieron tratamiento. La posología de enoxaparina utilizada como comparador fue 30 mg dos veces al día según lo indicado en el rótulo para los Estados Unidos. En el estudio RE-MOBILIZE no fue posible establecer la no inferioridad del fármaco. No hubo ninguna diferencia estadísticamente significativa en términos de sangrado entre los comparadores.
Asimismo, dabigatrán se evaluó en un estudio aleatorizado, de grupos paralelos, doble ciego, de Fase II, comparativo con placebo, realizado en pacientes japoneses a los cuales se les administraron dosis de dabigatrán etexilato de 110 mg, 150 mg y 220 mg al día siguiente de la cirugía programada de reemplazo total de rodilla. Este estudio en pacientes japoneses demostró una clara relación dosis-respuesta para la eficacia del dabigatrán etexilato y un perfil de sangrado similar al del placebo.
En los estudios RE-MODEL y RE-NOVATE, la asignación aleatoria a la respectiva medicación del estudio fue realizada antes de la cirugía, y en el estudio RE-MOBILIZE y en el estudio comparativo con placebo realizado en pacientes japoneses, la asignación aleatoria de la respectiva medicación del estudio se realizó después de la cirugía. Esto es especialmente importante para la evaluación de la seguridad de estos estudios. Por ello, en la Tabla 8 los estudios se agrupan en estudios con aleatorización precirugía y estudios con aleatorización poscirugía.
Los datos del criterio de valoración conformado por TEV grave y mortalidad relacionada con TEV y sangrado importante adjudicado se presentan en la Tabla 8, a continuación. La TEV se definió como la tasa de incidencia compuesta de trombosis venosa profunda y embolia pulmonar.
|
Tabla 8. Análisis de los eventos de TEV grave y mortalidad relacionada con TEV producidos durante el período de tratamiento en los estudios de cirugía ortopédica RE-MODEL y RE-NOVATE |
|||
|
Estudio |
Dabigatrán etexilato 220 mg |
Dabigatrán etexilato 150 mg |
Enoxaparina 40 mg |
|
RE-NOVATE (cadera)1 |
|||
|
N |
909 |
888 |
917 |
|
Incidencias (%) |
28 (3,1) |
38 (4,3) |
36 (3,9) |
|
Diferencias de riesgo frente a la enoxaparina (%) |
- 0,8 |
0,4 |
|
|
IC 95 % |
-2,5; 0,8 |
-1,5; 2,2 |
|
|
Cociente de riesgo frente a la enoxaparina |
0,78 |
1,09 |
|
|
IC 95 % |
0,48; 1,27 |
0,70; 1,70 |
|
|
RE-MODEL (rodilla)1 |
|||
|
N |
506 |
527 |
511 |
|
Incidencias (%) |
13 (2,6) |
20 (3,8) |
18 (3,5) |
|
Diferencias de riesgo frente a la enoxaparina (%) |
-1,0 |
0,3 |
|
|
IC 95 % |
-3,1; 1,2 |
-2,0; 2,6 |
|
|
Cociente de riesgo frente a la enoxaparina |
0,73 |
1,08 |
|
|
IC 95 % |
0,36; 1,47 |
0,58; 2,01 |
|
|
RE-MOBILIZE (rodilla)2 |
Enoxaparina 60 mg |
||
|
N |
618 |
656 |
668 |
|
Incidencias (%) |
21 (3,4) |
20 (3,0) |
15 (2,2) |
|
Diferencias de riesgo frente a la enoxaparina (%) |
1,2 |
0,8 |
|
|
IC 95 % |
(-0,7; 3,0) |
(-0,9; 2,5) |
|
|
Cociente de riesgo frente a la enoxaparina |
1,51 |
1,36 |
|
|
IC 95 % |
(0,79; 2,91) |
(0,70; 2,63) |
|
|
Estudio en pacientes japoneses sometidos a cirugía de rodilla2 |
|||
|
Placebo |
|||
|
N |
102 |
113 |
104 |
|
Incidencias (%) |
0 |
2 (1,8) |
6 (5,8) |
|
Diferencias de riesgo frente al placebo (%) |
-5,8 |
-4,0 |
|
|
IC 95 % |
(-10,3; -1,3) |
(-9,1; 1,1) |
|
|
1 Estudios con aleatorización previa a la intervención quirúrgica 2 Estudios con aleatorización posterior a la intervención quirúrgica |
|||
Estudios clínicos en la prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: La evidencia clínica de la eficacia de dabigatrán etexilato se obtuvo a partir del estudio RE-LY (Randomized Evaluation of Long-term anticoagulant therapy; Evaluación aleatorizada de la terapia anticoagulante prolongada), un estudio multicéntrico, multinacional, aleatorizado, de grupos paralelos, de dos dosis de dabigatrán etexilato administradas en un régimen con cegamiento (110 mg dos veces al día y 150 mg dos veces al día) en comparación con un régimen de diseño abierto de warfarina en pacientes con fibrilación auricular con riesgo moderado a alto de accidente cerebrovascular o embolia sistémica. El objetivo principal de este estudio fue determinar si el dabigatrán etexilato era no inferior a la warfarina en la reducción de la ocurrencia del criterio de valoración compuesto de accidente cerebrovascular y eventos embólicos sistémicos (EES).
En el estudio RE-LY, se aleatorizó un total de 18 113 pacientes, con una edad promedio de 71,5 años y un valor medio de puntaje de CHADS2 de 2,1. La población estuvo conformada por partes aproximadamente iguales de pacientes con puntaje CHADS2 de 1, pacientes con puntaje CHADS2 de 2 y pacientes con puntaje CHADS2 ≥3. La población de pacientes estuvo conformada en un 64 % por pacientes de sexo masculino, en un 70 % por pacientes caucásicos y en un 16 % por pacientes asiáticos. La mediana de la duración del tratamiento en el estudio RE-LY fue de 20 meses, con dabigatrán etexilato administrado como una dosis fija sin monitoreo de la coagulación. Además de la fibrilación auricular (FA) no valvular documentada, p. ej. FA persistente o paroxística, los pacientes tenían uno de los siguientes factores de riesgo de accidente cerebrovascular adicionales:
— Evento previo de accidente cerebrovascular, accidente isquémico transitorio o embolia sistémica.
— Fracción de eyección ventricular izquierda <40%
— Insuficiencia cardíaca sintomática, ≥ Clase 2 de la NYHA
— Edad ≥75 años
— Edad ≥65 años asociada con uno de los siguientes factores: Diabetes mellitus, enfermedad coronaria o hipertensión.
Las enfermedades concomitantes de los pacientes de este estudio incluyeron hipertensión arterial (79 %), diabetes (23 %) y enfermedad coronaria (EC) (28 %). El 50 % de la población de pacientes era virgen de tratamiento previo con antagonistas de la vitamina K (AVK), definido como un total de menos de 2 meses de exposición en su lapso vital. El 32 % de la población nunca había estado expuesta a un AVK. En el caso de los pacientes aleatorizados a warfarina, el tiempo en el rango terapéutico (RIN 2,0 a 3,0) para el estudio fue una mediana de 67 %. Las medicaciones concomitantes incluyeron AAS (el 25 % de los sujetos la usaron por lo menos el 50 % del tiempo durante el estudio), clopidogrel (3,6 %), AAS + clopidogrel (2 %), AINE (6,3 %), betabloqueantes (63,4 %), diuréticos (53,9 %), estatinas (46,4 %), inhibidores de la ECA (44,6 %), bloqueadores de los receptores de angiotensina (26,1 %), hipoglucemiantes orales (17,5 %), insulina (5,2 %), digoxina (29,4 %), amiodarona (11,3 %), diltiazem (8,9 %), verapamilo (5,4 %) e inhibidores de la bomba de protones (17,8 %). Para el criterio de valoración primario, accidente cerebrovascular y embolia sistémica, no se identificó ningún subgrupo (p. ej., edad, peso, sexo, función renal, origen étnico, etc.) que tuviera un cociente de riesgo diferente en comparación con la warfarina. Este estudio demostró que el dabigatrán etexilato, en una dosis de 110 mg dos veces al día, es no inferior a la warfarina en la prevención del accidente cerebrovascular y la embolia sistémica en sujetos con fibrilación auricular, con un riesgo reducido de hemorragia intracraneana y sangrado total. La dosis más alta, de 150 mg, administrada dos veces al día reduce significativamente el riesgo de accidente cerebrovascular isquémico y hemorrágico, muerte vascular, hemorragia intracraneana y sangrado total en comparación con la warfarina. La dosis más baja de dabigatrán tiene un riesgo significativamente más bajo de sangrado importante en comparación con la warfarina.
En la Figura 1 y en las Tablas 9-13 se presentan datos de los resultados clave:
|
Tabla 9. Análisis de la primera ocurrencia de accidente cerebrovascular o EES (criterio de valoración primario) durante el período del estudio en el ensayo RE-LY (conjunto de sujetos aleatorizados) |
||||
|
Dabigatrán etexilato 150 mg dos veces al día |
Dabigatrán etexilato 110 mg dos veces al día |
Warfarina |
||
|
Sujetos aleatorizados |
6076 |
6015 |
6022 |
|
|
Accidente cerebrovascular y/o EES |
||||
|
Incidencias (%) |
135 (1,12) |
183 (1,54) |
203 (1,72) |
|
|
Razón de riesgo frente a la warfarina (IC 95 %) |
0,65 (0,52; 0,81) |
0,89 (0,73; 1,09) |
||
|
Superioridad, valor p |
p = 0,0001 |
p = 0,2721 |
||
|
El % se refiere a la tasa de eventos anual |
||||
Figura 1. Estimación de la curva de Kaplan-Meier del tiempo hasta el primer evento de accidente cerebrovascular o embolia sistémica
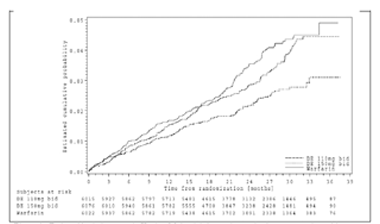
|
Tabla 10. Análisis de primera ocurrencia de accidente cerebrovascular isquémico o hemorrágico durante el período del estudio en el ensayo RE-LY (conjunto de sujetos aleatorizados) |
||||
|
Dabigatrán etexilato 150 mg dos veces al día |
Dabigatrán etexilato 110 mg dos veces al día |
Warfarina |
||
|
Sujetos aleatorizados |
6076 |
6015 |
6022 |
|
|
Accidente cerebrovascular |
||||
|
Incidencias (%) |
123 (1,02) |
171 (1,44) |
187 (1,59) |
|
|
Razón de riesgo frente a la warfarina (IC 95 %) |
0,64 (0,51; 0,81) |
0,91 (0,74; 1,12) |
||
|
Valor p |
0,0001 |
0,3553 |
||
|
EES |
||||
|
Incidencias (%) |
13 (0,11) |
15 (0,13) |
21 (0,18) |
|
|
Razón de riesgo frente a la warfarina (IC 95 %) |
0,61 (0,30; 1,21) |
0,71 (0,37; 1,38) |
||
|
Valor p |
0,1582 |
0,3099 |
||
|
Accidente cerebrovascular isquémico |
||||
|
Incidencias (%) |
104 (0,86) |
152 (1,28) |
134 (1,14) |
|
|
Razón de riesgo frente a la warfarina (IC 95 %) |
0,76 (0,59; 0,98) |
1,13 (0,89; 1,42) |
||
|
Valor p |
0,0351 |
0,3138 |
||
|
Accidente cerebrovascular hemorrágico |
||||
|
Incidencias (%) |
12 (0,10) |
14 (0,12) |
45 (0,38) |
|
|
Razón de riesgo frente a la warfarina (IC 95 %) |
0,26 (0,14; 0,49) |
0,31 (0,17; 0,56) |
||
|
Valor p |
< 0,0001 |
0,0001 |
||
|
El % se refiere a la tasa de eventos anual |
||||
|
Tabla 11. Análisis de sobrevida de los eventos cardiovasculares y todas las causas durante el período de estudio en el ensayo RE-LY (conjunto de sujetos aleatorizados) |
||||
|
Dabigatrán etexilato 150 mg dos veces al día |
Dabigatrán etexilato 110 mg dos veces al día |
Warfarina |
||
|
Sujetos aleatorizados |
6076 |
6015 |
6022 |
|
|
Mortalidad por todas las causas |
||||
|
Incidencias (%) |
438 (3,64) |
446 (3,75) |
487 (4,13) |
|
|
Razón de riesgo frente a la warfarina (IC 95 %) |
0,88 (0,77; 1,00) |
0,91 (0,80; 1,03) |
||
|
Valor p |
0,0517 |
0,1308 |
||
|
Mortalidad vascular |
||||
|
Incidencias (%) |
274 (2,28) |
289 (2,43) |
317 (2,69) |
|
|
Razón de riesgo frente a la warfarina (IC 95 %) |
0,85 (0,72; 0,99) |
0,90 (0,77; 1,06) |
||
|
Valor p |
0,0430 |
0,2081 |
||
|
El % se refiere a la tasa de eventos anual. |
||||
Se evaluó el beneficio clínico neto (BCN) medido por el criterio de valoración clínico compuesto no ponderado de accidente cerebrovascular, embolia sistémica, embolia pulmonar, infarto agudo de miocardio, muertes por causa vascular y sangrados importantes; el BCN se presenta como parte de la Tabla 12. Las tasas de eventos anuales para los grupos de dabigatrán etexilato fueron más bajas en comparación con el grupo de warfarina. La reducción del riesgo para este criterio de valoración compuesto fue del 8 % y del 10 % para los grupos de tratamiento con dabigatrán etexilato 110 mg dos veces al día y 150 mg dos veces al día, respectivamente. Otros componentes evaluados incluyeron todas las hospitalizaciones, las cuales se produjeron en un número significativamente menor desde el punto de vista estadístico con dabigatrán etexilato 110 mg dos veces al día en comparación con la warfarina (reducción de riesgo del 7 %; IC 95 % 0,87; 0,99, p = 0,021).
|
Tabla 12. Otros parámetros evaluados |
||||
|
Dabigatrán etexilato 150 mg dos veces al día |
Dabigatrán etexilato 110 mg dos veces al día |
Warfarina |
||
|
Sujetos aleatorizados |
6076 |
6015 |
6022 |
|
|
Accidente cerebrovascular/EES/muerte |
||||
|
Incidencias (%) |
520 (4,32) |
577 (4,85) |
613 (5,20) |
|
|
Razón de riesgo frente a la warfarina (IC 95 %) |
0,83 (0,74; 0,93) |
0,93 (0,83; 1,04) |
||
|
Valor p |
0,0015 |
0,2206 |
||
|
Accidente cerebrovascular / EES/EP/IM/muerte / sangrado importante (BCN) |
||||
|
Incidencias (%) |
850 (7,06) |
863 (7,25) |
925 (7,84) |
|
|
Razón de riesgo frente a la warfarina (IC 95 %) |
0,90 (0,82; 0,99) |
0,92 (0,84; 1,01) |
||
|
Valor p |
0,0287 |
0,0849 |
||
|
Embolia pulmonar |
||||
|
Incidencias (%) |
18 (0,15) |
14 (0,12) |
12 (0,10) |
|
|
Razón de riesgo frente a la warfarina (IC 95 %) |
1,41 (0,71; 3,06) |
1,16 (0,54; 2,51) |
||
|
Valor p |
0,2980 |
0,7076 |
||
|
Infarto de miocardio (incl. infarto silencioso) |
||||
|
Incidencias (%) |
97 (0,81) |
98 (0,82) |
75 (0,64) |
|
|
Razón de riesgo frente a la warfarina (IC 95 %) |
1,27 (0,94; 1,71) |
1,29 (0,96; 1,75) |
||
|
Valor p |
0,1240 |
0,0929 |
||
|
Tabla 13. Pruebas de función hepática |
|||
|
En el estudio RE-LY se produjeron potenciales anormalidades de las pruebas de función hepática (PFH), con una incidencia comparable o más baja en los pacientes tratados con dabigatrán etexilato que en los pacientes tratados con warfarina. |
|||
|
Dabigatrán etexilato 150 mg dos veces al día N (%) |
Dabigatrán etexilato 110 mg dos veces al día N (%) |
Warfarina N (%) |
|
|
Total de pacientes tratados |
6059 (100,0) |
5983 (100,0) |
5998 (100,0) |
|
ALT o AST > 3 veces el LNS |
106 (1,7) |
118 (2,0) |
125 (2,1) |
|
ALT o AST > 5 veces el LNS |
45 (0,7) |
36 (0,6) |
50 (0,8) |
|
ALT o AST > 3 veces el LNS + Bilirrubina > 2 veces el LNS |
14 (0,2) |
11 (0,2) |
21 (0,4) |
El estudio de extensión del estudio RE-LY (RELY-ABLE) proporcionó información adicional sobre seguridad para una gran cohorte de pacientes que continuaron con la misma dosis de dabigatrán etexilato que la asignada en el ensayo RE-LY. Los pacientes fueron elegibles para el ensayo RELY-ABLE si no habían interrumpido de forma permanente la medicación del estudio al momento de la visita final del estudio RE-LY. Los pacientes enrolados continuaron recibiendo la misma dosis de dabigatrán etexilato que se les había asignado aleatoriamente y a doble ciego en el estudio RE-LY, por hasta 43 meses de seguimiento luego del estudio RE-LY (seguimiento total medio RE-LY + RELY-ABLE de 4,5 años). Se enrolaron 5897 pacientes, que representan el 49 % de los pacientes originalmente aleatorizados a recibir dabigatrán etexilato en el estudio RE-LY y el 86 % de los pacientes elegibles para el estudio RELY-ABLE.
Durante los 2,5 años de tratamiento adicional en el estudio RELY-ABLE, con una exposición máxima de más de 6 años (exposición total RELY + RELY-ABLE), el perfil de seguridad a largo plazo de dabigatrán etexilato fue confirmado para ambas dosis estudiadas. No se observaron nuevos hallazgos de seguridad.
Las tasas de los eventos correspondientes a los criterios de valoración, incluidos sangrado importante y otros eventos de sangrado, concordaron con las observadas en el estudio RE-LY.
Además del estudio RE-LY, un estudio no intervencionista internacional (GLORIA-AF), recopiló prospectivamente (en su segunda fase) datos de seguridad y eficacia en pacientes con diagnóstico reciente de fibrilación auricular no valvular tratados con dabigatrán etexilato en un entorno real. El estudio incluyó 4859 pacientes tratados con dabigatrán etexilato (dosificación según la práctica clínica local y el rótulo local; 55 % tratados con 150 mg 2 veces al día, 43 % tratados con 110 mg dos veces al día, 2 % tratados con 75 mg dos veces al día). A los pacientes se les hizo un seguimiento durante 2 años. Los valores medios de los puntajes CHADS2 y HAS-BLED fueron 1,9 y 1,2, respectivamente, en comparación con un valor medio de los puntajes CHADS2 y HAS-BLED de 2,1 y 1,3 en el estudio RE-LY, respectivamente. El tiempo promedio de seguimiento durante el tratamiento fue de 18,3 meses. Se produjo sangrado importante en 0,97 por 100 pacientes-año. Se informó sangrado potencialmente fatal en 0,46 por 100 pacientes-año, hemorragia intracraneana en 0,17 por 100 pacientes-año, y sangrado gastrointestinal en 0,60 por 100 pacientes-año. Se presentó accidente cerebrovascular en 0,65 por 100 pacientes-año. Asimismo, en un estudio no intervencionista realizado en más de 134 000 pacientes de edad avanzada con fibrilación auricular no valvular en los Estados Unidos (que aportó más de 37 500 pacientes-año de tiempo de seguimiento durante el tratamiento) se asoció al dabigatrán etexilato (84 % de pacientes tratados con 150 mg dos veces al día, 16 % de pacientes tratados con 75 mg dos veces al día) con una reducción estadísticamente significativa del riesgo de accidente cerebrovascular isquémico (cociente de riesgo 0,80; intervalo de confianza del 95 % [IC] 0,67 - 0,96), de hemorragia intracraneana (cociente de riesgo 0,34; IC 0,26 - 0,46) y de mortalidad (cociente de riesgo 0,86; IC 0,77 - 0,96), y con un aumento del riesgo de sangrado gastrointestinal (cociente de riesgo 1,28; IC 1,14 - 1,44) en comparación con la warfarina. No se observó una diferencia significativa en el caso de sangrado importante (cociente de riesgo 0,97; IC 0,88 - 1,07).
Estas observaciones en entornos reales resultan compatibles con el perfil de seguridad y eficacia establecido para el dabigatrán etexilato en esta indicación.
Manejo de síntomas gastrointestinales: En un estudio exploratorio se evaluó la eficacia de dos estrategias de manejo de síntomas gastrointestinales (SGI): la administración de PRADAXA® dentro de los 30 minutos posteriores a una de las comidas principales y el agregado de pantoprazol en un régimen de 40 mg diarios.
En total, n = 1067 pacientes tratados con PRADAXA® ingresaron en el estudio; 117 pacientes desarrollaron SGI y fueron aleatorizados a uno de los dos tratamientos.
Ambas estrategias de manejo iniciales (la administración de PRADAXA® luego de una comida y el agregado de pantoprazol 40 mg diarios) brindaron un alivio completo de los SGI primarios en más del 55 % de los pacientes que informaron SGI (administración de PRADAXA® después de una comida: 55,9 %; pantoprazol: 67,2 %).
Como estrategia individual de manejo de los SGI, el agregado de pantoprazol en un régimen de 40 mg diarios permitió una completa resolución de los síntomas en el 67,2 % de los pacientes luego de 4 semanas de tratamiento, en tanto que la administración de PRADAXA® tras una de las comidas principales se tradujo en la resolución completa de los síntomas en el 55,9 % de los pacientes. Luego de 1 semana de tratamiento, se logró una completa resolución de los síntomas en el 51,7 % de los pacientes que recibieron pantoprazol frente a un 39,0 % en el caso de los pacientes que tomaron PRADAXA® luego de una comida.
En los pacientes que al finalizar las 4 semanas no tenían una respuesta completa a la estrategia inicial debía implementarse además una estrategia alternativa (= estrategias combinadas) durante 4 semanas más.
Se informó una efectividad completa o parcial luego de 4 semanas de las estrategias de manejo combinadas (8 semanas, tratamiento total) en 12 de 14 (85,7 %) pacientes que tomaron PRADAXA® después de una comida en la primera parte del estudio y en 12 de 15 (80,0 %) pacientes que tomaron pantoprazol en la primera parte del estudio.
Últimamente, 92 (78.6%) pacientes (79 con efectividad completa y 13 con efectividad parcial) experimentaron resultados positivos usando las dos estrategias de manejo GIS, 45 en el grupo de PRADAXA® después de una comida (39 efectividad completa + 6 efectividad parcial) y 47 en el grupo pantoprazol (40 efectividad completa + 7 efectividad parcial).
Pacientes sometidos a ablación con catéter de la fibrilación auricular: Se llevó a cabo un estudio exploratorio, aleatorizado, prospectivo, abierto, multicéntrico con adjudicación central y ciega de los criterios de valoración (RE-CIRCUIT) en 704 pacientes que estaban bajo tratamiento anticoagulante estable. En el estudio se compararon 150 mg de dabigatrán etexilato ininterrumpido administrado dos veces al día con warfarina ajustada según RIN ininterrumpida en la ablación con catéter de la fibrilación auricular persistente o paroxística. De los 704 pacientes enrolados, 317 fueron sometidos a ablación de la fibrilación auricular sin interrumpir el tratamiento con dabigatrán y 318 fueron sometidos a ablación de la fibrilación auricular sin interrumpir el tratamiento con warfarina. A todos los pacientes se les realizó una ecocardiografía transesofágica (ETE) antes de la ablación con catéter. El criterio de valoración primario (sangrado importante adjudicado de acuerdo con el criterio de la ISTH) se presentó en 5 (1,6 %) pacientes del grupo de dabigatrán etexilato y en 22 (6,9 %) pacientes del grupo de warfarina (diferencia de riesgo -5,3 %; IC 95 % -8,4, -2,2; P=0,0009). No hubo ningún evento de accidente cerebrovascular/embolia sistémica/ataque isquémico transitorio (AIT) (criterio de valoración compuesto) en el grupo de dabigatrán etexilato, y hubo un evento (AIT) en el grupo de warfarina desde el momento de la ablación y hasta 8 semanas postablación. La tasa de incidencia compuesta de MBE y de eventos de tromboembolia (accidente cerebrovascular/embolia sistémica/AIT) fue menor en el grupo de dabigatrán etexilato (5 [1,6 %] versus 23 [7,2 %] pacientes). En este estudio exploratorio quedó demostrado que el dabigatrán etexilato estuvo asociado con una reducción significativa desde el punto de vista estadístico y clínicamente relevante de la tasa de MBE en comparación con la warfarina ajustada según RIN, y no hubo diferencias en la incidencia de accidente cerebrovascular o de embolia sistémica en el contexto de la ablación.
Pacientes que fueron sometidos a una intervención coronaria percutánea con colocación de stent: Se llevó a cabo un estudio aleatorizado, prospectivo, abierto con adjudicación ciega de los criterios de valoración (PROBE) (Fase IIIb) para evaluar el tratamiento doble con dabigatrán etexilato (110 mg o 150 mg dos veces al día) más clopidogrel o ticagrelor (antagonista del receptor P2Y12) versus el tratamiento triple con warfarina (ajustada a un RIN de 2,0 - 3,0) más clopidogrel o ticagrelor y aspirina en 2725 pacientes con fibrilación auricular no valvular sometidos a una ICP con colocación de stent (ICP RE-DUAL). Los pacientes fueron aleatorizados al tratamiento doble con dabigatrán etexilato 110 mg 2 veces al día, al tratamiento doble con dabigatrán etexilato 150 mg 2 veces al día o al tratamiento triple con warfarina. Los pacientes de edad avanzada que viven fuera de los Estados Unidos (≥80 años en todos los países, ≥70 años en Japón) fueron aleatorizados al grupo de tratamiento doble con dabigatrán etexilato 110 mg o al grupo de tratamiento triple con warfarina. El desenlace primario consistió en una combinación de sangrado mayor según la definición de la ISTH o en un evento de sangrado no mayor, pero clínicamente relevante.
La incidencia del desenlace primario ocurrió en el 15,4 % (151 pacientes) en el grupo de tratamiento doble con dabigatrán etexilato 110 mg en comparación con 26,9 % (264 pacientes) en el grupo de tratamiento triple con warfarina (HR 0,52; IC 95 % 0,42; 0,63; P<0,0001 para la no inferioridad y P<0,0001 para la superioridad) y de 20,2 % (154 pacientes) en el grupo de tratamiento doble con dabigatrán etexilato 150 mg en comparación con 25,7 % (196 pacientes) en el correspondiente grupo de tratamiento triple con warfarina (HR 0,72; IC 95 % 0,58; 0,88; P<0,0001 para la no inferioridad y P=0,002 para la superioridad). Como parte del análisis descriptivo, los eventos de sangrado mayor de la clasificación del grupo de trombólisis en el infarto de miocardio (Thrombolysis In Myocardial Infarction, TIMI) fueron menores en ambos grupos de tratamiento doble con dabigatrán etexilato que en el grupo de tratamiento triple con warfarina: 14 eventos (1,4 %) en el grupo de tratamiento doble con dabigatrán etexilato 110 mg en comparación con 37 eventos (3,8 %) en el grupo de tratamiento triple con warfarina (HR 0,37; IC 95 % 0,20; 0,68; P=0,002) y 16 eventos (2,1 %) en el grupo de tratamiento doble con dabigatrán etexilato 150 mg en comparación con 30 eventos (3,9 %) en el correspondiente grupo de tratamiento triple con warfarina (HR 0,51; IC 95 % 0,28; 0,93; P=0,03). Ambos grupos de tratamiento doble con dabigatrán etexilato presentaron tasas de hemorragia intracraneana menores que las del correspondiente grupo de tratamiento triple con warfarina: 3 eventos (0,3 %) en el grupo de tratamiento doble con dabigatrán etexilato 110 mg en comparación con 10 eventos (1,0 %) en el grupo de tratamiento triple con warfarina (HR 0,30; IC 95 % 0,08; 1,07; P=0,06) y 1 evento (0,1 %) en el grupo de tratamiento doble con dabigatrán etexilato 150 mg en comparación con 8 eventos (1,0 %) en el correspondiente grupo de tratamiento triple con warfarina (HR 0,12; IC 95 % 0,02; 0,98; P=0,047). La incidencia del desenlace de eficacia compuesto de muerte, eventos tromboembólicos (infarto de miocardio, accidente cerebrovascular o embolia sistémica) o revascularización no planificada en los dos grupos de tratamiento doble con dabigatrán etexilato combinados fue no inferior a la del grupo de tratamiento triple con warfarina (13,7 % versus 13,4 % respectivamente; HR 1,04; IC 95 %: 0,84; 1,29; P=0,0047 para la no inferioridad). No hubo diferencias estadísticas en los componentes individuales del desenlace de eficacia entre cualquiera de los grupos de tratamiento doble con dabigatrán etexilato y el tratamiento triple con warfarina.
En este estudio quedó demostrado que el tratamiento doble con dabigatrán etexilato y un antagonista del receptor P2Y12 redujo significativamente el riesgo de sangrado versus el tratamiento triple con warfarina, y fue no inferior para el desenlace compuesto de eventos tromboembólicos, en pacientes con fibrilación auricular sometidos a una ICP con colocación de stent.
Estudios clínicos en la prevención de la tromboembolia en pacientes con válvulas cardíacas protésicas: Se llevó a cabo un estudio de fase II en el cual se examinaron el dabigatrán etexilato y la warfarina en un total de 252 pacientes con una cirugía de reemplazo de válvula cardíaca mecánica reciente (es decir, dentro de la internación hospitalaria en curso) y en pacientes que recibieron un reemplazo de válvula cardíaca mecánica más de tres meses atrás. Se observó un desequilibrio en los eventos de sangrado tromboembólicos y totales (principalmente menores) en contra de dabigatrán etexilato en este estudio. En los pacientes que se encontraban en la fase posoperatoria temprana, los sangrados importantes se presentaron mayormente como derrames pericárdicos hemorrágicos, específicamente en pacientes que comenzaron a recibir dabigatrán etexilato en forma temprana (es decir, el Día 3) luego de la cirugía de reemplazo de válvula cardíaca.
Estudios clínicos en el tratamiento de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) aguda: La evidencia clínica obtenida a partir de dos estudios multicéntricos, aleatorizados, doble ciego, de grupos paralelos, replicados, RE-COVER y RE-COVER II, ha demostrado que dabigatrán etexilato es un tratamiento seguro y eficaz para la TVP y/o la EP. En estos estudios se comparó dabigatrán etexilato (150 mg dos veces al día) con warfarina (valor objetivo de RIN 2,0-3,0) en pacientes con TVP y/o EP aguda. El objetivo primario de estos estudios fue determinar si dabigatrán era no inferior a la warfarina en la reducción de la ocurrencia del criterio de valoración primario, que fue el criterio de valoración compuesto de TVP y/o EP sintomática recurrente y muertes relacionadas dentro del período de tratamiento agudo de 6 meses.
En los estudios RE-COVER y RE-COVER II combinados, un total de 5153 pacientes fueron aleatorizados y 5107 de ellos recibieron tratamiento. Los eventos índice en el nivel basal fueron: TVP -68,5 %, EP -22,2 %, EP y TVP -9,1 %. Los factores de riesgo más frecuentes fueron antecedentes de TVP y/o EP -21,5 %, cirugía/traumatismo -18,1 %, insuficiencia venosa -17,6 % e inmovilización prolongada -14,6 %. Las características basales de los pacientes fueron: media de edad 54,8 años, sexo masculino 59,5 %, raza caucásica 86,1 %, raza asiática 11,8 %, raza negra 2,1 %. Las comorbilidades incluyeron: hipertensión 35,5 %, diabetes mellitus 9,0 %, EC 6,8 % y úlcera gástrica o duodenal 4,1 %.
La duración del tratamiento con la dosis fija de dabigatrán fue 174,0 días sin monitoreo de la coagulación. En el caso de los pacientes aleatorizados a warfarina, la mediana del tiempo dentro del rango terapéutico (RIN 2,0 a 3,0) fue 60,6 %. Los medicamentos concomitantes incluyeron vasodilatadores 28,5 %, reguladores del sistema renina-angiotensina 24,7 %, hipolipemiantes 19,1 %, betabloqueantes 14,8 %, bloqueadores del canal de calcio 9,7 %, AINE 21,7 %, aspirina 9,2 %, antiplaquetarios 0,7 %, inhibidores de la P-gp 2,0 % (verapamilo -1,2 % y amiodarona -0,4 %).
Dos estudios en pacientes con TVP y/o EP aguda tratados inicialmente durante un mínimo de 5 días con tratamiento parenteral, el estudio RE-COVER y el estudio RE-COVER II, demostraron que el tratamiento con dabigatrán etexilato administrado en dosis de 150 mg dos veces al día era no inferior al tratamiento con warfarina (valores p para la no inferioridad: RE-COVER p < 0,0001, RE-COVER II p = 0,0002). Los eventos de sangrado (MBE, MBE/CRBE y sangrado de cualquier tipo) fueron significativamente más bajos en los pacientes que recibieron dabigatrán etexilato 150 mg dos veces al día en comparación con aquellos que recibieron warfarina.
Figura 2. Tiempo hasta el primer evento adjudicado de TEV y muerte relacionada con TEV hasta el fin del período postratamiento para el conjunto de datos combinados de RE-COVER y RE-COVER II
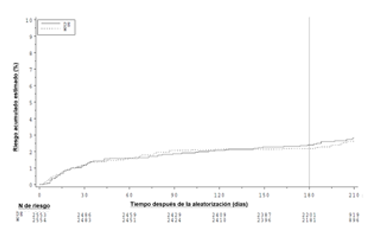
|
Tabla 14. Análisis de los criterios de valoración de eficacia primarios y secundarios (TEV es un criterio de valoración compuesto de TVP y/o EP) hasta el fin del período postratamiento para los estudios RE-COVER y RE-COVER II combinados |
||
|
Dabigatrán etexilato 150 mg |
Warfarina |
|
|
RE-COVER/RE-COVER II combinados |
||
|
Pacientes, n (%) |
2553 (100,0) |
2554 (100,0) |
|
TEV sintomática recurrente y muerte relacionada con TEV |
68 (2,7) |
62 (2,4) |
|
Razón de riesgo versus warfarina |
1,09 |
|
|
IC 95 % |
(0,77; 1,54) |
|
|
Criterios de valoración de eficacia secundarios |
||
|
TEV sintomática recurrente y muertes por todas las causas |
109 (4,3) |
104 (4,1) |
|
IC 95 % |
3,52; 5,13 |
3,34; 4,91 |
|
TVP sintomática |
45 (1,8) |
39 (1,5) |
|
IC 95 % |
1,29; 2,35 |
1,09; 2,08 |
|
EP sintomática |
27 (1,1) |
26 (1,0) |
|
IC 95 % |
0,70; 1,54 |
0,67; 1,49 |
|
Muertes relacionadas con TEV |
4 (0,2) |
3 (0,1) |
|
IC 95 % |
0,04; 0,40 |
0,02; 0,34 |
|
Muertes por todas las causas |
51 (2,0) |
52 (2,0) |
|
IC 95 % |
1,49; 2,62 |
1,52; 2,66 |
• Otros parámetros evaluados:
Alternativo a la Warfarina en el tratamiento de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) aguda: El infarto de miocardio se produjo con una frecuencia baja en los cuatro estudios de TEV en todos los grupos de tratamiento. La muerte de origen cardíaco se produjo en un paciente del grupo de tratamiento con warfarina.
En los tres estudios con control activo, se informó una mayor incidencia de infarto de miocardio en los pacientes que recibieron dabigatrán etexilato (20; 0,5 %) que en aquellos que recibieron warfarina (5; 0,1 %).
En el estudio RE-SONATE, en el cual se comparó el dabigatrán etexilato frente a un placebo, hubo 1 evento de infarto de miocardio en cada uno de los grupos de tratamiento, lo cual dio lugar a tasas de infarto de miocardio con dabigatrán iguales a las observadas con el placebo.
• Pruebas de función hepática:
Alternativo a la Warfarina en el tratamiento de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) aguda: En los estudios con control activo RE-COVER, RE-COVER II y RE-MEDY se produjeron potenciales anormalidades de las pruebas de función hepática (PFH), con una incidencia comparable o más baja en los pacientes tratados con dabigatrán etexilato que en los pacientes tratados con warfarina. En el estudio RE-SONATE, no hubo ninguna diferencia marcada entre los grupos de dabigatrán y de placebo en lo que respecta a valores de PFH anormales posiblemente significativos desde el punto de vista clínico.
Estudios clínicos en la prevención de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) recurrente: La evidencia clínica ha demostrado que el dabigatrán etexilato es un tratamiento seguro y eficaz para la TVP y/o la EP recurrente. Se llevaron a cabo dos estudios aleatorizados, de grupos paralelos, doble ciego, en pacientes previamente tratados con terapia anticoagulante. En el estudio RE-MEDY, un estudio con control de warfarina, se enrolaron pacientes que ya habían sido tratados durante un lapso de 3 a 12 meses y que necesitaban continuar con el tratamiento anticoagulante, y en el estudio RE-SONATE, un estudio con control de placebo, se enrolaron pacientes que ya habían sido tratados durante 6 a 18 meses con inhibidores de la vitamina K.
El objetivo del estudio RE-MEDY fue comparar la seguridad y la eficacia del dabigatrán etexilato oral (150 mg dos veces al día) frente a la warfarina (valor objetivo de RIN 2,0-3,0) para el tratamiento prolongado y la prevención de la TVP y/o la EP sintomática recurrente. Un total de 2866 pacientes fueron aleatorizados, y 2856 de ellos recibieron tratamiento. Los eventos índice en el nivel basal fueron: TVP -65,1 %, EP -23,1 %, EP y TVP -11,7 %. Las características basales de los pacientes fueron: media de edad 54,6 años, sexo masculino 61,0 %, raza caucásica 90,1 %, raza asiática 7,9 %, raza negra 2,0 %. Las comorbilidades incluyeron hipertensión 38,6 %, diabetes mellitus 9,0 %, EC 7,2 % y úlcera gástrica o duodenal 3,8 %. Medicamentos concomitantes: reguladores del sistema renina-angiotensina 27,9 %, vasodilatadores 26,7 %, hipolipemiantes 20,6 %, AINE 18,3 %, betabloqueantes 16,3 %, bloqueadores del canal de calcio 11,1 %, aspirina 7,7 %, inhibidores de la P-gp 2,7 % (verapamilo 1,2 % y amiodarona 0,7 %), antiplaquetarios 0,9 %. La duración del tratamiento con dabigatrán etexilato fue de entre 6 y 36 meses (mediana -534,0 días). En el caso de los pacientes aleatorizados a warfarina, la mediana del tiempo dentro del rango terapéutico (RIN 2,0-3,0) fue 64,9%. El estudio RE-MEDY demostró que el tratamiento con dabigatrán etexilato 150 mg dos veces al día fue no inferior a la warfarina (p = 0,0135 para la no inferioridad). Los eventos de sangrado (MBE/CRBE; sangrado de cualquier tipo) fueron significativamente más bajos en los pacientes que recibieron dabigatrán etexilato en comparación con aquellos que recibieron warfarina.
Al igual que lo observado en los estudios RE-COVER/RE-COVER II combinados, en el estudio RE-MEDY el uso concomitante de inhibidores de la P-gp fue informado por un número reducido de pacientes (2,7 %); el verapamilo (1,2 %) y la amiodarona (0,7 %) fueron los más frecuentes. En los estudios de tratamiento de la TEV aguda combinados, el uso concomitante de inhibidores de la P-gp fue informado por un número reducido de pacientes (2,0 %); los más frecuentes fueron verapamilo (1,2 % en total) y amiodarona (0,4 % en total).
Figura 3. Tiempo hasta el primer evento adjudicado de TEV y muerte relacionada con TEV hasta el fin del período de tratamiento planeado para el estudio RE-MEDY
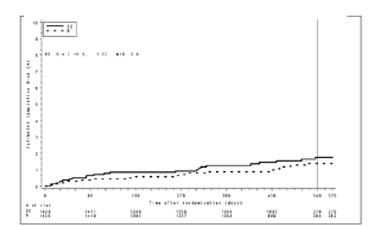
En la Tabla 15 se presentan los datos de los resultados clave del estudio RE-MEDY.
|
Tabla 15. Análisis de los criterios de valoración de eficacia primarios y secundarios (TEV es un criterio de valoración compuesto de TVP y/o EP) hasta el fin del período postratamiento para el estudio RE-MEDY |
||
|
Dabigatrán etexilato 150 mg |
Warfarina |
|
|
RE-MEDY |
||
|
Pacientes, n (%) |
1430 (100,0) |
1426 (100,0) |
|
TEV sintomática recurrente y muerte relacionada con TEV |
26 (1,8) |
18 (1,3) |
|
Razón de riesgo versus warfarina |
1,44 |
|
|
IC 95 % |
0,78; 2,64 |
|
|
Valor p (no inferioridad) |
0,0135 |
|
|
Pacientes con evento a los 18 meses |
22 |
17 |
|
Riesgo acumulado a los 18 meses (%) |
1,7 |
1,4 |
|
Diferencia de riesgo frente a la warfarina (%) |
0,4 |
|
|
IC 95 % |
-0,5; 1,2 |
|
|
Valor p (no inferioridad) |
<0,0001 |
|
|
Criterios de valoración de eficacia secundarios |
||
|
TEV sintomática recurrente y muertes por todas las causas |
42 (2,9) |
36 (2,5) |
|
IC 95 % |
2,12; 3,95 |
1,77; 3,48 |
|
TVP sintomática |
17 (1,2) |
13 (0,9) |
|
IC 95 % |
0,69; 1,90 |
0,49; 1,55 |
|
EP sintomática |
10 (0,7) |
5 (0,4) |
|
IC 95 % |
0,34; 1,28 |
0,11; 0,82 |
|
Muertes relacionadas con TEV |
1 (0,1) |
1 (0,1) |
|
IC 95 % |
0,00; 0,39 |
0,00; 0,39 |
|
Muertes por todas las causas |
17 (1,2) |
19 (1,3) |
|
IC 95 % |
0,69; 1,90 |
0,80; 2,07 |
El objetivo del estudio RE-SONATE fue evaluar la superioridad de dabigatrán etexilato frente al placebo para la prevención de la TVP y/o EP sintomática recurrente en pacientes que ya habían completado 6 a 18 meses de tratamiento con antagonistas de la vitamina K. El tratamiento previsto era 6 meses de dabigatrán etexilato 150 mg dos veces al día sin necesidad de monitoreo.
Los eventos índice en el nivel basal fueron: TVP 64,5 %, EP 27,8%, EP y TVP 7,7 %. Un total de 1353 pacientes fueron aleatorizados, y 1343 de ellos recibieron tratamiento. Las características basales de los pacientes fueron: media de edad 55,8 años, sexo masculino 55,5 %, raza caucásica 89,0 %, raza asiática 9,3 %, raza negra 1,7 %. Las comorbilidades incluyeron hipertensión 38,8 %, diabetes mellitus 8,0 %, EC 6,0 % y úlcera gástrica o duodenal 4,5 %. Medicamentos concomitantes: reguladores del sistema renina-angiotensina 28,7 %, vasodilatadores 19,4 %, hipolipemiantes 17,9 %, betabloqueantes 18,5 %, bloqueadores del canal de calcio 8,9 %, AINE 12,1 %, aspirina 8,3 %, antiplaquetarios 0,7 %, inhibidores de la P-gp 1,7 % (verapamilo 1,0 % y amiodarona 0,3 %).
El estudio RE-SONATE demostró que dabigatrán etexilato era superior al placebo para la prevención de los eventos de TVP/EP sintomática recurrente, incluidas las muertes por causa desconocida, con una reducción del riesgo del 92 % durante el período de tratamiento (p < 0,0001). Todos los análisis secundarios y de sensibilidad del criterio de valoración primario y todos los criterios de valoración secundarios confirmaron la superioridad de dabigatrán etexilato respecto del placebo. Las tasas de MBE y la combinación de MBE/CRBE fueron significativamente más altas en los pacientes tratados con dabigatrán etexilato que en aquellos que recibieron placebo.
El estudio incluyó un seguimiento observacional de 12 meses tras la conclusión del tratamiento. Luego de interrumpirse la medicación del estudio, el efecto se mantuvo hasta el fin del seguimiento, lo que indica que el efecto inicial del tratamiento de dabigatrán etexilato se sostuvo. No se observó ningún efecto rebote. Al final del seguimiento, la tasa de eventos de TEV en los pacientes tratados con dabigatrán etexilato fue del 6,9 % frente a un 10,7 % en el grupo de placebo (cociente de riesgo 0,61 (0,42; 0,88), p = 0,0082).
Figura 4. Tiempo hasta el primer evento adjudicado de TEV y muerte relacionada con TEV hasta el fin del período de tratamiento planeado para el estudio RE-SONATE
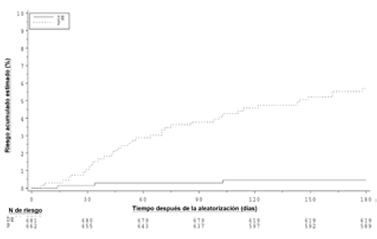
En la Tabla 16 se presentan los datos de los resultados clave del estudio RE-SONATE.
|
Tabla 16. Análisis de los criterios de valoración de eficacia primarios y secundarios (TEV es un criterio de valoración compuesto de TVP y/o EP) hasta el fin del período postratamiento para el estudio RE-SONATE |
||
|
Dabigatrán etexilato 150 mg |
Placebo |
|
|
RE-SONATE |
||
|
Pacientes, n (%) |
681 (100,0) |
662 (100,0) |
|
TEV sintomática recurrente y muertes relacionadas |
3 (0,4) |
37 (5,6) |
|
Razón de riesgo |
0,08 |
|
|
IC 95 % |
0,02; 0,25 |
|
|
Valor p |
<0,0001 |
|
|
Criterios de valoración de eficacia secundarios |
||
|
TEV sintomática recurrente y muertes por todas las causas |
3 (0,4) |
37 (5,6) |
|
IC 95 % |
0,09; 1,28 |
3,97; 7,62 |
|
TVP sintomática |
2 (0,3) |
23 (3,5) |
|
IC 95 % |
0,04; 1,06 |
2,21; 5,17 |
|
EP sintomática |
1 (0,1) |
14 (2,1) |
|
IC 95 % |
0,00; 0,82 |
1,16; 3,52 |
|
Muertes relacionadas con TEV |
0 (0) |
0 (0) |
|
IC 95 % |
0,00; 0,54 |
0,00; 0,56 |
|
Muertes por causa desconocida |
0 (0) |
2 (0,3) |
|
IC 95 % |
0,00; 0,54 |
0,04; 1,09 |
|
Muertes por todas las causas |
0 (0) |
2 (0,3) |
|
IC 95 % |
0,00; 0,54 |
0,04; 1,09 |
• Otros parámetros evaluados:
Alternativo a la Warfarina en la prevención de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) recurrente: El infarto de miocardio se produjo con una frecuencia baja en todos los cuatro estudios de TEV en todos los grupos de tratamiento. La muerte de origen cardíaco se produjo en un paciente del grupo de tratamiento con warfarina.
En los tres estudios con control activo, se informó una mayor incidencia de infarto de miocardio en los pacientes que recibieron dabigatrán etexilato (20; 0,5 %) que en aquellos que recibieron warfarina (5; 0,1 %).
En el estudio RE-SONATE, en el cual se comparó el dabigatrán etexilato frente a un placebo, hubo 1 evento de infarto de miocardio en cada uno de los grupos de tratamiento, lo cual dio lugar a tasas de infarto de miocardio con dabigatrán iguales a las observadas con el placebo.
• Pruebas de función hepática:
Alternativo a la Warfarina en la prevención de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) recurrente: En los estudios con control activo RE-COVER, RE-COVER II y RE-MEDY se produjeron potenciales anormalidades de las pruebas de función hepática (PFH), con una incidencia comparable o más baja en los pacientes tratados con dabigatrán etexilato que en los pacientes tratados con warfarina. En el estudio RE-SONATE, no hubo ninguna diferencia marcada entre los grupos de dabigatrán y de placebo en lo que respecta a valores de PFH anormales posiblemente significativos desde el punto de vista clínico.
FARMACOCINÉTICA: Absorción: Luego de la administración por vía oral de dabigatrán etexilato en voluntarios sanos, el perfil farmacocinético de dabigatrán en el plasma se caracteriza por una rápida elevación de las concentraciones plasmáticas con un máximo de concentración (Cmax) alcanzado dentro de un lapso de 0,5 a 2,0 horas tras la administración. Los valores de Cmax y el área bajo la curva (AUC) de la concentración plasmática en función del tiempo fueron proporcionales a la dosis.
La biodisponibilidad absoluta de dabigatrán luego de la administración oral de dabigatrán etexilato como cápsulas de HPMC fue de aproximadamente un 6,5 %.
La ingesta de alimentos no afecta la biodisponibilidad de dabigatrán etexilato, pero se traduce en una prolongación de 2 horas en el tiempo hasta las concentraciones plasmáticas máximas.
La biodisponibilidad oral puede verse incrementada por un factor de aproximadamente 1,4 (+37 %) en comparación con la formulación en cápsulas de referencia cuando los gránulos se toman sin la cubierta de cápsula de HPMC. Por ello, la integridad de las cápsulas de HPMC debe preservarse en todas las instancias del uso clínico a fin de evitar un incremento no intencional de la biodisponibilidad de dabigatrán etexilato. Por lo tanto, se debe indicar a los pacientes que no deben abrir las cápsulas y que no deben tomar los gránulos solos (p. ej., espolvoreados sobre las comidas o mezclados con las bebidas). (ver Posología y administración).
Un estudio destinado a evaluar la absorción posoperatoria de dabigatrán etexilato, administrado 1-3 horas después de la cirugía, demostró una absorción relativamente lenta en comparación con aquella de los voluntarios sanos, lo cual indica un perfil de concentración plasmática en el tiempo uniforme, sin valores elevados de concentración plasmática máxima. Las concentraciones plasmáticas máximas se alcanzan a las 6 horas de la administración, o a las 7 a 9 horas luego de una cirugía (Estudio BISTRO Ib). Cabe destacar, sin embargo, que existen otros factores que inciden sobre dicho parámetro, como la anestesia, la paresia gastrointestinal y los efectos quirúrgicos, que harán que una proporción de pacientes experimente un retardo en la absorción que es independiente de la formulación oral del fármaco. Aunque este estudio no predijo si el deterioro en la absorción persistirá con las dosis subsiguientes, se demostró en un estudio posterior que la presencia de una absorción lenta y retardada sólo se observa el día de la cirugía. En los días subsiguientes, la absorción de dabigatrán es rápida, con concentraciones plasmáticas máximas alcanzadas 2 horas después de la administración del fármaco.
Distribución: Se observó un grado bajo de unión de dabigatrán a las proteínas plasmáticas humanas (34-35 %), el cual fue independiente de la concentración. El volumen de distribución de dabigatrán, el cual es de 60-70 L, superó el volumen total de agua del organismo, lo que indica una distribución tisular moderada del dabigatrán.
Biotransformación: Luego de la administración por vía oral, el dabigatrán etexilato se convierte en forma rápida y completa en dabigatrán, que es la forma activa en el plasma. La escisión del profármaco dabigatrán etexilato a través de un mecanismo de hidrólisis catalizado por esterasas y la consecuente conversión del profármaco en el principio activo dabigatrán es la reacción metabólica predominante. El dabigatrán experimenta conjugación, con la consecuente formación de acilglucurónidos farmacológicamente activos. Existen cuatro isómeros posicionales, 1-O, 2-O, 3-O y 4-O-acilglucurónido, cada uno de los cuales representa menos del 10 % del dabigatrán total en plasma. Sólo se detectaron trazas de otros metabolitos mediante métodos analíticos de alta sensibilidad. El dabigatrán se elimina principalmente inalterado en la orina, a una velocidad de aproximadamente 100 ml/min, valor este que se corresponde con la tasa de filtración glomerular.
Eliminación: Después de la Cmax, las concentraciones plasmáticas de dabigatrán presentaron una disminución biexponencial con una vida media terminal promedio de aproximadamente 11 horas en sujetos sanos de edad avanzada. Después de múltiples dosis, se observó una vida media terminal de alrededor de 12-14 horas. La vida media era independiente de la dosis. Sin embargo, la vida media se prolonga en caso de deterioro de la función renal, tal como se muestra a continuación, en la Tabla 17.
El metabolismo y la excreción de dabigatrán se estudiaron luego de la administración de una dosis intravenosa única de dabigatrán radiomarcado en sujetos sanos de sexo masculino. Tras una dosis intravenosa, la radioactividad derivada de dabigatrán se eliminó principalmente en la orina (85 %). La excreción fecal representó el 6 % de la dosis administrada. La recuperación de la radioactividad total se ubicó en el rango del 88 % al 94 % de la dosis administrada a las 168 horas posdosis.
|
Tabla 17. Vida media de dabigatrán total en los sujetos sanos y en los sujetos con deterioro de la función renal |
|
|
Tasa de filtración glomerular (ClCr) |
Media geométrica (gCV %; rango) de la vida media |
|
[ml/min] |
[h] |
|
>80 |
13,4 (25,7 %; 11,0-21,6) |
|
>50 - ≤80 |
15,3 (42,7 %; 11,7-34,1) |
|
>30 - ≤50 |
18,4 (18,5 %; 13,3-23,0) |
|
≤30 |
27,2 (15,3 %; 21,6-35,0) |
• PK (farmacocinética) en poblaciones específicas:
Insuficiencia renal: La exposición (AUC) de dabigatrán luego de la administración por vía oral de dabigatrán etexilato en un estudio de Fase I fue aproximadamente 3 veces más alta en los voluntarios adultos con insuficiencia renal moderada (ClCr 30-50 ml/min) que en aquellos sin insuficiencia renal.
En un número reducido de voluntarios adultos con insuficiencia renal grave (ClCr 10-30 ml/min), la exposición (AUC) a dabigatrán fue aproximadamente 6 veces mayor y la vida media fue aproximadamente 2 veces más prolongada que los valores observados en una población sin insuficiencia renal (ver Posología y administración y Contraindicaciones).
La depuración del dabigatrán mediante hemodiálisis se investigó en pacientes adultos con nefropatía en estadio final sin fibrilación auricular. La diálisis se llevó a cabo con una velocidad de flujo del dializante de 700 ml/min, una duración de cuatro horas y una velocidad de flujo sanguíneo de 200 ml/min o bien de 350-390 ml/min. Esto permitió una eliminación del 50 % o del 60 % de las concentraciones de dabigatrán libre o total, respectivamente. La cantidad de fármaco eliminado mediante diálisis es proporcional a la velocidad del flujo sanguíneo. La actividad anticoagulante de dabigatrán se redujo conforme menores fueron las concentraciones plasmáticas y la relación farmacocinética/farmacodinamia no se vio afectada por este procedimiento.
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: La mediana de ClCr en el estudio RE-LY fue 68,4 ml/min. Casi la mitad (45,8 %) de los pacientes del estudio RE-LY tenía un valor de ClCr >50 -< 80 ml/min. Los pacientes con insuficiencia renal moderada (ClCr 30-50 ml/min) tuvieron en promedio concentraciones plasmáticas de dabigatrán 2,29 veces y 1,81 veces más altas antes y después de la dosis, respectivamente, en comparación con los pacientes sin insuficiencia renal (ClCr ≥80 ml/min).
Alternativo a la Warfarina en el tratamiento de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) aguda: La mediana de ClCr en el estudio RE-COVER fue 100,3 ml/min. El 21,7 % de los pacientes tenía insuficiencia renal leve (ClCr >50 - <80 ml/min) y el 4,5 % de los pacientes tenía insuficiencia renal moderada (ClCr entre 30 y 50 ml/min). Los pacientes con insuficiencia renal leve y moderada tuvieron concentraciones valle en estado de equilibrio de dabigatrán que fueron en promedio 1,7 y 3,4 veces más altas en comparación con los pacientes con ClCr> 80 ml/min. Se observaron valores similares para la ClCr en el estudio RE-COVER II.
Alternativo a la Warfarina en la prevención de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) recurrente: La mediana de ClCr en el estudio RE-MEDY y en el estudio RE-SONATE fue 99,0 ml/min y 99,7 ml/min respectivamente. El 22,9 % y el 22,5 % de los pacientes tenía valores de ClCr >50 - <80 ml/min, y el 4,1 % y el 4,8 % tenía valores de ClCr de 30-50 ml/min en el estudio RE-MEDY y en el estudio RE-SONATE.
Pacientes de edad avanzada: Estudios de farmacocinética específicos realizados en pacientes de edad avanzada en estudios de Fase I indicaron un aumento de 1,4 a 1,6 veces (+ 40 al 60 %) en el valor de AUC y de más de 1,25 veces (+25 %) en los valores de Cmax en comparación con los sujetos jóvenes.
Los valores de AUCτ,ss y Cmax,ss en los sujetos de edad avanzada (>65 años) de ambos sexos fueron aproximadamente 1,9 y 1,6 veces más altos en las mujeres de edad avanzada en comparación con las jóvenes; dichos valores fueron 2,2 y 2,0 veces más altos, respectivamente, para los hombres de edad avanzada que para los sujetos de sexo masculino de 18-40 años de edad.
El aumento observado en la exposición a dabigatrán se correlacionó con la reducción en la depuración de creatinina a consecuencia de la edad.
El efecto de la edad sobre la exposición a dabigatrán se confirmó en el estudio RE-LY, con una concentración valle aproximadamente 1,3 veces (+31 %) más alta para los sujetos ≥75 años y aproximadamente un 22 % más baja en los sujetos <65 años en comparación con sujetos de entre 65 y 75 años de edad.
Insuficiencia hepática: No se observó cambio alguno en la exposición a dabigatrán en un total de 12 sujetos en un estudio de Fase I realizado en pacientes con insuficiencia hepática moderada (Categoría B de Child Pugh) en comparación con 12 controles.
Prevención de los eventos de tromboembolia venosa en pacientes sometidos a una cirugía ortopédica mayor: Se excluyó de los estudios clínicos a los pacientes con insuficiencia hepática moderada o grave (Clase B y C de Child-Pugh) o con una enfermedad hepática con una repercusión prevista en la sobrevida del paciente o con enzimas hepáticas elevadas en valores ≥2 veces el límite normal superior (LNS).
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: Se excluyó de los estudios clínicos a los pacientes con enfermedad hepática activa, lo cual comprende, sin carácter taxativo, la elevación persistente de las enzimas hepáticas a valores ≥2 veces el límite normal superior (LNS) o la presencia de hepatitis A, B o C.
Alternativo a la Warfarina en el tratamiento de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) aguda: Se excluyó de los estudios clínicos a los pacientes con insuficiencia hepática moderada o grave (Clase B y C de Child-Pugh) o con una enfermedad hepática con una repercusión prevista en la sobrevida del paciente o con enzimas hepáticas elevadas en valores ≥2 veces el límite normal superior (LNS).
Alternativo a la Warfarina en la prevención de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) recurrente: Se excluyó de los estudios clínicos a los pacientes con insuficiencia hepática moderada o grave (Clase B y C de Child-Pugh) o con una enfermedad hepática con una repercusión prevista en la sobrevida del paciente o con enzimas hepáticas elevadas en valores ≥2 veces el límite normal superior (LNS).
Peso corporal: Las concentraciones valle de dabigatrán fueron aproximadamente 20 % más bajas en los pacientes con un peso corporal (PC) >100 kg en comparación con los pacientes con un PC de 50-100 kg. La mayoría (80,8 %) de los sujetos pertenecía a la categoría de ≥50 kg y <100 kg, sin que se detectara ninguna diferencia clara en relación con este parámetro. Existen disponibles datos limitados de pacientes de ≤50 kg.
— Sexo:
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: En los pacientes con fibrilación auricular, las mujeres tuvieron en promedio valores 1,3 veces (+30 %) más altos en las concentraciones valle y en las concentraciones posdosis.
Este hallazgo careció de relevancia clínica.
Prevención de los eventos de tromboembolia venosa en pacientes sometidos a una cirugía ortopédica mayor: La exposición al fármaco en los estudios de prevención primaria de la TEV fue aproximadamente 1,4 a 1,5 veces más alta (+40 % a 50 %) en las pacientes de sexo femenino.
Este hallazgo careció de relevancia clínica.
Origen étnico: La farmacocinética de dabigatrán se estudió en voluntarios caucásicos y japoneses tras la administración de dosis únicas y múltiples. El origen étnico no afectó la farmacocinética de dabigatrán en forma clínicamente relevante.
Se dispone de datos farmacocinéticos limitados obtenidos en pacientes de raza negra, los cuales no sugieren diferencia relevante alguna.
Interacciones medicamentosas (estudios): Los estudios de interacción in vitro no indicaron ninguna inhibición ni inducción del citocromo P450. Esto ha sido confirmado en estudios in vivo realizados en voluntarios sanos, los cuales no revelaron ninguna interacción entre el tratamiento con dabigatrán etexilato y los siguientes fármacos: atorvastatina (CYP3A4) y diclofenaco (CYP2C9).
Atorvastatina: Cuando dabigatrán etexilato se coadministró con atorvastatina, un sustrato del CYP3A4, la exposición de atorvastatina, los metabolitos de atorvastatina y de dabigatrán no se modificaron, lo cual indica la ausencia de cualquier tipo de interacción.
Diclofenaco: Cuando dabigatrán etexilato se coadministró con diclofenaco, un sustrato del CYP2C9, la farmacocinética de ambos fármacos se mantuvo sin cambios, lo cual indica la ausencia de interacción entre dabigatrán etexilato y diclofenaco.
• Interacciones con inhibidores/inductores de la P-gp:
El profármaco dabigatrán etexilato, pero no así el dabigatrán, es un sustrato del transportador de eflujo denominado glucoproteína P (P-gp). Por lo tanto, se investigó la coadministración con inhibidores e inductores de dicho transportador.
— Coadministración con inhibidores de la P-gp:
Amiodarona: Cuando dabigatrán etexilato se administró con una dosis única oral de 600 mg de amiodarona, la magnitud y la velocidad de absorción de la amiodarona y su metabolito activo DEA se mantuvieron básicamente inalteradas. Los valores de AUC y Cmax de dabigatrán se incrementaron por un factor de aproximadamente 1,6 y 1,5 (+60 % y 50 %), respectivamente.
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: En el estudio de farmacocinética poblacional del estudio RE-LY, no se observó ningún cambio importante en los niveles valle de dabigatrán en los pacientes que recibieron amiodarona (ver Interacciones).
Dronedarona: Cuando dabigatrán etexilato y dronedarona se administraron en forma simultánea, los valores de AUC0-∞ y Cmax de dabigatrán total se incrementaron por un factor de aproximadamente 2,4 y 2,3 (+136 % y 125 %), respectivamente, tras la administración de dosis múltiples de 400 mg de dronedarona dos veces al día, y por un factor de aproximadamente 2,1 y 1,9 (+114 % y 87 %), respectivamente, tras la administración de una dosis única de 400 mg. La vida media terminal y la depuración renal de dabigatrán no se vieron afectadas por la dronedarona. Cuando se administraron dosis únicas y dosis múltiples de dronedarona 2 horas después de la administración de dabigatrán etexilato, los valores de AUC0-∞ del dabigatrán se incrementaron por un factor de 1,3 y de 1,6, respectivamente.
Verapamilo: Cuando dabigatrán etexilato se coadministró junto con verapamilo oral, los valores de AUC y Cmax de dabigatrán aumentaron de manera dependiente del momento de administración y de la formulación de verapamilo utilizada.
La mayor elevación de la exposición a dabigatrán se observó con la primera dosis de una formulación de liberación inmediata de verapamilo administrada una hora antes de la toma de dabigatrán etexilato (aumento de Cmax por un factor de aproximadamente 2,8 (+180 %) y del AUC por un factor de aproximadamente 2,5 (+150 %)). Este efecto disminuyó progresivamente con la administración de una formulación de liberación prolongada (aumento de Cmax por un factor de aproximadamente 1,9 (+90%) y del AUC por un factor de aproximadamente 1,7 (+70 %)) o bien con la administración de dosis múltiples de verapamilo (aumento de Cmax por un factor de aproximadamente 1,6 (+60 %) y del AUC por un factor de aproximadamente 1,5 (+50 %)). Esto puede explicarse por la inducción de la P-gp en los intestinos producida por el tratamiento crónico con verapamilo.
No se observaron interacciones significativas cuando el verapamilo se administró 2 horas después de dabigatrán etexilato (aumento de la Cmax de aproximadamente un 10 % y del AUC de aproximadamente un 20 %). Esto se explica por la absorción completa de dabigatrán que se observa al cabo de 2 horas (ver Posología y administración).
No existen datos disponibles respecto de la aplicación parenteral de verapamilo; sobre la base del mecanismo de interacción, no es dable esperar interacción significativa alguna.
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: En el estudio de farmacocinética poblacional del estudio RE-LY, no se produjo ningún cambio importante en los valores valle de dabigatrán en los pacientes que recibieron verapamilo (ver Interacciones).
Ketoconazol: El ketoconazol administrado por vía sistémica se tradujo en incrementos en los valores de AUC0-∞ y Cmax de dabigatrán total por un factor de alrededor de 2,4 (+138 % y 135 %), respectivamente, luego de una dosis única de 400 mg, y por un factor de aproximadamente 2,5 (+153 % y 149 %), respectivamente, tras la administración de dosis múltiples de ketoconazol de 400 mg una vez al día. El tiempo hasta la concentración máxima, la vida media terminal y la media del tiempo de residencia no se vieron afectados por el ketoconazol.
Claritromicina: Cuando se administró claritromicina en dosis de 500 mg dos veces al día junto con dabigatrán etexilato, no se observó ninguna interacción farmacocinética que fuera clínicamente relevante (incrementos en los valores de Cmax de aproximadamente un 15 % y del AUC de aproximadamente un 19 %).
Quinidina: La quinidina se administró en dosis de 200 mg cada 2 horas hasta alcanzar una dosis total de 1000 mg. El dabigatrán etexilato se administró dos veces al día durante 3 días consecutivos, y al tercer día se administró con o sin quinidina. Los valores de AUCτ,ss y Cmax,ss de dabigatrán experimentaron un incremento promedio de 1,5 veces (+53 % y 56 %), respectivamente, con la administración concomitante de quinidina.
Ticagrelor: Cuando una dosis única de 75 mg de dabigatrán etexilato se coadministró en forma simultánea con una dosis de carga de 180 mg de ticagrelor, los valores de AUC y Cmax de dabigatrán se incrementaron por un factor de 1,73 y de 1,95 (+73 % y 95 %), respectivamente. Tras la administración de dosis múltiples de ticagrelor de 90 mg dos veces al día, el aumento en la exposición a dabigatrán se redujo a un factor de 1,56 y 1,46 (+56 % y 46 %) para Cmax y AUC, respectivamente.
La administración concomitante de una dosis de carga de 180 mg de ticagrelor y de 110 mg de dabigatrán etexilato (en estado de equilibrio dinámico) incrementó el AUCτ,ss y la Cmax,ss de dabigatrán por un factor de 1,49 y 1,65 (+49 % y 65 %), respectivamente, en comparación con dabigatrán etexilato administrado solo. Cuando se administró una dosis de carga de 180 mg de ticagrelor 2 horas después de la administración de 110 mg de dabigatrán etexilato (en estado de equilibrio), el aumento del AUCτ,ss y de la Cmax,ss de dabigatrán se redujo a un factor de 1,27 y 1,23 (+27 % y 23 %), respectivamente, en comparación con dabigatrán etexilato administrado solo. La administración concomitante de 90 mg de ticagrelor dos veces al día (dosis de mantenimiento) con 110 mg de dabigatrán etexilato incrementó los valores ajustados de AUCτ,ss y Cmax,ss de dabigatrán por un factor de 1,26 y 1,29, respectivamente, en comparación con dabigatrán etexilato administrado solo.
— Coadministración con sustratos de la P-gp:
Digoxina: Cuando el dabigatrán etexilato se coadministró con digoxina, un sustrato de la P-gp, no se observaron interacciones farmacocinéticas. Ni el dabigatrán ni el profármaco dabigatrán etexilato son inhibidores clínicamente relevantes de la P-gp.
— Coadministración con inductores de la P-gp:
Rifampicina: La administración previa del fármaco inductor rifampicina en una dosis de 600 mg una vez al día durante 7 días redujo la concentración máxima y la exposición total de dabigatrán total a razón de un 65,5 % y un 67 %, respectivamente. El efecto inductor se redujo, lo cual dio como resultado una exposición a dabigatrán cerca de la referencia para el día 7 luego de la interrupción del tratamiento con rifampicina. No se observó ningún otro incremento de la biodisponibilidad durante un lapso adicional de 7 días.
— Coadministración con inhibidores plaquetarios:
Ácido acetilsalicílico (AAS): El efecto de la administración concomitante de dabigatrán etexilato y el ácido acetilsalicílico (AAS) sobre el riesgo de sangrados se estudió en pacientes con fibrilación auricular en un estudio de Fase II en el cual se aplicó un régimen aleatorizado de coadministración de AAS. Sobre la base del análisis de regresión logística, la coadministración de AAS y dabigatrán etexilato en dosis de 150 mg dos veces al día puede aumentar el riesgo de cualquier tipo de sangrado del 12 % a un 18 % y a un 24 % con 81 mg y 325 mg de AAS, respectivamente.
A partir de los datos recopilados en el estudio de Fase III RE-LY, se observó que la administración conjunta de AAS o clopidogrel con dabigatrán etexilato en dosis de 110 o 150 mg dos veces al día puede aumentar el riesgo de un sangrado importante. Sin embargo, el aumento de la tasa de eventos de sangrado producido por la coadministración con AAS o clopidogrel también se observó con la warfarina.
AINE: Se ha comprobado que los AINE administrados para la analgesia perioperatoria a corto plazo no están asociados con un mayor riesgo de sangrado cuando se administran en forma conjunta con dabigatrán etexilato. Existe evidencia limitada con respecto al uso de AINE comunes con vidas medias inferiores a 12 horas durante el tratamiento con dabigatrán etexilato; dicha evidencia no sugirió ningún riesgo de sangrado adicional.
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: Los AINE incrementaron el riesgo de sangrado en el estudio RE-LY en todos los grupos de tratamiento.
Clopidogrel: En un estudio de Fase I realizado en voluntarios sanos jóvenes de sexo masculino, la administración concomitante de dabigatrán etexilato y clopidogrel no condujo a una prolongación adicional de los tiempos de sangrado capilar (TSC) en comparación con la monoterapia de clopidogrel. Asimismo, los valores de AUCτ,ss y de Cmax,ss de dabigatrán y los valores de coagulación como una medida del efecto de dabigatrán, el aPTT, el ECT o el TT (anti-FIIa), o bien la inhibición de la agregación plaquetaria (IAP), como una medida del efecto de clopidogrel, se mantuvieron esencialmente sin cambios en la comparación del tratamiento combinado frente a las respectivas monoterapias. Con una dosis de carga de 300 o 600 mg de clopidogrel, los valores de AUCτ,ss y de Cmax,ss de dabigatrán se incrementaron por un factor de aproximadamente 1,3 a 1,4 (+30 a 40 %). (ver en los párrafos anteriores la subsección referida al AAS)
Antiplaquetarios u otros anticoagulantes: El uso concomitante de dabigatrán etexilato y antiplaquetarios o anticoagulantes de otro tipo puede aumentar el riesgo de sangrado (ver Advertencias y precauciones especiales).
• Coadministración con inhibidores selectivos de la recaptación de serotonina:
Los ISRS incrementaron el riesgo de sangrado en el estudio RE-LY en todos los grupos de tratamiento.
• Coadministración con elevadores del pH gástrico:
Los cambios en la exposición a dabigatrán, según lo determinado por el análisis de farmacocinética poblacional, provocados por los inhibidores de la bomba de protones (IBP) y los antiácidos no se consideraron clínicamente relevantes puesto que la magnitud de dicho efecto fue mínima (disminución fraccional de la biodisponibilidad no significativa para los antiácidos y del 14,6 % para los IBP).
Pantoprazol: Cuando dabigatrán etexilato se coadministró con pantoprazol, se observó una disminución del área bajo la curva de la concentración plasmática en función del tiempo de dabigatrán de aproximadamente un 30 %. El pantoprazol y otros inhibidores de la bomba de protones se coadministraron con dabigatrán etexilato en estudios clínicos sin observarse efecto alguno sobre el sangrado o la eficacia.
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: En el estudio de Fase III, RE-LY, la administración conjunta con IBP no se tradujo en un descenso de los niveles valle y, en promedio, sólo causó una ligera reducción de las concentraciones posdosis (11 %). En concordancia con ello, la coadministración con IBP aparentemente no estuvo asociada con una mayor incidencia de accidente cerebrovascular o EES, especialmente en comparación con la warfarina y, por lo tanto, la reducción de la biodisponibilidad provocada por la administración conjunta de pantoprazol aparentemente careció de relevancia clínica.
Ranitidina: La administración de ranitidina junto con dabigatrán etexilato no tuvo ningún efecto significativo sobre el grado de absorción del dabigatrán.
CONTRAINDICACIONES:
— Hipersensibilidad conocida a dabigatrán, a dabigatrán etexilato o a alguno de los excipientes del producto.
— Insuficiencia renal grave (ClCr <30 ml/min) en pacientes adultos.
— Manifestaciones hemorrágicas, pacientes con diátesis hemorrágica o pacientes con alteración espontánea o farmacológica de la hemostasia.
— Lesiones en órganos con riesgo de sangrado clínicamente significativo, incluido el accidente cerebrovascular hemorrágico dentro de los últimos 6 meses.
— Tratamiento sistémico concomitante con ketoconazol (ver Interacciones).
— Pacientes con prótesis de válvulas cardíacas que requieran tratamiento anticoagulante.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR VEHÍCULOS Y OPERAR MAQUINARIAS: No se han realizado estudios en torno a los efectos de este fármaco sobre la capacidad para conducir vehículos, andar en bicicleta y operar maquinarias.
REACCIONES ADVERSAS:
Resumen del perfil de seguridad: PRADAXA® se evaluó en estudios clínicos en más de 64 000 pacientes en total; de ellos, más de 35 000 pacientes fueron tratados con PRADAXA®.
Prevención de eventos de tromboembolia venosa en pacientes que han sido sometidos a una cirugía ortopédica mayor: En los estudios de prevención primaria de la TEV luego de una cirugía ortopédica mayor, un total de 10 795 pacientes fueron tratados con al menos una dosis de dabigatrán etexilato (150 mg una vez al día, 220 mg una vez al día, enoxaparina) en 6 estudios controlados. De dichos 10 795 pacientes, 6684 fueron tratados con una dosis de 150 o 220 mg de dabigatrán etexilato administrada una vez al día.
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: En el estudio RE-LY, en el cual se investigó la prevención del accidente cerebrovascular y de la embolia sistémica en pacientes con fibrilación auricular, un total de 12 042 pacientes fueron tratados con dabigatrán etexilato. De dichos pacientes, 6059 fueron tratados con 150 mg de dabigatrán etexilato dos veces al día, mientras que 5983 recibieron dosis de 110 mg dos veces al día.
Alternativo a la Warfarina en el tratamiento de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) aguda: En los estudios de tratamiento de la TVP/EP aguda (RE-COVER, RE-COVER II) un total de 2553 pacientes fueron incluidos en el análisis de seguridad de dabigatrán etexilato. Todos los pacientes fueron tratados con dabigatrán etexilato 150 mg dos veces al día.
Alternativo a la Warfarina en la prevención de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) recurrente: En los estudios de prevención de la TVP/EP recurrente (RE-MEDY, RE-SONATE) un total de 2114 pacientes fueron tratados con dabigatrán etexilato; 552 de dichos 2114 pacientes eran pacientes que habían pasado del estudio RE-COVER (tratamiento de la TVP/EP aguda) al estudio RE-MEDY y están contabilizados en los totales de pacientes de los dos tipos de eventos de TVP/EP, agudos y recurrentes. Todos los pacientes fueron tratados con dabigatrán etexilato 150 mg dos veces al día.
En total, aproximadamente el 9 % de los pacientes tratados por una cirugía programada de cadera o de rodilla (tratamiento a corto plazo de hasta 42 días), el 22 % de los pacientes con fibrilación auricular tratados para la prevención del accidente cerebrovascular y de la embolia sistémica (tratamiento prolongado de hasta 3 años), el 14 % de los pacientes que recibieron este fármaco para el tratamiento de una TVP/EP aguda (tratamiento prolongado de hasta 6 meses), el 15 % de los pacientes que recibieron este fármaco para la prevención de una TVP/EP recurrente (tratamiento prolongado de hasta 36 meses) tuvieron reacciones adversas.
• Sangrado:
El sangrado es la reacción adversa más relevante de PRADAXA®; se produjeron sangrados de diverso tipo o severidad, según la indicación, en aproximadamente el 14 % de los pacientes que recibieron tratamiento a corto plazo con este fármaco por una cirugía programada de reemplazo de cadera o de rodilla, en el tratamiento prolongado en el 16,6 % anual de los pacientes con fibrilación auricular tratados para la prevención del accidente cerebrovascular y la embolia sistémica y en el 14,4 % de los pacientes adultos con TVP/EP aguda. En el estudio RE-MEDY (pacientes adultos), de TVP/EP recurrente, el 19,4 % de los pacientes tuvieron algún sangrado, mientras que en el estudio RE-SONATE (pacientes adultos) el porcentaje de pacientes con algún sangrado fue del 10,5%.
Si bien es un evento raro en términos de frecuencia en los estudios clínicos, existe la posibilidad de que se produzca sangrado importante o grave, los cuales, independientemente de su localización, pueden tener desenlaces incapacitantes, potencialmente fatales o incluso fatales.
Prevención de los eventos de tromboembolia venosa en pacientes que han sido sometidos a una cirugía ortopédica mayor: Las tasas de sangrado total fueron similares entre los grupos de tratamiento, sin diferencias significativas entre ellas.
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular:
— Los sangrados importantes cumplían uno o varios de los siguientes criterios:
- Sangrado asociado con un descenso en los valores de hemoglobina de al menos 20 gramos por litro o bien un sangrado que requiere una transfusión de al menos 2 unidades de sangre o de concentrado de células sanguíneas.
- Sangrado sintomático en un órgano o un área críticos: sangrado intraocular, sangrado intracraneano, sangrado intraespinal o sangrado intramuscular con síndrome compartimental, sangrado retroperitoneal, sangrado intraarticular o sangrado pericárdico.
— Los sangrados importantes fueron clasificados como potencialmente fatales si cumplían uno o varios de los siguientes criterios:
- Sangrado fatal; sangrado intracraneano sintomático, descenso en los valores de hemoglobina de al menos 50 gramos por litro; transfusión de al menos 4 unidades de sangre o concentrado de células sanguíneas; sangrado asociado con hipotensión que requiere del uso de agentes inotrópicos intravenosos; sangrado que requiere intervención quirúrgica.
Los sujetos aleatorizados al tratamiento con dabigatrán etexilato en una posología de 110 mg dos veces al día o 150 mg dos veces al día tuvieron un riesgo significativamente menor de eventos potencialmente fatales de sangrado, accidentes cerebrovasculares hemorrágicos y sangrados intracraneanos en comparación con la warfarina [p <0,05]. Ambas concentraciones de dabigatrán etexilato tuvieron también una tasa de sangrado total significativamente menor desde el punto de vista estadístico. Los sujetos asignados aleatoriamente a dabigatrán etexilato 110 mg dos veces al día tuvieron un riesgo significativamente menor de sangrados importantes en comparación con aquellos tratados con warfarina (cociente de riesgo de 0,81, p = 0,0027).
Alternativo a la Warfarina en el tratamiento de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) aguda: La definición del evento hemorrágico mayor (major bleeding event, MBE) se generó de acuerdo con las recomendaciones de la Sociedad Internacional de Trombosis y Hemostasia (International Society on Thrombosis and Haemostasis, ISTH). Un evento de sangrado se calificaba como un MBE si cumplía al menos uno de los siguientes criterios:
• Sangrado fatal.
• Sangrado sintomático en una zona o un órgano críticos, tal como sangrado intracraneano, sangrado intraespinal, sangrado intraocular, sangrado retroperitoneal, sangrado intraarticular o sangrado pericárdico, o sangrado intramuscular con síndrome compartimental. Para que un sangrado en una zona o un órgano críticos se clasificara como un MBE, debía estar asociado con una presentación clínica sintomática.
• Sangrado que provoca un descenso en los niveles de hemoglobina de 20 g/L (1,24 mmol/L) o más, o que conduce a una transfusión de 2 o más unidades de sangre total o de glóbulos rojos.
En un análisis de datos combinados de los dos estudios pivote (RE-COVER y RE-COVER II) en el tratamiento de la TVP/EP aguda, los sujetos aleatorizados a dabigatrán etexilato tuvieron tasas más bajas de los siguientes eventos de sangrado, las cuales fueron estadísticamente significativas:
• Eventos hemorrágicos mayores (cociente de riesgo 0,60 (0,36; 0,99)).
• Eventos hemorrágicos mayores o eventos de sangrado clínicamente relevantes (clinically relevant bleeding events, CRBE) (cociente de riesgo 0,56 (0,45; 0,71)).
• Cualquier evento de sangrado (cociente de riesgo 0,67 (0,59; 0,77)).
Todas estas tasas fueron superiores en comparación con la warfarina.
Los eventos de sangrado de ambos tratamientos se contabilizan a partir de la primera toma de dabigatrán etexilato o warfarina tras la interrupción de la terapia parenteral (período de tratamiento oral solamente). Esto incluye todos los eventos de sangrado que se produjeron durante el tratamiento con dabigatrán. Todos los eventos de sangrado que se produjeron durante el tratamiento con warfarina están incluidos, excepto los que se produjeron durante el lapso de superposición entre la warfarina y la terapia parenteral.
Alternativo a la Warfarina en la prevención de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) recurrente: La definición de los MBE se generó de acuerdo con las recomendaciones de la Sociedad Internacional de Trombosis y Hemostasia. En el estudio RE-MEDY, un evento de sangrado se calificaba como un MBE si cumplía al menos uno de los siguientes criterios:
— Sangrado fatal.
— Sangrado sintomático en una zona o un órgano críticos, tal como sangrado intracraneano, sangrado intraespinal, sangrado intraocular, sangrado retroperitoneal, sangrado intraarticular o sangrado pericárdico, o sangrado intramuscular con síndrome compartimental. Para que un sangrado en una zona o un órgano críticos se clasificara como un MBE, debía estar asociado con una presentación clínica sintomática.
— Sangrado que provoca un descenso en los niveles de hemoglobina de 20 g/L (1,24 mmol/L) o más, o que conduce a una transfusión de 2 o más unidades de sangre total o de glóbulos rojos.
En el estudio RE-MEDY, los pacientes aleatorizados a dabigatrán etexilato tuvieron un número significativamente menor de eventos de sangrado en comparación con la warfarina en lo que respecta a las siguientes categorías: eventos hemorrágicos mayores o eventos de sangrado clínicamente relevantes (cociente de riesgo 0,55 (0,41; 0,72), p < 0,0001) y cualquier evento de sangrado (cociente de riesgo 0,71 (0,61; 0,83), p < 0,0001).
En el estudio RE-SONATE, un evento de sangrado se calificaba como un MBE si cumplía al menos uno de los siguientes criterios:
— Sangrado fatal.
— Asociado con un descenso en el nivel de hemoglobina de 2 g/dl o más.
— Condujo a transfusión de ≥2 unidades de concentrado de células sanguíneas o sangre total.
— Se produce en una zona crítica: sangrado intracraneano, sangrado intraespinal, sangrado intraocular, sangrado pericárdico, sangrado intraarticular, sangrado intramuscular con síndrome compartimental, sangrado retroperitoneal.
En el estudio RE-SONATE, las tasas de MBE fueron bajas (2 pacientes con MBE (0,3%) para dabigatrán etexilato versus 0 pacientes con MBE (0%) para placebo. Las tasas de eventos hemorrágicos mayores o eventos de sangrado clínicamente relevantes fueron más altas con dabigatrán etexilato que con el placebo (5,3 % versus 2,0 %).
• Resumen tabulado de reacciones adversas:
Las reacciones adversas de todos los estudios comparativos informadas en cualquier grupo de tratamiento, por población, se presentan en los listados que se brindan a continuación, clasificadas por sistema y órgano y términos preferentes del MedDRA. En la Tabla 6 se presentan las reacciones adversas identificadas que son aplicables a todas las indicaciones registradas. En la Tabla 7 se presentan las reacciones adversas identificadas específicas de cada indicación.
Las reacciones adversas generalmente están asociadas con la forma de acción farmacológica del dabigatrán etexilato y representan eventos asociados con el sangrado que pueden producirse en diferentes zonas anatómicas u órganos.
Prevención de eventos de tromboembolia venosa en pacientes que han sido sometidos a una cirugía ortopédica mayor: En los pacientes tratados para la prevención de la TEV tras una cirugía de reemplazo de cadera o de rodilla, las incidencias observadas de reacciones adversas de dabigatrán etexilato se ubicaron dentro del mismo rango que aquel de la enoxaparina.
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: Las incidencias de reacciones adversas de dabigatrán etexilato observadas en los pacientes con fibrilación auricular tratados para la prevención del accidente cerebrovascular se ubicaron en el rango de la warfarina, a excepción de los trastornos gastrointestinales, los cuales se produjeron con una mayor incidencia en las ramas de tratamiento con dabigatrán etexilato.
Alternativo a la Warfarina en el tratamiento de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) aguda: La frecuencia general de reacciones adversas en los pacientes que recibieron PRADAXA® para el tratamiento de una TVP/EP aguda fue más baja para PRADAXA® en comparación con la warfarina (14,2 % versus 18,9 %).
Alternativo a la Warfarina en la prevención de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) recurrente: La frecuencia general de reacciones adversas en los pacientes tratados para la prevención de la TVP/EP recurrente fue más baja para PRADAXA® en comparación con la warfarina (14,6 % versus 19,6 %), en tanto que en comparación con el placebo la frecuencia fue más alta (14,6 % versus 6,5 %).
Tabla 6. Reacciones adversas:
Reacciones adversas identificadas a partir de estudios y datos posteriores a la comercialización en:
• Programa de prevención primaria de la TEV luego de una cirugía ortopédica mayor.
• Prevención del accidente cerebrovascular tromboembólico y la embolia sistémica en pacientes con fibrilación auricular.
• Tratamiento de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) aguda.
• Prevención de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) recurrente.
|
Trastornos de la sangre y el sistema linfático |
Anemia, trombocitopenia, neutropenia* , agranulocitosis* |
|
Trastornos del sistema inmunológico |
Hipersensibilidad al fármaco, lo que incluye prurito, exantema y urticaria, broncoespasmo*, angioedema* y reacción anafiláctica* |
|
Trastornos del sistema nervioso |
Hemorragia intracraneana |
|
Trastornos vasculares |
Hematoma, hemorragia |
|
Trastornos respiratorios, torácicos y mediastínicos |
Epistaxis, hemoptisis |
|
Trastornos gastrointestinales |
Hemorragia gastrointestinal, dolor abdominal, diarrea, dispepsia, náuseas, úlcera gastrointestinal, incluida úlcera esofágica, gastroesofagitis, enfermedad de reflujo gastroesofágico, vómitos, disfagia |
|
Trastornos hepatobiliares |
Función hepática anormal |
|
Trastornos de la piel y del tejido subcutáneo |
Hemorragia cutánea, alopecia* |
|
Trastornos musculoesqueléticos, óseos y del tejido conjuntivo |
Hemartrosis |
|
Trastornos renales y urinarios |
Hemorragia urogenital |
|
Trastornos generales y afecciones del sitio de administración |
Hemorragia en el lugar de la inyección, hemorragia en el lugar del catéter |
|
Lesiones, intoxicaciones y complicaciones del procedimiento |
Hemorragia traumática, hemorragia en el lugar de la incisión |
|
* incluidos los datos posteriores a la comercialización |
|
|
Tabla 7. Reacciones adversas específicas adicionales identificadas, clasificadas por indicación |
|
|
Prevención de los eventos de tromboembolia venosa en pacientes que han sido sometidos a una cirugía ortopédica mayor: |
|
|
Trastornos vasculares |
Hemorragia de herida |
|
Trastornos generales y afecciones del sitio de administración |
Secreción sanguinolenta |
|
Lesiones, intoxicaciones y complicaciones del procedimiento |
Hematoma posprocedimiento, hemorragia posprocedimiento, anemia posoperatoria, secreción posprocedimiento, secreción de la herida |
|
Procedimientos médicos y quirúrgicos |
Drenaje de herida, drenaje posprocedimiento |
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: Ninguno.
Alternativo a la Warfarina en el tratamiento de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) aguda: Ninguno.
Alternativo a la Warfarina en la prevención de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) recurrente: Ninguno.
INTERACCIONES: El uso concomitante de PRADAXA® con tratamientos que actúan sobre la hemostasia o la coagulación, incluidos los antagonistas de la vitamina K, puede incrementar significativamente el riesgo de sangrado. (ver Advertencias y precauciones especiales).
El dabigatrán etexilato y el dabigatrán no son metabolizados por el sistema del citocromo P450 y no ejercen ningún efecto in vitro sobre las enzimas del citocromo P450 en los seres humanos. Por lo tanto, no es dable esperar que se produzcan interacciones medicamentosas relacionadas con dicho sistema con la administración de dabigatrán etexilato o dabigatrán (ver PK en poblaciones específicas).
• Interacciones con la glucoproteína P:
Inhibidores de la glucoproteína P: El dabigatrán etexilato es un sustrato del transportador de eflujo P-gp. Se prevé que la administración concomitante de inhibidores de la P-gp (tales como amiodarona, verapamilo, quinidina, ketoconazol sistémico, dronedarona, ticagrelor, claritromicina y la combinación a dosis fija de glecaprevir/pibrentasvir) conducirá a concentraciones plasmáticas incrementadas de dabigatrán.
La administración concomitante de un tratamiento sistémico con ketoconazol está contraindicada.
Prevención de eventos de tromboembolia venosa en pacientes que han sido sometidos a una cirugía ortopédica mayor: Para el caso del uso concomitante de inhibidores de la P-gp y la administración de PRADAXA® en esta indicación, ver Posología y administración y PK en poblaciones específicas.
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: Para el caso de los inhibidores de la P-gp antes mencionados, no se requiere ningún ajuste de dosis para PRADAXA® en esta indicación.
Alternativo a la Warfarina en el tratamiento de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) aguda: En el caso de los inhibidores de la P-gp antes mencionados, no se requiere ningún ajuste de dosis para PRADAXA® en esta indicación.
Alternativo a la Warfarina en la prevención de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) recurrente: En el caso de los inhibidores de la P-gp antes mencionados, no se requiere ningún ajuste de dosis para PRADAXA® en esta indicación.
Amiodarona: La exposición a dabigatrán en los sujetos sanos se incrementó por un factor de 1,6 (+60 %) en presencia de amiodarona (ver PK en poblaciones específicas).
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: En los pacientes del estudio RE-LY, las concentraciones se incrementaron un máximo de 14 % y no se observó ningún riesgo incrementado de sangrado.
Verapamilo: Cuando PRADAXA® (150 mg) se coadministró con verapamilo oral, los valores de Cmax y AUC de dabigatrán se vieron incrementados, pero la magnitud de este cambio difiere según el momento de la administración y la formulación del verapamilo (ver PK en poblaciones específicas).
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: En los pacientes del estudio RE-LY, las concentraciones se incrementaron un máximo de 21 % y no se observó ningún riesgo incrementado de sangrado.
Quinidina: La exposición al dabigatrán en los sujetos sanos se incrementó por un factor de 1,5 (+53 %) en presencia de quinidina (ver PK en poblaciones específicas).
Claritromicina: La exposición al dabigatrán en los sujetos sanos se incrementó a razón de aproximadamente un 19% en presencia de claritromicina sin ninguna inquietud en términos de seguridad a nivel clínico (ver PK en poblaciones específicas).
Ketoconazol: La exposición a dabigatrán se incrementó por un factor de 2,5 (+150 %) tras la administración de dosis únicas y múltiples de ketoconazol por vía sistémica (ver Contraindicaciones y PK en poblaciones específicas).
Dronedarona: La exposición a dabigatrán se incrementó por un factor de 2,1 (+114 %) tras la administración de una dosis única de dronedarona y por un factor de 2,4 (+136 %) luego de la administración de dosis múltiples de dicho fármaco (ver PK en poblaciones específicas).
Ticagrelor: La exposición a dabigatrán en los sujetos sanos se incrementó por un factor de 1,46 (+46 %) en presencia de ticagrelor en estado de equilibrio dinámico o por un factor de 1,73 (+73 %) cuando se administró una dosis de carga de ticagrelor en forma simultánea con una dosis única de 75 mg de dabigatrán etexilato.
La exposición en estado de equilibrio dinámico a dabigatrán en los sujetos sanos se incrementó por un factor de 1,26 (+26 %) en presencia de ticagrelor en estado de equilibrio dinámico o por un factor de 1,49 (+49 %) cuando se administró una dosis de carga de ticagrelor en forma simultánea con 110 mg de dabigatrán etexilato. El aumento de la exposición fue menos pronunciado cuando se administró la dosis de carga de ticagrelor de 180 mg dos horas después de la toma de dabigatrán (+27 %).
• Sustrato de la glucoproteína P:
Digoxina: En un estudio realizado con 24 sujetos sanos, cuando PRADAXA® se coadministró con digoxina, no se observó ningún cambio en relación con la digoxina y tampoco ningún cambio clínico relevante en la exposición al dabigatrán (ver PK en poblaciones específicas).
• Inductores de la glucoproteína P:
Luego de 7 días de tratamiento con 600 mg de rifampicina administrada una vez al día, los valores de AUC0-∞ y Cmax de dabigatrán total se redujeron en un 67 % y un 66 %, respectivamente, en comparación con el tratamiento de referencia.
El uso concomitante con inductores de la P-gp (p. ej., rifampicina) reduce la exposición a dabigatrán y, por ende, debe evitarse (ver Advertencias y precauciones especiales y PK en poblaciones específicas).
ADVERTENCIAS Y PRECAUCIONES ESPECIALES: Riesgo de hemorragia: Tal como sucede con todos los anticoagulantes, PRADAXA® debe utilizarse con precaución en los cuadros en que exista un riesgo aumentado de sangrado. El sangrado puede producirse en cualquier lugar anatómico durante el tratamiento con PRADAXA®. Ante un descenso inexplicable de los valores de hemoglobina y/o hematocrito o de la presión arterial, deberá examinarse al paciente para localizar el origen del posible sangrado.
Para pacientes adultos en situaciones en las que hay un sangrado no controlado o potencialmente fatal, cuando se requiere una rápida reversión de los efectos anticoagulantes de dabigatrán, está disponible el agente reversor específico (PRAXBIND®, idarucizumab) (ver las secciones Cirugías e intervenciones, Fase preoperatoria y Sobredosis).
El tratamiento con PRADAXA® no requiere de un control de la actividad anticoagulante. La prueba de RIN no es confiable en los pacientes tratados con PRADAXA® y se han informado falsos positivos de elevaciones en los valores de RIN. Por lo tanto, no deben realizarse pruebas de RIN.
Existen disponibles diversas pruebas para evaluar la actividad anticoagulante, tales como la prueba del tiempo de trombina (TT), la prueba del tiempo de coagulación por ecarina (ecarin clotting time, ECT) y la prueba del tiempo parcial de tromboplastina activada (activated partial thromboplastin time, aPTT), que pueden utilizarse para detectar una actividad excesiva de dabigatrán.
La actividad anticoagulante relacionada con el dabigatrán puede evaluarse mediante la prueba de ECT o la prueba de TT. En los adultos, en el caso de que no estuviera disponible el método de ECT o de TT, la prueba de aPTT brindará una aproximación de la actividad anticoagulante de PRADAXA®.
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: En los pacientes con fibrilación auricular del estudio RE-LY tratados con 150 mg dos veces al día, un valor de aPTT de más de 2,0-3,0 veces el rango normal en el nivel valle estuvo asociado con un riesgo incrementado de sangrado.
Los estudios farmacocinéticos revelaron un aumento de la exposición al fármaco en los pacientes con función renal disminuida, incluidos aquellos con deterioro de la función renal a consecuencia de la edad.
PRADAXA® está contraindicado en los casos de insuficiencia renal grave (ClCr <30 ml/min).
Debe interrumpirse el uso de PRADAXA® en los pacientes que desarrollen falla renal aguda.
Determinados factores, tales como un deterioro de la función renal (ClCr 30-50 ml/min), edad ≥75 años o coadministración con inhibidores potentes de la glucoproteína P (P-gp) están asociados con niveles plasmáticos incrementados de dabigatrán. La presencia de uno o varios de estos factores puede incrementar el riesgo de sangrado (ver Posología y administración).
El uso concomitante de PRADAXA® junto con los siguientes tratamientos no ha sido estudiado y puede aumentar el riesgo de sangrado: heparinas no fraccionadas (excepto en las dosis necesarias para mantener permeable un catéter arterial o venoso central, o durante la ablación con catéter de la fibrilación auricular) y derivados de la heparina, heparinas de bajo peso molecular (HBPM), fondaparinux, desirudina, trombolíticos, antagonistas de los receptores GPIIb/IIIa, ticlopidina, dextrano, sulfinpirazona, rivaroxaban, prasugrel, antagonistas de la vitamina K e inhibidores de la P-gp tales como, entre otros, itraconazol, tacrolimús, ciclosporina, ritonavir, tipranavir, nelfinavir y saquinavir.
Se ha demostrado que el uso concomitante de PRADAXA® con la combinación a dosis fija de los inhibidores de la P-gp glecaprevir/pibrentasvir incrementa la exposición a dabigatrán y puede aumentar el riesgo de sangrado.
El uso concomitante de dronedarona incrementa la exposición a dabigatrán y, por ende, no está recomendado (ver PK en poblaciones específicas).
El uso concomitante de ticagrelor aumenta la exposición a dabigatrán y puede involucrar una interacción farmacodinámica, lo cual podría dar lugar a un riesgo incrementado de sangrado.
El riesgo de sangrado puede estar incrementado en los pacientes tratados en forma concomitante con inhibidores selectivos de la recaptación de serotonina (ISRS) o inhibidores selectivos de la recaptación de serotonina-norepinefrina (ISRSN).
• Uso de fibrinolíticos para el tratamiento del accidente cerebrovascular isquémico agudo:
Puede considerarse el uso de fibrinolíticos para el tratamiento del accidente cerebrovascular isquémico agudo si el paciente presenta un tiempo de trombina (TT) o un tiempo de coagulación por ecarina (ECT), o un tiempo parcial de tromboplastina activada (aPTT) que no supere el límite normal superior (LNS) según los valores de referencia del laboratorio local para los adultos.
En situaciones en las que existe un riesgo incrementado de hemorragia (p. ej., un traumatismo importante o una biopsia reciente, o endocarditis bacteriana) generalmente se requiere una observación estrecha del paciente (en pos de signos de sangrado o anemia).
Prevención de los eventos de tromboembolia venosa en pacientes sometidos a una cirugía ortopédica mayor: Se ha comprobado que los AINE administrados para la analgesia perioperatoria a corto plazo no están asociados con un aumento del riesgo de sangrado cuando se administran en forma conjunta con PRADAXA®. Existe evidencia clínica limitada en torno al uso de AINE comunes con vidas medias de menos de 12 horas durante el tratamiento con PRADAXA®, la cual no brinda ningún indicio de un riesgo adicional de sangrado.
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: La administración conjunta de antiplaquetarios (incluidos el AAS y el clopidogrel) y tratamientos con AINE aumenta el riesgo de sangrado. Específicamente, el riesgo de sangrado importante, incluido el sangrado gastrointestinal, se incrementa con la toma concomitante de antiplaquetarios o inhibidores potentes de la P-gp en los pacientes de ≥75 años.
Ante una sospecha clínica de sangrado, se sugiere la implementación de las medidas apropiadas, como una prueba de detección de sangre oculta en heces, o una medición de los valores de hemoglobina para detectar un posible descenso de la hemoglobina.
• Interacción con inductores de la P-gp:
El uso concomitante de PRADAXA® con un inductor potente de la P-gp como es la rifampicina reduce las concentraciones plasmáticas de dabigatrán. También es dable esperar que otros inductores de la P-gp, tales como la hierba de San Juan o la carbamazepina, reduzcan las concentraciones de dabigatrán en plasma y, por lo tanto, deben coadministrarse con precaución (ver Interacciones y PK en poblaciones específicas).
• Pacientes con síndrome antifosfolipídico:
No se recomienda el uso de anticoagulantes orales de acción directa (ACOD) como dabigatrán etexilato en pacientes con antecedentes de trombosis a los que se les haya diagnosticado síndrome antifosfolipídico. Particularmente en pacientes con triple positividad (anticoagulante lúpico, anticuerpos anticardiolipina y anticuerpos anti-beta 2-glucoproteína I), el tratamiento con ACOD podría asociarse a mayores tasas de episodios trombóticos recurrentes que el tratamiento con antagonistas de la vitamina K.
• Cirugías e intervenciones:
Los pacientes bajo tratamiento con PRADAXA® que sean sometidos a una cirugía o a procedimientos invasivos tienen un riesgo incrementado de sangrado. Por lo tanto, las intervenciones quirúrgicas pueden requerir de una suspensión temporal de PRADAXA® (ver Farmacocinética).
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: Los pacientes pueden continuar bajo tratamiento con PRADAXA® durante la cardioversión. No es necesario interrumpir el tratamiento con PRADAXA® (150 mg dos veces al día) en los pacientes sometidos a ablación con catéter de la fibrilación auricular (ver Dosis y administración).
Para el caso de cirugías de emergencia o procedimientos de urgencia en los que se requiere una rápida reversión del efecto anticoagulante, para los pacientes adultos existe un agente reversor específico (PRAXBIND®, idarucizumab) capaz de revertir la acción de PRADAXA®.
La reversión de la terapia con dabigatrán expone al paciente al riesgo de trombosis de su enfermedad de base.
El tratamiento con PRADAXA® puede reiniciarse 24 horas después de la administración de PRAXBIND® (idarucizumab), en tanto el paciente esté clínicamente estable y se haya logrado una hemostasia adecuada.
• Fase preoperatoria:
Antes de la realización de procedimientos invasivos o quirúrgicos, la administración de PRADAXA® puede interrumpirse temporalmente, en vista del mayor riesgo de sangrado que existe en dichos casos.
Cirugía de emergencia o procedimiento de urgencia: Existe disponible el agente reversor específico (PRAXBIND®, idarucizumab) de PRADAXA® para la rápida reversión del efecto anticoagulante (ver la sección Cirugías e intervenciones).
— Intervención/cirugía aguda: La administración de PRADAXA® debe interrumpirse temporalmente. Una intervención/cirugía por un cuadro agudo debe demorarse, de ser posible, hasta que hayan transcurrido al menos 12 horas desde la última dosis. Si la cirugía no puede postergarse, puede haber un riesgo incrementado de sangrado.
— Intervención/cirugía programada: De ser posible, PRADAXA® debe interrumpirse al menos 24 horas antes de los procedimientos invasivos o quirúrgicos. En los pacientes con un riesgo incrementado de sangrado o en los casos de cirugía mayor en los que puede ser necesaria una hemostasia completa, debe considerarse la posibilidad de interrumpir el tratamiento con PRADAXA® 2-4 días antes de la cirugía. La depuración de dabigatrán en los pacientes con insuficiencia renal puede ser más lenta. Esto debe ser tomado en consideración antes de realizar cualquier procedimiento (ver la Tabla 5 y también la sección Farmacocinética).
En la Tabla 5 se resumen las reglas para la interrupción de dabigatrán previo a la realización de procedimientos quirúrgicos o invasivos.
|
Tabla 5. Resumen de las reglas para la interrupción de dabigatrán previo a la realización de procedimientos quirúrgicos o invasivos |
|||
|
Función renal (ClCr en ml/min) |
Vida media estimada (horas) |
Interrumpir la toma de dabigatrán antes de la cirugía programada |
|
|
Riesgo elevado de sangrado o cirugía mayor |
Riesgo estándar |
||
|
≥80 |
~ 13* |
2 días antes |
24 horas antes |
|
≥50 <80 |
~ 15* |
23 días antes |
12 días antes |
|
≥30 <50 |
~ 18* |
4 días antes |
23 días antes (>48 horas) |
|
*Para acceder a información más detallada, ver la Tabla 17 en la sección “Farmacocinética” |
|||
PRADAXA® está contraindicado en los pacientes con insuficiencia renal grave (ClCr <30 ml/min) pero, si se diera el caso, la administración de PRADAXA® debe interrumpirse al menos 5 días antes de la cirugía mayor.
Anestesia raquídea/anestesia epidural/punción lumbar: Procedimientos como la anestesia raquídea pueden requerir de una función hemostática completa.
El riesgo de un hematoma espinal o epidural puede resultar incrementado en los casos de punción traumática o repetitiva y también por el uso prolongado de catéteres epidurales. Tras la remoción de un catéter, debe dejarse transcurrir un intervalo de por lo menos 1 hora antes de la administración de la primera dosis de PRADAXA®. Estos pacientes requieren de una observación frecuente en pos de signos y síntomas neurológicos de hematomas espinales o epidurales.
Período posprocedimiento: El tratamiento con PRADAXA® puede reanudarse / iniciarse una vez lograda una hemostasia completa.
POSOLOGÍA Y ADMINISTRACIÓN:
Posología:
• Adultos:
— Prevención primaria de la tromboembolia venosa (TEV):
Prevención de la tromboembolia venosa (TEV) en pacientes que han sido sometidos a una cirugía ortopédica mayor: La dosis recomendada de PRADAXA® es 220 mg una vez al día, administrada como 2 cápsulas de 110 mg. Los pacientes con insuficiencia renal moderada están expuestos a un riesgo incrementado de sangrado. Para dichos pacientes, la dosis recomendada de PRADAXA® es 150 mg una vez al día, administrada como 2 cápsulas de 75 mg.
Prevención de la tromboembolia venosa (TEV) luego de una cirugía de reemplazo de rodilla: El tratamiento con PRADAXA® debe iniciarse por vía oral dentro de un lapso de 1-4 horas de completada la cirugía, con una cápsula sola (110 mg), y posteriormente debe continuarse con 2 cápsulas una vez al día durante un total de 10 días. Si la hemostasia no está asegurada, el inicio del tratamiento debe postergarse. Si el tratamiento no se inicia en el día de la cirugía, en ese caso deberá iniciarse con 2 cápsulas administradas una vez al día.
Prevención de la tromboembolia venosa (TEV) luego de una cirugía de reemplazo de cadera: El tratamiento con PRADAXA® debe iniciarse por vía oral dentro de un lapso de 1-4 horas de completada la cirugía, con una cápsula sola (110 mg), y posteriormente debe continuarse con 2 cápsulas una vez al día durante un total de 28 - 35 días. Si la hemostasia no está asegurada, el inicio del tratamiento debe postergarse. Si el tratamiento no se inicia en el día de la cirugía, en ese caso deberá iniciarse con 2 cápsulas administradas una vez al día.
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: La dosis diaria recomendada de PRADAXA® es 300 mg administrada por vía oral como cápsulas duras de 150 mg dos veces al día. El tratamiento debe continuarse de por vida.
Alternativo a la Warfarina en el tratamiento de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) aguda: La dosis diaria recomendada de PRADAXA® es 300 mg administrada por vía oral como cápsulas duras de 150 mg dos veces al día luego del tratamiento con un anticoagulante parenteral durante un mínimo de 5 días. El tratamiento debe continuarse por un lapso de hasta 6 meses.
Alternativo a la Warfarina en la prevención de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) recurrente: La dosis diaria recomendada de PRADAXA® es 300 mg administrada por vía oral como cápsulas duras de 150 mg dos veces al día. El tratamiento puede continuarse de por vida dependiendo del riesgo de cada caso en particular.
• Población pediátrica:
Prevención de eventos de tromboembolia venosa en pacientes que han sido sometidos a una cirugía ortopédica mayor: PRADAXA® no ha sido investigado en pacientes de <18 años. El tratamiento con PRADAXA® en pacientes pediátricos no está recomendado.
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: PRADAXA® no ha sido investigado en pacientes de <18 años. El tratamiento con PRADAXA® en pacientes pediátricos no está recomendado.
Alternativo a la Warfarina en el tratamiento de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) aguda: No está registrado el tratamiento con PRADAXA® en pacientes pediátricos en la indicación de tratamiento de la TVP y/o la EP aguda.
Alternativo a la Warfarina en la prevención de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) recurrente: No está registrado el tratamiento con PRADAXA® en pacientes pediátricos en la indicación de prevención de la TVP y/o la EP recurrente.
— Insuficiencia renal:
La función renal debe evaluarse mediante el cálculo de la depuración de creatinina (ClCr) antes del inicio del tratamiento con PRADAXA® a fin de excluir del tratamiento con este fármaco a los pacientes con insuficiencia renal grave (es decir, ClCr <30 ml/min). No hay datos que respalden el uso en pacientes con insuficiencia renal grave (ClCr <30 ml/min); el tratamiento con PRADAXA® en esta población no está recomendado (ver Contraindicaciones).
La función renal debe ser evaluada durante el tratamiento en ciertas circunstancias clínicas en las que exista sospecha de que dicha función podría reducirse o deteriorarse (como en el caso de hipovolemia, deshidratación y con coadministración de determinados medicamentos, etc.).
El dabigatrán puede eliminarse mediante diálisis; existe experiencia clínica limitada de los estudios clínicos en torno a la utilidad de este abordaje.
Prevención de los eventos de tromboembolia venosa en pacientes sometidos a una cirugía ortopédica mayor: La posología de PRADAXA® debe reducirse a 150 mg una vez al día, administrada como 2 cápsulas de 75 mg en los pacientes con insuficiencia renal moderada (ClCr 30-50 ml/min).
Prevención de los eventos de tromboembolia venosa luego de una cirugía de reemplazo de rodilla o de cadera: El tratamiento con PRADAXA® debe iniciarse por vía oral dentro de un lapso de 1-4 horas de completada la cirugía, con una cápsula sola de 75 mg, y posteriormente debe continuarse con 2 cápsulas de 75 mg una vez al día durante un total de 10 días (luego de una cirugía de reemplazo de rodilla) o 28-35 días (luego de una cirugía de reemplazo de cadera). En ambas cirugías, si la hemostasia no está asegurada, el inicio del tratamiento debe postergarse. Si el tratamiento no se inicia en el día de la cirugía, en ese caso deberá iniciarse con 2 cápsulas administradas una vez al día.
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: En los pacientes con insuficiencia renal moderada (ClCr 30-50 ml/min), la función renal debe controlarse como mínimo una vez al año.
No se requiere ningún ajuste de la dosis; los pacientes deben ser tratados con una dosis diaria de 300 mg administrada por vía oral como cápsulas duras de 150 mg dos veces al día.
Alternativo a la Warfarina en el tratamiento de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) aguda: No es necesario ningún ajuste de la dosis en los pacientes con valores de función renal (ClCr) superiores a 30 ml/min. Los pacientes deben ser tratados con una dosis diaria de 300 mg administrada por vía oral como cápsulas duras de 150 mg dos veces al día.
Alternativo a la Warfarina en la prevención de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) recurrente: En los pacientes con insuficiencia renal moderada (ClCr 30-50 ml/min), la función renal debe controlarse como mínimo una vez al año.
No es necesario ningún ajuste de la dosis en los pacientes con valores de función renal (ClCr) superiores a 30 ml/min. Los pacientes deben ser tratados con una dosis diaria de 300 mg administrada por vía oral como cápsulas duras de 150 mg dos veces al día.
• Pacientes de edad avanzada:
Prevención de los eventos de tromboembolia venosa en pacientes sometidos a una cirugía ortopédica mayor: En vista de que la insuficiencia renal es frecuente en los pacientes de edad avanzada (>75 años), en dichos pacientes la función renal debe evaluarse mediante el cálculo de la depuración de creatinina (ClCr) antes del inicio del tratamiento con PRADAXA® a fin de excluir del tratamiento con este fármaco a los pacientes que tengan insuficiencia renal grave (es decir, ClCr <30 ml/min). La función renal también debe ser evaluada en aquellas circunstancias clínicas en las que exista sospecha de que podría producirse un deterioro o una reducción de dicha función (como en el caso de hipovolemia, deshidratación y con coadministración de determinados medicamentos, etc.).
No se requiere ningún ajuste de la dosis; los pacientes deben ser tratados con una dosis diaria de 220 mg de PRADAXA® una vez al día, administrada como 2 cápsulas de 110 mg.
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: En vista de que la insuficiencia renal es frecuente en los pacientes de edad avanzada (>75 años), en dichos pacientes la función renal debe evaluarse mediante el cálculo de la depuración de creatinina (ClCr) antes del inicio del tratamiento con PRADAXA® a fin de excluir del tratamiento con este fármaco a los pacientes que tengan insuficiencia renal grave (es decir, ClCr <30 ml/min). En los pacientes tratados con PRADAXA®, la función renal también debe ser evaluada como mínimo una vez por año, o con una frecuencia mayor en el caso de que así lo ameriten circunstancias clínicas específicas en las que exista sospecha de que podría producirse un deterioro o una reducción de dicha función (como en el caso de hipovolemia, deshidratación y con coadministración de determinados medicamentos, etc.).
Los pacientes de 80 años o más deben ser tratados con una dosis diaria de 220 mg administrada por vía oral como cápsulas duras de 110 mg dos veces al día.
Alternativo a la Warfarina en el tratamiento de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) aguda: En vista de que la insuficiencia renal es frecuente en los pacientes de edad avanzada (>75 años), en dichos pacientes la función renal debe evaluarse mediante el cálculo de la depuración de creatinina (ClCr) antes del inicio del tratamiento con PRADAXA® a fin de excluir del tratamiento con este fármaco a los pacientes que tengan insuficiencia renal grave (es decir, ClCr <30 ml/min). La función renal también debe ser evaluada en los pacientes tratados con PRADAXA® según sea necesario en aquellas circunstancias clínicas en las que exista sospecha de que podría producirse un deterioro o una reducción de dicha función (como en el caso de hipovolemia, deshidratación, y con coadministración de determinados medicamentos, etc.).
No se requiere ningún ajuste de la dosis; los pacientes deben ser tratados con una dosis diaria de 300 mg administrada por vía oral como cápsulas duras de 150 mg dos veces al día.
Alternativa a la Warfarina en la prevención de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) recurrente: En vista de que la insuficiencia renal es frecuente en los pacientes de edad avanzada (>75 años), en dichos pacientes la función renal debe evaluarse mediante el cálculo de la depuración de creatinina (ClCr) antes del inicio del tratamiento con PRADAXA® a fin de excluir del tratamiento con este fármaco a los pacientes que tengan insuficiencia renal grave (es decir, ClCr <30 ml/min). En los pacientes tratados con PRADAXA®, la función renal también debe ser evaluada como mínimo una vez por año, o con una frecuencia mayor en el caso de que así lo ameriten circunstancias clínicas específicas en las que exista sospecha de que podría producirse un deterioro o una reducción de dicha función (como en el caso de hipovolemia, deshidratación y con coadministración de determinados medicamentos, etc.).
No se requiere ningún ajuste de la dosis; los pacientes deben ser tratados con una dosis diaria de 300 mg administrada por vía oral como cápsulas duras de 150 mg dos veces al día.
Los estudios de farmacocinética realizados en pacientes de edad avanzada indicaron un incremento de la exposición al fármaco en los pacientes con deterioro de la función renal a consecuencia de la edad.
(Ver también Posología y administración en insuficiencia renal).
• Peso: No se requiere ningún ajuste de la dosis.
• Uso concomitante de PRADAXA® con inhibidores potentes de glucoproteína P, como amiodarona, quinidina o verapamilo:
Prevención de los eventos de tromboembolia venosa en pacientes sometidos a una cirugía ortopédica mayor: La posología de PRADAXA® debe reducirse a una dosis de 150 mg administrada una vez al día como 2 cápsulas de 75 mg en los pacientes que reciban amiodarona, quinidina o verapamilo en forma concomitante con el tratamiento con PRADAXA® (ver Interacciones). Debe evitarse el inicio del tratamiento con verapamilo en los pacientes que han sido sometidos a una cirugía ortopédica mayor y ya están siendo tratados con PRADAXA®. También debe evitarse el inicio simultáneo del tratamiento con PRADAXA® y verapamilo.
Prevención de los eventos de tromboembolia venosa luego de una cirugía de reemplazo de rodilla o de cadera: El tratamiento con PRADAXA® debe iniciarse por vía oral dentro de un lapso de 1-4 horas de completada la cirugía, con una cápsula sola de 75 mg, y posteriormente debe continuarse con 2 cápsulas de 75 mg una vez al día durante un total de 10 días (luego de una cirugía de reemplazo de rodilla) o 28-35 días (luego de una cirugía de reemplazo de cadera). En ambas cirugías, si la hemostasia no está asegurada, el inicio del tratamiento debe postergarse. Si el tratamiento no se inicia en el día de la cirugía, en ese caso deberá iniciarse con 2 cápsulas administradas una vez al día.
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: No se requiere ningún ajuste de la dosis; los pacientes deben ser tratados con una dosis diaria de 300 mg administrada por vía oral como cápsulas duras de 150 mg dos veces al día.
Alternativo a la Warfarina en el tratamiento de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) aguda: No se requiere ningún ajuste de la dosis; los pacientes deben ser tratados con una dosis diaria de 300 mg administrada por vía oral como cápsulas duras de 150 mg dos veces al día.
Alternativo a la Warfarina en la prevención de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) recurrente: No se requiere ningún ajuste de la dosis; los pacientes deben ser tratados con una dosis diaria de 300 mg administrada por vía oral como cápsulas duras de 150 mg dos veces al día.
• Pacientes con riesgo de sangrado:
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: La presencia de los factores que se indican a continuación puede incrementar el riesgo de sangrado: p. ej., edad ≥75 años, insuficiencia renal moderada (ClCr 30-50 ml/min), tratamiento concomitante con inhibidores potentes de la glucoproteína P (ver “PK en poblaciones específicas”), antiplaquetarios o sangrado gastrointestinal previo (ver “Advertencias y precauciones especiales”). En los pacientes con uno o varios de estos factores de riesgo, puede considerarse la opción de una dosis diaria reducida de 220 mg administrada como dosis de 110 mg dos veces al día, a criterio del médico.
Alternativo a la Warfarina en el tratamiento de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) aguda: La presencia de los factores que se indican a continuación puede incrementar el riesgo de sangrado: p. ej., edad ≥75 años, insuficiencia renal moderada (ClCr 30-50 ml/min) o sangrado gastrointestinal previo (ver Advertencias y precauciones especiales).
No se requieren ajustes de la dosis en los pacientes que tienen un solo factor de riesgo.
Existen datos clínicos limitados en relación con los pacientes con múltiples factores de riesgo.
En estos pacientes, PRADAXA® debe administrarse únicamente en los casos en que el beneficio previsto supere los riesgos de sangrado.
Alternativo a la Warfarina en la prevención de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) recurrente: La presencia de los factores que se indican a continuación puede incrementar el riesgo de sangrado: p. ej., edad ≥75 años, insuficiencia renal moderada (ClCr 30-50 ml/min) o sangrado gastrointestinal previo (ver Advertencias y precauciones especiales).
No se requieren ajustes de la dosis en los pacientes que tienen un solo factor de riesgo.
Existen datos clínicos limitados en relación con los pacientes con múltiples factores de riesgo.
En estos pacientes, PRADAXA® debe administrarse únicamente en los casos en que el beneficio previsto supere los riesgos de sangrado.
• Cambio del tratamiento con PRADAXA® a anticoagulantes parenterales:
Prevención de los eventos de tromboembolia venosa en pacientes sometidos a una cirugía ortopédica mayor: Debe dejarse transcurrir un lapso de 24 horas luego de la última dosis antes de cambiar del tratamiento con PRADAXA® a un anticoagulante parenteral.
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: Debe dejarse transcurrir un lapso de 12 horas luego de la última dosis antes de cambiar del tratamiento con PRADAXA® a un anticoagulante parenteral.
Alternativo a la Warfarina en el tratamiento de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) aguda: Debe dejarse transcurrir un lapso de 12 horas luego de la última dosis antes de cambiar del tratamiento con PRADAXA® a un anticoagulante parenteral.
Alternativo a la Warfarina en la prevención de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) recurrente: Debe dejarse transcurrir un lapso de 12 horas luego de la última dosis antes de cambiar del tratamiento con PRADAXA® a un anticoagulante parenteral.
• Cambio del tratamiento con un anticoagulante parenteral a PRADAXA®
PRADAXA® debe administrarse 0-2 horas antes del momento que estaba designado para la administración de la dosis siguiente de la terapia alternativa o bien en el momento de la interrupción en el caso de un tratamiento continuo (p. ej., heparina no fraccionada (HNF) administrada por vía intravenosa).
• Cambio del tratamiento con antagonistas de la vitamina K a PRADAXA®
Prevención del accidente cerebrovascular y la embolia sistémica con fibrilación auricular: Debe suspenderse el antagonista de la vitamina K. La administración de PRADAXA® puede realizarse tan pronto como el valor de RIN sea <2,0.
Alternativo a la Warfarina en el tratamiento de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) aguda: Debe suspenderse el antagonista de la vitamina K. La administración de PRADAXA® puede realizarse tan pronto como el valor de RIN sea <2,0.
Alternativo a la Warfarina en la prevención de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) recurrente: Debe suspenderse el antagonista de la vitamina K. La administración de PRADAXA® puede realizarse tan pronto como el valor de RIN sea <2,0.
• Cambio del tratamiento con PRADAXA® a antagonistas de la vitamina K (AVK):
— Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular:
El momento del inicio de los AVK debe ajustarse sobre la base del valor de ClCr del paciente, según se indica a continuación: ClCr ≥50 ml/min, iniciar el tratamiento con AVK 3 días antes de interrumpir el tratamiento con dabigatrán etexilato.
ClCr ≥30 - <50 ml/min, iniciar el tratamiento con AVK 2 días antes de interrumpir el tratamiento con dabigatrán etexilato.
— Alternativo a la Warfarina en el tratamiento de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) aguda:
El momento del inicio de los AVK debe ajustarse sobre la base del valor de ClCr del paciente, según se indica a continuación: ClCr ≥50 ml/min, iniciar el tratamiento con AVK 3 días antes de interrumpir el tratamiento con dabigatrán etexilato.
ClCr ≥30 - <50 ml/min, iniciar el tratamiento con AVK 2 días antes de interrumpir el tratamiento con dabigatrán etexilato.
— Alternativo a la Warfarina en la prevención de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) recurrente:
El momento del inicio de los AVK debe ajustarse sobre la base del valor de ClCr del paciente, según se indica a continuación: ClCr ≥50 ml/min, iniciar el tratamiento con AVK 3 días antes de interrumpir el tratamiento con dabigatrán etexilato.
ClCr ≥30 - <50 ml/min, iniciar el tratamiento con AVK 2 días antes de interrumpir el tratamiento con dabigatrán etexilato.
• Cardioversión:
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: Los pacientes pueden continuar bajo tratamiento con PRADAXA® durante la cardioversión.
• Ablación con catéter de la fibrilación auricular:
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: La ablación con catéter puede realizarse en pacientes bajo tratamiento con 150 mg de PRADAXA® dos veces al día. No es necesario interrumpir el tratamiento con PRADAXA® (ver Propiedades farmacológicas).
• Intervención coronaria percutánea (ICP) con colocación de stent:
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: Los pacientes con fibrilación auricular no valvular que sean sometidos a una ICP con colocación de stent pueden ser tratados con PRADAXA® en combinación con antiplaquetarios después de haberse logrado la hemostasia (ver Propiedades farmacológicas).
• Dosis omitidas:
Prevención de los eventos de tromboembolia venosa en pacientes sometidos a una cirugía ortopédica mayor: Continuar con las dosis diarias restantes de PRADAXA® a la misma hora del día siguiente.
No debe administrarse una dosis doble para compensar la dosis omitida.
Prevención del accidente cerebrovascular y la embolia sistémica en pacientes con fibrilación auricular: La dosis de PRADAXA® que haya sido omitida puede tomarse hasta 6 horas antes de la siguiente dosis programada. Dentro del lapso de 6 horas previo a la siguiente dosis programada, la dosis omitida no debe ser administrada.
No debe administrarse una dosis doble para compensar la dosis omitida.
Alternativo a la Warfarina en el tratamiento de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) aguda: La dosis de PRADAXA® que haya sido omitida puede tomarse hasta 6 horas antes de la siguiente dosis programada. Dentro del lapso de 6 horas previo a la siguiente dosis programada, la dosis omitida no debe ser administrada.
No debe administrarse una dosis doble para compensar la dosis omitida.
Alternativo a la Warfarina en la prevención de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) recurrente: La dosis de PRADAXA® que haya sido omitida puede tomarse hasta 6 horas antes de la siguiente dosis programada. Dentro del lapso de 6 horas previo a la siguiente dosis programada, la dosis omitida no debe ser administrada.
No debe administrarse una dosis doble para compensar la dosis omitida.
Modo de administración: PRADAXA® cápsulas duras se puede tomar junto con las comidas o alejado de ellas. PRADAXA® debe tomarse con un vaso de agua para facilitar la llegada al estómago. En el caso de presentarse síntomas gastrointestinales, se recomienda que la toma de PRADAXA® se realice junto con una de las comidas principales y/o con un inhibidor de la bomba de protones, como pantoprazol. No abrir la cápsula.
MODO DE EMPLEO / MANIPULACIÓN: Condiciones de almacenamiento: El producto debe conservarse en el envase original para protegerlo de la humedad.
Las cápsulas no deben colocarse en pastilleros ni en organizadores de dosis, a menos que las cápsulas puedan mantenerse dentro del envase original.
• Modo de empleo:
Al retirar una cápsula dura del blíster, deben seguirse las instrucciones que se brindan a continuación:
— Corte el blíster por la línea punteada del troquelado para separar solo una de las cápsulas del resto de la tira.
— Abra el blíster desprendiendo manualmente la lámina metalizada de la parte posterior, y retire la cápsula.
— No presione la cápsula contra la lámina metalizada para abrir el blíster.
INDICACIONES/USO:
• PRADAXA® 75 mg: Anticoagulante en prevención de eventos venosos tromboembólicos en pacientes que requieran cirugía ortopédica mayor.
• PRADAXA® 110 mg: Anticoagulante en prevención de eventos venosos tromboembólicos en pacientes que requieran cirugía ortopédica mayor.
Prevención del accidente cerebrovascular y del embolismo sistémico en pacientes con fibrilación auricular.
• PRADAXA® 150 mg:
— Prevención del accidente cerebrovascular y del embolismo sistémico en pacientes con fibrilación auricular.
— Alternativo a la warfarina en el tratamiento de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) aguda.
— Alternativo a la warfarina en la prevención de la trombosis venosa profunda (TVP) y/o la embolia pulmonar (EP) recurrente.
SOBREDOSIS: Síntomas: La sobredosis luego de la administración de PRADAXA® puede conducir a complicaciones hemorrágicas debido a las propiedades farmacodinámicas de este fármaco. Las dosis de PRADAXA® mayores a las recomendadas exponen al paciente a un riesgo incrementado de sangrado.
Tratamiento: En el caso de producirse complicaciones hemorrágicas, debe suspenderse el tratamiento y debe investigarse el origen del sangrado. En vista de que el dabigatrán se excreta predominantemente por vía renal, debe mantenerse una diuresis adecuada.
Dependiendo de la situación clínica, debe instaurarse un tratamiento estándar adecuado, tal como hemostasia quirúrgica, según esté indicado y reposición del volumen sanguíneo.
Para pacientes adultos en situaciones en las que se requiere una rápida reversión, está disponible el agente reversor específico (PRAXBIND®, idarucizumab) que antagoniza el efecto farmacodinámico de PRADAXA®. (Ver las secciones Advertencias y precauciones especiales, Cirugías e intervenciones y Fase preoperatoria).
También puede considerarse el uso de sangre total fresca o plasma fresco congelado.
Puede tomarse en consideración el uso de concentración de factores de coagulación (activados o no activados) o Factor recombinante VIIa. Existe cierta evidencia experimental que respalda el rol de estos agentes en la reversión del efecto anticoagulante del dabigatrán, pero su utilidad en el contexto clínico aún no ha sido demostrada sistemáticamente. También debe considerarse la administración de concentrados de plaquetas en los cuadros de trombocitopenia o en los casos en que se hayan utilizado antiplaquetarios de acción prolongada. Todos los tratamientos sintomáticos deben ser instaurados a criterio del médico a cargo del tratamiento.
Dado que su grado de unión a las proteínas es bajo, el dabigatrán puede ser eliminado mediante diálisis; sin embargo, existe experiencia clínica limitada en torno al uso de la diálisis en este contexto (ver PK en poblaciones específicas).
TOXICOLOGÍA: Se realizaron estudios de toxicidad oral aguda en ratas y ratones. En ambas especies, la dosis letal aproximada luego de la administración de una dosis oral única fue superior a 2000 mg/kg. En los perros y en los monos Rhesus, la administración oral de 600 mg/kg de dabigatrán etexilato no indujo ningún cambio toxicológicamente significativo.
En estudios de toxicidad de dosis repetidas, de hasta 26 semanas de duración en el caso de las ratas, y de hasta 52 semanas en los monos Rhesus, se utilizaron dosis de hasta 300 mg/kg (equivalente de base libre). En general, estas dosis fueron toleradas sumamente bien tanto en las ratas como en los monos Rhesus. Los problemas de sangrado se observaron en asociación con traumatismos (p. ej., extracción de sangre) dentro de las primeras 4-6 horas posteriores a la administración, y están directamente relacionados con la actividad farmacodinámica de dabigatrán.
Se realizaron estudios de teratología con dosis de hasta 200 mg/kg (equivalente de base libre) en ratas y en conejos. Se observó un leve efecto en la morfogénesis de los fetos en las ratas con las dosis de 200 mg/kg (equivalente de base libre). No se observaron efectos teratogénicos en los conejos.
En el estudio de fertilidad en ratas, no se observó ningún hallazgo parental que fuera digno de mención desde el punto de vista toxicológico. En cuanto a los parámetros de la camada, se observó una ligera reducción de los cuerpos lúteos y un incremento de las pérdidas preimplantación que condujo a un descenso en la media del número de implantaciones en el grupo de dosis de 200 mg/kg (equivalente de base libre).
Estudios exhaustivos in vitro e in vivo no revelaron evidencia de potencial mutagénico del dabigatrán etexilato. En un estudio de toxicidad juvenil realizado en ratas Han Wistar, la mortalidad estuvo asociada con eventos de sangrado a exposiciones similares, en las cuales se observó sangrado en animales adultos. Tanto en ratas adultas como jóvenes, se considera que la mortalidad está relacionada con la actividad farmacológica excesiva del dabigatrán junto con el empleo de fuerzas mecánicas durante la dosificación y la manipulación. Los datos del estudio de toxicidad juvenil no indicaron un aumento de la sensibilidad a la toxicidad, ni toxicidad específica de animales jóvenes. En estudios de toxicología de lapso vital realizados en ratas y ratones, no hubo evidencia alguna de un potencial carcinogénico de dabigatrán etexilato hasta las dosis máximas de 200 mg/kg (equivalente de base libre).
• Respecto a las frecuencias de las reacciones adversas
— PRADAXA®
Categorías de frecuencia:
— Muy frecuente: ≥ 1/10
— Frecuente: ≥ 1/100 - < 1/10
— Poco frecuente: ≥ 1/1000 - < 1/100
— Rara: ≥ 1/10 000 - < 1/1000
— Muy rara: < 1/10 000
— Frecuencia desconocida: No se puede estimar a partir de los datos disponibles.
Nota: Las categorías de frecuencia mencionadas anteriormente están basadas en la Guía de SmPC de la UE (Septiembre 2009); por consiguiente, en los países no pertenecientes a la Unión Europea pueden resultar aplicables otras definiciones.
|
Tabla 18. Reacciones adversas enumeradas en la IPP y las frecuencias correspondientes según la Guía de SPC de la UE |
||||||
|
Efectos no deseados |
||||||
|
Clasificación por Sistema y órgano Terminología del MedDRA |
Término preferente del MedDRA (versión 15.0) |
Según se consigna en la IPP |
Categorías de frecuencia según la Guía de SPC de la UE |
|||
|
Indicación |
SPAF |
ppTEV |
Tratamiento TVP adultos |
Prevención TVP adultos |
||
|
Pacientes |
12042 |
6684 |
2553 |
2114 |
||
|
Trastornos de la sangre y el sistema linfático |
Anemia |
Anemia |
Frecuente |
Poco frecuente |
Poco frecuente |
Rara |
|
Trombocitopenia |
Trombocitopenia |
Poco frecuente |
Rara |
Rara |
Rara |
|
|
Neutropenia* |
Neutropenia* |
Frecuencia desconocida |
Frecuencia desconocida |
Frecuencia desconocida |
Frecuencia desconocida |
|
|
Agranulocitosis* |
Agranulocitosis* |
Frecuencia desconocida |
Frecuencia desconocida |
Frecuencia desconocida |
Frecuencia desconocida |
|
|
Trastornos del sistema inmunológico |
Hipersensibilidad al fármaco |
Hipersensibilidad al fármaco |
Poco frecuente |
Poco frecuente |
Poco frecuente |
Poco frecuente |
|
Prurito |
Prurito |
Poco frecuente |
Rara |
Rara |
Poco frecuente |
|
|
Exantema |
Exantema |
Poco frecuente |
Rara |
Poco frecuente |
Poco frecuente |
|
|
Trastornos del sistema inmunológico |
Urticaria |
Urticaria |
Rara |
Rara |
Rara |
Rara |
|
Broncoespasmo* |
Broncoespasmo* |
Frecuencia desconocida |
Frecuencia desconocida |
Frecuencia desconocida |
Frecuencia desconocida |
|
|
Reacción anafiláctica * |
Reacción anafiláctica * |
Frecuencia desconocida1 |
Frecuencia desconocida1 |
Frecuencia desconocida1 |
Frecuencia desconocida1 |
|
|
Angioedema |
Angioedema |
Rara |
Rara |
Rara |
Rara |
|
|
Trastornos del sistema nervioso |
Hemorragia intracraneana |
Hemorragia intracraneana |
Poco frecuente |
Rara |
Rara |
Rara |
|
Trastornos vasculares |
Hematoma |
Hematoma |
Poco frecuente |
Poco frecuente |
Poco frecuente |
Poco frecuente |
|
Hemorragia |
Hemorragia |
Poco frecuente |
Rara |
Poco frecuente |
Poco frecuente |
|
|
Trastornos respiratorios, torácicos y mediastínicos |
Epistaxis |
Epistaxis |
Frecuente |
Poco frecuente |
Frecuente |
Frecuente |
|
Hemoptisis |
Hemoptisis |
Poco frecuente |
Rara |
Poco frecuente |
Poco frecuente |
|
|
Trastornos gastrointestinales |
Hemorragia gastrointestinal |
Hemorragia gastrointestinal |
Frecuente |
Poco frecuente |
Frecuente |
Frecuente |
|
Dolor abdominal |
Dolor abdominal |
Frecuente |
Rara |
Poco frecuente |
Poco frecuente |
|
|
Diarrea |
Diarrea |
Frecuente |
Poco frecuente |
Poco frecuente |
Poco frecuente |
|
|
Dispepsia |
Dispepsia |
Frecuente |
Rara |
Frecuente |
Frecuente |
|
|
Disfagia |
Disfagia |
Poco frecuente |
Rara |
Rara |
Rara |
|
|
Úlcera gastrointestinal |
Úlcera gastrointestinal |
Poco frecuente |
Rara |
Poco frecuente |
Rara |
|
|
Gastroesofagitis |
Gastroesofagitis |
Poco frecuente |
Rara |
Poco frecuente |
Poco frecuente |
|
|
Enfermedad de reflujo gastroesofágico |
Enfermedad de reflujo gastroesofágico |
Poco frecuente |
Rara |
Poco frecuente |
Poco frecuente |
|
|
Náuseas |
Náuseas |
Frecuente |
Poco frecuente |
Poco frecuente |
Poco frecuente |
|
|
Vómitos |
Vómitos |
Poco frecuente |
Poco frecuente |
Poco frecuente |
Poco frecuente |
|
|
Trastornos hepatobiliares |
Función hepática anormal |
Función hepática anormal |
Poco frecuente |
Frecuente |
Poco frecuente |
Poco frecuente |
|
Trastornos de la piel y del tejido subcutáneo |
Hemorragia cutánea |
Hemorragia cutánea |
Frecuente |
Poco frecuente |
Frecuente |
Frecuente |
|
Alopecia* |
Alopecia* |
Frecuencia desconocida |
Frecuencia desconocida |
Frecuencia desconocida |
Frecuencia desconocida |
|
|
Trastornos musculoesqueléticos, óseos y del tejido conjuntivo |
Hemartrosis |
Hemartrosis |
Rara |
Poco frecuente |
Poco frecuente |
Rara |
|
Trastornos renales y urinarios |
Hemorragia urogenital |
Hemorragia urogenital |
Frecuente |
Poco frecuente |
Frecuente |
Frecuente |
|
Hematuria |
Hematuria |
Frecuente |
Poco frecuente |
Frecuente |
Frecuente |
|
|
Trastornos generales y afecciones del sitio de administración |
Hemorragia en el lugar de la inyección |
Hemorragia en el lugar de la inyección |
Rara |
Rara |
Rara |
Rara |
|
Hemorragia en el lugar del catéter |
Hemorragia en el lugar del catéter |
Rara |
Rara |
Rara |
Rara |
|
|
Lesiones, intoxicaciones y complicaciones del procedimiento |
Hemorragia traumática |
Hemorragia traumática |
Rara |
Poco frecuente |
Poco frecuente |
Rara |
|
Hemorragia en el lugar de la incisión |
Hemorragia en el lugar de la incisión |
Rara |
Rara |
Rara |
Rara |
|
|
* En los estudios clínicos, estos efectos secundarios no se informaron como RAM (solo EA); por lo tanto, no fue posible calcular una frecuencia. Cálculo de la frecuencia de efectos secundarios sobre la base de la experiencia posterior a la comercialización. 1 En aquellos efectos secundarios para los cuales no se han informado reacciones adversas en los conjuntos de datos de referencia, las frecuencias se estimaron conforme a la Guía de SmPC de la UE de septiembre de 2009 sobre informes espontáneos de reacciones adversas, es decir, el límite superior del intervalo de confianza del 95 % para la estimación puntual de 3/N donde N representa el tamaño total de la muestra utilizada para el cálculo, que es de 6,684 pacientes (ppTEV), 12.042 pacientes (SPAF), 2.456 pacientes (tratamiento TVP adultos) y 2.114 pacientes (prevención TVP adultos). Como consecuencia, la frecuencia de dichos efectos secundarios se consideró ‘rara’ para las indicaciones de ppTEV (3/6.684 = 0,04 %) y SPAF (3/12.042 = 0,02 %) y ‘poco frecuente’ para las indicaciones de tratamiento TVP adultos (3/2.456 = 0,12 %) y prevención TVP adultos (3/2.114 = 0,14). |
||||||
|
Tabla 19. Efectos secundarios identificados únicamente para la indicación: ppTEV |
||||||
|
Efectos no deseados |
||||||
|
Clasificación por Sistema y órgano Terminología del MedDRA |
Término preferente del MedDRA (versión 15.0) |
Según se consigna en la IPP |
Categorías de frecuencia según la Guía de SPC de la UE |
|||
|
Indicación |
SPAF |
ppTEV |
Tratamiento TVP adultos |
Prevención TVP adultos |
||
|
Pacientes |
12042 |
6684 |
2553 |
2114 |
||
|
Trastornos vasculares |
Hemorragia de herida |
Hemorragia de herida |
No corr. |
Poco frecuente |
No corr. |
No corr. |
|
Trastornos generales y afecciones del sitio de administración |
Secreción sanguinolenta |
Secreción sanguinolenta |
No corr. |
Rara |
No corr. |
No corr. |
|
Lesiones, intoxicaciones y complicaciones del procedimiento |
Hematoma posprocedimiento |
Hematoma posprocedimiento |
No corr. |
Poco frecuente |
No corr. |
No corr. |
|
Hemorragia posprocedimiento |
Hemorragia posprocedimiento |
No corr. |
Poco frecuente |
No corr. |
No corr. |
|
|
Anemia posoperatoria |
Anemia posoperatoria |
No corr. |
Rara |
No corr. |
No corr. |
|
|
Secreción posprocedimiento |
Secreción posprocedimiento |
No corr. |
Poco frecuente |
No corr. |
No corr. |
|
|
Secreción de la herida |
Secreción de la herida |
No corr. |
Poco frecuente |
No corr. |
No corr. |
|
|
Procedimientos médicos y quirúrgicos |
Drenaje de herida |
Drenaje de herida |
No corr. |
Rara |
No corr. |
No corr. |
|
Drenaje posprocedimiento |
Drenaje posprocedimiento |
No corr. |
Rara |
No corr. |
No corr. |
|
PRESENTACIÓN: PRADAXA® 75 mg: Caja con blíster por 30 cápsulas (Reg. San. No. INVIMA 2008M-0008448). PRADAXA® 110 mg: Caja con blíster por 30 y 60 cápsulas (Reg. San. No. INVIMA 2008M-0008446). PRADAXA® 150 mg: Caja con blíster por 30 y 60 cápsulas (Reg. San. No. INVIMA 2021M-0011886-R2)
„¡Almacenar en un lugar seguro; fuera del alcance de los niños!
La información de seguridad del producto puede cambiar, consulte la información vigente en la Dirección Médica.
Teléfono: (601) 319 91 00
e-mail: medfora.co@boehringer-ingelheim.com
Carrera 11 No. 84A-09 Piso 5, Bogotá D.C. Colombia.
BOEHRINGER INGELHEIM S.A.
Versión 23 del 27 de septiembre de 2019