
RENAGEL 800 MG
SEVELÁMERO
Tabletas
Frasco , 180 Tabletas recubiertas , 800 Miligramos
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN
Ingrediente activo: Clorhidrato de sevelamer.
Naturaleza y contenido del contenedor: Las tabletas RENAGEL® son empacadas en botellas blancas de polietileno de alta densidad (PEAD), con una tapa de polipropileno a prueba de niños y un sello de ruptura, en presentación por 180 tabletas.
INDICACIONES: Tratamiento de la hiperfosfatemia en pacientes con insuficiencia renal en estadío terminal sin presentar riesgo de hipercalcemia.
Dicho de otra manera, RENAGEL® está indicado para el control del fósforo sérico en los pacientes con Enfermedad Renal Crónica (ERC) en diálisis. En los pacientes en diálisis, RENAGEL® reduce la incidencia de los episodios de hipercalcemia relacionados con los pacientes con tratamiento de calcio.
FARMACOCINÉTICA
Absorción: Un estudio de equilibrio de masas usando14 C-clorhidrato de sevelamer e 16 voluntarios, hombres y mujeres, sanos mostró que el clorhidrato de sevelamer no es absorbido sistemáticamente. No se han realizado estudios de absorción en pacientes con enfermedad renal.
FARMACODINÁMICA: Los pacientes con enfermedad renal crónica retienen fósforo y pueden desarrollar hiperfosfatemia. Alto fósforo en suero puede precipitar el calcio sérico, lo que resulta en calcificaciones ectópicas. Cuando el producto de las concentraciones séricas de calcio y fósforo (Ca x P) excede 55 mg2/dL2 existe un mayor riesgo de que se presente calcificación ectópica. La hiperfosfatemia tiene parte en el desarrollo de hiperparatiroidismo secundario en la insuficiencia renal. Un aumento en el nivel de la hormona paratiroidea (PTH) es característico de los pacientes con enfermedad renal crónica. El aumento en los niveles de PTH puede inducir osteítis fibrosa.
La disminución en el fósforo en suero puede reducir los niveles de PTH.
El tratamiento de hiperfosfatemia incluye la disminución de la ingesta alimenticia de fosfato, a la inhibición de la absorción de fosfato en el intestino con quelantes de fosfato, y la eliminación del fosfato con la diálisis. RENAGEL® tomado junto con las comidas ha demostrado reducir las concentraciones séricas de fósforo en pacientes con enfermedad renal crónica que se encuentran en hemodiálisis. Los estudios in vitro han demostrado que las formulaciones de la cápsula y la tableta se unen al fosfato en una extensión similar.
El tratamiento con RENAGEL® también tiene como resultado una disminución en los niveles de colesterol de lipoproteínas de baja densidad (LDL) y total en suero.
MODO DE ACCIÓN/ CARACTERÍSTICAS FARMACODINÁMICAS
Mecanismo de acción: RENAGEL® contiene clorhidrato de sevelamer, un polímero de poli (clorhidrato de alilamina), no absorbido, libre de metal y calcio. Contiene múltiples aminas separadas por un carbón de la estructura del polímero. Estas aminas existen en la forma parcialmente protonada en el intestino e interactúan las moléculas de fosfato a través de la unión de iones e hidrógeno. Al unirse al fosfato en el tracto dietético, el clorhidrato de sevelamer reduce la concentración de fosfato en suero. Efectivo para reducir el fósforo sérico en los pacientes que reciben hemodiálisis o diálisis peritoneal.
Clorhidrato de sevelamer disminuye la incidencia de episodios de hipercalcemia en comparación con los pacientes que usan solo quelantes de fosfato a base de calcio. Se ha demostrado que los efectos sobre el fosfato y el calcio se conservan a lo largo de un estudio con un seguimiento de un año.
Clorhidrato de sevelamer ha demostrado unirse al ácido biliar in vitro e in vivo en modelos experimentales en animales. La unión al ácido biliar mediante resinas de intercambio de iones es un método bien establecido para reducir el colesterol en sangre. En los estudios clínicos tanto el colesterol total como LDL promedio se redujo un 15 - 31%. Este efecto se observa después de 2 semanas y se conserva con el tratamiento a largo plazo. Los triglicéridos, el colesterol HDL y la albúmina permanecieron sin cambios.
En los estudios clínicos en los paciente en hemodiálisis, el clorhidrato de sevelamer solo no tiene un efecto consistente y clínicamente significativo sobre la hormona paratiroidea intacta (iPTH). En los pacientes con hiperparatiroidismo secundario, RENAGEL® debe usarse en el contexto de un enfoque terapéutico múltiple, el cual podría incluir suplementos de calcio, y – dihidroxivitamina D3 o uno de sus análogos para reducir los niveles de hormona paratiroidea intacta (iPTH).
CONTRAINDICACIONES: RENAGEL® está contraindicado en pacientes con hipofosfatemia u obstrucción intestinal. RENAGEL® también está contraindicado en pacientes reconocidos por presentar hipersensibilidad al clorhidrato de sevelamer o a cualquiera de sus componentes.
EMBARAZO: No se han realizado estudios de seguridad de RENAGEL® en mujeres embarazadas. En los estudios en animales no hubo evidencia de que el clorhidrato de sevelamer indujera toxicidad embrio-fetal. RENAGEL® debe administrarse a mujeres embarazadas solo en caso de clara necesidad y después de que se haya realizado un cuidadoso análisis riesgo/beneficio tanto para la madre como para el feto. No se han realizado estudios adecuados y bien controlados en mujeres lactando.
LACTANCIA: No se ha establecido la seguridad de RENAGEL® en mujeres lactantes. RENAGEL® debe administrarse a mujeres lactantes solo en caso de clara necesidad y después de que se haya realizado un cuidadoso análisis riesgo/beneficio tanto para la madre como para el bebé. No se han realizado estudios adecuados y bien controlados en mujeres lactantes.
CONDUCIR UN VEHÍCULO O REALIZAR OTRAS TAREAS PELIGROSAS: No se han observado efectos sobre la actividad para conducir y utilizar maquinaria.
REACCIONES ADVERSAS
Se utiliza el siguiente rango de frecuencia CIOMS, según aplique: Muy frecuente ³ 10%; Frecuente ³ 1 y <10%; Poco frecuente³ 0.1 y <1%; Rara³ 0.01 y < 0.1%; Muy rara < 0.01%; Desconocida (no puede estimarse con los datos estimados).
En un estudio de diseño paralelo de clorhidrato de sevelamer con una duración de 52 semanas, las reacciones adversas reportadas con clorhidrato de sevelamer (n=99) fueron similares a las reportadas en el grupo de control activo (n=101). Los eventos adversos surgidos del tratamiento presentados con mayor frecuencia (³5% de los pacientes), posible o probablemente relacionados con RENAGEL® fueron todos del sistema órgano clase MedDRA de trastorno gastrointestinal (vea la Tabla 3). En este estudio, la principal razón para abandonar el grupo de RENAGEL® fueron los eventos adversos.
|
Tabla 3. Resumen de eventos adversos surgidos del tratamiento presentados con frecuencia (=5% de los pacientes) posible o probablemente relacionados con RENAGEL® |
||
|
Sistema órgano clase (SOC) |
Descripción del evento |
% Pacientes |
|
Trastornos gastrointestinales |
Vómito |
10.1 |
|
Náusea |
10.1 |
|
|
Dispepsia |
9.1 |
|
|
Diarrea |
8.1 |
|
|
Dolor abdominal |
5.1 |
|
|
Flatulencia |
5.1 |
|
En un estudio controlado con placebo con una duración de tratamiento de dos semanas, los eventos adversos surgidos del tratamiento, posible o probablemente relacionados con RENAGEL® (N=24) incluyeron dispepsia (8.3%) y vómito (4.2%). En un estudio cruzado con duraciones de tratamiento de ocho semanas cada uno los eventos surgidos del tratamiento posible o probablemente relacionados con RENAGEL® (N=82) incluyeron dispepsia (8.5%), diarrea (4.9%), náusea (4.9%), vómito (4.9%), anorexia (3.7%), y trastorno gastrointestinal (3.7%).4 En un estudio de extensión, abierto, a largo plazo, los eventos surgidos del tratamiento posible o probablemente relacionados con RENAGEL® (N=192) incluyeron náusea (7.3%), dolor abdominal (5.2%), y dispepsia (4.7%).
En un estudio de diseño paralelo con una duración de tratamiento de12 semanas, los eventos adversos reportados para clorhidrato de sevelamer en los pacientes en diálisis peritoneal (N=97) fueron similares a los eventos adversos observados en los pacientes en hemodiálisis. Los eventos adversos posiblemente relacionados con clorhidrato de sevelamer incluyeron dispepsia (12.4%), diarrea (5.2%), náusea (5.2%), constipación (4.1%), prurito (4.1%), distensión abdominal (3.1%), vómito (3.1%), fatiga (3.1%), anorexia (3.1%), y artralgia (3.1%).
Durante la experiencia post-marketing, se han reportado los siguientes eventos adversos en pacientes que reciben RENAGEL® aunque no se pudo establecer una relación directa con RENAGEL®: Hipersensibilidad, prurito, sarpullido, dolor abdominal y casos poco frecuentes de íleo, obstrucción intestinal y perforación intestinal.
INTERACCIONES
Medicamento/medicamento: No se han realizado estudios de interacción en pacientes en diálisis.
En estudios de interacción en voluntarios sanos, RENAGEL® no tiene ningún efecto sobre la biodisponibilidad de una dosis única de digoxina, warfarina, enalapril, metoprolol o hierro. Sin embargo, la biodisponibilidad de ciprofloxacina disminuyó aproximadamente 50% cuando se administró junto con RENAGEL® en un estudio de una sola dosis. Por consiguiente, RENAGEL® no debe administrarse de manera simultánea con ciprofloxacina.
Durante la experiencia post-mercadeo, se ha reportado disminución en las concentraciones de ciclosporina, mofetil micofenolato y tacrolimus en pacientes trasplantados cuando se administra junto con clorhidrato de sevelamer sin ninguna consecuencia clínica (p. ej., rechazo del injerto). No se puede excluir la posibilidad de una interacción y se debe considerar un monitoreo cercano de las concentraciones de ciclosporina, mofetil micofenolato y tacrolimus en sangre, durante el uso de cualquiera de estos agentes en combinación con sevelamer y después de sus suspensión.
Durante la experiencia post-mercadeo se han reportado muy raros casos de aumento en los niveles de TSH en los pacientes a los que se les administra conjuntamente RENAGEL® y levotiroxina. Por lo tanto se recomienda un monitoreo más cercano de los niveles de TSH en los pacientes que reciben ambos medicamentos.
RENAGEL® puede afectar la biodisponibilidad de otros productos medicinales. Al administrar un producto medicinal en el cual la reducción de la biodisponibilidad de dicho medicamento podría tener un impacto clínicamente significativo sobre su seguridad y eficacia, dicho producto medicinal debe ser administrado al menos una hora antes o tres horas después de RENAGEL®, o el médico debe considerar el monitoreo de los niveles en sangre.
Los pacientes que toman medicamentos antiarrítmicos para el control de las arritmias y medicamentos anticonvulsivos para el control de los trastornos convulsivos fueron excluidos de los estudios clínicos. Se deben tener precauciones especiales al prescribir RENAGEL® a los pacientes que también toman estos medicamentos.
Medicamento/alimento: No se han realizado estudios adecuados y bien controlados relacionados con las interacciones medicamento/alimento.
Pruebas de Laboratorio/Medicamento: Consulte sección Dosis y Administración y la Sección Advertencias-General.
DATOS DE SEGURIDAD NO CLÍNICA
Toxicidad aguda: En estudios preclínicos en ratas y perros, RENAGEL® a una dosis de 10 veces la máxima dosis clínica de 13 g/día, redujo la absorción de las vitaminas D, E y K, solubles en grasa y de ácido fólico.
Carcinogenicidad: Se llevaron a cabo estudios estándares de carcinogenicidad vitalicia en ratones y ratas. A las ratas se les suministró clorhidrato de sevelamer en la dieta a 0.3, 1, 3 g/kg/día. Se presentó un aumento en la incidencia de papiloma de las células transicionales de la vesícula biliar en los ratones machos (3 g/kg/día) a exposiciones del doble de la máxima dosis clínica de 13 g/día, con base en la comparación del área de la superficie corporal relativa. Los ratones recibieron dosis promedio de dieta de 0.8, 3, 9 g/kg/día. No se observó aumento en la incidencia de los tumores en ratones a exposiciones de hasta 3 veces la máxima dosis clínica de 13 g/día, con base en la comparación del área de la superficie corporal relativa.
Mutagenicidad: En una prueba citogenética de mamífero in vitro con activación metabólica, el clorhidrato de sevelamer provocó un aumento estadísticamente significativo en el número de anomalías cromosómicas estructurales. El clorhidrato de Sevelamer fue no mutagénico en la prueba de mutación bacteriana de Ames.
Teratogenicidad: En las ratas embarazadas a las que se les suministró una dosis alimentaria de 0.5, 1.5 o 4.5 g/kg/día de clorhidrato de sevelamer durante la organogénesis, se presentó una osificación reducida o irregular de los huesos fetales, probablemente debida a una disminución en la reabsorción de la vitamina D soluble en grasa, en los grupos de dosis media y alta (dosis equivalentes en humanos inferiores a la máxima dosis del estudio clínico de 13 g). En las conejas preñadas a las que se les suministraron dosis orales de 100, 500 o 1000 mg/kg/día de clorhidrato de sevelamer mediante alimentación por sonda durante la organogénesis, se presentó un aumento de reabsorciones prematuras en el grupo de dosis alta (dosis equivalente en humanos al doble de la máxima dosis de los estudios clínicos).
Deterioro de la fertilidad: En un estudio diseñado para evaluar el deterioro potencial en la fertilidad, se suministró a las ratas hembras dosis alimentarias de 0.5, 1.5, 4.5 g/kg/día comenzando 14 días antes del apareamiento, las cuales continuaron durante la gestación. A las ratas machos se les suministraron las mismas dosis y continuaron en tratamiento durante 28 días antes del apareamiento. Clorhidrato de sevelamer no deterioró la fertilidad en las ratas hembras o machos a exposiciones del doble de la máxima dosis clínica de 13 g/día, con base en la comparación del área de superficie corporal relativa.
Incompatibilidades/compatibilidades: No existen incompatibilidades farmacéuticas conocidas.
INTERFERENCIA CON PRUEBAS DE LABORATORIO Y DIAGNÓSTICAS
Abuso y dependencia: No se han presentado reportes de abuso o dependencia de RENAGEL® en los pacientes. Debido a que RENAGEL® no es absorbido, tiene un bajo riesgo de abuso o dependencia.
ADVERTENCIAS
General: No se ha establecido la seguridad y eficacia de RENAGEL® en pacientes con menos de 18 años de edad o en pacientes en pre-diálisis.
No se ha establecido la seguridad y eficacia de RENAGEL® en pacientes con disfagia, trastornos de la alimentación, trastornos severos de la motilidad gastrointestinal (GI) incluyen constipación severa, o cirugía importante en el tracto GI. Por lo tanto, se debe tener precaución al usar RENAGEL® en pacientes con estos trastornos GI.
Se ha informado de reportes de caso poco comunes de dificultad para tragar la tableta de RENAGEL®. Muchos de estos casos involucraron a los pacientes con condiciones comórbidas contribuyentes que afectan la capacidad de tragar incluyendo trastornos de la alimentación o anormalidades oroesofágicas. Se debe tener precaución al usar las tabletas de RENAGEL® tabletas en estos pacientes. Considere el uso de polvo de carbonato de sevelamer para suspensión oral (RENVELA® polvo) en pacientes con antecedentes de dificultada para tragar.
Los pacientes con insuficiencia renal pueden desarrollar hipocalcemia o hipercalcemia. RENAGEL® no contiene calcio. Los niveles de calcio en suero deben monitorearse igual como se hace en el seguimiento de rutina de un paciente en diálisis. El calcio elemental debe administrarse como complemento en caso de hipocalcemia. Los pacientes con enfermedad renal crónica están predispuestos a la acidosis metabólica. RENAGEL® no contiene complementos alcalinos; es necesario monitorear los niveles séricos de bicarbonato y cloruro.
Dependiendo de la ingesta alimenticia y la naturaleza de la enfermedad renal crónica, los pacientes en diálisis pueden desarrollar niveles bajos de vitamina A, D, E y K. Por lo tanto, en los pacientes que no toman estas vitaminas, se debe considerar el monitoreo de los niveles de vitamina A, D y E y la evaluación del estado de la vitamina K por medio de la medición del tiempo de tromboplastina y se debe administrar complemento con estas vitaminas en caso de ser necesario.
Pruebas de laboratorio útiles para el monitoreo de los pacientes.
Ver sección Dosis y Administración y la Sección Advertencias - General.
ADMINISTRACIÓN: Las tabletas deben tragarse intactas y no deben ser pulverizadas, masticadas ni partidas en pedazos, ni dividirse de ninguna otra forma antes de su administración.
DOSIS Y ADMINISTRACIÓN
General
Adultos y adultos mayores (> 65 años):
Los pacientes que no toman un quelante de fósforo.
La dosis de inicio recomendada para los pacientes que no toman un quelante de fosfato es 800 a 1600 mg, la cual puede administrarse en una o dos tabletas de RENAGEL® 800 mg con cada comida, con base en el nivel de fósforo sérico.
|
Tabla 1 -: Dosis inicial para los pacientes que no toman un quelante de fosfato |
|
|
Fósforo sérico |
RENAGEL® 800 mg |
|
>5.5 y < 7.5 mg/dL (>1.78 y <2.42 mmol/l) |
1 tableta, tres veces al día con las comidas |
|
= 7.5 y < 9.0 mg/dL (=2.42 y <2.91 mmol/l) |
2 tabletas, tres veces al día con las comidas |
|
= 9.0 mg/dL (=2.91 mmol/l) |
2 tabletas, tres veces al día con las comidas |
Los pacientes que se cambian de un quelante basado en calcio: Cuando los pacientes se están pasando de un quelante basado en calcio, el clorhidrato de sevelamer debe administrarse a dosis equivalentes de mg con base en el peso mg comparado con el quelante de fosfato anterior basado en calcio. La Tabla 2 suministra las dosis de inicio recomendadas de RENAGEL® con base en la dosis de acetato de calcio actual del paciente.
|
Tabla 2. Dosis inicial para los pacientes que se pasan de acetato de calcio a RENAGEL® |
|
|
Acetato de Calcio 667 mg |
RENAGEL® 800 mg |
|
1 tableta |
1 tableta |
|
2 tabletas |
2 tabletas |
|
3 tabletas |
3 tabletas |
Titulación de la dosis para todos los pacientes que toman RENAGEL®: Se debe monitorear meticulosamente los niveles de fósforo y se debe ajustar la dosis de RENAGEL® según la meta de reducción de fósforo sérico a 1.78 mmol/L (5.5 mg/dL) o menos.5 Se debe probar el fósforo sérico cada 2 a 3 semanas hasta lograr un nivel sérico estable, y de manera regular de ahí en adelante.
POBLACIONES ESPECIALES
Los pacientes pediátricos: No se ha establecido la seguridad y eficacia de este producto en pacientes menores de 18 años de edad.
Los pacientes adultos mayores: Igual que los adultos.
SOBREDOSIS: RENAGEL® ha sido administrado a voluntarios normales sanos en dosis de hasta 14.4 gramos, el equivalente de aproximadamente treinta y cinco tabletas de 400 mg o diecisiete tabletas de 800 mg, por día durante 8 días sin efectos adversos.
RENAGEL® ha sido administrado en dosis promedio de hasta 13 gramos por día a los pacientes en hemodiálisis. No se han reportado sobredosis de RENAGEL® en los pacientes. Debido a que RENAGEL® no es absorbido, tienen un bajo riesgo de toxicidad sistémica.
DESCRIPCIÓN
Ingredientes activos: Cada TABLETA Recubierta de RENAGEL® contiene 800 mg de clorhidrato de sevelamer en base anhidra.
Clase terapéutica o farmacológica
Código ATC: VO3A EO2 Tratamiento de hiperfosfatemia.1
EFICACIA CLÍNICA/ESTUDIOS CLÍNICOS: La capacidad de RENAGEL® para reducir el fósforo sérico en los pacientes con ERC en hemodiálisis se demostró en seis estudios clínicos, un estudio doble-ciego, controlado, de 2 semanas (RENAGEL® N=24); dos estudios de etiqueta abierta no controlados, de 8 semanas (RENAGEL® N=220) y tres estudios de control activo, de etiqueta abierta con duraciones del tratamiento de 8 a 52 semanas (RENAGEL® N=256). Aquí describimos tres de los estudios con control activo. Uno de estos fue un estudio cruzado con dos periodos de 8 semanas que comparó RENAGEL® con el acetato de calcio. El segundo estudio fue un estudio de diseño paralelo de 52 semanas que comparó RENAGEL® con acetato de calcio o carbonato de calcio. EL tercero fue un estudio de diseño paralelo de 12 semanas que se realizó para comparar RENAGEL® y acetato de calcio en pacientes en diálisis peritoneal.
Estudio cruzado de RENAGEL® y acetato de calcio: Ochenta y cuatro pacientes con ERC en hemodiálisis que tenían hiperfosfatemia (fósforo sérico > 6 mg/dL) después de un periodo de limpieza del quelante de fosfato de 2 semanas fueron aleatorizados para recibir bien fuera RENAGEL® durante 8 semanas seguido de acetato de calcio durante 8 semanas, o acetato de calcio durante 8 semanas seguido de RENAGEL® durante 8 semanas. Los periodos de tratamiento estuvieron separados por un periodo de limpieza del quelante de fosfato de 2 semanas. Los pacientes comenzaron con cápsulas de RENAGEL® o tabletas de acetato de calcio 3 veces al día con las comidas. Durante cada periodo de tratamiento de 8 semanas, en tres diferentes puntos de tiempo, se podía titular la dosis de cualquier agente en aumento de una cápsula o tableta por comida (3 al día) para controlar el fósforo sérico. RENAGEL® y el acetato de calcio redujeron ambos de manera significativa el promedio de fósforo sérico en aproximadamente 2 mg/dL.
|
Tabla 4. Promedio de fósforo sérico (mg/dL) al inicio y al punto de valoración |
||
|
RENAGEL® |
Acetato Ca |
|
|
Valor inicial al finalizar la limpieza |
8.4 |
8.0 |
|
Cambio desde el valor inicial hasta el punto de valoración (Intervalo de Confianza de 95%) |
-2.0* (-2.5, -1.5) |
-2.1* (-2.6, -1.7) |
|
*p < 0.0001, comparación entre los grupos de tratamiento |
||
La Figura 1 muestra que la proporción de pacientes que lograron el nivel dado de disminución del fósforo sérico es comparable entre los dos grupos de tratamiento. Por ejemplo, cerca de la mitad de los pacientes en cada uno de los grupos tuvo una disminución de al menos 2 mg/dL al punto de evaluación.
Figura 1: Porcentaje acumulado de pacientes (eje Y) que logran un cambio en fósforo desde el valor inicial al menos igual de grande al valor del eje X. El cambio hacia la izquierda de la curva indica una mejor repuesta.
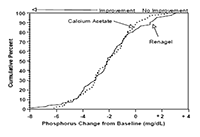
Cambio en fósforo desde el valor inicial (mg/dL): El consumo promedio diario al final del tratamiento era de 4.9 g de clorhidrato de sevelamer (rango de 0 a 12.6 g) y de 5.0 g de acetato de calcio (rango de 0 a 17.8 g). Durante el tratamiento con acetato de calcio, 22% de los pacientes desarrollaron calcio en suero ³ 11 mg/dL al menos en una ocasión, versus 5% con clorhidrato de sevelamer (p<0.05). Por lo tanto, el riesgo de desarrollar hipercalcemia es menor con RENAGEL® comparado con acetato de calcio. El colesterol LDL promedio y el colesterol total promedio disminuyeron de manera significativa con el tratamiento con RENAGEL® (-24% y -15%, respectivamente). Ni el colesterol LDL ni el colesterol total cambiaron con el tratamiento con acetato de calcio. Los triglicéridos, el colesterol de lipoproteínas de alta densidad (HDL) y la albúmina no cambiaron con ningún tratamiento. Reducciones similares en el fósforo sérico y el colesterol LDL se observaron en un estudio de 8 semanas, de etiqueta abierta, no controlado de 172 pacientes con enfermedad renal en etapa terminal en hemodiálisis.
Estudio paralelo de RENAGEL® y acetato de calcio o carbonato de calcio: Doscientos pacientes con ERC en hemodiálisis que eran hiperfosfatémicos (fósforo sérico > 5.5 mg/dL) fueron aleatorizados para recibir tabletas de 800 mg de RENAGEL® (N=99) o calcio, bien fuera acetato de calcio (N=54) o carbonato de calcio (N=47), después de un periodo de limpieza del quelante de fosfato de 2 semanas. El acetato de calcio y el carbonato de calcio produjeron disminuciones comparables en el fósforo en suero. A la semana 52, usando la última observación llevada cabo, tanto RENAGEL® como calcio redujeron de manera significativa el promedio de fósforo sérico.
|
Tabla 5 Fósforo sérico promedio (mg/dL) y producto iónico (mg2/dL2) al inicio y al final del tratamiento |
|||
|
RENAGEL® |
Calcio |
||
|
Fósforo |
Al inicio |
7.5 |
7.3 |
|
Cambio desde el inicio hasta el punto de valoración |
-2.1 |
-1.8 |
|
|
Producto Ca x ión de fósforo |
Al inicio |
70.5 |
68.4 |
|
Cambio desde el inicio hasta el punto de valoración |
-19.4 |
-14.2 |
|
Sesenta y uno por ciento de los pacientes en RENAGEL®, y 73% de los pacientes en calcio completaron todas las 52 semanas de tratamiento. La principal razón de abandono en el grupo RENAGEL® fueron los eventos adversos gastrointestinales. La Figura 2, una representación del cambio en fósforo desde el valor inicial de los que completaron el estudio, muestra la durabilidad de la respuesta en los pacientes con capacidad de continuar en el tratamiento.
Figura 2: Cambio promedio en fósforo desde el valor inicial en los pacientes que completaron las 52 semanas de Tratamiento.
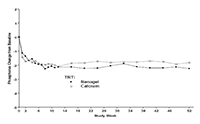
El consumo diario promedio al final del tratamiento era de 6.5 g de clorhidrato de sevelamer (rango de 0.8 a 13 g) o aproximadamente ocho tabletas de 800 mg (rango de 1 a 16 tabletas), 4.6 g de acetato de calcio (rango de 0.7 a 9.5 g) y 3.9 g de carbonato de calcio (rango de 1.3a 9.1 g). Durante el tratamiento con calcio 34% de los pacientes desarrollaron calcio sérico corregido para albúmina ³ 11.0 mg/dL al menos en una ocasión, versus 7% con RENAGEL® (p<0.05). Por lo tanto, el riesgo de desarrollar hipercalcemia es menor con RENAGEL® comparado con los quelantes a base de calcio.
El colesterol LDL promedio y el colesterol total promedio disminuyeron de manera significativa (p<0.05) con el tratamiento con RENAGEL® (-32% y -20%, respectivamente) comparados con el calcio (+0.2% y -2%, respectivamente). Los triglicéridos, el colesterol HDL, y la albúmina no presentaron cambios.
Estudio paralelo de clorhidrato de sevelamer o acetato de calcio en los pacientes con diálisis peritoneal: Ciento cuarenta y tres pacientes en diálisis peritoneal que eran hiperfosfatémicos (fósforo sérico >5.5 mg/dL) fueron aleatorizados para recibir tabletas de 800 mg de RENAGEL® (N=97) o acetato de calcio (N=46), después de un periodo de limpieza del quelante de fosfato de dos semanas. El tratamiento con RENAGEL® durante 12 semanas fue no inferior al acetato de calcio en la disminución del fósforo sérico. Se presentaron cambios estadísticamente significativos en el fósforo en suero (p<0.001) desde el valor inicial tanto para los grupos de RENAGEL® (-1.61 mg/dL desde 7.48 mg/dL) como para el acetato de calcio (-1.81 mg/dL desde 7.29 mg/dL).
El consumo diario promedio al final del tratamiento fue de 5.9 g para RENAGEL® (rango de 0.8 a 14.3 g) y de 4.3 g para acetato de calcio (rango de 1.7 a 9.0 g). Durante el tratamiento con acetato de calcio, 18% de los pacientes presentaron calcio sérico corregido para albúmina ³ 11.0 mg/dL al final del estudio, versus 2% para RENAGEL® (p=0.001). Se observó una disminución estadísticamente significativa desde el valor inicial en el colesterol total-, LDL-, y no HDL en el grupo RENAGEL®, pero no en el grupo de calcio
PRESENTACIÓN: (Reg. San. INVIMA 2014M-0003667-R1).
Fabricado
por Genzyme Ireland, Ltd., Waterford, Irlanda
Importado por: Genzyme de Colombia S.A.
SANOFI-AVENTIS DE COLOMBIA S. A.
Transversal 23 No. 97-73, Pisos 8 y 9
Teléfono: 6214400, Fax: 7444237
Bogotá, D.C., Colombia
CONDICIONES DE ALMACENAMIENTO Y VIDA ÚTIL
Precauciones para el almacenamiento: Almacene a temperatura inferior a 30 °C.
Vida útil: La vida útil es de 24 meses a partir de la fecha de fabricación cuando se almacena según las recomendaciones. No use RENAGEL® después de la fecha de expiración mencionada en la botella.