
RISPERDAL CONSTA
RISPERIDONA
Suspensión inyectable
1 Frasco vial, Suspensión inyectable, 25 y 37.5 Miligramos
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: RISPERDAL® CONSTA® contiene 25 mg, 37,5 mg y 50 mg de risperidona.
RISPERDAL® CONSTA® es una formulación de risperidona en microesferas de liberación prolongada, compuesta por la sustancia medicamentosa risperidona microencapsulada en poliláctido-co-glicólido, en concentración de 381 mg de risperidona por gramo de microesferas.
INDICACIONES TERAPÉUTICAS:
Esquizofrenia y trastorno esquizoafectivo: RISPERDAL® CONSTA® (risperidona) (risperidona) está indicado para el tratamiento de la esquizofrenia y trastorno esquizoafectivo.
Desorden bipolar: RISPERDAL® CONSTA® está indicado como monoterapia o terapia combinada con litio o valproato para el tratamiento de mantenimiento del trastorno afectivo Bipolar I.
FORMA FARMACÉUTICA:
• Polvo de liberación prolongada y solvente para suspensión para inyección.
• Frasco-vial con polvo.
• Polvo suelto de color blanco o blanco mate.
• Jeringa prellenada con diluyente para reconstitución.
• Solución acuosa transparente e incolora.
PROPIEDADES FARMACOCINÉTICAS:
Características generales de la risperidona después de la administración de RISPERDAL® CONSTA® a los pacientes.
Después de una sola inyección intramuscular de RISPERIDAL® CONSTA®, el perfil de liberación consiste en una pequeña liberación inicial del fármaco (<1% de la dosis), seguida de un periodo de retraso de 3 semanas. La principal liberación del fármaco comienza de la semana 3 en adelante, se mantiene de la semana 4 a la 6 y cede a la semana 7. Por lo tanto, debe administrarse antipsicótico oral complementario durante las primeras 3 semanas de tratamiento con RISPERIDAL® CONSTA® (véase Dosis y administración).
[La farmacocinética de risperidona después de dosis únicas de RISPERIDAL® CONSTA® es lineal en el intervalo de dosis de 12.5-75 mg.]
Después de inyecciones intramusculares repetidas con RISPERIDAL® CONSTA® 25 o 50 mg cada dos semanas, las concentraciones plasmáticas mínima y máxima medias de la fracción antipsicótica activa fluctuó de 9.9 a 19.2 ng/mL y de 17.9 a 45.5 ng/mL, respectivamente.
La farmacocinética de risperidona es lineal en el intervalo de dosis de 25-50 mg inyectados cada 2 semanas. No se observó acumulación de risperidona durante el uso prolongado (12 meses) en pacientes que se inyectaron 25-50 mg cada dos semanas.
Los estudios previos se realizaron con inyección glútea. Las inyecciones intramusculares deltoideas y glúteas en las mismas dosis son bioequivalentes y por tanto, intercambiables.
Un solo estudio con risperidona oral mostró concentraciones plasmáticas activas más altas y depuración reducida de la fracción antipsicótica activa en 30% de los ancianos y 60% de los pacientes con insuficiencia renal. Las concentraciones plasmáticas de risperidona fueron normales en pacientes con insuficiencia hepática, pero la fracción libre media de risperidona en plasma aumentó en cerca de 35%.
Relación farmacocinética/farmacodinámica: No hubo relación entre las concentraciones plasmáticas de la fracción antipsicótica activa y el cambio en las calificaciones totales de PANSS (Positive and Negative Syndrome Scale) y de ESRS (Extrapyramidal Symptom Rating Scale) en las visitas de valoración en ninguno de los estudios fase III en los que se examinaron la eficacia y la seguridad.
Absorción: La absorción de risperidona de RISPERIDAL® CONSTA® es completa.
Distribución: La risperidona se distribuye con rapidez. El volumen de distribución es 1-2 L/kg. en el plasma, la risperidona se une con albúmina y glucoproteína alfa-1. Mantiene un 90% de unión con proteínsa plasmáticas, la unión % del metabolito activo de la risperidona, 9-hidroxirrisperidona, es del 77%.
Metabolismo: La risperidona se metaboliza mediante CYP2D6 hasta 9-hidroxirrisperidona, que tiene actividad farmacológica similar a la risperidona. La risperidona más la 9-hidroxirrisperidona constituyen la fracción antipsicótica activa. Otra vía metabólica de la risperidona es la N-desalquilación.
Eliminación: La depuración respectiva de la fracción antipsicótica activa y de risperidona fue de 5.0 y 13.7 L/h en los sujetos con metabolismo intenso, y de 3.2 y 3.3 L/h en los sujetos con metabolismo deficiente mediante CYP2D6.
La combinación del perfil de liberación y el régimen de administración (inyección intramuscular cada dos semanas) produce concentraciones plasmáticas terapéuticas sostenidas. Las concentraciones plasmáticas terapéuticas se conservan hasta 4 a 6 semanas después de la última inyección de RISPERIDAL® CONSTA®. La fase de eliminación se completa alrededor de 7 a 8 semanas después de la última inyección.
PROPIEDADES FARMACODINÁMICAS:
Grupo farmacoterapéutico: Medicamentos antipsicóticos; código ATC: N05AX08.
La risperidona es un antagonista monoaminérgico selectivo dotado con propiedades únicas. Posee una alta afinidad por los receptores serotoninérgicos 5-HT2 y dopaminérgicos D2. La risperidona también se fija a los receptores alfa1-adrenérgicos y, con una afinidad menor, a los histaminérgicos H1 y alfa2-adrenérgicos. La risperidona carece de afinidad por los receptores colinérgicos. Si bien la risperidona es un potente antagonista D2, del que se sabe que mejora los síntomas positivos de la esquizofrenia, causa menos depresión de la actividad motriz e inducción de catalepsia que los neurolépticos clásicos. El equilibrio de la serotonina y el antagonismo de la dopamina en el nivel central pueden reducir la predisposición a los efectos secundarios extrapiramidales y extender la actividad terapéutica a los síntomas negativos y afectivos de la esquizofrenia.
Más información proveniente de estudios clínicos: La eficacia del RISPERDAL® CONSTA® (25 y 50 mg) en el tratamiento de las manifestaciones de los trastornos psicóticos (esquizofrenia / trastorno esquizoafectivo) se estableció en un estudio de 12 semanas controlado con placebo en pacientes psicóticos adultos internados y ambulatorios que cumplían los criterios del DSM-IV para esquizofrenia.
En un estudio comparativo de 12 semanas en pacientes estables con esquizofrenia, RISPERDAL® CONSTA® mostró ser tan eficaz como la formulación oral en tabletas. También se evaluaron la seguridad y la eficacia a largo plazo (50 semanas) de RISPERDAL® CONSTA® en un estudio de rótulo abierto en pacientes psicóticos estables internados y ambulatorios que cumplieron los criterios del DSM-IV para esquizofrenia o trastorno esquizoafectivo. La eficacia de RISPERDAL® CONSTA® se mantuvo en el tiempo. La información de seguridad está disponible en la sección correspondiente.
Figura 1. Media en la puntuación total PANSS con el tiempo (LOCF) en pacientes con esquizofrenia
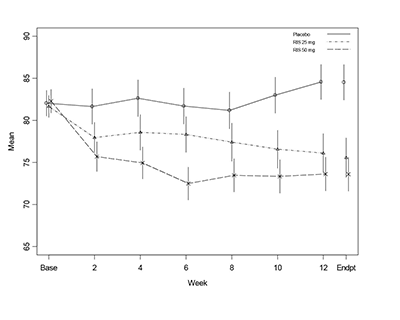
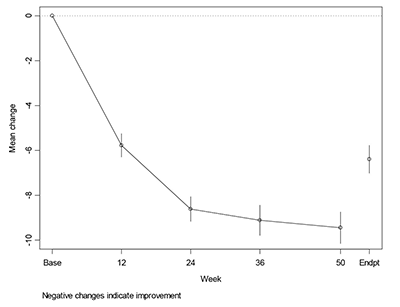
Figura 2. Cambio promedio a partir de la línea de base para todas las dosis probadas en el estudio de rótulo abierto de 50 semanas
DATOS DE ENSAYOS CLÍNICOS: La seguridad de RISPERDAL® CONSTA® se evaluó a partir de una base de datos de ensayos clínicos compuesta por datos de 2392 pacientes expuestos a una o más dosis de RISPERDAL® CONSTA® para el tratamiento de la esquizofrenia. De estos 2392 pacientes, 332 eran pacientes que habían recibido RISPERDAL® CONSTA® durante su participación en un ensayo doble ciego, controlado con placebo, de 12 semanas de duración. Un total de 202 de esos 332 pacientes eran pacientes esquizofrénicos que recibieron 25 o 50 mg de RISPERDAL® CONSTA®. Las condiciones y la duración del tratamiento con RISPERDAL® CONSTA® en los otros estudios clínicos fueron muy variables, e incluyeron (en categorías que se solapan entre sí) estudios doble ciego, con dosis fija y dosis flexible, controlados con placebo o con comparador activo, fases abiertas de algunos estudios, con pacientes hospitalizados y pacientes ambulatorios y exposiciones a corto plazo (hasta 12 semanas) y a largo plazo (hasta cuatro años). Además de los estudios en pacientes con esquizofrenia, se presentan datos de seguridad y eficacia de RISPERDAL® CONSTA® cuando se administra como terapia combinada en pacientes con trastorno bipolar y cuando se administra como monoterapia para el tratamiento de mantenimiento del trastorno bipolar I.
Los sujetos del estudio multi-céntrico, doble ciego, controlado con placebo, cuando se administró el medicamento como monoterapia para el tratamiento de mantenimiento del trastorno bipolar I, fueron pacientes adultos que cumplen criterios DSM-IV para el Trastorno Bipolar de Tipo I y que se mantuvieron estables en risperidona ( oral o inyectable de acción prolongada) y que se mantuvieron estables en otros antipsicóticos o estabilizadores del ánimo o experimentan un episodio agudo. Después de un período de 3 semanas de tratamiento abierto con la risperidona oral (n = 440), los sujetos que demostraron en este periodo una respuesta inicial a la risperidona oral y los que se mantuvieron estables en risperidona (oral o inyectable de larga acción) entraron en un estudio abierto de RISPERDAL® CONSTA® (n = 501) por un período de 26 semanas de estabilización. Los sujetos que demostraron una respuesta mantenida durante este período fueron aleatorizados en un estudio doble ciego, controlado de 24 meses, período en que recibieron RISPERDAL® CONSTA® (n = 154) o placebo (n = 149) como monoterapia. Los sujetos quienes recayeron o quienes completaron el estudio doble ciego, podrían ingresar a un estudio abierto de RISPERDAL® CONSTA® por un período de extensión de 8 semanas (n = 160).
Los pacientes del estudio, de la terapia combinada para el tratamiento de mantenimiento del trastorno afectivo Bipolar, un estudio clínico multi-céntrico, doble ciego, controlado con placebo, fueron pacientes adultos que cumplen los criterios DSM-IV para el trastorno bipolar de tipo I o II y que experimentaron por lo menos 4 episodios de trastorno del estado de ánimo que necesitaron intervención psiquiátrica / clínica en los últimos 12 meses, incluyendo al menos 2 episodios en los 6 meses previos al inicio del estudio.
Al inicio de este estudio, todos los pacientes (n = 275) entraron en la fase de tratamiento, abierto, de 16 semanas, en las cuales recibieron RISPERDAL® CONSTA®, además de continuar su tratamiento de costumbre, que consistía en diversos estabilizadores de ánimo, los antidepresivos y / o ansiolíticos. Los pacientes que alcanzaron la remisión al final de estas 16 semanas de tratamiento de fase abierta (n = 139) fueron entonces aleatorizados en uno estudio doble ciego, controlado con placebo de 52 semanas, en la que recibieron RISPERDAL® CONSTA® (n = 72) o placebo (n = 67) como tratamiento adyuvante, además de continuar con su tratamiento como de costumbre. Los pacientes que no alcanzaron la remisión al final de las 16 semanas de tratamiento de fase abierta podría optar por seguir recibiendo RISPERDAL® CONSTA® como tratamiento adyuvante en una manera abierta, además de continuar su tratamiento de costumbre, hasta por 36 semanas adicionales, como está indicado clínicamente por un período total hasta de 52 semanas, estos pacientes (n = 70) también se incluyeron en la evaluación de la seguridad.
La mayoría de las reacciones adversas fueron de intensidad leve a moderada.
Datos de ensayos doble ciego, controlados con placebo - Esquizofrenia: Las reacciones adversas comunicadas por ≥ 2% de los pacientes con esquizofrenia tratados con RISPERDAL® CONSTA® en un ensayo doble ciego, controlado con placebo y de 12 semanas de duración se muestran en la Tabla 1.
|
Tabla 1. |
|||
|
Grupo sistémico/ |
RISPERDAL |
RISPERDAL CONSTA® |
Placebo |
|
Infecciones e infestaciones |
|||
|
Infección del tracto respiratorio superior |
2 |
0 |
1 |
|
Trastornos del sistema nervioso |
|||
|
Cefalea |
15 |
21 |
12 |
|
Parkinsonismo* |
8 |
15 |
9 |
|
Mareos |
7 |
11 |
6 |
|
Acatisia* |
4 |
11 |
6 |
|
Somnolencia |
4 |
4 |
0 |
|
Temblor |
0 |
3 |
0 |
|
Sedación |
2 |
2 |
3 |
|
Síncope |
2 |
1 |
0 |
|
Hipoestesia |
2 |
0 |
0 |
|
Trastornos de la visión |
|||
|
Visión borrosa |
2 |
3 |
0 |
|
Trastornos respiratorios, torácicos y mediastínicos |
|||
|
Tos |
4 |
2 |
3 |
|
Congestión sinusal |
2 |
0 |
0 |
|
Trastornos gastrointestinales |
|||
|
Estreñimiento |
5 |
7 |
1 |
|
Sequedad bucal |
0 |
7 |
1 |
|
Dispepsia |
6 |
6 |
0 |
|
Náuseas |
3 |
4 |
5 |
|
Dolor dental |
1 |
3 |
0 |
|
Hipersalivación |
4 |
1 |
0 |
|
Trastornos de la piel y del tejido subcutáneo |
|||
|
Acné |
2 |
2 |
0 |
|
Sequedad cutánea |
2 |
0 |
0 |
|
Trastornos musculoesqueléticos y del tejido conectivo |
|||
|
Dolor en las extremidades |
6 |
2 |
1 |
|
Trastornos generales y locales en el sitio de administración |
|||
|
Fatiga |
3 |
6 |
0 |
|
Astenia |
0 |
3 |
0 |
|
Edema periférico |
2 |
3 |
1 |
|
Dolor |
4 |
1 |
0 |
|
Pirexia |
2 |
1 |
0 |
|
Investigaciones |
|||
|
Aumento de peso |
5 |
4 |
2 |
|
Pérdida de peso |
4 |
1 |
1 |
|
* El término parkinsonismo incluye el síndrome extrapiramidal, la rigidez musculoesquelética, la rigidez muscular y la bradicinesia. El término acatisia incluye la acatisia y los movimientos de inquietud. |
|||
Datos doble ciego, Placebo-Controlado –Desorden Bipolar: Las reacciones adversas reportadas ≥ 2% de los pacientes tratados con RISPERDAL® CONSTA® en un ensayo doble ciego, controlado con placebo y de 24 meses, en el período de evaluación de la eficacia y seguridad de RISPERDAL® CONSTA® cuando se administra en monoterapia para el tratamiento de mantenimiento en pacientes con trastorno bipolar I, se muestran en la Tabla 2.
|
Tabla 2. Reacciones adversas comunicadas por ≥ 2% de los pacientes con desordén bipolar I tratados con RISPERDAL CONSTA® como monoterapia en un ensayo doble ciego, controlado con placebo y de 24 meses de duración |
||
|
Porcentaje de pacientes que reportan RA |
||
|
Grupo sistémico/ |
RISPERDAL CONSTA® |
Placebo (N=149) |
|
Trastornos del sistema nervioso |
||
|
Mareo |
3 |
1 |
|
Trastornos vasculares |
||
|
Hipertensión |
3 |
1 |
|
Investigaciones |
||
|
Incremento del peso |
5 |
1 |
Las reacciones adversas reportadas ≥ 4% de los pacientes tratados con RISPERDAL® CONSTA® en un ensayo doble ciego, controlado con placebo y de 52 semanas, en el período de evaluación de la eficacia y seguridad de RISPERDAL® CONSTA® cuando se administra como tratamiento de mantenimiento con adyuvante en pacientes con trastorno bipolar, se muestran en la Tabla 3.
|
Tabla 3. Reacciones adversas comunicadas por ≥ 4% de los pacientes con con trastorno bipolar tratados con RISPERDAL CONSTA® como terapia adyuvante en un ensayo doble ciego, controlado con placebo y de 52 semanas de duración |
||
|
Grupo sistémico/ |
RISPERDAL CONSTA® + Tratamiento usuala (N=72) |
Placebo + tratamiento usuala |
|
Infecciones e infestaciones |
||
|
Infección del tracto respiratorio superior |
6 |
3 |
|
Trastornos del metabolismo y la alimentación |
||
|
Périda del apetido |
6 |
1 |
|
Incremento del apetito |
4 |
0 |
|
Trastorno del sistema nervioso |
||
|
Temblor |
24 |
16 |
|
Parkinsonismob |
15 |
6 |
|
Diskinesiab |
6 |
3 |
|
Sedación |
6 |
0 |
|
Alteración en la atención |
4 |
0 |
|
Trastornos respiratorios, torácicos y mediastínicos |
||
|
Tos |
4 |
1 |
|
Trastornos musculoesqueléticos, óseos y del tejido conectivo |
||
|
Artralgia |
4 |
3 |
|
Trastornos del sistema reproductor y las glándulas mamarias |
||
|
Amenorrea |
4 |
1 |
|
Trastornos generales y locales en el sitio de administración |
||
|
Marcha anormal |
4 |
0 |
|
Investigaciones |
||
|
Aumento de peso |
7 |
1 |
|
a Los pacientes recibieron RISPERDAL CONSTA® doble-ciego o placebo, además de continuar su tratamiento habitual, que incluía los estabilizadores de ánimo, los antidepresivos y/o ansiolíticos. b Parkinsonismo incluyen rigidez muscular, hipokinesia, rigidez en la mandibula y la bradikinesia. Disquinesia incluye contraccion muscular y disquinesia. |
||
Datos de otros estudios clínicos: Paliperidona es el metabolito activo de la risperidona, por lo tanto los perfiles de reacción adversa de estos compuestos (incluyendo tanto las formulaciones oral e inyectable) son relevantes para uno y otro. Esta subsección incluye las RAD adicionales informadas con risperidona y/o paliperidona en ensayos clínicos. Las reacciones adversas informadas con risperidona y/o paliperidona por ≥ 2% de los sujetos tratados con RISPERDAL® CONSTA® con esquizofrenia se muestran en la Tabla 4a.
|
Tabla 4a. |
|
|
Clase de sistema orgánico |
Reacción adversa |
|
Trastornos psiquiátricos |
Agitación, ansiedad, depresión, insomnio* |
|
Trastornos del sistema nervioso |
Acatisia*, Parkinsonismo* |
|
Trastornos cardiacos |
Taquicardia |
|
Trastornos respiratorios, torácicos y del mediastino |
Congestión nasal |
|
Trastornos gastrointestinales |
Malestar abdominal, diarrea, vómitos |
|
Trastornos de la piel y del tejido subcutáneo |
Rash |
|
Trastornos musculoesqueléticos y del tejido conectivo |
Dolor de espalda, espasmos musculares, dolor musculoesquelético |
|
Trastornos generales y condiciones en el lugar de la administración |
Edema* |
|
*Insomnio incluye: Insomnio inicial, insomnio medio; Acatisia incluye: Hiperquinesia, síndrome de las piernas inquietas, inquietud; Parkinsonismo incluye: Aquinesia, bradiquinesia, rigidez de la rueda dentada, babeo, síntomas extrapiramidales, reflejo glabelar anormal, rigidez muscular, tensión muscular, entumecimiento muscular; Edema incluye: Edema generalizado, edema periférico, edema con fóvea. |
|
Las Reacciones adversas informadas con risperidona y/o paliperidona por <2% de los sujetos tratados con RISPERDAL® CONSTA® con esquizofrenia se muestran en la Tabla 4b.
|
Tabla 4b. Reacciones adversas informadas con risperidona y/o paliperidona por < 2% de los sujetos tratados con RISPERDAL CONSTA® con esquizofrenia (los términos dentro de cada clase de sistema orgánico están ordenados alfabéticamente) |
|
|
Clase de sistema orgánico |
Reacción adversa |
|
Infecciones e infestaciones |
Infección en el oído, infección, Influenza, Sinusitis |
|
Trastornos del sistema inmune |
Hipersensibilidad |
|
Trastornos del metabolismo y nutrición |
Disminución del apetito, incremento del apetito |
|
Trastornos psiquiátricos |
Estado de confusión, disminución de la libido, pesadilla |
|
Trastornos del sistema nervioso |
Mareo postural, disartria, disquinesia*, paresia |
|
Trastornos oculares |
Fotofobia |
|
Trastornos del oído y laberínticos |
Dolor de oído |
|
Trastornos cardiacos |
Bradicardia, trastorno de la conducción, electrocardiograma anormal, QT prolongado en electrocardiograma, palpitaciones |
|
Trastornos respiratorios, torácicos y del mediastino |
Disnea, dolor faringolaríngeo, sibilancia |
|
Trastornos hepatobiliares |
Aumento de la gamma-glutamiltransferasa, aumento de la enzima hepática |
|
Trastornos de la piel y del tejido subcutáneo |
Prurito, dermatitis seborreica, trastornos de la piel |
|
Trastornos musculoesqueléticos y del tejido conectivo |
Rigidez de articulaciones, debilidad muscular |
|
Trastornos renales y urinarios |
Incontinencia urinaria |
|
Trastornos del sistema reproductivo y mamario |
Malestar mamario, trastorno de la eyaculación, disfunción eréctil, galactorrea |
|
Trastornos generales y condiciones en el lugar de la administración |
Malestar torácico, sensación anormal, reacción en el lugar de la inyección |
|
*Disquinesia incluye: Atetosis, corea, coreoatetosis, trastorno del movimiento, espasmos musculares, mioclonia |
|
Las Reacciones adversas informadas con risperidona y/o paliperidona en otros ensayos clínicos pero no informadas por los sujetos tratados con RISPERDAL® CONSTA® (25 mg o 50 mg) con esquizofrenia se muestran en la Tabla 4c.
|
Tabla 4c. Reacciones adversas reportados con risperidona y/o paliperidona en otros estudios clínicos pero no reportados por sujetos tratados con RISPERDAL® CONSTA® (25 mg o 50 mg) con esquizofrenia |
|
|
Clase de sistema orgánico |
Reacción adversa |
|
Infecciones e infestaciones |
Acarodermatitis, bronquitis, celulitis, cistitis, infección ocular, infección localizada, onicomicosis, neumonía, infección de las vías respiratorias, absceso subcutáneo, amigdalitis, infección del tracto urinario, infección viral |
|
Trastornos sanguíneo y del sistema linfático |
Anemia, incremento en el recuento de eosinófilos, disminución de los hematocritos, neutropenia, disminución en el recuento de glóbulos blancos |
|
Trastornos del sistema inmune |
Reacción anafiláctica |
|
Trastornos endocrinos |
Glucosa presente en orina, hiperprolactemia |
|
Trastornos del metabolismo y nutrición |
Anorexia, incremento de colesterol en sangre, incremento de triglicéridos en sangre, hiperglucemia, hiperinsulinemia, polidipsia |
|
Trastornos psiquiátricos |
Anorgasmia, afecto plano, trastorno del sueño |
|
Trastornos del sistema nervioso |
Trastorno del equilibrio, accidente cerebrovascular, trastorno cerebrovascular, convulsión*, coordinación anormal, nivel de conciencia deprimido, coma diabético, distonía*, agitación de la cabeza, pérdida de conciencia, síndrome neuroléptico maligno, hiperactividad psicomotriz, disquinesia tardía, insensibilidad a los estímulos |
|
Trastornos oculares |
Conjuntivitis, ojo seco, trastornos del movimiento ocular, nistagmo rotatorio, formación de costras en el borde del párpado, glaucoma, aumento de lagrimeo, hiperemia ocular |
|
Trastornos del oído y laberíntico |
Tinitus, vértigo |
|
Trastornos cardiacos |
Bloqueo atrioventricular, síndrome de taquicardia ortostática postural, arritmia sinusal |
|
Trastornos vasculares |
Eritema, hipotensión, hipotensión ortostática |
|
Trastornos respiratorios, torácicos y del mediastino |
Disfonía, epistaxis, hiperventilación, neumonía por aspiración, congestión pulmonar, rales, trastorno respiratorio, congestión de las vías respiratorias |
|
Trastornos gastrointestinales |
Queilitis, disfagia, incontinencia fecha, fecaloma, flatulencia, gastroenteritis, obstrucción intestinal, inflamación de la lengua |
|
Trastornos hepatobiliares |
Aumento de las transaminasas |
|
Trastornos del sistema reproductivo y mamario |
Secreción mamaria, ingurgitación mamaria, distensión mamaria, ginecomastia, trastorno menstrual*, atraso menstrual, disfunción sexual, secreción vaginal |
|
Trastornos generales y condiciones en el lugar de la administración |
Disminución de la temperatura corporal, incremento de la temperatura corporal, escalofríos, incomodidad, síndrome de abstinencia, edema facial, induración, malestar, enfriamiento periférico, sed |
|
Lesión, intoxicación y complicaciones en el procedimiento |
Caída, dolor por el procedimiento |
|
Convulsión * incluye: Convulsión de Gran mal; Distonía incluye: Blefasoespasmo, espasmo cervical, emprostótonos, espasmo facial, hipertonía, laringoespasmo, contracciones musculares involuntarias, miotonía, oculogiración, opistótonos, espasmo orofaríngeo, pleurotótonos, risus sardónicus, tetania, parálisis de la lengua, espasmo de lengua, tortículis, trismus; Trastorno menstrual incluye: Menstruación irregular, oligomenorrea |
|
Datos posteriores a la comercialización: Los acontecimientos adversos identificados en primer lugar como Reacciones adversas durante la experiencia posterior a la comercialización con risperidona y/o paliperidona se muestran en la Tabla 5. En la tabla se indican las frecuencias de acuerdo con la siguiente convención:
• Muy frecuente: ≥1/10
• Frecuente: ≥1/100 a < 1/10
• Poco frecuente: ≥1/1000 a < 1/100
• Raro: ≥1/10000 a < 1/1000
• Muy raro: < 1/10000, incluyendo informes aislados.
En la Tabla 5, las reacciones adversas se presentan categorizadas por su frecuencia, de acuerdo con sus tasas de comunicación espontánea.
|
Tabla 5: Reacciones adversas identificadas durante la experiencia posterior a la comercialización con Risperidona y/0 Paliperidona categorizadas por su frecuencia, estimada a partir de sus tasas de comunicación espontánea con Risperidona |
|
|
Trastornos de la sangre y del sistema linfático |
|
|
Muy raro |
Agranulocitosis, trombocitopenia |
|
Trastornos del sistema endocrino |
|
|
Muy raro |
Secreción inadecuada de hormona antidiurética |
|
Trastornos del metabolismo y la alimentación |
|
|
Muy raro |
Diabetes mellitus, Cetoacidosis diabética, Hipoglucemia, Intoxicación hídrica |
|
Trastornos psiquiátricos |
|
|
Muy raro |
Manía |
|
Trastornos del sistema nervioso |
|
|
Muy raro |
Disgeusia |
|
Trastornos de la visión |
|
|
Muy raro |
Oclusión de la arteria retinianaa , síndrome de iris flácido (intra-operatorio)i |
|
Trastornos cardiacos |
|
|
Muy raro |
Fibrilación atrial. |
|
Trastornos vasculares |
|
|
Muy raro |
Trombosis venosa profunda, Embolismo pulmonar |
|
Trastornos respiratorios, torácicos y mediastínicos |
|
|
Muy raro |
Síndrome de apnea del sueño |
|
Trastornos gastrointestinales |
|
|
Muy raro |
Pancreatitis, Íleo |
|
Trastornos hepatobiliares |
|
|
Muy raro |
Ictericia |
|
Trastornos de la piel y del tejido subcutáneo |
|
|
Muy raro |
Alopecia, Angioedema |
|
Trastornos renales y urinarios |
|
|
Muy raro |
Retención Urinaria |
|
Embarazo, puerperio y condiciones perinatales |
|
|
Muy raro |
Síndrome neonatal de retiro de la droga |
|
Alteraciones del sistema reproductor y las glándulas mamarias |
|
|
Muy raro |
Priapismo |
|
Trastornos de carácter general y condiciones del sitio de administración |
|
|
Muy raro |
Hipotermia, Absceso en el sitio de inyección, Celulitis en el lugar de la inyección, quistes en el lugar de la inyección, hematomas en el lugar de la inyección, necrosis en el lugar de la inyección y ulceras en el lugar de la inyección. |
|
a 0.11% en el grupo placebo. La incidencia general en todos los estudios fue 0.43% en todos los sujetos tratados con risperidona. b Sólo la formulación RISPERIDAL® CONSTA®, reportado en presencia de un defecto intracardiaco predisponente a un cortocircuito de derecha a izquierda (p. ej., persistencia de ventana oval) Muy raramente, casos de reacción anafiláctica después de la inyección con RISPERDAL® CONSTA® ha sido reportados durante la experiencia post-marketing en pacientes quienes han previamente tolerado risperidona oral. |
|
CONTRAINDICACIONES: RISPERDAL® CONSTA® está contraindicado en pacientes con hipersensibilidad conocida al producto o a cualquiera de sus componentes. Embarazo y lactancia. Puede producir hipotensión ortostática e interferir con actividades que requieran agudeza visual. Puede interactuar con otros depresores del sistema nervioso central. Puede antagonizar los efectos de la levodopa y otros agonistas dopaminérgicos. Se han presentado accidentes cerebro/vasculares en pacientes tratados con risperidona.
USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: No se ha establecido la seguridad de la risperidona en el embarazo humano. Si bien en experimentos en animales no se ha demostrado una toxicidad directa de la risperidona sobre la reproducción, sí se observaron algunos efectos indirectos mediados por la prolactina y por el sistema nervioso central. No se observó efecto teratogénico en ningún estudio clínico.
Los neonatos expuestos a drogas antipsicóticas (incluido RISPERDAL®) durante el tercer trimestre de embarazo, están en riesgo de síntomas extrapiramidales y/o de abstinencia que pueden variar en severidad después del parto. Estos síntomas en los neonatos pueden incluir agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria, o desórdenes alimenticios.
Sólo se usará RISPERDAL® CONSTA® durante el embarazo si los beneficios sobrepasan a los riesgos.
Lactancia: En estudios en animales la risperidona y la 9-hidroxi-riperidona se excretan por la leche. Se ha demostrado que la risperidona y la 9-hidroxi-risperidona también se excretan por la leche humana. En consecuencia, las mujeres que reciben RISPERDAL® CONSTA® no deben lactar a sus hijos.
EFECTOS SOBRE LA CAPACIDAD DE CONDUCIR Y USAR MÁQUINAS: La risperidona puede interferir con las actividades que requieran de un estado de alerta. En consecuencia, hay que advertirles a los pacientes que no conduzcan ni operen maquinaria hasta tanto no se conozca su susceptibilidad individual.
REACCIONES ADVERSAS: En toda esta sección se presentan las reacciones adversas. Las reacciones adversas son eventos desfavorables que se consideraron razonablemente relacionados con el uso de risperidona, según la valoración integral de la información disponible sobre el evento adverso. No es posible establecer de manera confiable una relación causal con risperidona en casos individuales. Además, como los estudios clínicos se realizan en condiciones muy diversas, las tasas de reacciones adversas observadas en los estudios clínicos de un fármaco no pueden compararse de manera directa con los estudios clínicos de otros fármacos y es probable que no reflejen las tasas observadas en la práctica clínica.
INCOMPATIBILIDADES: RISPERDAL® CONSTA® no se debe mezclar o diluir con medicamentos o líquidos diferentes del diluyente que acompaña la presentación para administración.
Vida en el estante: 36 meses a temperatura de 2-8°C.
Después de la preparación de la mezcla: Se ha demostrado estabilidad química y física en uso durante 24 horas a 25º C. Desde el punto de vista microbiológico, el producto debe ser aplicado inmediatamente. Si no se usa de inmediato, los tiempos y condiciones de almacenamiento en uso antes de la aplicación son responsabilidad del usuario y normalmente no deben ser mayores de 6 horas a 25ºC a menos que la reconstitución haya tenido lugar en condiciones asépticas controladas y validadas.
INFORMACIÓN NO CLÍNICA:
Toxicología en animales: Similar a los estudios de toxicidad (sub)crónica con Risperidona oral en ratas y perros, los principales efectos observados en el tratamiento con RISPERDAL® CONSTA® (con una administración intramuscular hasta de 12 meses) fueron la estimulación de la glándula mamaria, cambios en el tracto genital masculino y femenino mediados por prolactina y efectos sobre el sistema nervioso central relacionados con la actividad farmacodinámica de la risperidona. En un estudio de toxicidad oral con ratas jóvenes, se observó mortalidad aumentada de crías y un retraso en el desarrollo físico. En un estudio de 40 semanas de duración con perros jóvenes tratados con risperidona oral, la maduración sexual resultó retardada. El crecimiento del fémur no se vio afectado con una dosis similar a la dosis oral máxima humana en adolescentes (6 mg/ día); se observaron efectos con una dosis de 4 veces (en una base de AUC) o 7 veces (en una base de mg/ m2) la dosis oral máxima humana en adolescentes.
La administración de RISPERDAL® CONSTA® a ratas macho y hembra por 12 y 24 meses produjo osteodistrofia a una dosis de 40 mg/kg por 2 semanas. La dosis efecto para osteodistrofia en ratas fue sobre una base de mg/m2 8 veces la dosis humana máxima recomendada y está asociada con una exposición del plasma 2 veces la máxima exposición anticipada en humanos a la dosis máxima recomendada. No se observó osteodistrofia en perros tratados por 12 meses con RISPERDAL® CONSTA® hasta de 20 mg/kg por 2 semanas. Esta dosis produjo una exposición de plasma hasta 14 veces el máximo recomendado para dosis humanas.
Carcinogénesis y mutagénesis: No hubo evidencia de potencial mutágeno.
Como se anticipaba de un potente antagonista D2 de la dopamina, en un estudio de carcinogenicidad intramuscular en ratas Wistar (Hannover), se observaron incidencias más altas de tumores del páncreas endocrino, hipófisis y médula suprarrenal mediados por prolactina con 40 mg/kg, mientras que se desarrollaron tumores de la glándula mamaria con 5 y 40 mg/kg. En ambos grupos se observó hipercalcemia, considerada un factor contribuyente a la mayor incidencia de tumores de la médula suprarrenal. No hay evidencia sugestiva de que la hipercalcemia pudiera causar feocromocitomas en humanos.
Se desarrollaron adenomas tubulares renales en ratas macho con 40 mg/kg/2 semanas. No hubo tumores en los grupos con dosis baja, con NaCl 0.9% ni en el grupo control con vehículo de las microesferas. Se desconoce el mecanismo subyacente a los tumores renales en las ratas macho Wistar (Hannover) tratadas con RISPERIDAL® CONSTA®. No hubo aumento en la incidencia de tumores renales relacionada con el tratamiento en los estudios de carcinogenicidad oral en ratas Wistar (Wiga) macho ni en ratones suizos a los que se administró risperidona oral. Los estudios realizados para explorar las diferencias por sub-cepas en los perfiles orgánicos tumorales sugieren que la sub-cepa Wistar (Hannover) usada en el estudio de carcinogenicidad difiere mucho de la sub-cepa Wistar (Wiga) usada en el estudio de carcinogenicidad oral con respecto a los cambios renales no neoplásicos relacionados con la edad, aumentos de prolactina sérica y cambios renales como respuesta a risperidona. No hay datos sugestivos de cambios renales en perros tratados por periodos prolongados con RISPERIDAL® CONSTA®.
Se desconoce la relevancia de la osteodistrofia, los tumores mediados por prolactina y los supuestos tumores renales específicos por sub-cepa en términos de riesgo humano.
Se observó irritación local en el sitio de inyección en perros y ratas después de la administración de dosis altas de RISPERIDAL® CONSTA®. En un estudio de carcinogenicidad IM de 24 meses en ratas, no se observó aumento en la incidencia de tumores en el sitio de inyección en los grupos con vehículo o con fármaco activo.
ADVERTENCIAS ESPECIALES Y PRECAUCIONES: En pacientes que jamás han recibido risperidona se recomienda establecer la tolerabilidad con la formulación oral antes de iniciar el tratamiento con RISPERDAL® CONSTA®. Usar con precaución en pacientes con enfermedad cardiovascular conocida.
• Pacientes ancianos con demencia:
Generalidades en mortalidad: Los pacientes ancianos con demencia tratados con fármacos antipsicóticos atípicos presentan una mayor mortalidad que los que recibieron placebo en un meta-análisis de 17 estudios clínicos controlados con medicamentos antipsicóticos atípicos, incluido el RISPERDAL®. En un estudio clínico placebo-controlado con RISPERDAL® por vía oral realizados en esta población, la incidencia de la mortalidad fue del 4.0% en los pacientes tratados con RISPERDAL® y del 3.1% en los pacientes tratados con placebo. El promedio de edad (rango) de los pacientes que murieron fue de 86 años (rango 67 - 100).
Uso concomitante con Furosemida: En el mismo ensayo placebo-controlado en pacientes ancianos con demencia, una incidencia más alta de mortalidad fue observada en pacientes tratados con furosemida más risperidona (7.3%; promedio de edad, 89 años, rango 75 - 97) cuando se comparó con pacientes tratados con risperidona sola (3.1%; promedio de edad 84, años, rango 70 - 96) o furosemida sola (4.1%; promedio de edad, 80 años, rango 67-90). El incremento en la mortalidad de pacientes tratados con furosemida más risperidona fue observada en dos de los cuatro ensayos clínicos.
Ningún mecanismo fisiopatológico se ha identificado para explicar este descubrimiento, y ningún patrón para la causa de las muertes observadas. En todo caso, se debe tener precaución y los riesgos y beneficios de esta combinación se deben considerar antes de la decisión de uso. No hubo un incremento en la incidencia de la mortalidad entre pacientes tomando otros diuréticos como medicamento concomitante con risperidona. Independiente del tratamiento, la deshidratación fue sobre todo un factor de riesgo de mortalidad y debería por esto ser cuidadosamente evitado in pacientes ancianos con demencia.
Independientemente del tratamiento, la deshidratación fue un factor de riesgo global de mortalidad y por tanto debe evitarse con precaución en los pacientes ancianos con demencia.
Eventos Adversos Cerebrovasculares (EAC): Durante los ensayos controlados con placebo, la incidencia de complicaciones cerebrovasculares (accidentes cerebrovasculares y ataques isquémicos transitorios), incluidas las muertes, fue mayor en los pacientes ancianos con demencia (promedio de edad 85 años; rango 73 - 97) tratados con RISPERDAL® por la vía oral que en los pacientes que recibieron un placebo.
Hipotensión ortostática: Debido a la actividad alfa-bloqueadora de la risperidona, se puede presentar hipotensión (ortostática), en especial durante el comienzo del tratamiento. Se han observado casos de hipotensión clínicamente significativa durante la experiencia posterior a la comercialización con el uso concomitante de risperidona y tratamiento antihipertensivo. La risperidona se debe usar con precaución en pacientes con enfermedad cardiovascular conocida (p. ej., insuficiencia cardiaca, infarto de miocardio, trastornos de conducción, deshidratación, hipovolemia o enfermedad cerebrovascular). Deberá analizarse el balance riesgo beneficio del tratamiento con RISPERDAL® CONSTA® en caso de que persista la hipotensión ortostática clínicamente relevante.
Leucopenia, neutropenia y agranulositosis: Se han informado eventos de leucopenia, neutropenia y agranulositosis con agentes antipsicóticos, incluyendo RISPERDAL® CONSTA®. Muy raramente se ha informado agranulositosis (< 1/10.000 pacientes) durante la fármaco-vigilancia posterior a la comercialización.
Los pacientes con antecedentes de recuento bajo de glóbulos blancos (WBC) clínicamente significativo, o leucopenia/neutropenia inducida por la droga deben ser controlados durante los primeros meses de la terapia y se debe considerar la discontinuación de RISPERDAL® CONSTA® ante el primer signo de disminución del WBC clínicamente significativa en ausencia de otros factores causantes.
Los pacientes con neutropenia clínicamente significativa deben ser controlados cuidadosamente por fiebre u otros síntomas o signos de infección y tratados inmediatamente si ocurriesen tales síntomas o signos. Los pacientes con neutropenia severa (recuento absoluto de neutrófilos < 1 X 109/L) deben discontinuar RISPERDAL® CONSTA® y controlar su WBC hasta la recuperación.
Tromboembolismo venoso: Se han informado casos de tromboembolismo venoso (TEV) con drogas antipsicóticas. Debido a que los pacientes tratados con antipsicóticos frecuentemente presentan factores de riesgo adquiridos para TEV, todos los posibles factores de riesgo para TEV deben identificarse antes y durante el tratamiento con RISPERDAL® CONSTA® y tomarse las medidas preventivas.
Disquinesia tardía/Síntomas extrapiramidales (DT/SEP): Los medicamentos que tienen propiedades antagonísticas de los receptores de dopamina se han asociado con la inducción de disquinesia tardía caracterizada por movimientos rítmicos involuntarios, de predominio en la lengua o la cara. Se ha informado que la aparición de síntomas extrapiramidales constituye un factor de riesgo para el desarrollo de la disquinesia tardía. Dado que la risperidona tiene un potencial menor de inducción de síntomas extrapiramidales que los neurolépticos clásicos, el riesgo de que induzca la disquinesia tardía debe ser también menor comparado con el de los neurolépticos clásicos. Si aparecen signos o síntomas de disquinesia tardía, deberá considerarse la interrupción de todos los fármacos antipsicóticos.
Síndrome Neuroléptico Maligno (SNM): Se ha reportado el desarrollo del Síndrome Neuroléptico Maligno, caracterizado por hipertermia, rigidez muscular, inestabilidad autonómica, alteración de la conciencia y elevación de los niveles de creatinina fosfoquinasa plasmatica, en asociación con los antipsicóticos. Otros signos pueden ser mioglobinuria (rabdomiolisis) e insuficiencia renal aguda. En este caso, deberá interrumpirse la administración de todos los medicamentos antipsicóticos, incluida la risperidona. Después de la última administración de RISPERDAL® CONSTA® los niveles plasmáticos de risperidona estarán presentes hasta por un (mínimo) de seis semanas.
Enfermedad de Parkinson y Demencia con Cuerpos de Lewy: Los médicos deberán sopesar el riesgo versus el beneficio cuando prescriben antipsicóticos, incluyendo RISPERDAL® CONSTA®, a pacientes con enfermedad de Parkinson o demencia de cuerpos de Lewy (DCL) ya que ambos grupos pueden incrementar el riesgo de Síndrome Neuroléptico Maligno, así como de tener una sensibilidad incrementada a medicamentos antipsicóticos. Entre las manifestaciones de esta incrementada sensibilidad puede incluir confusión, embotamiento, inestabilidad en la postura con caídas frecuentes, además de los síntomas extrapiramidales.
Reacciones de hipersensibilidad: Aunque se debe establecer la tolerabilidad de la risperidona oral antes de iniciar el tratamiento con RISPERDAL® CONSTA®, se han reportado muy raros casos de reacciones anafilácticas durante la experiencia posterior a la comercialización en pacientes que han tolerado previamente la risperidona oral (ver Posología y Método de Administración y Reacciones adversas).
Si se presentan reacciones de hipersensibilidad, descontinuar el uso de RISPERDAL® CONSTA®; iniciar medidas de soporte generales según sea clínicamente apropiado y monitorear al paciente hasta que se resuelvan los signos y los síntomas. (Ver Contraindicaciones y Reacciones adversas).
Hiperglucemia y Diabetes Mellitus: En unos pocos casos se ha informado de la aparición de hiperglucemia o la exacerbación de una diabetes preexistente durante el tratamiento con RISPERDAL®. La evaluación de la relación entre el uso de antipsicóticos atípicos y las anormalidades en cuanto a la glucosa se complica por la posibilidad de un incremento del riesgo de base de diabetes mellitus en pacientes con esquizofrenia y el aumento en la incidencia de diabetes mellitus en la población general. Dadas estas variables de confusión, la relación entre el uso de antipsicóticos atípicos y los eventos adversos relacionados con la hiperglucemia no se comprende en su totalidad. Cualquier paciente tratado con antipsicóticos, incluyendo RISPERDAL® CONSTA® debe ser controlado para la detección de síntomas de hiperglucemia y diabetes mellitus. (Ver sección Reacciones adversas).
Aumento de Peso: Se ha informado aumento significativo de peso. Se aconseja el control del aumento de peso cuando se está utilizando RISPERDAL® CONSTA®.
Intervalo QT: Al igual que ocurre con otros antipsicóticos, es necesario proceder con prudencia cuando se prescriba RISPERDAL® CONSTA® a pacientes con antecedentes de arritmias cardíacas, pacientes con síndrome QT largo congénito, o con su uso concomitante con fármacos que prolonguen el intervalo QT.
Priapismo: Se ha informado que las drogas con efectos bloqueantes alfa-adrenérgicos inducen el priapismo. Se ha informado priapismo con RISPERDAL® durante la fármaco-vigilancia posterior a la comercialización (ver sección Reacciones adversas).
Regulación de la Temperatura Corporal: La alteración de la capacidad del cuerpo para reducir la temperatura corporal interna ha sido atribuida a los agentes antipsicóticos. Se aconseja el cuidado apropiado cuando se prescribe RISPERDAL® CONSTA® a pacientes que estarán experimentando condiciones que pueden contribuir a una elevación de la temperatura corporal interna, por ejemplo, ejercitarse enérgicamente, estar expuestos al calor extremo, recibir medicamentos concomitantes con actividad anticolinérgica o ser propensos a la deshidratación.
Efecto antiemético: Se observó un efecto antiemético en estudios preclínicos con risperidona. Este efecto, si ocurriera en humanos, puede enmascarar los signos y síntomas de sobredosis con ciertas drogas o de condiciones tales como obstrucción intestinal, el síndrome de Reye y tumor cerebral.
Convulsiones: Como con otras drogas antipsicóticas, RISPERDAL® CONSTA® debe ser usado cuidadosamente en pacientes con antecedentes de convulsiones u otras condiciones que potencialmente disminuyan el umbral de convulsión.
Síndrome del Iris Flácido Intra-operatorio: El síndrome del iris flácido intra-operatorio (IFIS) ha sido observado durante una cirugía de catarata en pacientes tratados con medicamentos con efecto antagonista alfa 1a adrenérgico, incluyendo RISPERDAL® CONSTA® (ver Reacciones adversas).
IFIS puede aumentar el riesgo de complicaciones en el ojo durante y después de la operación. El uso vigente o pasado de medicamentos con efecto antagonista alfa 1a adrenérgico deberá hacerse del conocimiento del cirujano oftálmico antes de la cirugía. El beneficio potencial de detener la terapia de bloqueo de alfa1 previo a la cirugía de catarata no ha sido establecido y deber ser sopesado contra el riesgo de detener la terapia anti-psicótica.
Administración: Cuidados deben ser tomados para evitar inyectar inadvertidamente RISPERDAL® CONSTA® dentro de una vena (ver sección Oclusión arterial).
Interacción: Las interacciones de RISPERIDAL® CONSTA® con la administración concomitante de otros fármacos no se ha evaluado de manera sistemática. Los datos de interacción farmacológica proporcionados en esta sección se basan en los estudios con RISPERIDAL® oral.
• Interacciones relacionadas con la farmacodinámica:
Fármacos de acción central y alcohol: Dados los efectos primarios de la risperidona sobre el sistema nervioso central, ésta deberá usarse con precaución cuando se combina con otros medicamentos de acción central o alcohol.
Levodopa y agonistas de la dopamina: La risperidona puede antagonizar el efecto de la levodopa y otros antagonistas de la dopamina.
Fármacos con efectos hipotensores: Se han observado casos de hipotensión clínicamente significativa durante la experiencia posterior a la comercialización con el uso concomitante de risperidona y tratamiento antihipertensivo.
Fármacos que prolongan el intervalo QT: Se recomienda prudencia cuando se prescriba RISPERDAL® CONSTA® junto con otros fármacos que prolonguen el intervalo QT.
Interacciones relacionadas con la farmacocinética: La risperidona se metaboliza sobre todo mediante CYP2D6 y en menor medida mediante CYP3A4. Tanto risperidona como su metabolito activo, 9-hidroxirrisperidona, son sustratos de la glucoproteína P (P-gp). Las sustancias que modifican la actividad de CYP2D6 y las sustencias que son inhibidores o inductores potentes de CYP3A4 y/o la actividad de P-gp pueden influir en la farmacocinética de la fracción antipsicótica activa de risperidona.
Inhibidores potentes de CYP2D6: La administración concurrente de RISPERIDAL® CONSTA® con un inhibidor potente de CYP2D6 puede aumentar la concentración plasmática de risperidona, pero menos la de su fracción antipsicótica activa. Las dosis altas de un inhibidor potente de CYP2D6 elevan las concentraciones de la fracción antipsicótica activa de risperidona (p. ej., paroxetina, véase más adelante). Cuando se inicia o suspende la paroxetina concomitante u otro inhibidor potente de CYP2D6, sobre todo en dosis altas, el médico debe evaluar de nuevo la posología de RISPERIDAL® CONSTA®.
Inhibidores de CYP3A4 y/o P-gp: La administración concurrente de RISPERIDAL® CONSTA® con un inhibidor potente de CYP3A4 y/o P-gp puede elevar mucho la concentración plasmática de la fracción antipsicótica activa de risperidona. Cuando se inicia o suspende el itraconazol concomitante u otro inhibidor potente de CYP3A4 y/o P-gp, sobre todo en dosis altas, el médico debe evaluar de nuevo la posología de RISPERIDAL® CONSTA®.
Inductores de CYP3A4 y/o P-gp: La administración concurrente de RISPERIDAL® CONSTA® con un inductor potente de CYP3A4 y/o P-gp puede elevar mucho la concentración plasmática de la fracción antipsicótica activa de risperidona. Cuando se inicia o suspende la carbamazepina concomitante u otro inductor potente de CYP3A4 y/o P-gp, el médico debe evaluar de nuevo la posología de RISPERIDAL® CONSTA®.
Fármacos con alto porcentaje de unión con proteínas: Cuando se toma RISPERIDAL® CONSTA® al tiempo con otros medicamentos que tienen afinidad de unión a las proteínas del plasma, no se produce un desplazamiento clínicamente relevante de ninguno de los medicamentos de las proteínas plasmáticas.
Cuando se usa un medicamento concomitante, debe consultarse la etiqueta correspondiente para obtener información sobre la vía metabólica y la posible necesidad de ajustar las dosis.
Ejemplos: A continuación se citan ejemplos de los fármacos que pueden interactuar o con falta de interacción demostrada con risperidona.
• Antibacterianos:
— Eritromicina, un inhibidor moderado de la CYP 3A4, no cambia la farmacocinética de la risperidona ni la de la fracción antipsicótica activa.
— Rifampicina, un potente inductor de CYP3A4 y de P-gp, disminuyó las concentraciones plasmáticas de la fracción antipsicótica activa.
• Anticolinesterásicos:
— Donepezilo y galantamina, ambos sustratos de CYP2D6 y CUYP3A4, no muestran ningún efecto clínicamente relevante sobre la farmacocinética de la risperidona y de la fracción antipsicótica activa.
• Antiepilépticos:
— Carbamazepina, un potente inductor de CYP3A4 y de P-gp, ha demostrado que disminuye las concentraciones plasmáticas de la fracción antipsicótica activa de la risperidona.
— Topiramato reduce modestamente la biodisponibilidad de la risperidona, pero no la fracción activa antipsicótica. Por tanto, es poco probable que esta interacción tenga importancia clínica.
— La risperidona no muestra un efecto clínico relevante sobre la farmacocinética de valproato o topiramato.
• Antimicóticos:
— Itraconazol, un potente inhibidor de CYP3A5 y un inhibidor de P-gp, en dosis de 200 mg/día aumentó las concentraciones plasmáticas de la fracción antipsicótica activa en cerca de 70%, con dosis de risperidona de 2 a 8 mg/día.
— Ketoconazol, un potente inhibidor de CYP3A4 y un inhibidor de P-gp, en dosis de 200 mg/día aumentó las concentrcaciones plasmáticas de risperidona y redujo las concentraciones plasmáticas de 9-hidroxirrisperidona.
• Antipsicóticos:
— Las fenotiazinas, pueden elevar la concentración plasmática de risperidona pero no la de la fracción antipsicótica activa.
— Aripiprazol, sustrato de CYP2D6 y CYP3A4: las tabletas o inyecciones de risperidona no afectaron la farmacocinética de la suma de aripiprazol y su metabolito activo, dehidroaripiprazol.
• Antivirales:
— Inhibidores de la proteasa: no existen datos de estudios formales, pero como el ritonavir es un potente inhibidor de CYP3A4 e inhibidor débil de CYP2D6, ritonavir y los inhibidores de la proteasa reforzados con ritonavir pueden elevar las concentraciones de la fracción antipsicótica activa de risperidona.
• Bloqueadores beta:
— Algunos beta bloqueadores pueden elevar la concentración plasmática de risperidona pero no la de la fracción antipsicótica activa.
• Bloqueadores del conducto de calcio:
— Verapamilo, un inhibidor moderado de CYP3A4 e inhibidor de P-gp, aumenta la concentración plasmática de risperidona y su fracción antipsicótica activa.
• Glucósidos digitálicos:
— La risperidona no muestra un efecto clínicamente relevante sobre la farmacocinética de la digoxina.
• Diuréticos:
— Furoxemida: Ver sección Advertencias y precauciones que trata el incremento en la mortalidad en pacientes ancianos con demencia quienes recibían concomitantemente furosemida y RISPERDAL® oral.
• Fármacos gastrointestinales:
— Antagonistas del receptor H2: La cimetidina y la ranitidina, ambos inhibidores débiles de CYP2D6 y CYP3A4, aumentaron la biodisponibilidad de la risperidona, pero sólo marginalmente por encima de la de la fracción antipsicótica activa.
• Litio:
— La risperidona no muestra un efecto clínicamente relevante sobre la farmacocinética del litio.
• SSRI y antidepresivos tricíclicos:
— Fluoxetina un potente, inhibidor de la CYP 2D6, aumenta la concentración plasmática de risperidona, pero, en menor medida, la de la fracción antipsicótica activa.
— Paroxetina un potente, inhibidor de la CYP 2D6, aumenta la concentración plasmática de risperidona, pero, en dosis de hasta 20 mg/día, en menor medida, la de la fracción antipsicótica activa. Sin embargo, las dosis más altas de paroxetina pueden elevar las concentraciones de la fracción antipsicótica activa de risperidona.
— Antidepresivos tricíclicos pueden aumenta la concentración plasmática de risperidona, pero, en menor medida, la de la fracción antipsicótica activa. La amitriptilina no modifica la farmacocinética de la risperidona ni la de la fracción antipsicótica activa.
— La sertralina, un inhibidor débil de CYP2D6, y fluvoxamina, un inhibidor débil de CYP3A4, en dosis de hasta 100 mg/día no se relacionan concambios clínicamente significativos en las concentraciones de la fracción antipsicótica activa de risperidona. Sin embargo, las dosis mayores de 100 mg/día de sertralina o fluvoxamina pueden elevar las concentraciones de la fracción antipsicótica activa de risperidona.
ADMINISTRACIÓN: RISPERDAL® CONSTA® debe administrarse cada dos semanas en inyección intramuscular profunda en el glúteo usando la aguja de seguridad que se adjunta. Las inyecciones deben aplicarse alternando los glúteos. No debe administrarse por vía intravenosa. (Ver la sección Advertencias especiales y precauciones e Instrucciones para el uso).
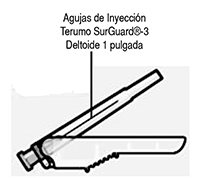
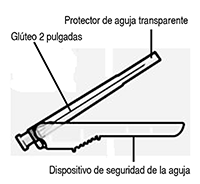
RISPERDAL® CONSTA® se debe administrar cada dos semanas en inyección intramuscular profunda en el deltoides o el glúteo usando la aguja de seguridad adecuada. Para la administración en el deltoides, usar la aguja de 2,54 cm alternando las inyecciones entre los dos brazos. Para la administración en el glúteo, usar la aguja de 5,08 cm alternando las inyecciones entre las dos nalgas. No se debe no se debe administrar por vía intravenosa (ver la sección Advertencias especiales y precauciones – Administración y la Sección, Instrucciones para el uso).
INSTRUCCIONES DE USO:
Información importante: El RISPERDAL® CONSTA® requiere que se preste estricta atención a las siguientes instrucciones de uso paso a paso para ayudar a asegurar el éxito de la administración.
Espere 30 minutos: Saque el empaque de la dosis de la nevera y déjelo reposar a temperatura ambiente durante mínimo 30 minutos antes de la reconstitución.
No lo caliente de ninguna otra manera.
Utilizar los componentes proporcionados: Los componentes de este empaque de dosis están diseñados específicamente para usarlos con el RISPERDAL® CONSTA®. El RISPERDAL® CONSTA® debe ser reconstituido solo en el diluyente que viene en el paquete de la dosis.
No reemplace ninguno de los componentes del empaque de la dosis.
No guarde la suspensión después de la reconstitución.
Administre la dosis tan pronto como sea posible después de la reconstitución para evitar la sedimentación.
Dosificación correcta: Se debe administrar todo el contenido del vial para asegurar que se inyecta la dosis correcta de RISPERDAL® CONSTA®.
DISPOSITIVO DE UN SOLO USO.
NO REUTILIZAR. Los dispositivos médicos requieren características materiales específicas para que cumplan su propósito previsto. Estas características han sido verificadas para un solo uso. Cualquier intento de volver a procesar el dispositivo para su posterior reutilización puede afectar negativamente la integridad del dispositivo o conducir al compromiso de su desempeño.
Contenido del empaque de dosis
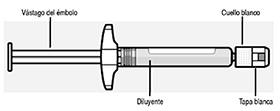
Jeringa prellenada
Vial
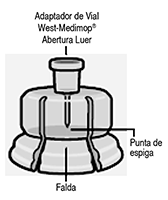
Paso 1. Ensamble de los componentes: Conecte el adaptador del vial al vial:
|
Retire la tapa del vial Levante la tapa de color del vial. Limpie la parte superior del tapón gris con una toalla impregnada con alcohol. Dejar secar al aire. No quite el tapón de caucho gris. |
Prepare el adaptador del vial Mantenga el blister estéril como se muestra. Desprenda y retire el papel protector. No retire el adaptador del vial del blíster. No toque la punta del pico en ningún momento. Esto puede causar contaminación. |
Conecte el adaptador del vial al vial Ponga el vial sobre una superficie dura y sujételo por la base. Centre el adaptador del vial sobre el tapón gris de caucho. Empuje el adaptador del vial contra la parte de arriba del vial hasta que encaje en su lugar. No ponga el adaptador del vial en ángulo porque puede escapar el diluyente cuando se transfiera al vial.
|
Conecte la jeringa prellenada al adaptador del vial
|
Quite el blister estéril Quite el adaptador del vial del blíster estéril solo cuando esté listo para quitar la tapa blanca de la jeringa prellenada Mantenga el vial vertical para evitar fugas. Sujete la base del vial y hale hacia arriba sobre el blíster estéril para retirarlo. No lo agite. No toque la abertura luer expuesta en el adaptador del vial. Esto puede causar contaminación. |
Use un buen agarre Sujete por el cuello blanco en la punta de la jeringa. No sostenga la jeringa por el barril de vidrio durante el ensamble.
|
Quite el tapón Sujete el cuello blanco, quite la tapa blanca. No retuerza o corte la tapa blanca. No toque la punta de la jeringa. Esto puede causar contaminación
Cuando se quita la tapa, la jeringa se verá así. Se puede desechar la tapa rota |
Conecte la jeringa al adaptador del vial Sujete el adaptador del vial por la falda para mantenerlo quieto. Sostenga la jeringa por el cuello blanco e inserte la punta en la apertura Luer del adaptador del vial. No sujete el barril de vidrio de la jeringa. Esto puede hacer que el cuello blanco se afloje o desconecte. Conecte la jeringa al adaptador del vial con un firme movimiento de giro hacia la derecha hasta que la sienta apretada. No apriete en exceso. Esto puede hacer que se rompa la punta de la jeringa |
Paso 2. Reconstituir las microesferas
|
Inyecte el diluyente Inyectar el diluyente Inyecte toda la cantidad de diluyente de la jeringa en el vial. El contenido del vial ahora estará bajo presión. Siga sujetando el vástago del émbolo hacia abajo con el pulgar. |
Suspender las microesferas en el diluyente Sujetando hacia abajo el vástago del émbolo, agite vigorosamente durante al menos 10 segundos, como se muestra. Mire la suspensión. Cuando está bien mezclada, la suspensión se ve uniforme, espesa y de color lechoso. Las microesferas serán visibles en el líquido. Siga inmediatamente con el próximo paso para que la suspensión no se asiente. |
Transfiera la suspensión a la jeringa Invierta el vial por completo. Tire despacio del vástago del émbolo hacia abajo para extraer todo el contenido del vial con la jeringa. |
Retire el adaptador de vial Sujete el cuello blanco sobre la jeringa del vial y desenrósquelo del adaptador del vial. Rasgue la sección de la etiqueta del vial por la perforación. Pegue la etiqueta desprendida a la jeringa para efectos de identificación. Deseche el frasco y el adaptador del vial adecuadamente. |
Paso 3. Fije la aguja
|
Seleccione la aguja adecuada con base en la ubicación del sitio de inyección (deltoides o glúteo). |
Conecte la aguja Despegue la funda del blíster parcialmente y úsela para agarrar la base de la aguja, como se muestra. Sujetando el cuello blanco sobre la jeringa, conecte la jeringa a la conexión luer de la aguja con un firme movimiento de giro en el sentido de las manecillas del reloj hasta que quede ajustado. No toque la abertura Luer de la aguja. Esto puede causar contaminación. |
Resuspenda las microesferas Retire completamente la funda del blíster. Justo antes de la inyección, agitar vigorosamente la jeringa de nuevo, porque puede haberse producido cierto asentamiento. |
Paso 4. Inyectar la dosis:
|
Quite el protector transparente de la aguja Regrese el dispositivo de seguridad de la aguja hacia la jeringa, como se muestra. Entonces sujete el cuello blanco en la jeringa y saque con cuidado el protector transparente de la aguja en línea recta. No retuerza el protector transparente de la aguja, porque la conexión Luer se puede aflojar. |
Elimine las burbujas de aire Sostenga la jeringa vertical y golpéela suavemente para hacer que las burbujas de aire suban a la parte superior. Despacio y con cuidado, presione el vástago del émbolo hacia arriba para extraer el aire. |
Inyecte de inmediato todo el contenido de la jeringa por vía intramuscular (!M) en el músculo deltoides o glúteo del paciente. La inyección en el glúteo debe aplicarse en el cuadrante superior externo del área glútea. No administre por vía intravenosa. |
Fije la aguja en el dispositivo de seguridad. Con una sola mano ponga el dispositivo de seguridad de la aguja en un ángulo de 45 grados sobre una superficie dura y plana. Presione hacia abajo con un movimiento firme y rápido hasta cuando la aguja esté totalmente acoplada en el dispositivo de seguridad. Evite pinchazos: No use las dos manos. No desconecte o manipule intencionalmente el dispositivo de seguridad de la aguja. No intente enderezar la aguja o conectar el dispositivo de seguridad si la aguja está doblada o dañada. |
Deseche las agujas Confirme que el dispositivo de seguridad de la aguja está totalmente acoplado. Deseche en un recipiente aprobado para objetos cortopunzantes. También deseche la aguja no utilizada que viene en el paquete de dosis. |
RISPERDAL® CONSTA® 25 mg (Reg. San. INVIMA 2014M-0002349-R2).
RISPERDAL® CONSTA® 37.5 mg (Reg. San. INVIMA 2009M-0009457).
JANSSEN-CILAG, S. A.
Av. Calle 26 No. 69-76 - Edificio Elemento Torre 2, Piso 11 - PBX: +57 1 927 1200 - Bogotá, D. C.
POSOLOGÍA Y MÉTODO DE ADMINISTRACIÓN: En aquellos pacientes que nunca hayan recibido risperidona, se recomienda establecer la tolerabilidad con risperidona oral antes de iniciar el tratamiento con RISPERDAL® CONSTA®.
Adultos (mayores de 18 años): La dosis recomendada es de 25 mg en inyección intramuscular cada dos semanas. Algunos pacientes pueden beneficiarse de dosis más elevadas de 37,5 o 50 mg. No se observaron beneficios en los estudios clínicos con dosis de 75 mg. No se recomiendan dosis superiores a 50 mg cada dos semanas.
Hay que asegurar una cobertura antipsicótica suficiente durante el periodo de tres semanas anteriores a la primera inyección de RISPERDAL® CONSTA® (ver Propiedades farmacocinéticas).
El ajuste de la dosis hacia arriba no debe realizarse más frecuentemente que cada 4 semanas. El efecto de este ajuste de la dosis no debe anticipar tempranamente, se debe esperar que hayan pasado tres semanas después de la primera inyección con la dosis más alta.
• Poblaciones especiales:
Niños: No se ha estudiado RISPERDAL® CONSTA® en pacientes menores de 18 años de edad.
Ancianos (65 años de edad y más): La dosis recomendada es de 25 mg en inyección intramuscular cada dos semanas. Se proporcionará cobertura antipsicótica suficiente durante el período de latencia de 3 semanas después de la primera inyección de RISPERDAL® CONSTA® (véase Propiedades farmacocinéticas).
Insuficiencia hepática y renal: No se ha estudiado RISPERDAL® CONSTA® en pacientes con deterioro de la función hepática o renal.
Paciente con deterioro de la función hepática o renal que requieren tratamiento con RISPERDAL® CONSTA® se recomienda iniciar con una dosis oral de 0,5 mg de risperidona dos veces al día durante la primera semana. Durante la segunda semana se puede administrar bien sea 1 mg dos veces al día o bien 2 mg una vez al día. Si se tolera bien una dosis oral al menos de 2 mg, se puede administrar una inyección intramuscular de 25 mg de RISPERDAL® CONSTA® cada dos semanas.
SOBREDOSIS: Aunque es menos probable que se presente una sobredosis con la administración parenteral que con la oral, se presenta aquí la información pertinente a la sobredosis oral.
Síntomas y signos: En general, los signos y síntomas informados han sido aquéllos provenientes de una exageración de los efectos farmacológicos conocidos del medicamento. Entre ellos se incluyen somnolencia y sedación, taquicardia e hipotensión y síntomas extrapiramidales. En casos de sobredosis se ha descrito la prolongación del segmento QT y la aparición de convulsiones. Se ha comunicado la aparición de torsade de pointes en asociación con sobredosis combinada de RISPERDAL® oral y paroxetina.
En caso de sobredosis aguda, se contemplará la posibilidad de que el paciente haya tomado varios fármacos.
Tratamiento: Establecer y mantener la permeabilidad de la vía aérea y asegurar adecuadas oxigenación y ventilación. La monitorización cardiovascular debe comenzar de inmediato y debe incluir monitorización electrocardiográfica continua a fin de detectar cualquier posible arritmia.
No existe un antídoto específico para el RISPERDAL®. Por tanto, hay que instaurar las medidas de soporte adecuadas. La hipotensión y el colapso circulatorio se tratan con las medidas pertinentes como la administración de líquidos intravenosos y/o agentes simpaticomiméticos. En caso de síntomas extrapiramidales pronunciados se pueden administrar medicamentos anticolinérgicos. La supervisión médica estrecha y la monitorización continuarán hasta la recuperación del paciente.
NATURALEZA Y CONTENIDO DEL RECIPIENTE:
RISPERDAL® CONSTA® se empaca en la siguiente configuración de recipiente/cierre:
— Un vial que contiene RISPERDAL® CONSTA® en microesferas de liberación extendida.
— Una jeringa prellenada que contiene el diluyente para RISPERDAL® CONSTA®.
— Un West-Medimop Vial Adapter® para reconstitución (se hace referencia como adaptador de vial).
— Dos agujas Terumo SurGuard®-3 para inyección intramuscular (aguja de seguridad 21G UTW de 1 pulgada con dispositivo de protección de aguja para la administración en el deltoide y una aguja de seguridad 20G TW de 2 pulgadas con dispositivo de protección de aguja para la administración en el glúteo) (“Rx - only” = dispositivo para venta exclusivamente con medicamentos de prescripción médica).
PRECAUCIONES ESPECIALES PARA EL ALMACENAMIENTO: El empaque completo de la dosis debe guardarse en el refrigerador (2-8ºC) protegido de la luz. No debe exponerse a temperaturas superiores a 25ºC.
Si no es posible la refrigeración, puede almacenarse RISPERDAL® CONSTA® a una temperatura que no sobrepase los 25ºC durante no más de 7 días antes de la administración. No debe exponerse el producto no refrigerado a temperaturas superiores a 25ºC.
Manténgase fuera del alcance de los niños.