
STELARA
USTEKINUMAB
Viales
1 Caja, 1 Vial(es), Solución para inyección, 1 Mililitros
Caja , Jeringa prellenada , 0,5 Mililitros
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: STELARA® es un anticuerpo monoclonal IgG1K totalmente humano con un peso molecular aproximado de 148 600 daltones. STELARA® se produce a través de una línea celular recombinante cultivada por perfusión continua y se purifica mediante una serie de pasos que incluye medidas para desactivar y eliminar virus.
STELARA® está disponible como una solución para inyección para administración subcutánea, en las siguientes presentaciones:
Jeringa prellenada: 45 mg/0.5 mL.
PROPIEDADES FARMACOLÓGICAS/PROPIEDADES FARMACODINÁMICAS:
Grupo farmacoterapéutico: Inmunosupresores, inhibidores de la interleucina, Código ATC: L04AC05.
Mecanismo de acción: STELARA® es un anticuerpo monoclonal IgG1K totalmente humano que se une con gran afinidad y especificidad a la subunidad proteínica p40 compartida de la interleuquina de citoquinas humanas (IL)-12 e IL-23. STELARA® inhibe la bioactividad de IL-12 e IL-23 humanas al evitar que estas citoquinas se unan a la proteína P40 receptora IL-12Rß1 expresada en la superficie de células inmunes. STELARA® no se puede unir a IL-12 ni IL-23 ya unido a los receptores de la superficie celular IL-12Rß]. Por tanto, es poco probable que STELARA® contribuya a citotoxicidad complementaria o mediada por anticuerpos de células con los receptores IL-12 y/o IL-23.
IL-12 e IL-23 son citoquinas heterodiméricas segregadas por antígenos activados que presentan células como macrófagos y células dendríticas. IL-12 estimula las células asesinas naturales (NK) y conduce la diferenciación de las células CD4+ T en relación al fenotipo T1 ayudante (Th1) y estimula la producción del interferón gamma (IFN?). IL-23 induce la ruta del T ayudante 17 (Th17) y promueve la secreción de IL-17A, IL-21, y IL-22. Los niveles de IL-12 y IL-23 son elevados en la piel y sangre de pacientes con psoriasis y el IL12/23p40 sérico se distingue de pacientes con artritis psoriásica de aquellos individuos sanos, implicando IL-12 y IL-23 en la pato-fisiología de padecimientos psoriásicos inflamatorios. Polimorfismo genético en genes IL23A, IL23R, y IL-12B confieren susceptibilidad a estos desórdenes. IL-12 y IL-23 están altamente expresados en piel psoriásica lesionada, y la inducción mediada por IL-12 de IFN? se correlaciona con la actividad del padecimiento por psoriasis. Células T receptivas de IL-23 han sido encontradas en la entesis en un modelo de ratón de artritis inflamatoria, donde IL-23 conduce a inflamación entesial. Además, hay evidencia pre-clínica implicando IL-23 y las rutas de fase posterior en la erosión y destrucción de hueso mediante regulación a la alza del activador de receptor del ligando de factor nuclear-κB (RANKL), el cual activa los osteoclastos.
Al ligar la sub-unidad compartida p40 de IL-12 y IL-23, STELARA puede ejercer sus efectos clínicos tanto en psoriasis como en artritis psoriásica a través de la interrupción de las rutas de las citocinas Th1 y Th17, las cuales son centrales a la patología de estos padecimientos.
Efectos farmacodinámicos: El tratamiento con STELARA® ha dado como resultado mejores medidas histológicas de psoriasis, incluyendo hiperplasia epidérmica y proliferación celular. Estos resultados concuerdan con los observados en la eficacia clínica.
En pacientes con psoriasis y/o artritis psoriásica, STELARA® no tuvo un efecto evidente en los porcentajes de poblaciones de células inmunes circulantes, incluyendo los subconjuntos de células de la memoria o T sin previo tratamiento o niveles de citoquina circulante. Los marcadores sistémicos de inflamación fueron medibles en el suero en línea base y 4 marcadores (MDC, VEGF, MCSF-1 y YKL-40) mostraron diferencias modestas en la concentración post-tratamiento en pacientes tratados con STELARA® comparado con placebo.
El tratamiento con STELARA® dio como resultado una disminución en la expresión genética de sus objetivos moleculares IL-12 e IL-23, como se muestra en los análisis de ARNm obtenidos de biopsias en piel lesionada de pacientes con psoriasis en los valores iniciales y hasta 2 semanas después del tratamiento. Además, STELARA® aminora la expresión genética de citoquinas y quemoquinas inflamatorias como MCP-1, TNF-alfa, IP-10 e IL-8 en biopsias de piel con lesiones. Estos resultados concuerdan con el beneficio clínico significativo observado en el tratamiento con STELARA® en psoriasis.
En estudios de psoriasis y artritis psoriásica, la respuesta clínica (mejora en las mediciones PASI o ACR, respectivamente) pareció relacionarse con los niveles séricos de ustekinumab. Los pacientes con psoriasis con respuestas clínicas superiores, según las medidas de respuesta PASI, obtuvieron concentraciones séricas medias superiores de ustekinumab que aquellos con respuestas clínicas inferiores. En estudios de psoriasis, la proporción de pacientes con psoriasis que lograron una respuesta PASI 75 aumentó con mayores niveles séricos de ustekinumab. La proporción de pacientes que lograron una respuesta PASI 75 en la semana 38 aumentó con mayores concentraciones séricas residuales en la semana 28.
En estudios de artritis psoriásica, los pacientes que alcanzaron una respuesta ACR 20 tuvieron concentraciones medianas séricas mayores de ustekinumab que los que no tuvieron respuesta ACR 20. La proporción de pacientes quienes alcanzaron respuesta en ACR 20 y ACR 50 aumentaron con un aumento en los niveles séricos de ustekinumab.
Inmunización: Durante la extensión de largo plazo del estudio de psoriasis de Fase 3 (PHOENIX 2), pacientes tratados con STELARA por al menos 3.5 años generaron respuestas similares de anticuerpo tanto a la vacuna de tétanos como a la de polisacáridos pneumococales como un grupo de control de psoriasis tratado de manera no-sistemática. Proporciones similares de pacientes desarrollaron niveles protectores de anticuerpos anti-tétanos y anti-neumococo y las concentraciones por titulación de anticuerpos fueron similares entre los pacientes tratados con STELARA® y lo pacientes de control.
Estudios clínicos:
Eficacia clínica - Psoriasis en Placa
|
Tabla 4: Características de los valores iniciales de la enfermedad |
||||
|
PHOENIX 1 |
PHOENIX 2 |
|||
|
Placebo |
STELARA® |
Placebo |
STELARA® |
|
|
Pacientes asignados al azar en la semana 0 |
N= 255 |
N= 511 |
N= 410 |
N= 820 |
|
BSA media |
22.0 |
21.0 |
20.0 |
21.0 |
|
BSA >20% |
145 (57%) |
276 (54%) |
217 (53%) |
445 (54%) |
|
PASI media |
17.80 |
17.40 |
16.90 |
17.60 |
|
PASI >20 |
91 (36%) |
169 (33%) |
133 (32%) |
300 (37%) |
|
PGA de marcado o grave |
112 (44%) |
223 (44%) |
160 (39%) |
328 (40%) |
|
Antecedentes de artritis psoriásica |
90 (35%) |
168 (33%) |
105 (26%) |
200 (24%) |
|
Fototerapia anterior |
150 (59%) |
342 (67%) |
276 (67%) |
553 (67%) |
|
Tratamiento sistémico convencional anterior excluyendo el biológico |
142 (56%) |
282 (55%) |
241 (59%) |
447 (55%) |
|
Tratamiento sistémico o biológico convencional anterior |
189 (74%) |
364 (71%) |
287 (70%) |
536 (65%) |
|
No respondió, estaba contraindicado o era intolerante a >1 tratamiento convencional |
139 (55%) |
270 (53%) |
254 (62%) |
490 (60%) |
|
No respondió, estaba contraindicado o era intolerante a >3 tratamientos convencionales |
30 (12%) |
54 (11%) |
66 (16%) |
134 (16%) |
Eficacia en el criterio de valoración primario, PHOENIX 1 y 2: En ambos estudios, PHOENIX 1 y PHOENIX 2, una mayor proporción de los pacientes asignados al azar al tratamiento con STELARA® lograron una respuesta PASI 75 en la semana 12 en comparación con placebo (Tabla 4). En el estudio PHOENIX 1, 67% y 66% de los pacientes que recibieron 45 mg y 90 mg de STELARA® , respectivamente, lograron una respuesta PASI 75 en la semana 12 comparado con 3% de los pacientes que recibieron placebo. En el estudio PHOENIX 2, 67% y 76% de los pacientes que recibieron 45 mg y 90 mg de STELARA® respectivamente lograron una respuesta PASI 75 en la semana 12 en comparación con 4% de los pacientes que recibieron placebo.
Los 3 componentes del PASI (grosor y endurecimiento de la placa, eritema y descamación) contribuyeron comparativamente con la mejora de PASI.
La eficacia de STELARA® fue significativamente superior (p<0.001) a placebo entre todos los subgrupos definidos por los datos demográficos en los valores iniciales, características clínicas de la enfermedad (incluyendo pacientes con antecedentes de artritis psoriásica) y uso previo del medicamento. Aun cuando el modelo farmacocinético sugiere una tendencia hacia una mayor CL/F en pacientes con diabetes, no se observó un efecto constante en la eficacia.
Otras medidas de eficacia en la semana 12: En ambos estudios, PHOENIX 1 y PHOENIX 2, comparados con placebo, proporciones mucho mayores de pacientes asignados al azar a 45 mg o 90 mg de STELARA® obtuvieron una calificación de PGA mínima o de eliminación y proporciones significativamente mayores de pacientes asignados al azar a 45 mg o 90 mg de STELARA® lograron una respuesta PASI 90 y PASI 50 en la semana 12 (Tabla 3). En el estudio PHOENIX 1, 60% y 62% de los pacientes tratados con 45 mg y 90 mg de STELARA® , respectivamente, lograron calificaciones de PGA mínimas o de eliminación comparadas con 4% de los pacientes tratados con placebo. En PHOENIX 2, 68% y 73% de los pacientes que recibieron 45 mg y 90 mg de STELARA® , respectivamente, obtuvieron calificaciones de PGA mínimas o de eliminación en comparación con 4% de los pacientes con placebo. En PHOENIX 1, el 42% y 37% de los pacientes tratados con 45 mg y 90 mg de STELARA® , respectivamente, lograron una PASI 90, en comparación con 2% de los pacientes tratados con placebo. En PHOENIX 2, el porcentaje de pacientes que lograron una PASI 90 fue de 42% en el grupo de 45 mg de STELARA® , 51% en el grupo de 90 mg de STELARA® y 15 en el grupo con placebo. El porcentaje de pacientes que lograron una PASI 50 en el PHOENIX 1 fue de 84% y 86% en los grupos de 45 mg y 90 mg de STELARA®, respectivamente, comparados con 10% en el grupo con placebo. De igual modo, 84% de los pacientes tratados con 45 mg de STELARA®, 89% de los pacientes tratados con 90 mg de STELARA® y 10% de los pacientes tratados con placebo lograron una PASI 50 en PHOENIX 2 (Tabla 4).
|
Tabla 3: Criterios de valoración clave en psoriasis: PHOENIX 1 y PHOENIX 2 |
||||||
|
Semana 12 |
||||||
|
PHOENIX 1 |
PHOENIX 2 |
|||||
|
Pacientes asignados al azar en la semana 0 |
STELARA® |
STELARA® |
||||
|
Placebo |
45 mg |
90 mg |
Placebo |
45 mg |
90 mg |
|
|
255 |
255 |
256 |
410 |
409 |
411 |
|
|
Respuesta PASI |
||||||
|
Respuesta PASI 50a |
26 (10%) |
213 (84%) |
220 (86%) |
41 (10%) |
342 (84%) |
367 (89%) |
|
Respuesta PASI 75a |
8 (3%) |
171 (67%) |
170 (66%) |
15 (4%) |
273 (67%) |
311 (76%) |
|
Respuesta PASI 90a |
5 (2%) |
106 (42%) |
94 (37%) |
3 (1%) |
173 (42%) |
209 (51%) |
|
PGA de eliminación o mínimoa,b |
10 (4%) |
151 (59%) |
156 (61%) |
18 (4%) |
277 (68%) |
300 (73%) |
|
Respuesta PASI 75 por peso |
||||||
|
≤ 100 kg |
||||||
|
n |
166 |
168 |
164 |
290 |
297 |
289 |
|
Respuesta PASI 75 |
6 (4%) |
124 (74%) |
107 (65%) |
12 (4%) |
218 (73%) |
225 (78%) |
|
>100 kg |
||||||
|
n |
89 |
87 |
92 |
120 |
112 |
121 |
|
Respuesta PASI 75 |
2 (2%) |
47 (54%) |
63 (68%) |
3 (3%) |
55 (49%) |
86 (71%) |
|
PGA de eliminación o mínimo por peso |
||||||
|
≤ 100 kg |
||||||
|
n |
166 |
168 |
164 |
290 |
297 |
289 |
|
Respuesta PGAb |
7 (4%) |
1108(64%) |
103 (63%) |
14 (5%) |
220 (74%) |
216 (75%) |
|
>100 kg |
||||||
|
n |
89 |
87 |
92 |
120 |
112 |
121 |
|
Respuesta PGAb |
3 (3%) |
43 (49%) |
53 (58%) |
4 (3%) |
57 (51%) |
84 (69%) |
|
Semana 28 |
||||||
|
PHOENIX 1 |
PHOENIX 2 |
|||||
|
STELARA® |
STELARA® |
|||||
|
45 mg |
90 mg |
45 mg |
90 mg |
|||
|
n |
250 |
243 |
397 |
400 |
||
|
Respuesta PASI |
||||||
|
Respuesta PASI 50 |
228 (91%) |
234 (96%) |
369 (93%) |
380 (95%) |
||
|
Respuesta PASI 75 |
178 (71%) |
191 (79%) |
276 (70%) |
314 (79%) |
||
|
Respuesta PASI 90e |
123 (49%) |
135 (56%) |
178 (45%) |
217 (54%) |
||
|
PGA de eliminación o mínimob |
146 (58%) |
160 (66%) |
241 (61%) |
279 (70%) |
||
|
Respuesta PASI 75 por peso |
||||||
|
≤ 100 kg |
||||||
|
n |
164 |
153 |
287 |
280 |
||
|
Respuesta PASI 75 |
130 (79%) |
124 (81%) |
217 (76%) |
226 (81%) |
||
|
>100 kg |
||||||
|
n |
86 |
90 |
110 |
119 |
||
|
Respuesta PASI 75 |
48 (56%) |
67 (74%) |
59 (54%) |
88 (74%) |
||
|
PGA de eliminación o mínimo por peso |
||||||
|
≤ 100 kg |
||||||
|
n |
164 |
153 |
287 |
280 |
||
|
Respuesta PGAb |
106 (65%) |
106 (69%) |
192 (67%) |
207 (74%) |
||
|
>100 kg |
||||||
|
n |
86 |
90 |
110 |
119 |
||
|
Respuesta PGA |
40 (47%) |
54 (60%) |
49 (45%) |
71 (60%) |
||
|
a p < 0.001 para comparación de 45 mg o 90 mg con placebo. |
||||||
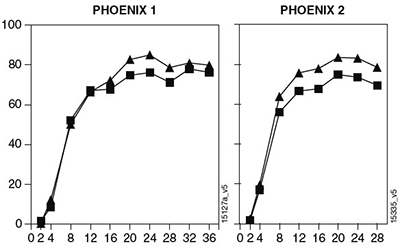
Respuesta con el tiempo: En PHOENIX 1, proporciones mucho mayores de pacientes tratados con STELARA® lograron respuestas PASI 50 (9% y 10% para los grupos de 45 mg y 90 mg, respectivamente) comparados con placebo (2%) en la semana 2 (p< 0.001). Proporciones mucho mayores de pacientes tratados con STELARA® lograron respuestas PASI 75 (9% y 12% para los grupos de 45 mg y 90 mg de STELARA®, respectivamente) comparado con placebo (0.4%) en la semana 4 (p< 0.001). La respuesta máxima por lo general se obtuvo en la semana 24 en los grupos de tratamiento de 45 mg y 90 mg de STELARA® y las tasas de respuesta normalmente fueron sostenidas hasta la semana 36 (véase la Figura 1). En el PHOENIX 1, las tasas de PASI 75 en la semana 24 fueron de 76% para el grupo de 45 mg y de 85% para el grupo de 90 mg. Se observaron tasas de respuesta más altas en pacientes que recibieron 90 mg de STELARA® que quienes recibieron 45 mg de STELARA® en la semana 16 y estas tasas de respuesta superiores se mantuvieron hasta la semana 36 (Figura 1). Se observaron resultados semejantes en el estudio PHOENIX 2 hasta la semana 28.
En análisis de eficacia previamente especificados por peso corporal en PHOENIX 1 y PHOENIX 2, no se observó un patrón constante de respuesta a la dosis en pacientes ≤ 100 kg. En pacientes con un peso superior a >100 kg, se observaron tasas de respuesta PASI 75 más altas con dosis de 90 mg en comparación con una dosis de 45 mg y una proporción más alta de pacientes que recibieron una dosis de 90 mg obtuvieron calificaciones de PGA de eliminación o mínimas en comparación con los pacientes que recibieron una dosis de 45 mg (Tabla 4).
En la figura 1 se muestra la respuesta de PASI 75 al paso del tiempo en PHOENIX 1 y 2:
Beneficio terapéutico del uso continuo de largo plazo: En la semana 40 del PHOENIX 1, 162 pacientes fueron elegidos al azar para recibir STELARA® (mantenimiento) y 160 fueron asignados al azar para recibir placebo (retiro del tratamiento). El mantenimiento de PASI 75 fue significativamente superior con el tratamiento continuo, comparado con el retiro del tratamiento (p<0.001). Se observaron resultados semejantes en cada dosis de STELARA® (Figura 2). Al año (semana 52), 89% de los pacientes reasignados al azar al tratamiento de mantenimiento lograron una respuesta PASI 75 en comparación con 63% de los pacientes reasignados al azar a placebo (retiro del tratamiento) (p<0.001).
A los 18 meses (semana 76), 84% de los pacientes reasignados al azar al tratamiento de mantenimiento lograron una respuesta PASI 75 en comparación con 19% de los pacientes reasignados al azar a placebo (sin tratamiento). A los 3 años (Semana 148), 82% de los pacientes rerandomizados al tratamiento de mantenimiento respondieron a PASI 75. A los 5 años (semana 255), 80% de los pacientes re-aleatorizados a tratamiento de mantenimiento tuvieron respuesta PASI 75.
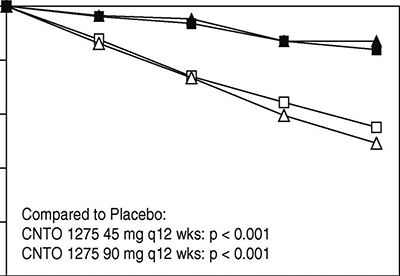
Duración de la respuesta PASI 75 (semanas) cada 12 semanas
Figura 2: Estimación de tabla de vida del porcentaje de pacientes que mantienen una respuesta PASI 75; placientes asignados al azar en la semana 40 (PHOENIX 1).
Eficacia del retratamiento: En el PHOENIX 1, después del retiro del tratamiento, los pacientes reiniciaron su esquema de tratamiento original con STELARA® después de perder una mejoría de PASI ≥ 50%. El retratamiento con STELARA® dio como resultado que el 71% de los pacientes evaluados recuperaran una respuesta PASI 75 a las 8 semanas de reiniciar el tratamiento y 85% de pacientes evaluados mostraron una mejoría PASI 75 a las 12 semanas después de iniciada la terapia.
Ajuste del intervalo de dosificación: En el PHOENIX 1, se ajustó la dosis de los pacientes que respondieron parcialmente en la semana 28 y la semana 40 y los que no respondieron a la semana 40 de cada 12 semanas a cada 8 semanas. Cerca del 40% a 50% de los pacientes que respondieron parcialmente en la semana 28 con una dosis de cada 12 semanas lograron una respuesta PASI 75 después del ajuste a su dosis a cada 8 semanas y esta proporción de los que respondieron PASI 75 se mantuvo hasta la semana 52. Una proporción semejante de pacientes que en la semana lograron una respuesta PASI 75 y que respondieron parcialmente o no respondieron en la semana 40 lograron una respuesta PASI 75 después de un ajuste en el intervalo de dosificación a cada 8 semanas.
Calidad de vida: En los estudios PHOENIX 1 y 2, las calificaciones DLQI de los valores iniciales promedio variaron de 11 a 12. En el PHOENIX 1, el Componente físico SF-36 de los valores iniciales promedio variaron de 47 a 49 y el Componente mental SF-36 de los valores iniciales promedio fue de aproximadamente 50. La calidad de vida mejoró de manera significativa en pacientes asignados al azar a 45 mg o 90 mg de STELARA® en comparación con los pacientes asignados a placebo según la evaluación de DLQI en los estudios PHOENIX 1 y 2 y SF-36 en el PHOENIX 1 (Tabla 5 ). Las mejorías en la calidad de vida fueron considerables a las 2 semanas que los pacientes fueron tratados con STELARA® y estas mejorías se mantuvieron con el tiempo bajo una dosis continua.
|
Tabla 5: Criterios de valoración de calidad de vida hasta la semana 40: PHOENIX 1 |
|||
|
STELARA® |
|||
|
Placebo |
45 mg |
90 mg |
|
|
Pacientes asignados al azar en la semana 0 |
255 |
255 |
256 |
|
DLQI |
|||
|
Valores iniciales |
|||
|
n |
254 |
255 |
255 |
|
Promedio ± DE |
11.8 ± 7.41 |
11.1 ± 7.09 |
11.6 ± 6.92 |
|
Media |
10.0 |
10.0 |
11.0 |
|
Cambio a partir de los valores iniciales |
|||
|
Semana 2a |
|||
|
n |
253 |
255 |
254 |
|
Promedio ± DE |
-0.9 ± 4.88 |
-3.6 ± 4.51 |
-4.5 ± 5.31 |
|
Media |
-1.0 |
-3.0 |
-4.0 |
|
Semana 12a |
|||
|
n |
252 |
254 |
249 |
|
Promedio ± DE |
-0.6 ± 5.97 |
-8.0 ± 6.87 |
-8.7 ± 6.47 |
|
Media |
0.0 |
-6.0 |
-7.0 |
|
Semana 28 |
|||
|
n |
NA |
249 |
241 |
|
Promedio ± DE |
NA |
-8.1±7.23 |
-9.6±7.17 |
|
Media |
NA |
-7.0 |
-8.0 |
|
Semana 40 |
|||
|
n |
NA |
246 |
236 |
|
Promedio ± DE |
NA |
-8.2±7.23 |
-9.5 ± 6.96 |
|
Media |
NA |
-7.0 |
-9.0 |
|
SF-36 |
|||
|
Resumen de componentes físicos |
|||
|
Valores iniciales |
|||
|
n |
254 |
255 |
255 |
|
Promedio ± DE |
47.22 ± 10.240 |
48.90 ± 9.555 |
47.51 ± 9.224 |
|
Media |
50.70 |
51.60 |
49.60 |
|
Cambio a partir de los valores iniciales |
|||
|
Semana 12a |
|||
|
n |
250 |
255 |
249 |
|
Promedio ± DE |
-0.53 ± 7.457 |
1.97 ± 7.422 |
3.23 ± 7.590 |
|
Media |
-0.25 |
1.30 |
1.50 |
|
Semana 28 |
|||
|
n |
NA |
250 |
239 |
|
Promedio ± DE |
NA |
1.86 ± 8.301 |
3.17±7.855 |
|
Media |
NA |
1.00 |
1.90 |
|
Semana 40 |
|||
|
n |
NA |
246 |
236 |
|
Promedio ± DE |
NA |
1.77±8.402 |
2.96±8.027 |
|
Media |
NA |
0.80 |
2.10 |
|
Resumen de componente mental |
|||
|
Valores iniciales |
|||
|
n |
254 |
255 |
255 |
|
Promedio ± DE |
49.62 ± 10.582 |
50.02 ±10.425 |
49.86 ± 10.175 |
|
Media |
53.35 |
52.90 |
53.10 |
|
Cambios a partir de los valores iniciales |
|||
|
Semana 12a |
|||
|
n |
250 |
255 |
249 |
|
Promedio ± DE |
-1.33 ± 7.473 |
2.12 ± 9.308 |
2.54 ± 9.506 |
|
Media |
-0.60 |
0.80 |
1.50 |
|
Semana 28 |
|||
|
n |
NA |
250 |
239 |
|
Promedio ± DE |
NA |
1.80 ± 9.578 |
3.47 ± 9.587 |
|
Media |
NA |
0.40 |
1.50 |
|
Semana 40 |
|||
|
n |
NA |
246 |
236 |
|
Promedio ± DE |
NA |
2.17 ± 9.137 |
2.91 ± 9.418 |
|
Media |
NA |
0.95 |
1.10 |
|
ap < 0.001 para comparación de 45 mg o 90 mg con placebo. NA = No aplica |
|||
|
Tabla 6: Criterios de valoración de calidad de vida hasta la semana 24: PHOENIX 2 |
|||
|
STELARA® |
|||
|
Placebo |
45 mg |
90 mg |
|
|
Pacientes asignados al azar en la semana 0 |
410 |
409 |
411 |
|
DLQI |
|||
|
Valores iniciales |
|||
|
n |
408 |
406 |
408 |
|
Promedio ± DE |
12.3 ± 6.86 |
12.2 ± 7.07 |
12.6 ± 7.29 |
|
Media |
11.0 |
12.0 |
12.0 |
|
Cambio a partir de los valores iniciales |
|||
|
Semana 4a |
|||
|
n |
405 |
404 |
404 |
|
Promedio ± DE |
-1.4 ± 4.68 |
-6.9 ± 6.07 |
-7.0 ± 5.86 |
|
Media |
-1.0 |
-6.0 |
-6.0 |
|
Semana 12a |
|||
|
n |
400 |
401 |
402 |
|
Promedio ± DE |
-0.5 ± 5.66 |
-9.3 ± 7.12 |
-10.0 ± 6.67 |
|
Media |
-0.5 |
-8.0 |
-9.0 |
|
Semana 24 |
|||
|
n |
NA |
394 |
399 |
|
Promedio ± DE |
NA |
-9.5 ± 7.26 |
-10.3 ± 6.96 |
|
Media |
NA |
-8.0 |
-9.0 |
|
a p < 0.001 para comparación de 45 mg o 90 mg con placebo. |
|||
Psoriasis en las uñas: En el PHOENIX 1, la calificación NAPSI de los valores iniciales promedio para la psoriasis en la uñas fue de 4.0 y el número promedio de las uñas con psoriasis fue de 8.0. La psoriasis en las uñas mejoró de manera significativa en pacientes asignados al azar con 45 mg o 90 mg de STELARA® en comparación con los pacientes asignados a placebo cuando se aplicó la medición para la calificación de NAPSI (Tablas 6 and 7). La psoriasis en las uñas siguió mejorando con el tiempo hasta la semana 52 en pacientes tratados con STELARA®.
|
Tabla 7: Resumen del porcentaje de mejoría a partir de los valores iniciales de NAPSI en la semana 12; pacientes asignados al azar en la semana 0 con psoriasis en las uñas en la semana 0: PHOENIX 1 |
|||
|
STELARA® |
|||
|
Placebo |
45 mg |
90 mg |
|
|
Pacientes asignados al azar en la semana 0 con psoriasis en las uñas en la semana 0 |
176 |
182 |
187 |
|
Semana 12a |
|||
|
n |
174 |
182 |
184 |
|
Promedio ± DE |
11.8 ± 51.09 |
26.7 ± 56.80 |
24.9 ± 48.90 |
|
Media |
0.0 |
25.0 |
25.0 |
|
a p ≤ 0.001 para comparación de 45 mg o 90 mg con placebo. |
|||
|
Tabla 8: Resumen de porcentaje de mejoría a partir de los valores iniciales de NAPSI en la semana 24; pacientes asignados al azar en la semana 0 con psoriasis en las uñas en la semana 0: PHOENIX 1 |
||||
|
STELARA® |
||||
|
Placebo ® → 45 mg |
Placebo ® → 90 mg |
45 mg |
90 mg |
|
|
Pacientes asignados al azar en la semana 0 con psoriasis en las uñas en la semana 0 |
93 |
83 |
182 |
187 |
|
Semana 24 |
||||
|
n |
89 |
77 |
179 |
181 |
|
Promedio ± DE |
29.1 ± 60.83 |
40.5 ± 43.37 |
46.5 ± 47.41 |
48.7 ± 45.58 |
|
Media |
33.3 |
42.9 |
50.0 |
50.0 |
Escala hospitalaria de depresión y ansiedad: En los valores iniciales de PHOENIX 2, las calificaciones promedio de ansiedad y depresión de HADS fueron 6.9 t 5.1, respectivamente. Las calificaciones de ansiedad y depresión disminuyeron de manera significativa en pacientes asignados al azar a 45 mg o 90 mg de STELARA® en la semana 12 en comparación con los pacientes asignados a placebo (Tabla 8). La mejoría en la HADS se mantuvo hasta la semana 24 (Tabla 9).
|
Tabla 9: Resumen de cambios a partir de los valores iniciales de ansiedad y depresión hospitalaria en la semana 12; pacientes asignados al azar en la semana 9: PHOENIX 2 |
|||
|
STELARA® |
|||
|
Placebo |
45 mg |
90 mg |
|
|
Pacientes asignados al azar en la semana 0 |
410 |
409 |
411 |
|
Calificación de ansiedada |
|||
|
n |
395 |
399 |
399 |
|
Promedio ± DE |
-0.11 ± 2.689 |
-1.59 ± 3.570 |
-1.60 ± 3.351 |
|
Media |
0.00 |
-1.00 |
-1.00 |
|
Calificación de depresióna |
|||
|
n |
398 |
399 |
401 |
|
Promedio ± DE |
0.21 ± 2.757 |
-1.71 ± 3.124 |
-2.06 ± 3.420 |
|
Media |
0.0 |
-1,00 |
-1.00 |
|
a p < 0.001 para comparación de 45 mg o 90 mg con placebo. |
|||
|
Tabla 10: Resumen de cambios a partir de los valores iniciales de ansiedad y depresión hospitalaria en la semana 24; pacientes asignados al azar en la semana 0: PHOENIX 2 |
||||
|
STELARA® |
||||
|
Placebo → 45 mg |
Placebo → 90 mg |
45 mg |
90 mg |
|
|
Pacientes asignados al azar en la semana 0 |
205 |
205 |
409 |
411 |
|
Calificación de ansiedad |
||||
|
n |
183 |
191 |
393 |
395 |
|
Promedio ± DE |
-1.52 ± 3.148 |
-1.76 ± 3.245 |
-1.80 ± 3.725 |
-1.99 ± 3.463 |
|
Media |
-1.00 |
-1.00 |
-1.00 |
-1.00 |
|
Calificación de depresión |
||||
|
n |
184 |
190 |
391 |
398 |
|
Promedio ± DE |
-1.65 ± 3.207 |
-1.42 ± 3.013 |
-1.77 ± 3.449 |
-2.26 ± 3.490 |
|
Media |
-1.00 |
-1.00 |
-1.00 |
-2.00 |
Cuestionario sobre limitaciones laborales: En el Cuestionario sobre limitaciones laborales obtenido en los valores iniciales se observó un efecto en la productividad laboral en las calificaciones de componentes de Demanda física, Manejo del tiempo, Demandas mental-interpersonal y de producción de los pacientes con psoriasis evaluados en el PHOENIX 2.
La productividad laboral mejoró más en los pacientes asignados al azar a STELARA® en la semana 12 en comparación con los pacientes asignados al azar a placebo conforme a las medidas de las cuatro sub escalas del WLQ (demandas físicas, manejo del tiempo, demandas mental-interpersonal y de producción; Tabla 11).
|
Tabla 11: Resumen de cambios a partir de los valores iniciales en el cuestionario de limitaciones laborales en la semana 12; pacientes asignados al azar en la semana 0: PHOENIX 2 |
|||
|
STELARA® |
|||
|
Placebo |
45 mg |
90 mg |
|
|
Pacientes asignados al azar en la semana 0 |
410 |
409 |
411 |
|
Calificación de demandas físicasa |
|||
|
n |
277 |
277 |
281 |
|
Promedio ± DE |
-0.20 ± 30.991 |
-7.61 ± 30.917 |
-5.05 ± 34.050 |
|
Media |
0.00 |
0.00 |
0.00 |
|
Calificación de manejo de tiempob |
|||
|
n |
259 |
255 |
265 |
|
Promedio ± DE |
0.74 ± 18.962 |
-6.58 ± 21.634 |
-9.06 ± 24.239 |
|
Media |
0.00 |
-5.00 |
-3.30 |
|
Calificación mental-interpersonalb |
|||
|
n |
272 |
275 |
276 |
|
Promedio ± DE |
1.11 ± 18.881 |
-7.82 ± 22.684 |
-7.51 ± 19.366 |
|
Media |
0.00 |
-2.80 |
-1.35 |
|
Calificación de demandas de producciónb |
|||
|
n |
276 |
274 |
279 |
|
Promedio ± DE |
1.08 ± 16.062 |
-6.82 ± 22.367 |
-6.98 ± 20.866 |
|
Media |
0.00 |
0.00 |
0.00 |
|
a p = 0.001 y 0.06 para las comparaciones de 45 mg y 90 mg, respectivamente, con placebo b p < 0.001 para comparación de 45 mg o 90 mg con placebo |
|||
VAS sobre comezón: De acuerdo con la evaluación VAS sobre comezón en el PHOENIX 1 (Tabla 11), la comezón asociada con psoriasis mejoró significativamente (p<0.001) en la semana 12 en pacientes asignados al azar a 45 mg o 90 mg STELARA® en comparación con pacientes asignados a placebo.
|
Tabla 12: Resumen de cambios a partir de los valores iniciales en VAS sobre comezón en la semana 12; pacientes asignados al azar en la semana 0: PHOENIX 1 |
|||
|
STELARA® |
|||
|
Placebo |
45 mg |
90 mg |
|
|
Pacientes asignados al azar en la semana 0 |
255 |
255 |
256 |
|
Semana 12a |
|||
|
n |
252 |
253 |
249 |
|
Promedio ± DE |
-0.78 ± 2.538 |
-4.91 ± 3.142 |
-5.14 ± 3.020 |
|
Media |
-0.30 |
-5.50 |
-5.50 |
|
ap < 0.001 para comparación de 45 mg o 90 mg con placebo |
|||
ACCEPT: Además, en un estudio multicéntrico, aleatorizado, simple ciego, con controlador activo (ACCEPT) se compararon la seguridad y eficacia de ustekinumab y etanercept en pacientes mayores de 18 años de edad con psoriasis crónica en placa (>6 meses) que tenían un compromiso BSA mínimo de 10%, puntuación PASI ≥12, puntuación de la Valoración Global del Médico (PGA) ≥ 3, que eran candidatos para fototerapia o terapia sistémica, y que tenían respuesta inadecuada, intolerancia o contraindicación para el uso de ciclosporina, metotrexate o PUVA. En este estudio se reclutó un total de 903 pacientes.
En el estudio ACCEPT se comparó la eficacia de ustekinumab a etanercept y se evaluó la seguridad de ustekinumab y etanercept en pacientes con psoriasis moderada a grave. La porción con controlador activo del estudio transcurrió de la Semana 0 a la Semana 12, durante el cual los pacientes fueron asignados aleatoriamente a recibir etanercept (50 mg dos veces a la semana) ustekinumab 45 mg a las Semanas 0 y 4, o ustekinumab 90 mg a las Semanas 0 y 4.
Este estudio tuvo poder suficiente para examinar la superioridad de cada dosis de ustekinumab con el etanercept en el punto final primario de la proporción de los pacientes que alcanzan un PASI de 75 a la semana 12.
Una proporción significativamente mayor de sujetos tratados con ustekinumab 45 mg (67%; p = 0,012) o 90 mg (74%; p < 0,001) fueron respondedores PASI 75 a la semana 12 comparados con el grupo de etanercept (57%). La respuesta PASI 90 se observó en 36% y 45% de los pacientes de los grupos de ustekinumab 45 mg y 90 mg, respectivamente, comparados con 23% de los pacientes que recibieron etanercept (p<0,001 para cada comparación frente a etanercept). La respuesta PASI 100 se observó en 12% y 21% de los pacientes de los grupos de ustekinumab 45 mg y 90 mg, respectivamente, comparados con 6% de los pacientes que recibieron etanercept (Tabla 12). Además, una mayor proporción de los pacientes de los grupos de tratamiento de 45 mg y 90 mg alcanzó una puntuación PGA de “mejoría” o “mínima” (65% y 71%, respectivamente) comparados con los pacientes en el grupo de tratamiento con etanercept (49%) (p<0,001 para cada comparación frente a etanercept).
En análisis previamente especificados de eficacia por peso corporal en el estudio ACCEPT, mínima respuesta a la dosis de ustekinumab fue evidente en pacientes ≤ 100 kg. En pacientes que pesaban >100 kg, se observaron tasas de respuesta PASI 75 más altas con la dosis de 90 mg comparada con la dosis de 45 mg, y una más alta proporción de los pacientes que recibieron la dosis de 90 mg tuvieron puntuaciones PGA de aclarado o mínimo comparados con pacientes que recibieron la dosis de 45 mg (Tabla 12).
|
Tabla 13: Puntos finales clave de psoriasis a la semana 12: ACCEPT |
|||
|
ACCEPT |
|||
|
Etanercept (50 mg dos veces a la semana) |
Ustekinumab (semana 0 y semana 4) |
||
|
45 mg |
90 mg |
||
|
Pacientes asignados aleatoriamente |
347 |
209 |
347 |
|
Respuesta PASI |
|||
|
Respuesta PASI 50 |
286 (82%) |
181 (87%) |
320 (92%)a |
|
Respuesta PASI 75 |
197 (57%) |
141 (67%)b |
256 (74%)a |
|
Respuesta PASI 90 |
80 (23%) |
76 (36%)a |
155 (45%)a |
|
Respuesta PASI 100 |
22 (6%) |
25 (12%)c |
74 (21%)a |
|
PGA de aclarado o mínimoa |
170 (49%) |
136 (65%)a |
245 (71%)a |
|
Respuesta PASI 75 por peso |
|||
|
< 100 kg |
|||
|
N |
251 |
151 |
244 |
|
Respuesta PASI 75 |
154 (61%) |
109 (72%) |
189 (77%) |
|
N |
96 |
58 |
103 |
|
Respuesta PASI 75 |
43 (45%) |
32 (55%) |
67 (65%) |
|
PGA de aclarada o mínima por peso |
|||
|
< 100 kg |
|||
|
N |
251 |
151 |
244 |
|
Respuesta PGA |
131 (52%) |
110 (73%) |
185 (76%) |
|
>100 kg |
|||
|
N |
96 |
58 |
103 |
|
Respuesta PGA |
39 (41%) |
26 (45%) |
60 (58%) |
|
Respuesta pasi 75 por número de agentes sistémicos convencionales no idóneosg -por lo menos una terapia |
|||
|
N |
347 |
209 |
346 |
|
Respuesta PASI 75 -por lo menos dos terapias |
197 (57%) |
141 (67%)b |
256 (74%)a |
|
N |
186 |
118 |
185 |
|
Respuesta PASI 75 |
94 (51%) |
79 (67%)d |
137 (74%)a |
|
N |
52 |
31 |
47 |
|
Respuesta PASI 75 |
20 (38%)% |
17 (55%)e |
34 (72)f |
|
a p < 0,001 para ustekinumab 45 mg o 90 mg en comparación con etanercept. b p = 0,012 para ustekinumab 45 mg en comparación con etanercept. c p = 0,020 para ustekinumab 45 mg en comparación con etanercept d p = 0,004 para ustekinumab 45 mg en comparación con etanercept. e p = 0,303 para ustekinumab 45 mg en comparación con etanercept. f p = 0,001 para ustekinumab 90 mg en comparación con etanercept. g Los agentes sistémicos convencionales incluyen psoralen más ultravioleta A, metotrexate, y ciclosporina. Los agentes sistémicos convencionales no idóneos se definen como aquellos a los cuales los pacientes han tenido un respuesta inadecuada, no los toleraron o los tenían contraindicados. |
|||
Eficacia Clínica - Artritis Psoriásica (PsA): La seguridad y eficacia de STELARA® fue valorada en dos estudios multi-centro, aleatorios, doble-ciego, placebo-controlado, de fase 3, PSUMMIT I y PSUMMIT II, en pacientes con artritis psoriásica activa. Los pacientes fueron aleatorizados para recibir tratamiento ya sea con STELARA® 45 mg, 90 mg, o placebo en inyecciones subcutánea en las Semanas 0 y 4 seguido por una dosificación cada 12 semanas (q12w). El criterio de valoración primario en estos estudios fue la reducción en los signos y síntomas de la artritis psoriásica (PsA) según lo medido por el porcentaje de respondientes ACR 20 en la Semana 24. Criterios de valoración secundarios incluyeron cambio desde línea base en el Índice de Incapacidad física del Cuestionario de Valoración de Salud (HAQ-DI), PASI 75, ACR 50 , ACR 70 y cambio desde línea base en los marcadores radiográficos totales de manos y pies, en la Semana 24.
Datos de eficacia fueron recolectados y analizados a la Semana 52. Estos estudios incluyeron 927 (PSUMMIT I, n=615; PSUMMIT II, n=312) pacientes adultos (≥18 años) quienes tuvieron artritis psoriásica activa (≥5 articulaciones inflamadas y ≥5 articulaciones sensibles, a pesar de antirreumáticos para modificar el padecimiento (DMARD) y/o terapia anti-inflamatoria no-esteroide (NSAID). El uso de metotrexato fue permitido durante los estudios pero no fue obligatorio. Aproximadamente 50% de pacientes continuo en dosis estables de MTX (≤25 mg/semana). En PSUMMIT I y PSUMMIT II, 80% y 86% de los pacientes, respectivamente, hubieron sido tratados previamente con DMARDs.
En los pacientes PSUMMIT I, quienes fueron previamente tratados con terapia anti-TNFa, previo a la primera dosis del estudio, fueron excluidos. En PSUMMIT II, la mayoría de pacientes (58%, n=180) fueron tratados previamente con uno o mas agentes anti-TNFa por al menos 8 semanas (14 semanas con infliximab) o hubieron discontinuado anti-TNFa por intolerancia en cualquier momento. Entre los pacientes quienes hubieron sido previamente tratados con un agente anti-TNFa, arriba del 70% tuvieron que descontinuar su tratamiento antiTNFa por una carencia de eficacia o intolerancia.
Pacientes con cada subtipo de artritis psoriásica fueron enrolados, incluyendo artritis poli-articular sin evidencia de nódulos reumatoides (39%, N=362), espondilitis con artritis periférica (28%, N=255), artritis periférica asimétrica (21%, N=193), artritis inter-falángica distal (DIP) artritis (12%, N=112) y artritis mutilante (0.5%, N=5). Más del 70% y 40%, respectivamente, de los pacientes en ambos estudios, tenían entesitis y dactilitis a línea base.
En ambos estudios, una proporción significativamente mayor de pacientes alcanzan las respuestas ACR 20 y ACR 50 a la semana 24 en el grupo de STELARA® 45 mg y 90 mg comparado a placebo (ver Tabla 14). En PSUMMIT I, una proporción significativamente mayor de pacientes y en PSUMMIT II una proporción numéricamente mayor de pacientes (p=NS) alcanzan las respuestas ACR 70 en el grupo de STELARA® 45 mg y 90 mg comparado a placebo (ver Tabla 14).
En ambos estudios, la proporción de pacientes que alcanzan un criterio de respuesta PsA modificado (PsARC) o una índice de actividad 28 usando proteína reactiva C (DAS28-CRP) la respuesta fue significativamente mayor en los grupos de STELARA® 45 mg y 90 mg comparado a placebo. En PSUMMIT I la proporción de pacientes que alcanzaron la remisión de DAS28-CRP fue significativamente más grande en los grupos de STELARA® 45 mg y 90 mg comparado a placebo. En PSUMMIT II, la proporción de pacientes quienes alcanzaron la remisión de DAS28-CRP fue significativamente mayor en el grupo de STELARA® 90 mg comparado a placebo (ver Tabla 14). Las respuestas DAS28-CRP y PsARC se mantuvieron a la Semana 52.
|
Tabla 14: Número de pacientes que alcanzaron respuesta ACR 20, ACR 50, ACR 70, PsARC, DAS28-CRP y remisión de DAS28-CRP a la semana 24 |
||||||
|
PSUMMIT I |
PSUMMIT II |
|||||
|
STELARA® |
STELARA® |
|||||
|
Placebo |
45 mg |
90 mg |
Placebo |
45 mg |
90 mg |
|
|
ACR 20 |
47 (23%) |
87 (42%) a |
101 (50%) a |
21 (20%) |
45 (44%)a |
46 (44%) a |
|
ACR 50 |
18 (9%) |
51 (25%) a |
57 (28%) a |
7 (7%) |
18 (17%) b |
24 (23%) a |
|
ACR 70 |
5 (2%) |
25 (12%) a |
29 (14%) a |
3 (3%) |
7 (7%) c |
9 (9%) c |
|
PsARC |
77 (37%) |
115 (56%) a |
132 (65%) a |
32 (31%) |
57 (55%)a |
54 (51%)b |
|
DAS28-CRP* |
71 (34%) |
135 (66%) a |
138 (68%) a |
31 (30%) |
56 (54%) a |
56 (53%) a |
|
Remisión de DAS28** |
17 (8%) |
42 (20%) a |
40 (20%) a |
4 (4%) |
11 (11%)c |
16 (15%)b |
|
a p<0.001 b p<0.05 c p= NS * Se combinan articulaciones con dolor (28 articulaciones), articulaciones con inflamación (28 articulaciones), Proteína C Reactiva (CRP), y la valoración global de la actividad de la enfermedad realizada por el paciente usando CRP. Los que respondieron a DAS 28 incluyen pacientes con moderada o buena respuesta. ** Los que presentaron remisión en el DAS 28 incluyen pacientes con un valor de DAS 28 con menos de 2.6 en una visita. |
||||||
Una respuesta ACR 20 (Felson et al, 1995) se definió como:
1. ≥ 20% de mejora en la recuento de articulaciones inflamadas (66 articulaciones) y en el recuento de articulaciones con dolor (68 articulaciones); y
2. ≥ 20 % de mejora en 3 de las siguientes evaluaciones:
• Evaluación del dolor en el paciente [Escala análoga visual (VAS)]
• Evaluación global de la actividad de la enfermedad en el paciente (VAS)
• Evaluación global de la actividad de la enfermedad por el médico (VAS)
• Evaluación del paciente de la función física medida por HAQ-DI
• Proteína C Reactiva CRP
ACR 50 o ACR 70 son definidas similarmente.
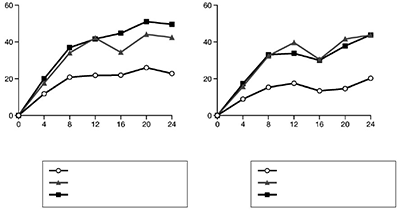
La tasa de respuesta para ACR 20 durante las primeras 24 semanas en ambos estudios los pacientes que recibieron STELARA® o placebo son sumados en la Figura 3. Respuestas ACR 20 mostraron mejoría a la primera valoración (semana 4). Las respuestas ACR 20, 50 y 70 continuaron mejorando o se mantuvieron a la Semana 52 (ver Tabla 15).
Figura 3: Porcentaje de pacientes alcanzando respuesta ACR 20 hacia la Semana 24
PSUMMIT I PSUMMIT II
|
Tabla 6: Proporción de pacientes que alcanzaron respuesta ACR 20, ACR 50, ACR 70 a la Semana 52. |
||||
|
PSUMMIT I |
PSUMMIT II |
|||
|
STELARA® |
STELARA® |
|||
|
45 mg |
90 mg |
45 mg |
90 mg |
|
|
N |
194 |
189 |
94 |
95 |
|
Respuesta ACR |
||||
|
ACR 20 |
55.7% |
60.3% |
46.8% |
48.4% |
|
ACR 50 |
31.4% |
37.0% |
27.7% |
26.3% |
|
ACR 70 |
18.0% |
21.2% |
12.8% |
17.9% |
En PSUMMIT I, de 205 sujetos aleatorizados a STELARA 45® mg, 153 continuaron con la misma dosis y estuvieron disponibles para evaluación en la Semana 52. Entre estos, las respuestas ACR 20, 50 y 70 fueron alcanzadas por 99 (64.7%), 57 (37.3%) y 34 (22.2%) de sujetos respectivamente. De 204 sujetos aleatorizados a STELARA® 90 mg, 185 estuvieron disponibles para evaluación en la Semana 52. Entre estos, las respuestas ACR 20, 50 y 70 fueron alcanzadas por 120 (64.9%), 74 (40%) y 41 (22.2%) de sujetos respectivamente.
En PSUMMIT II, de 103 sujetos aleatorizados a STELARA® 45 mg, 68 continuaron con la misma dosis y estuvieron disponibles para evaluación en la Semana 52. Entre estos, las respuestas ACR 20, 50, y 70 fueron alcanzadas por 41 (60.3%), 23 (33.8%) y 11 (16.2%) de los sujetos respectivamente. De 105 sujetos aleatorizados a STELARA® 90 mg, 83 estuvieron disponibles para evaluación en la Semana 52. Entre estos, las respuestas ACR 20, 50 y 70 fueron alcanzadas por 49 (59%), 26 (31.3%) y 17 (20.5%) de los sujetos respectivamente.
Adicionalmente, dentro de cada grupo de peso (≤100 kg y >100 kg), las respuestas ACR 20, ACR 50 y ACR 70 fueron consistentemente más altas en los grupos de STELARA® 45 y 90 mg que en el grupo de placebo (ver Tabla 16).
|
Tabla 16: Número de pacientes quienes alcanzaron respuestas ACR 20, ACR 50 y ACR 70 por peso hacia la Semana 24 |
||||||
|
PSUMMIT I |
PSUMMIT II |
|||||
|
STELARA® |
STELARA® |
|||||
|
Placebo |
45 mg |
90 mg |
Placebo |
45 mg |
90 mg |
|
|
Pacientes aleatorizados con peso basal ≤100 kg |
154 |
153 |
154 |
74 |
74 |
73 |
|
ACR 20 |
39 (25%) |
67 (44%) |
78 (51%) |
17 (23%) |
32 (43%) |
34 (47%) |
|
ACR 50 |
14 (9%) |
38 (25%) |
48 (31%) |
6 (8%) |
15 (20%) |
21 (29%) |
|
ACR 70 |
5 (3%) |
20 (13%) |
26 (17%) |
3 (4%) |
6 (8%) |
8 (11%) |
|
Pacientes aleatorizados con peso basal >100 kg |
52 |
52 |
50 |
30 |
29 |
31 |
|
ACR 20 |
8 (15%) |
20 (38%) |
23 (46%) |
4 (13%) |
13 (45%) |
12 (39%) |
|
ACR 50 |
4 (8%) |
13 (25%) |
9 (18%) |
1 (3%) |
3 (10%) |
3 (10%) |
|
ACR 70 |
0 |
5 (10%) |
3 (6%) |
0 |
1 (3%) |
1 (3%) |
El tratamiento con STELARA® dio como resultado una mejoría significativamente mayor comparado con placebo por cada componente ACR (ver Tabla 17).
|
Tabla 17: Resumen de porcentaje de mejora desde línea basal en componentes ACR en Semana 243,4 |
||||||
|
PSUMMIT I |
PSUMMIT II |
|||||
|
STELARA® |
STELARA® |
|||||
|
Placebo |
45 mg |
90 mg |
Placebo |
45 mg |
90 mg |
|
|
Número de articulaciones inflamadasd |
||||||
|
Mediana |
21.54 |
58.82a |
60.00a |
0.00 |
52.94b |
50.00c |
|
Número de articulaciones sensiblese |
||||||
|
Mediana |
13.61 |
45.45a |
51.51a |
0.00 |
33.33a |
35.00c |
|
Valoración de dolor del pacientef |
||||||
|
Mediana |
0.00 |
31.33a |
42.58a |
0.00 |
24.19a |
24.29a |
|
Valoración global del pacientef |
||||||
|
Mediana |
4.11 |
32.84a |
42.44a |
0.00 |
21.25a |
22.54a |
|
Valoración global del Médicof |
||||||
|
Mediana |
17.64 |
48.39a |
55.91a |
0.83 |
36.67a |
36.11a |
|
Índice de discapacidad (HAQ-DI)g |
||||||
|
Mediana |
0.00 |
22.22a |
32.46a |
0.00 |
12.50a |
14.29a |
|
CRP (mg/dL)h |
||||||
|
Mediana |
0.00 |
38.56a |
48.30a |
0.00 |
25.61c |
33.69a |
|
a p<0.001 b p<0.05 c p<0.01 d Número de articulaciones inflamadas contadas (0-66) e Número de articulaciones sensibles contadas (0-68) f Escala análoga visual ; 0= mejor, 10=peor. g Índice de discapacidad física del Cuestionario de Valoración de Salud; 0 = mejor, 3 = peor, mide la habilidad del paciente para llevar a cabo lo siguiente: vestirse/asearse, levantarse, comer, caminar, alcanzar, agarrar, mantener la higiene, y mantener la actividad diaria. h CRP: (Rango Normal 0.0-1.0 mg/dL) |
||||||
Uso de metotrexato: La proporción de pacientes alcanzando respuestas ACR fueron consistentemente mayores en pacientes tratados con STELARA® que aquellos tratados con placebo sin importar el uso de MTX concomitante (ver Tabla 18). Las respuestas observadas en los grupos de STELARA® fueron similares en pacientes recibiendo o no recibiendo MTX concomitante. Las respuestas ACR se mantuvieron a la semana 52.
|
Tabla 18: Resumen de pacientes alcanzando respuestas ACR 20, ACR 50 y ACR 70 hacia la Semana 24 por uso de metotrexato |
||||||
|
PSUMMIT I |
||||||
|
Recibiendo MTX basal |
No recibiendo MTX basal |
|||||
|
STELARA® |
STELARA® |
|||||
|
Placebo |
45 mg |
90 mg |
Placebo |
45 mg |
90 mg |
|
|
Pacientes aleatorizados |
96 |
99 |
101 |
110 |
106 |
103 |
|
ACR 20 |
25 (26%) |
43 (43%) |
46 (46%) |
22 (20%) |
44 (42%) |
55 (53%) |
|
ACR 50 |
8 (8%) |
23 (23%) |
27 (27%) |
10 (9%) |
28 (26%) |
30 (29%) |
|
ACR 70 |
2 (2%) |
11 (11%) |
13 (13%) |
3 (3%) |
14 (13%) |
16 (16%) |
|
PSUMMIT II |
||||||
|
Recibiendo MTX basal |
No recibiendo MTX basal |
|||||
|
STELARA® |
STELARA® |
|||||
|
Placebo (N=104) |
45 mg (N= 103) |
90 mg (N= 105) |
Placebo (N=104) |
45 mg (N= 103) |
90 mg (N= 105) |
|
|
Pacientes aleatorizados |
49 |
54 |
52 |
55 |
49 |
53 |
|
ACR 20 |
14 (29%) |
27 (50%) |
21 (40%) |
7 (13%) |
18 (37%) |
25 (47%) |
|
ACR 50 |
4 (8%) |
10 (19%) |
12 (23%) |
3 (5%) |
8 (16%) |
12 (23%) |
|
ACR 70 |
2 (4%) |
4 (7%) |
3 (6%) |
1 (2%) |
3 (6%) |
6 (11%) |
Terapia Anti-TNFa previa: PSUMMIT II evaluó 180 pacientes quienes fueron previamente tratados con uno o más agentes anti-TNFa por al menos 8 semanas (14 semanas con infliximab), o tuvieron intolerancia documentada de terapia anti-TNFa en cualquier momento en el pasado.
Entre los pacientes previamente tratados con agentes anti-TNFa, una proporción significativamente más grande de pacientes tratados con STELARA® alcanzó una respuesta ACR 20 en la Semana 24 comparado con placebo (ver Tabla 19). Las respuestas ACR 20, 50 y 70 se mantuvieron en lo general a la Semana 52.
|
Tabla 19: Número de pacientes tratados previamente con agentes anti-TNFa quienes alcanzaron respuestas ACR 20, ACR 50 y ACR 70 hacia la Semana 24 |
|||
|
PSUMMIT II |
STELARA® |
||
|
Placebo |
45 mg |
90 mg |
|
|
Pacientes aleatorizados |
62 |
60 |
58 |
|
ACR 20 |
9 (15%) |
22 (37%)a |
20 (34%)b |
|
ACR 50 |
4 (6%) |
9 (15%)c |
9 (16%)c |
|
ACR 70 |
1 (2%) |
3 (5%)c |
3 (5%)c |
|
a p<0.01 b p<0.05 c p=NS |
|||
Entesitis y dactilitis: Para pacientes con entesitis y/o dactilitis basal, en PSUMMIT I, una mejora significativa en el marcador de entesitis y dactilitis fue observada en los grupos de STELARA® 45 mg y 90 mg comparado con placebo. En PSUMMIT II, una mejora significativa en el marcador de entesitis y una mejora numérica en el marcador de dactilitis fueron observados en el grupo de 90 mg (p=NS) comparado con el grupo de placebo (ver Tabla 20). En ambos estudios, se mantuvo la mejora en el marcador de entesitis y marcador de dactilitis a la Semana 52.
|
Tabla 20: Resumen de cambio porcentual en los marcadores de entesitis y dactilitis en Semana 24 |
||||||
|
PSUMMIT I |
PSUMMIT II |
|||||
|
STELARA® |
STELARA® |
|||||
|
Marcador Entesitisd |
Placebo |
45 mg |
90 mg |
Placebo |
45 mg |
90 mg |
|
Pacientes aleatorizados con entesitis basal |
145 |
142 |
154 |
73 |
72 |
76 |
|
N |
137 |
140 |
148 |
68 |
70 |
70 |
|
Mediana |
0.00 |
-42.86 a |
-50.00b |
0.00 |
-33.33c |
-48.33a |
|
Marcador dactilitise |
||||||
|
Pacientes aleatorizados con dactilitis basal |
96 |
101 |
99 |
38 |
48 |
41 |
|
N |
92 |
99 |
95 |
33 |
46 |
38 |
|
Mediana |
0.00 |
-75.00b |
-70.83b |
0.00 |
0.00c |
-64.58c |
|
a p<0.01 b p<0.001 c p=NS d La Entesitis fue valorada en base al índice del Marcador de Entesis de Espondilitis Anquilosante de Maastricht (MASES) modificado por PSA (un instrumento que cuenta 15 sitios corporales). e La Dactilitis fue valorada en ambas manos y pies usando un sistema de marcaje desde 0 a 60. |
||||||
Una proporción más alta de pacientes tratados con STELARA®, que tiene espondilitis con artritis periférica como su presentación primaria, demostró una mejora de 50 y 70% del Índice de Actividad del Padecimiento de Espondilitis Anquilosante de Bath (BASDAI) de los marcadores BASDAI en la Semana 24 comparado con placebo (ver Tabla 21).
|
Tabla 21: Número de pacientes que alcanzaron mejora desde basal en BASDAI en Semana 24 |
||||||
|
PSUMMIT I |
PSUMMIT II |
|||||
|
STELARA® |
STELARA® |
|||||
|
Placebo |
45 mg |
90 mg |
Placebo |
45 mg |
90 mg |
|
|
Pacientes aleatorizados con espondilitis e implicación de articulación periférica basal |
70 |
52 |
64 |
22 |
26 |
22 |
|
N |
61 |
51 |
60 |
18 |
25 |
21 |
|
BASDAI 20 |
16 (26%) |
25 (49%)a |
35 (58%)b |
10 (56%) |
15 (60%)c |
11 (52%)c |
|
BASDAI 50 |
8 (13%) |
12 (24%)c |
19 (32%)a |
1 (6%) |
7 (28%)c |
8 (38%)a |
|
BASDAI 70 |
0 |
7 (14%)d |
9 (15%)d |
0 |
3 (12%)* |
5 (24%)* |
|
a p≤0.05 b p<0.001 c p=NS d p≤0.01 *p valor no calculado |
||||||
Respuesta PASI: En PSUMMIT I y PSUMMIT II, la proporción de pacientes con implicación de psoriasis de ≥3% BSA en línea base que alcanzaron una mejora de ≥75% en la valoración PASI a la Semana 24 fue significativamente mayor en los grupos de STELARA® 45 mg y 90 mg comparado con el grupo de placebo (ver Tabla 22). En ambos estudios la proporción de pacientes alcanzando la respuesta PASI 75 se mantuvo a la Semana 52 (PSUMMIT I, STELARA® 45 mg-70.1% y 90 mg- 68.1%; PSUMMIT II, STELARA® 45 mg-56.5% y 90 mg- 64.4%). La proporción de pacientes que alcanzaron tanto una respuesta PASI 75 como una respuesta ACR 20 fue evaluada para aquellos pacientes con implicación de psoriasis de piel ≥3% BSA basal. Una proporción significativamente mayor de pacientes alcanzaron la respuesta combinada en los grupos de STELARA® 45 mg y 90 mg comparado con el grupo de placebo en la Semana 24 (ver Tabla 22). En ambos estudios la proporción de pacientes alcanzando tanto la respuesta PASI 75 como la respuesta ACR20 se mantuvo a la Semana 52 (PSUMMIT I, STELARA® 45 mg-44.8% y 90 mg-44.3%; PSUMMIT II, STELARA® 45 mg-36.8% y 90 mg- 43.1%).
|
Tabla 22: Número de pacientes que alcanzaron respuestas PASI 75, PASI 90 y PASI 100 |
||||||
|
PSUMMIT I |
PSUMMIT II |
|||||
|
STELARAa |
STELARAa |
|||||
|
Placebo |
45 mg |
90 mg |
Placebo |
45 mg |
90 mg |
|
|
Pacientes con implicación de psoriasis en piel basal ≥3% BSA |
146 |
145 |
149 |
80 |
80 |
81 |
|
PASI 75 |
16 (11%) |
83 (57%) |
93 (62%) |
4 (5%) |
41 (51%) |
45 (56%) |
|
PASI 90 |
4 (3%) |
60 (41%) |
65 (44%) |
3 (4%) |
24 (30%) |
36 (44%) |
|
PASI 100 |
2 (1%) |
29 (20%) |
41 (28%) |
1 (1%) |
13 (16%) |
17 (21%) |
|
Combinación de respuestas de piel y articulación |
||||||
|
PASI 75 y ACR 20 |
8 (5%) |
40 (28%) |
62 (42%) |
2 (3%) |
24 (30%) |
31 (38%) |
|
a p<0.001 para comparación de 45 mg o 90 mg con placebo. |
||||||
Adicionalmente, dentro de cada grupo de peso (≤100 kg y >100 kg), las respuestas PASI 75, 90 y 100 fueron consistentemente más altas en los grupos de STELARA® 45 y 90 mg que en el grupo de placebo (ver Tabla 23).
|
Tabla 23: Resumen de pacientes que alcanzaron respuestas PASI 75, PASI 90 y PASI 100 por peso hacia la Semana 24 |
||||||
|
PSUMMIT I |
PSUMMIT II |
|||||
|
STELARA® |
STELARA® |
|||||
|
Placebo (N=206) |
45 mg (N= 205) |
90 mg (N= 204) |
Placebo (N= 104) |
45 mg (N= 103) |
90 mg (N= 105) |
|
|
Pacientes aleatorizados con peso basal ≤100 kg * |
105 |
105 |
111 |
54 |
58 |
57 |
|
PASI 75 |
14 (13%) |
64 (61%) |
73 (66%) |
4 (7%) |
31 (53%) |
32 (56%) |
|
PASI 90 |
4 (4%) |
46 (44%) |
48 (43%) |
3 (6%) |
20 (34%) |
27 (47%) |
|
PASI 100 |
2 (2%) |
21 (20%) |
30 (27%) |
1 (2%) |
11 (19%) |
13 (23%) |
|
Pacientes aleatorizados con peso basal >100 kg * |
41 |
40 |
38 |
26 |
22 |
24 |
|
PASI 75 |
2 (5%) |
19 (48%) |
20 (53%) |
0 |
10 (45%) |
13 (54%) |
|
PASI 90 |
0 |
14 (35%) |
17 (45%) |
0 |
4 (18%) |
9 (38%) |
|
PASI 100 |
0 |
8 (20%) |
11 (29%) |
0 |
2 (9%) |
4 (17%) |
|
* Pacientes aleatorizados con implicación de psoriasis en piel ≥ 3% BSA basal |
||||||
Uso de metotrexato: En ambos estudios, la proporción de pacientes que alcanzaron una respuesta PASI 75 a la Semana 24 fue consistentemente más alta en los grupos de STELARA® 45 mg y 90 mg comparado con placebo sin importar el uso de MTX concomitante. Se mantuvieron las respuestas PASI 75 a la Semana 52.
Terapia Anti-TNFa previa: En PSUMMIT II, la proporción de pacientes que alcanzaron una respuesta PASI 75 a la Semana 24 fue significativamente más alta en los grupos de STELARA® 45 mg y 90 mg comparado con placebo en pacientes tratados previamente con un agente anti-TNFa.
Función física y calidad de vida relacionada a la salud: En PSUMMIT I y PSUMMIT II, la función física y la calidad de vida relacionada con la salud fueron valoradas usando el Índice de Incapacidad Física del Cuestionario de Valoración de Salud (HAQ-DI), El Índice de Calidad de Vida Dermatológica (DLQI) y la encuesta de salud SF-36.
Pacientes tratados con STELARA® mostraron mejora significativa en la función física según lo valorado por la HAQ-DI a la Semana 4. La proporción de pacientes alcanzando una mejora clínicamente significativa ≥0.3 en el marcador HAQ-DI desde línea base a la Semana 24 fue también significativamente mayor en los grupos de STELARA® cuando se comparó con placebo (ver Tabla 25). Se observó mejora en la primera valoración (semana 4), alcanzó un máximo en la Semana 12 y se mantuvo hacia la Semana 24. La mejora en el marcador HAQ-DI desde línea base se mantuvo a la Semana 52.
En ambos estudios, la mejoría en HAQ-DI a la Semana 24 fue consistentemente mayor en los grupos de STELARA® 45 mg y 90 mg comparado con placebo sin importar el uso de MTX concomitante.
En PSUMMIT II, la mejoría en HAQ-DI a la Semana 24 fue significativamente mayor en los grupos de STELARA® 45 mg y 90 mg comparado con placebo en pacientes tratados previamente con agentes anti-TNFa.
|
Tabla 25:Mejora en la función física según lo medido por HAQ-DI a Semana 24 |
||||||
|
PSUMMIT I |
PSUMMIT II |
|||||
|
STELARA® |
STELARA® |
|||||
|
Placebo |
45 mg |
90 mg |
Placebo |
45 mg |
90 mg |
|
|
Marcador Basal HAQ-DI |
||||||
|
N |
204 |
205 |
204 |
104 |
103 |
104 |
|
Media (SD) |
1.24 (0.647) |
1.22 (0.610) |
1.22 (0.634) |
1.25 (0.723) |
1.34 (0.704) |
1.29 (0.666) |
|
Mediana |
1.25 |
1.25 |
1.25 |
1.25 |
1.38 |
1.25 |
|
Mejora en HAQ-DI |
||||||
|
N |
206 |
205 |
204 |
104 |
103 |
105 |
|
Media (SD) |
0.10 (0.390) |
0.31 (0.521) |
0.40 (0.514) |
0.03 (0.380) |
0.21 (0.461) |
0.22 (0.436) |
|
Mediana |
0.00 |
0.25 a |
0.25 a |
0.00 |
0.13 b |
0.25 a |
|
Respondientes HAQ-DI * |
58 (28%) |
98 (48%)a |
97 (48%)a |
17 (16%) |
35 (34%)b |
40 (38%)a |
|
a p<0.001 |
||||||
En PSUMMIT I, de 205 sujetos aleatorizados a STELARA® 45 mg, 153 continuaron con la misma dosis y estuvieron disponibles para evaluación en la Semana 52. Entre estos, la respuesta HAQ-DI fue alcanzada por 83 (54.2%) de los sujetos. De 204 sujetos aleatorizados a STELARA® 90 mg, 185 estuvieron disponibles para evaluación en la Semana 52. Entre estos, la respuesta HAQ-DI fue alcanzada por 102 (55.1%) sujetos.
En PSUMMIT II, de 103 sujetos aleatorizados a STELARA® 45 mg, 68 continuaron con la misma dosis y estuvieron disponibles para evaluación en la Semana 52. Entre estos, la respuesta HAQ-DI fue alcanzada por 29 (42.6%) de los sujetos. De 105 sujetos aleatorizados a STELARA® 90 mg, 83 estuvieron disponibles para evaluación en la Semana 52. Entre estos, la respuesta HAQ-DI fue alcanzada por 44 (53%) de los sujetos.
El DLQI fue valorado al comparar el cambio en los marcadores DLQI desde línea base para aquellos pacientes con ≥3% BSA basal. En ambos estudios a la Semana 24, hubo una mejora significativa desde línea base en los marcadores DLQI en ambos grupos de STELARA® 45 mg y 90 mg según lo comparado con placebo (ver Tabla 26) y la mejora se mantuvo a la Semana 52.
Tanto en PSUMMIT I como en PSUMMIT II a la Semana 24, el cambio desde línea base en los marcadores del resumen de componente físico (PCS) de SF-36 fue significativamente mayor en los grupos de STELARA® 45 mg y 90 mg comparado con el grupo de placebo. En ambos estudios, el cambio desde la línea base en los marcadores del resumen de componente mental (MCS) SF-36 en la Semana 24 fue mayor en ambos grupos de STELARA® comparados con el grupo de placebo (p<0.001 para PSUMMIT I - grupo de 90 mg, p=NS para otros grupos) (ver Tabla 26). En ambos estudios, el cambio desde línea base en los marcadores SF-36 PCS y MCS se mantuvo hacia la Semana 52.
En PSUMMIT II, un cambio significativo desde línea base en el marcador de Terapia de Valoración Funcional de Fatiga en Enfermedades Crónicas (FACIT-F) fue observado a la Semana 24 en los grupos de STELARA® 45 mg y 90 mg comparado con el grupo de placebo (mediana de mejora, todos 3.0 vs 0.0; p<0.007). Similarmente, el porcentaje de pacientes con mejora clínicamente significativa en fatiga desde línea base (4 puntos en la escala FACIT-F) fue significativamente mayor en los grupos de STELARA® 45 mg (49% [p<0.001]) y 90 mg (49% [p<0.001]) comparado con el grupo de placebo (25.8%). El cambio desde línea base en los marcadores FACIT-F se mantuvo hacia la Semana 52.
|
Tabla 26: Resumen de cambio desde línea base en marcadores DLQI y SF-36 en Semana 24 |
||||||
|
PSUMMIT I |
PSUMMIT II |
|||||
|
STELARA® |
STELARA® |
|||||
|
Placebo |
45 mg |
90 mg |
Placebo |
45 mg |
90 mg |
|
|
DLQI |
||||||
|
Pacientes aleatorizados con implicación de psoriasis en piel ≥ 3% BSA basal |
146 |
145 |
149 |
80 |
80 |
81 |
|
Basal |
||||||
|
N |
145 |
145 |
149 |
80 |
80 |
81 |
|
Media (SD) |
11.68 (7.705) |
11.02 (7.308) |
10.54 (7.179) |
11.93 (7.622) |
12.09 (7.667) |
11.98 (7.754) |
|
Mediana |
11.00 |
10.00 |
9.00 |
11.00 |
11.00 |
10.00 |
|
Cambio desde línea base |
||||||
|
N |
140 |
142 |
146 |
73 |
77 |
75 |
|
Media (SD) |
-1.40 (6.177) |
-6.63 (6.776) |
-7.54 (6.524) |
-0.75 (5.666) |
-6.95 (7.719) |
-7.16 (6.748) |
|
Mediana |
-1.00 |
-6.00 a |
-6.00 a |
0.00 |
-6.00 a |
-6.00 a |
|
SF-36 Resumen de componente físico |
||||||
|
Basal |
||||||
|
N |
203 |
203 |
204 |
104 |
102 |
104 |
|
Media (SD) |
31.39 (8.785) |
31.16 (8.511) |
31.45 (8.152) |
30.28 (9.361) |
28.69 (8.501) |
28.93 (8.480) |
|
Mediana |
30.40 |
29.80 |
29.70 |
29.35 |
27.95 |
28.15 |
|
Cambio desde línea base |
||||||
|
N |
196 |
200 |
197 |
97 |
99 |
97 |
|
Media (SD) |
1.4 (7.094) |
4.89 (9.333) |
6.22 (8.747) |
1.09 (5.892) |
4.29 (8.594) |
2.4.67 (8.758) |
|
Mediana |
1.15 |
3.90a |
5.80a |
0.00 |
2.70b |
3.50b |
|
Resumen de componente mental |
||||||
|
Basal |
||||||
|
N |
203 |
203 |
204 |
104 |
102 |
104 |
|
Media (SD) |
43.51 (10.848) |
42.77 (10.908) |
43.48 (11.608) |
42.11 (12.507) |
43.27 (12.911) |
42.81 (11.953) |
|
Mediana |
43.90 |
42.00 |
41.65 |
41.80 |
43.70 |
41.40 |
|
Cambio desde línea base |
||||||
|
N |
196 |
200 |
197 |
97 |
99 |
97 |
|
Media (SD) |
1.53 (9.582) |
3.35 (10.016) |
4.79 (10.054) |
0.63 (8.238) |
3.01 (11.144) |
3.52 (11.274) |
|
Mediana |
0.250 |
2.65b |
4.40c |
0.00 |
0.70b |
2.20b |
|
a p≤0.001 |
||||||
Economía relacionada a la salud: Datos económicos de salud acerca del tiempo perdido de trabajo, posibilidades de empleo, y productividad diaria en el trabajo, escuela, y hogar fueron recolectados a través de cuestionarios en línea base y a la Semana 24. Para valorar la productividad, los pacientes fueron cuestionados para indicar cuánto afectó su padecimiento su productividad en el trabajo, escuela o casa en las 4 semanas anteriores, usando una Escala Análoga Visual (VAS) de 10 cm (no afectado del todo [0] a muy afectado [10]).
La mejora en productividad auto-reportada fue significativamente mayor en los grupos de STELARA® 45 mg y 90 mg comparado a placebo en la Semana 24.
INDICACIONES TERAPÉUTICAS:
STELARA® está indicada: En pacientes con psoriasis en placa de moderada a grave que son candidatos para fototerapia o tratamiento sistémico.
En pacientes adultos con Artritis Psoriásica (PsA) cuando la respuesta a la terapia previa con medicamentos antireumáticos modificadores de la enfermedad no biologicos (DMARD) no ha sido adecuada.
Posología y método de administración (adultos): STELARA® se administra por inyección subcutánea.
Psoriasis de placa: La dosis recomendada de STELARA® es de 45 mg, administrados a las semanas 0 y 4, y en adelante cada 12 semanas. Como alternativa, 90 mg se puede usar en pacientes con un peso corporal superior a los 100 kg.
Ajuste de dosis: En pacientes que han tenido una respuesta inadecuada a dosis de 45 mg cada 12 semanas, puede ajustarse el tratamiento a 90 mg. cada 8 a 12 semanas.
Retratamiento: Se ha demostrado que el retratamiento con un esquema de dosificación de las semanas 0 y 4 después interrumpir el tratamiento es seguro y eficaz.
Artritis psoriásica: La dosis recomendada de STELARA® es 45 mg administrada en las Semanas 0 y 4, después cada 12 semanas a partir de allí. Alternativamente, 90 mg pueden ser usados en pacientes con un peso corporal mayor a 100 kg.
Consideración general para la administración: STELARA® está destinado a utilizarse bajo la dirección y supervisión de un médico. El paciente mismo puede inyectarse STELARA® si el médico determina que es oportuno y en caso necesario con seguimiento médico, una vez enseñada debidamente la técnica de inyección subcutánea.
Antes de la administración subcutánea, inspeccione detenidamente la solución en el vial de STELARA® para ver materia sólida y decoloración. El producto es incoloro a amarillo claro y puede contener algunas pequeñas partículas blancas o translúcidas de proteína. Este aspecto no es extraño en soluciones de naturaleza proteínica. El producto no debe utilizarse si la solución está decolorada o turbia o si se ven otras partículas. STELARA® no contiene conservadores y por ello todo producto no utilizado sobrante en el vial y en la jeringa debe desecharse.
Debe indicárseles a los pacientes que se inyecten todo el STELARA® según las instrucciones proporcionadas en el prospecto informativo para el paciente.
La aguja de la jeringa prellenada está cubierta con un protector que contiene goma natural (un derivado del látex), el cual puede causar reacciones alérgicas en individuos sensibles al látex.
Poblaciones especiales:
Uso pediátrico: No se han llevado a cabo estudios específicos de STELARA® en pacientes pediátricos menores de 18 años.
Uso geriátrico: De los 4135 pacientes expuestos a STELARA®, un total de 252 tuvieron 65 años de edad o más (183 pacientes con psoriasis y 69 pacientes con artritis psoriásica). No se observaron diferencias importantes relacionadas con la edad en cuanto a eliminación o volumen de distribución durante los estudios clínicos. Aunque no se observaron diferencias en seguridad ni eficacia entre pacientes más viejos y más jóvenes, el número de pacientes de 65 años de edad o mayores no es suficiente para determinar si responden de forma diferente de los pacientes más jóvenes.
Insuficiencia renal: No se han llevado a cabo estudios específicos en pacientes con insuficiencia renal.
Insuficiencia hepática: No se han llevado a cabo estudios específicos en pacientes con insuficiencia hepática.
DATOS FARMACÉUTICOS:
Precauciones especiales de almacenamiento
• Almacene en un refrigerador o 2ºC a 8ºC o 36ºF a 46ºF.
• Almacene en paquete original hasta su uso.
• Proteja de la luz.
• No congele.
• No agite.
Mantenga lejos del alcance de los niños.
Naturaleza y contenido del recipiente: STELARA® se presenta como solución estéril en frasco de vidrio de uso único (Tipo 1). STELARA® no contiene conservantes. El frasco está cerrado con un tapón recubierto. La solución es transparente a ligeramente opalescente, incolora a amarillo claro con un pH de aproximadamente 6.0. Cada mL de STELARA® contiene 90 mg de ustekinumab, 1.0 mg de L-histidina y L-histidina hidrocloruro, 76 mg de sucrosa, 0.04 mg de polisorbato 80 y agua para inyección, USP.
STELARA® también es suministrado como una solución estéril en una jeringa de vidrio tipo I pre-llenada (PFS) de uso único de 1 ml con aguja fija 27 G, cubierta con tapón tipo pistón. La aguja está cubierta con un protector de aguja de goma natural (un derivado del látex). (Ver advertencias y precauciones). La jeringa está fijada con un guarda de seguridad pasiva.
Instrucciones de uso y manejo y desecho: Después de administrar STELARA®, se debe desechar la jeringa de acuerdo con las prácticas médicas aceptadas para las jeringas usadas.
FORMA FARMACÉUTICA: Solución para inyección.
PROPIEDADES FARMACOCINÉTICAS:
Absorción: El tiempo promedio para lograr la concentración sérica máxima fue de 8.5 días posterior a una administración subcutánea única de 90 mg en sujetos sanos. Los valores tmáx promedio de ustekinumab después de una administración subcutánea única de 45 mg o 90 mg en pacientes con psoriasis fueron comparables en sujetos sanos.
Se calculó que la biodisponibilidad absoluta de ustekinumab posterior a una administración subcutánea única en pacientes con psoriasis era de 57.2%.
Distribución: El volumen de distribución promedio durante la fase terminal (Vz) después de una administración intravenosa única a pacientes con psoriasis varió de 57 a 83 mL/kg.
Metabolismo: Se desconoce la vía metabólica exacta de ustekinumab.
Eliminación: Eliminación sistémica promedio (CL en inglés, clearance) posterior a una administración intravenosa única en pacientes con psoriasis varió de 1.99 a 2.34 mL/día/kg.
La vida media promedio (t1/2) de ustekinumab fue de aproximadamente 3 semanas en pacientes con psoriasis y/o artritis psoriásica, que varió de 15 a 32 días en todos los estudios de psoriasis y estudios de artritis psoriásica.
Linealidad de dosis: La exposición sistémica de ustekinumab (Cmáx y AUC) aumentó de una manera aproximadamente proporcional a la dosis después de una administración intravenosa única en dosis que variaron de 0.09 mg/kg a 4.5 mg/kg o posterior a una administración subcutánea única en dosis que variaron de 24 mg a 240 mg en pacientes con psoriasis.
Dosis única comparado con dosis múltiples: Los perfiles de tiempo de concentración en suero de ustekinumab normalmente fueron predecibles después de la administración de dosis subcutáneas únicas o múltiples. Las concentraciones séricas en estado constante de ustekinumab se obtuvieron en la semana 28 después de las dosis subcutáneas iniciales a las semanas 0 y 4, seguidas de las dosis cada 12 semanas. La concentración mínima promedio en estado constante varió de 0.21 µg/mL a 0.26 µg/mL (45 mg) y de 0.47 µg/mL a 0.49 µg/mL (90 mg) en pacientes con psoriasis. No hubo acumulación aparente en la concentración de ustekinumab en suero con el tiempo cuando se administró subcutáneamente cada 12 semanas.
El impacto del peso en la farmacocinética: El peso del paciente influyó en las concentraciones de ustekinumab en suero en pacientes con psoriasis y/o artritis psoriásica. En cada dosis (45 mg o 90 mg), las concentraciones de promedio de ustekinumab en suero los pacientes con peso más alto (>100 kg) fueron inferiores en comparación con los pacientes de peso más bajo (≤ 100 kg). Sin embargo, entre dosis, las concentraciones promedio mínimas de ustekinumab en suero de pacientes con peso más alto (>100 kg) en el grupo de 90 mg fueron comparables con las de pacientes con peso más bajo (≤ 100 kg) en el grupo de 45 mg.
Análisis farmacocinético de la población: En un análisis farmacocinético de la población usando datos de pacientes con psoriasis, el aclaramiento aparente a (CL/F) y el volumen de distribución aparente (V/F) fueron de 0.465 L/d y 15.7 L, respectivamente, y el t1/2 fue de aproximadamente 3 semanas en pacientes con psoriasis. El sexo, la edad o la raza no influyeron en el CL/F de ustekinumab, pero el peso corporal sí afectó el CL/F con una tendencia a un CL/F mayor en pacientes con peso corporal más alto. El CL/F promedio en pacientes con peso >100 kg fue de aproximadamente 55% superior en comparación con los pacientes con peso < 100 kg. El V/F promedio de pacientes con peso >100 kg fue de aproximadamente 37% superior en comparación con pacientes con peso < 100 kg. Resultados similares fueron obtenidos de un análisis confirmatorio de farmacocinética de la población usando datos de pacientes con artritis psoriásica.
En el análisis farmacocinético de la población usando datos de pacientes con psoriasis, se evaluó el efecto de comorbilidades (antecedentes y situación actual de diabetes, hipertensión e hiperlipidemia) en la farmacocinética de ustekinumab. La comorbilidad de diabetes influyó en la farmacocinética de ustekinumab, con una tendencia de CL/F más alta en pacientes con diabetes. El CL/F promedio en pacientes con diabetes fue de aproximadamente 29% superior en comparación con pacientes sin diabetes.
Análisis farmacocinéticos de la población mostraron que había una alta tendencia de aclaración de ustekinumab en pacientes con respuesta positiva inmune.
No se han llevado a cabo estudios específicos de interacción entre fármacos en sujetos sanos o pacientes con psoriasis o artritis psoriásica.
En el análisis farmacocinético de la población, se exploró el efecto de los medicamentos concomitantes usados con más frecuencia en pacientes con psoriasis (incluyendo paracetamol / acetaminofén, ibuprofeno, ácido acetilsalicílico, metformina, atorvastatina, naproxeno, levotiroxina, hidroclorotiazida y vacuna contra la influenza) en la farmacocinética de ustekinumab. Ninguno de los medicamentos concomitantes ejerció un impacto significativo. La farmacocinética de ustekinumab no fue impactada con el uso anterior de MTX, ciclosporina y otros tratamientos biológicos para el tratamiento de psoriasis. La farmacocinética de ustekinumab no fue impactada por el uso concomitante de MTX, NSAIDs, y corticosteroides orales, o previa exposición a agentes anti-TNFa en pacientes con artritis psoriásica.
Los efectos de IL-12 o IL-23 en la regulación de las enzimas del CYP450 fueron evaluadas en estudios in vitro usando hepatocitos humanos.Que mostraron que los niveles de 10ng/mL de IL-12 y/o IL-23 no alteran las actividades de las enzimas del CYP450 (CYP1A2, 2B6, 2C9, 2C19, 2D6, or 3A4) (ver Interacciones del fármaco).
Poblaciones especiales:
Niños (menores de 17 años de edad): La farmacocinética de ustekinumab en pediatría no ha sido investigada.
Ancianos (mayores de 65 años): No se han llevado a cabo estudios específicos en pacientes de edad avanzada. En el análisis farmacocinético de la población no se indicaron cambios aparentes en las estimaciones de CL/F y V/F en pacientes >65 años.
Insuficiencia renal: No hay datos farmacocinéticos de pacientes con insuficiencia renal.
Insuficiencia hepática: No hay datos farmacocinéticos de pacientes con problemas hepáticos.
Otras poblaciones: La farmacocinética de ustekinumab fue generalmente comparable entre pacientes con psoriasis Asiáticos y no-Asiáticos.
El uso de tabaco y alcohol no influyó en la farmacocinética de ustekinumab.
CONTRAINDICACIONES: Hipersensibilidad severa a ustekinumab o a cualquiera de los componentes, embarazo, lactancia y en menores de 18 años (ver la Sección Advertencias y precauciones).
EMBARAZO Y LACTANCIA:
Uso durante el embarazo: En estudios animales, no hay evidencia de teratogenicidad, defectos de nacimiento ni retrasos en el desarrollo en niveles de dosis de hasta aproximadamente 45 veces más que la dosis equivalente más alta por administrarse a pacientes con psoriasis. Sin embargo, los estudios reproductivos o de desarrollo en animales no siempre son predictivos de una respuesta humana.
Se desconoce si STELARA® puede causar daño fetal al administrarse a una embarazada o influir en la capacidad reproductiva. STELARA® se debe administrar a una embarazada sólo si el beneficio supera ampliamente el riesgo.
Uso durante la lactancia: STELARA® se segrega en la leche de monos lactantes que recibieron STELARA®. Se desconoce si STELARA® se absorba sistémicamente después de la ingesta. Como muchos medicamentos e inmunoglobulinas se segregan en la leche humana y debido al potencial de reacciones adversas de STELARA® en lactantes, se debe decidir si se suspende la lactancia o se descontinúa el fármaco.
Fertilidad: El efecto de STELARA® sobre la fertilidad humana no se ha evaluado. No se identificó efecto adverso alguno sobre los parámetros de fertilidad en hembras en un estudio de toxicidad sobre El fertilidad en hembras conducido en ratones.
EFECTOS EN LA CAPACIDAD PARA CONDUCIR Y OPERAR MÁQUINAS: No se han llevado a cabo estudios sobre los efectos en la capacidad para conducir y operar máquinas.
REACCIONES ADVERSAS: A lo largo de esta sección, se presentan las reacciones adversas. Las reacciones adversas son eventos adversos que se consideran estar razonablemente asociados al uso del ustekinumab en base a la evaluación completa de la información disponible sobre acontecimientos adversos. No se puede determinar con fiabilidad una relación causal con el ustekinumab en casos individuales. Además, debido a que los ensayos clínicos se conducen bajo condiciones ampliamente cambiantes, las tasas de reacciones adversas observadas en los ensayos clínicos de un medicamento no pueden ser comparadas directamente con las tasas en los ensayos clínicos de otro medicamento y posiblemente no refleje las tasas observadas en la práctica clínica.
Experiencia en estudios clínicos en pacientes con psoriasis y/o artritis psoriásica: Los datos de seguridad descritos a continuación reflejan la exposición a STELARA® en 7 estudios controlados fase 2 y fase 3 en 4135 pacientes con psoriasis y/o artritis psoriásica, incluyendo 3256 expuestos durante al menos 6 meses, 1482 expuestos por lo menos 4 años y 838 por al menos 5 años.
Las reacciones adversas más comunes (>5%) en periodos controlados en estudios clínicos para psoriasis y artritis psoriásica con STELARA® fueron nasofaringitis, dolor de cabeza e infección en vías respiratorias superiores. La mayoría fueron consideradas leves y no fue necesario descontinuar el fármaco.
En la Tabla 1 se presenta un resumen de las Reacciones adversas al fármaco en estudios clínicos para psoriasis y estudios de clínicos de artritis psoriásica. La frecuencia de estas reacciones adversas estuvo basada en aquellas que ocurrieron durante los periodos controlados de los 7 estudios descritos arriba. Las reacciones adversas al fármaco se clasificaron por frecuencia mediante el uso de la siguiente convención:
Muy común (>1/10)
Común (frecuente) (>1/100, <1/10)
Poco común (poco frecuente) (>1/1,000, <1/100)
Rara (>1/10,000, <1/1,000)
|
Tabla 1: Resumen de adr en estudios clínicos para psoriasis |
|
|
Infecciones e infestaciones |
Común: infecciones dentales, infección del tracto respiratorio superior, nasofaringitis |
|
Poco común: Celulitis, herpes zoster, infección viral del tracto respiratorio superior |
|
|
Trastornos psiquiátricos |
Poco común: Depresión |
|
Trastornos del sistema nervioso |
Común: Mareo, dolor de cabeza |
|
Trastornos respiratorios, torácicos y mediastinales |
Común: Dolor oro-faríngeo Poco común: congestión nasal |
|
Trastornos gastrointestinales |
Común: Diarrea, náusea |
|
Trastornos en piel y tejido subcutáneo |
Común: Prurito |
|
Trastornos en tejido musculoesquelético y en tejido conectivo |
Común: Dolor de espalda, mialgia, artralgia |
|
Trastornos generales y condiciones en sitio de administración |
Muy común |
|
Común: Cansancio, eritema en sitio de inyección, dolor del sitio de inyección |
|
|
Poco común: reacciones en sitio de inyección (incluye dolor, swelling, hemorragia, hematoma, endurecimiento, irritación y prurito) |
|
Infecciones: En los estudios placebo- estudios controlados de pacientes con psoriasis y/o artritis psoriásica, las tasas de infección o infección grave fueron semejantes entre los pacientes tratados con STELARA® y los tratados con placebo. En el periodo controlado con placebo de los estudios clínicos de pacientes con psoriasis y pacientes con artritis psoriásica, la tasa de infección fue de 1.27 por paciente-año de seguimiento en pacientes tratados con STELARA® y de 1.17 por paciente-año de seguimiento en pacientes tratados con placebo. Las infecciones graves ocurrieron en 0.01 por paciente-año de seguimiento en pacientes tratados con STELARA® (5 infecciones graves en 616 pacientes-año de seguimiento) y 0.01 por paciente-año de seguimiento en pacientes tratados con placebo (4 infecciones graves en 287 pacientes-año de seguimiento (ver Advertencias y precauciones).
En las porciones controladas y no controladas de los estudios clínicos para psoriasis y artritis psoriásica, representan 9848 paciente-años de exposición en 4135 pacientes, la mediana de seguimiento fue 1.1 año; 3.2 años para estudios de psoriasis y 1.0 año para estudios de artritis psoriásica. La tasa de infección fue de 0.86 por paciente-año de seguimiento en pacientes tratados con STELARA®. La tasa de infecciones graves fue de 0.01 por paciente-año de seguimiento en pacientes tratados con STELARA® (107 infecciones graves en 9848 pacientes-año de seguimiento) que incluyeron diverticulitis, celulitis, neumonía, septicemia, apendicitis y colecistitis.
En estudios clínicos, los pacientes con tuberculosis latente que recibieron tratamiento de manera concurrente con isoniazida no desarrollaron tuberculosis.
Malignidad: En el periodo placebo-controlado de los estudios clínicos en psoriasis y artritis psoriásica, la incidencia de malignidad, excluyendo el cáncer de piel no melanoma, fue de 0.16 por 100 pacientes-año de seguimiento en el caso de pacientes tratados con STELARA® (1 paciente en 615 pacientes-año de seguimiento) comparado con el 0.35 por 100 pacientes-año de seguimiento para los pacientes tratados con placebo (1 paciente en 287 pacientes-año de seguimiento).
La incidencia de cáncer de piel no melanoma fue de 0.65 por 100 pacientes-año de seguimiento en el caso de los pacientes tratados con STELARA® (4 pacientes en 615 pacientes-año de seguimiento) comparado con 0.70 por 100 pacientes-año de seguimiento para los pacientes tratados con placebo (2 pacientes en 287pacientes-año de seguimiento).
En los periodos controlados y no controlados de los estudios clínicos de psoriasis y artritis psoriásica representando 9848 paciente-años de exposición en 4135 pacientes, la mediana de seguimiento fue 1.1 año; 3.2 años para estudios de psoriasis y 1.0 año para estudios de artritis psoriásica. Malignidades excluyendo cánceres de piel no melanoma en 55 pacientes en 9830 pacientesaños de seguimiento (incidencia de 0,56 por 100 pacientesaños de seguimiento para los pacientes tratados con STELARA®). Esta incidencia de enfermedades malignas informada en los pacientes tratados con STELARA® fue comparable a la incidencia esperada en la población general (proporción de incidencia estandarizada = 0.92 [intervalo de confianza de 95%: 0.69,1.20], ajustado por edad, género y raza)1. Las enfermedades malignas más frecuentemente observadas, diferentes del cáncer de piel no melanoma, fueron cáncer de próstata, colorrectal y melanoma de mama. La incidencia del cáncer de piel no melanoma fue de 0.50 por 100 pacientes-años de seguimiento para los pacientes tratados con STELARA (49 pacientes en 9815 pacientes-años de seguimiento). La tasa de pacientes con cánceres de células basales versus células escamosas (4:1) es comparable con la tasa esperada en la población general (ver Advertencias y Precauciones).
Reacciones de hipersensibilidad: Durante los periodos controlados de los estudios clínicos sobre psoriasis y artritis psoriásica de STELARA®, se observó salpullido y urticaria en <1% de los pacientes.
Inmunogenicidad: En estudios clínicos, menos de 8% de los pacientes tratados con STELARA® desarrollaron anticuerpos a ustekinumab, que, por lo general, fueron de baja titulación. No se observó ninguna asociación entre el desarrollo de anticuerpos para ustekinumab y el desarrollo de las reacciones en el sitio de la inyección. Los pacientes positivos en el caso de anticuerpos a ustekinumab presentaron una tendencia a una eficacia más baja, aunque el resultado positivo a los anticuerpos no impide una respuesta clínica. En estudios de psoriasis, la mayoría de pacientes quienes fueron positivos para anticuerpos a ustekinumab tuvieron anticuerpos neutralizantes.
Experiencia posterior a la comercialización: Las reacciones adversas en la tabla 2 están en orden de frecuencia* utilizando la siguiente convención:
Muy común: ≥1/10.
Común: ≥1/100 y <1/10.
Poco común o frecuente: ≥1/1,000 y <1/100
Rara: ≥1/10,000 y <1/1000:
Muy rara: <1/10,000, incluyendo reportes aislados.
|
Tabla 2: nformes Posteriores a la Comercialización |
|
|
Trastornos del sistema inmune |
Poco común: Reacciones de hipersensibilidad (incluyendo rash, urticaria). Rara: reacciones de hipersensibilidad serias, incluyendo anafilaxis y angioedema |
|
Trastornos de la piel y tejido subjuntivo |
Poco común: Psoriasis pustular Rara: Psoriasis eritrodérmica |
* La frecuencia de las reacciones adversas post-marketing es derivada de los 7 estudios clínicos si la reacción adversa ha sido observada en esos estudios. Por el contrario, ha sido estimada en una frecuencia menor adecuando la exposición en los 7 estudios clínicos designados cuando la reacción no fue observada.
INTERACCIONES: No se han realizado estudios de interacción farmacológica con STELARA® (ver Propiedades farmacocinéticas).
Los efectos de IL-12 o IL-23 en la regulación de las enzimas del CYP450 fueron evaluadas en estudios in vitro usando hepatocitos humanos. Que mostraron que los niveles de 10ng/mL de IL-12 y/o IL-23 no alteran las actividades de las enzimas del CYP450 (CYP1A2, 2B6, 2C9, 2C19, 2D6, or 3A4). Estos resultados no sugieren la necesidad de ajustes de dosis en pacientes que reciben CYP450 substratos concomitantes (ver Propiedades Farmacocinéticas).
No se deben aplicar vacunas vivas de manera concurrente con STELARA® (ver Advertencias y precauciones).
ADVERTENCIAS Y PRECAUCIONES:
Infecciones: STELARA® es un inmunosupresor selectivo y puede aumentar potencialmente el riesgo de infecciones y de infecciones reactivas latentes.
En estudios clínicos se han observado infecciones bacteriales, micóticas y virales graves en pacientes que reciben STELARA®.
STELARA® no debe administrarse en pacientes con una infección activa clínicamente importante. Se debe tener precaución con el uso de STELARA® en pacientes con una infección crónica o antecedentes de infecciones recurrentes.
Antes de iniciar el tratamiento con STELARA®, se debe evaluar a los pacientes en caso de tuberculosis. No se debe administrar STELARA® en pacientes con tuberculosis activa. Antes de administrar STELARA®, se debe iniciar el tratamiento contra la infección latente de tuberculosis.
Asimismo, se debe considerar el tratamiento contra la tuberculosis antes de STELARA® en pacientes con antecedentes de tuberculosis latente o activa cuyo curso de tratamiento adecuado no pueda ser confirmado. Se debe monitorear de cerca a los pacientes que reciben STELARA® en caso de signos o síntomas de tuberculosis activa durante y después del tratamiento.
Se debe indicar a los pacientes que, en caso de signos o síntomas que sugieran la presencia de una infección, acudan al médico. Si un paciente presenta una infección seria, se le debe monitorear de cerca y no se debe administrar STELARA® hasta que ceda la infección (ver Reacciones adversas).
Malignidades: STELARA® es un inmunosupresor selectivo. Los agentes inmunosupresores tienen el potencial de aumentar el riesgo de una malignidad. Algunos pacientes que recibieron STELARA® durante estudios clínicos presentaron malignidades cutáneas o no cutáneas (ver Reacciones adversas).
STELARA® no se ha estudiado en pacientes con antecedentes de malignidades. Se debe tener precaución con el uso de STELARA® en pacientes con antecedentes de malignidades o al considerar un tratamiento continuo en pacientes que desarrollen una malignidad.
Todos los pacientes, en particular aquellos mayores a 60 años de edad, pacientes con una historia médica de terapia inmunosupresora prolongada o aquellos con una historia de tratamiento PUVA, deberán ser monitoreados por aparición de cáncer de piel no melanoma (ver Reacciones adversas).
Reacciones de hipersensibilidad: En la experiencia post-marketing se han reportado reacciones de hipersensibilidad serias, incluyendo anafilaxis y angioedema. Si se presenta una reacción de hipersensibilidad grave o anafiláctica, instituir terapia apropiada y se debe descontinuar de inmediato STELARA e instituirse el tratamiento correspondiente (ver Reacciones adversas).
Inmunizaciones: Se recomienda que no se apliquen vacunas virales vivas o bacteriales vivas de manera concurrente con STELARA®.
Se pueden aplicar vacunas inactivas o no vivas concurrentes en pacientes que reciben STELARA®.
No existen datos disponibles sobre la transmisión secundaria de la infección por vacunas vivas en los pacientes que recibieron STELARA®. Se recomienda tener precaución al administrar algunas vacunas vivas a contactos familiares de pacientes que reciben STELARA® debido al riesgo potencial de propagación de contactos familiares y transmisión al paciente.
Tratamiento de largo plazo con STELARA® no suprime la respuesta inmune humoral a vacunas para tétanos o polisacáridos pneumococales (ver Propiedades farmacodinámicas).
Inmunosupresión: En estudios de psoriasis, no se ha evaluado la seguridad y eficacia de STELARA® combinado con agentes inmunosupresores o fototerapia. En estudios de artritis psoriásica, el uso de MTX concomitante no pareció influir la seguridad o eficacia de STELARA®. Se debe tener precaución al considerar el uso concomitante de agentes inmunosupresores y STELARA® o cuando haya un cambio de tratamiento a otros agentes biológicos usados para tratar la psoriasis.
Inmunoterapia: STELARA® no se ha evaluado en pacientes que han sido sometidos a inmunoterapia para alergias. STELARA® puede afectar la inmunoterapia para alergias. Se debe tener precaución en pacientes que reciben o que han recibido inmunoterapia para alergias en especial por anafilaxis.
General: La aguja de la jeringa prellenada está cubierta con un protector que contiene goma natural (un derivado del látex), el cual puede causar reacciones alérgicas en individuos sensibles al látex.
En pacientes con psoriasis, se han notificado casos de dermatitis exfoliativa tras el tratamiento con Ustekinumab. Los pacientes con psoriasis en placa pueden desarrollar psoriasis eritrodérmica, presentando síntomas que pueden no ser distinguidos clínicamente de la dermatitis exfoliativa, como parte del curso natural de su enfermedad. Como parte del seguimiento de la psoriasis del paciente, los médicos deben prestar atención a los síntomas de psoriasis eritrodérmica o dermatitis exfoliativa. Si se presentan estos síntomas, se debe instaurar el tratamiento adecuado. Se debe interrumpir el tratamiento con Ustekinumab si se sospecha de una reacción al fármaco.
SOBREDOSIS: Se administraron dosis únicas de hasta 6 mg/kg por vía intravenosa en estudios clínicos sin toxicidad que limitara la dosis. En el caso de sobredosis, se recomienda supervisar de cerca al paciente por cualquier signo o síntoma de reacción o efecto adverso y tratarlo de inmediato con el tratamiento sintomático correspondiente.
PRESENTACIÓN: STELARA® caja con una jeringa prellenada (PFS) de uso único. La PFS es fabricada en dosis de 45 mg/jeringa (0.5 ml). Están montadas en un sistema de administración UltraSafe Passive® para administración subcutánea. (Reg. San. INVIMA 2010M-0010789).
JANSSEN-CILAG, S. A.
Av. Calle 26 No. 69-76 - Edificio Elemento
Torre 2 - Piso 11 - PBX: (+57) 1 9271200 - Bogotá, D. C.