
TOUJEO 300 U/ML
INSULINA GLARGINA
Solución para inyección
1 Pluma precargada, Solución para inyección, 450/1.5 U/ml
3 Pluma precargada, Solución para inyección, 450/1.5 U/ml
5 Pluma precargada, Solución para inyección, 450/1.5 U/ml
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN:
Cada mililitro contiene:
Principio activo: 10,91 mg de insulina glargina, que corresponden a 300 U de insulina glargina.
Excipientes: cloruro de zinc 0,19 mg, metacresol 2,7 mg, glicerol al 85% 20 mg; ácido clorhídrico concentrado e hidróxido de sodio para ajuste del pH y agua para inyección. El pH de la solución es 4,0
Parte activa/principio activo:
Insulina glargina:
(21A-Gly-30Ba-L-Arg-30Bb-L-Arg- insulina humana o 21A-Gly-31B -32B -Di-Arg – insulina humana)
Análogo recombinante de la insulina humana
La insulina glargina se produce por la tecnología del ADN recombinante utilizando Escherichia coli (cepa K12) como organismo productor.
INDICACIONES TERAPÉUTICAS:
Acción terapéutica:
Agente antidiabético. Análogo de la insulina de acción prolongada.
Código ATC: A 10 A E04 (insulina y sus análogos, acción prolongada).
Indicaciones:
Tratamiento de la diabetes mellitus en niños > 6 años de edad, adolescentes y adultos en pacientes que requieran tratamiento con insulina.
FARMACOCINÉTICA Y FARMACODINAMIA:
Características farmacológicas farmacodinámia:
Modo de acción/características farmacodinámicas:
Modo de acción: La actividad principal de la insulina, incluida la insulina glargina, es la regulación del metabolismo de la glucosa. La insulina y sus análogos disminuyen los niveles de glucemia mediante la estimulación de la absorción periférica de la glucosa, especialmente en el músculo esquelético y tejido adiposo, y mediante la inhibición de la producción hepática de glucosa. La insulina inhibe la lipólisis en los adipocitos, inhibe la proteólisis y estimula la síntesis proteica.
Características farmacodinámicas: La insulina glargina es un análogo de la insulina humana que se ha diseñado para tener baja solubilidad en agua a pH neutro. A pH 4, la insulina glargina es completamente soluble. Tras la inyección en el tejido subcutáneo, la solución ácida se neutraliza, lo que lleva a la formación de un precipitado del cual se liberan constantemente pequeñas cantidades de insulina glargina.
En estudios de pinza euglucémica en sujetos sanos o en pacientes con diabetes tipo 1, el inicio de la acción de Lantus® vía subcutánea fue más lento que con insulina NPH, su perfil de efecto fue más suave y sin picos y la duración de su efecto fue más prolongado.
Como se observó en estudios de pinza euglucémica en pacientes con diabetes tipo 1, el efecto hipoglucemiante de TOUJEO® 300 U/ML fue más constante y prolongado en comparación con Lantus® tras la inyección subcutánea. La figura 1 muestra los resultados de un estudio cruzado en 18 pacientes con diabetes tipo 1 realizado durante un máximo de 36 horas tras la inyección. El efecto de TOUJEO® 300 U/ML sobrepasó las 24 horas (hasta 36 horas) a las dosis clínicamente relevantes.
El efecto hipoglucemiante prolongado de TOUJEO® 300 U/ML más allá de las 24 horas permite flexibilidad en el momento de administración una vez al día de TOUJEO® 300 U/ML(consulte las secciones Posología y administración - General y Eficacia clínica/Estudios clínicos).
La diferencia de perfil entre TOUJEO® 300 U/ML y Lantus® puede atribuirse a la modificación de la liberación de la insulina glargina del precipitado.
Para el mismo número de unidades de insulina glargina inyectado, el volumen inyectado de TOUJEO® 300 U/ML es un tercio del de LANTUS® 300 U/ML. Esto lleva a una disminución del área superficial del precipitado, lo que proporciona una liberación de insulina glargina más sostenida del precipitado de TOUJEO® 300 U/ML en comparación con el de Lantus®.
Figura 1. Perfil de actividad en pacientes con DMT1 en un estudio de pinza euglucémica de 36 horas
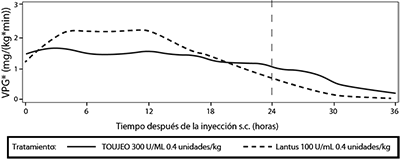
* Velocidad de infusión de glucosa.
Velocidad de infusión de glucosa: Determinada como la cantidad de glucosa infundida para mantener niveles constantes de glucosa plasmática (valores medios por hora). El final de la observación fue a las 36 horas.
En un estudio de farmacología clínica, se ha demostrado que el uso intravenoso de insulina glargina es equipotencial con el de insulina humana cuando se administran a la misma dosis.
La insulina glargina se metaboliza a dos metabolitos activos, M1 y M2 (consulte la sección Eliminación).
Unión al receptor de insulina: Los estudios in vitro indican que la afinidad de la insulina glargina y sus metabolitos M1 y M2 por el receptor de insulina humana es semejante a la de la insulina humana.
Unión al receptor de IGF-1: La afinidad de la insulina glargina por el receptor de IGF-1 humano es aproximadamente de 5 a 8 veces mayor que la de la insulina humana (pero aproximadamente de 70 a 80 veces menor que la del IGF-1), mientras que M1 y M2 se unen al receptor de IGF-1 con una afinidad ligeramente menor en comparación con la insulina humana.
La concentración total de insulina terapéutica (insulina glargina y sus metabolitos) encontrada en pacientes diabéticos tipo 1 fue notablemente menor que la que sería necesaria para la ocupación semimáxima del receptor de IGF-1 y la activación subsiguiente de la vía proliferativa mitogénica iniciada por el receptor de IGF-1. Las concentraciones fisiológicas de IGF-1 endógeno pueden activar la vía proliferativa mitogénica; sin embargo, las concentraciones terapéuticas encontradas en la terapia de insulina, incluida la terapia con TOUJEO® 300 U/ML, son considerablemente menores que las concentraciones farmacológicas necesarias para activar la vía del IGF-1.
Farmacocinética:
Absorción, distribución: Tras la inyección subcutánea de TOUJEO® 300 U/ML en sujetos sanos y pacientes diabéticos, las concentraciones séricas de insulina indicaron una absorción más lenta y prolongada, lo que resulta en un perfil de tiempo-concentración aún más plano por hasta 36 horas, en comparación con Lantus®. Las concentraciones fueron consistentes con el perfil de tiempo de la actividad farmacodinámica de TOUJEO® 300 U/ML.
El nivel de estado estacionario en el rango terapéutico se alcanza tras 3-4 días de administración diaria de TOUJEO® 300 U/ML .
Tras la inyección subcutánea de TOUJEO® 300 U/ML, la variabilidad intrasujeto, definida como el coeficiente de variación para la exposición a insulina durante 24 horas, fue baja en el estado estacionario (17,4%).
Metabolismo: Tras la inyección subcutánea de TOUJEO® 300 U/ML en sujetos sanos y pacientes diabéticos, la insulina glargina se metaboliza rápidamente en el extremo carboxílico de la cadena beta, formando dos metabolitos activos: M1 (21A-Gly-insulina) y M2 (21A-Gly-des-30B-Thr-insulina). En el plasma, el principal compuesto en circulación es el metabolito M1. La exposición a M1 se incrementa con la dosis administrada de TOUJEO® 300 U/ML. Los hallazgos farmacocinéticos y farmacodinámicos indican que el efecto de la inyección subcutánea de TOUJEO® 300 U/ML se basa principalmente en la exposición a M1. La insulina glargina y el metabolito M2 no eran detectables en la gran mayoría de los sujetos y, cuando lo eran, sus concentraciones eran independientes de la dosis administrada y de la formulación de la insulina glargina.
Eliminación: La vida media de M1, el metabolito predominante de TOUJEO® 300 U/ML tras una inyección subcutánea, es de 18-19 horas, independiente de la dosis.
Poblaciones especiales:
Género, etnia: No se dispone de información acerca del efecto del género o la etnia en la farmacocinética de la insulina glargina (consulte la sección Eficacia clínica/Estudios clínicos).
Pacientes de edad avanzada: No se ha estudiado el efecto de la edad sobre la farmacocinética de TOUJEO® 300 U/ML. En pacientes de edad avanzada con diabetes, la posología inicial, los incrementos de dosis y la dosis de mantenimiento deben ser conservadores para evitar las reacciones hipoglucémicas. Puede ser difícil reconocer la hipoglucemia en pacientes de edad avanzada. Se recomienda un monitoreo estrecho de la glucosa y la dosis de insulina debe ajustarse para cada paciente en particular (consulte las secciones Posología y administración - Poblaciones Especiales, Precauciones y Eficacia clínica/Estudios clínicos).
Pacientes pediátricos: El análisis farmacocinético de la población para TOUJEO® 300 U/ML se basó en los datos de concentración de su metabolito principal M1 utilizando datos de 75 sujetos pacientes (≥ 6 a < 18 años) con diabetes tipo 1. El peso corporal fue una covariable significativa que afectó el aclaramiento de TOUJEO® 300 U/ML. Después de ajustar por el peso corporal, la exposición total (AUC) a TOUJEO® 300 U/ML en estado estacionario fue independiente de la edad.
Insuficiencia renal: No se ha estudiado el efecto de la insuficiencia renal sobre la farmacocinética de TOUJEO® 300 U/ML. Sin embargo, algunos estudios con insulina humana han mostrado un aumento de los niveles de insulina en circulación en pacientes con insuficiencia renal. Se recomienda un monitoreo estrecho de la glucosa y la dosis de insulina debe ajustarse para cada paciente en particular (consulte las secciones Posología y administración - Poblaciones especiales, Precauciones y Eficacia clínica/Estudios clínicos).
Insuficiencia hepática: No se ha estudiado el efecto de la insuficiencia hepática sobre la farmacocinética de TOUJEO® 300 U/ML. Sin embargo, algunos estudios con insulina humana han mostrado un aumento de los niveles de insulina en circulación en pacientes con insuficiencia hepática. Se recomienda un monitoreo estrecho de la glucosa y la dosis de insulina debe ajustarse para cada paciente en particular (consulte las secciones de Posología y administración - Poblaciones especiales y Precauciones).
Carcinogenicidad: Se llevaron a cabo estudios de carcinogenicidad de dos años en ratas y ratones. Los resultados no indicaron ningún riesgo para los seres humanos.
Tolerancia local: Los estudios de tolerancia local con administración subcutánea, intramuscular, intravenosa e intraarterial en conejos no apuntaron a ningún riesgo en el uso de insulina glargina en el hombre.
Inmunogenicidad: Los estudios de inmunogenicidad estándar realizados en cerdos, conejos y conejillos de Indias indicaron un potencial inmunogénico semejante o inferior de la insulina glargina que de la insulina humana en estas especies.
CONTRAINDICACIONES:
TOUJEO® 300 U/ML no debe usarse en pacientes con hipersensibilidad a insulina glargina o a cualquiera de los excipientes.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: No existen estudios clínicos controlados aleatorizados sobre el uso de TOUJEO® 300 U/ML en mujeres embarazadas. Una gran cantidad (más de 1000 resultados de embarazos retrospectivos y prospectivos con Lantus®) de embarazos expuestos en la vigilancia postcomercialización no indican ningún efecto adverso específico sobre el embarazo ni sobre la salud del feto o del recién nacido. Además, se realizó un metanálisis de ocho estudios clínicos observacionales, que incluían a 331 mujeres que usaban Lantus® y a 371 mujeres que usaban NPH, para evaluar la seguridad de la insulina glargina y la insulina NPH en diabetes gestacional o pregestacional. No se observaron diferencias significativas entre la insulina glargina y la insulina NPH en cuanto a los resultados maternales o neonatales relacionados con la seguridad durante el embarazo.
Los estudios en animales, con dosis de insulina glargina de 100 U/mL de hasta de 6 a 40 veces las dosis humanas, no indican ningún efecto perjudicial directo sobre el embarazo.
Es esencial que las pacientes con diabetes gestacional o preexistente mantengan un buen control metabólico a lo largo del embarazo para prevenir los resultados adversos asociados con la hiperglucemia. Se puede usar Lantus durante el embarazo, si es clínicamente necesario.
Puede haber disminución de las necesidades de insulina durante el primer trimestre, con generalmente un incremento durante los trimestres segundo y tercero. Inmediatamente después del parto, la necesidad de insulina disminuye rápidamente. En estas pacientes es esencial el monitoreo cuidadoso del control de glucosa.
Las pacientes con diabetes deben informarle a su médico si están embarazadas o si piensan quedar embarazadas.
Lactancia: Las mujeres en periodo de lactancia pueden necesitar de ajustes en la dosis de insulina y la dieta.
RECOMENDACIONES:
Información al paciente: Los pacientes deben ser orientados a leer con detenimiento las Instrucciones de uso de la pluma precargada TOUJEO® 300 U/ML SoloStar y a usar la pluma como se describe en estas Instrucciones de uso. Si no siguen estas instrucciones, podría administrarse demasiada o muy poca insulina. Se han notificado mezclas accidentales entre insulinas de acción corta y de acción prolongada. Para evitar los errores de administración entre TOUJEO® 300 U/ML y otras insulinas, los pacientes deben ser orientados a verificar siempre la etiqueta de la insulina antes de cada inyección.
La “potencia” se destaca en color dorado miel en la etiqueta de la pluma precargada TOUJEO® SoloStar.
Se les debe informar a los pacientes que el contador de dosis muestra el número de unidades de TOUJEO® 300 U/ML que se inyectará. No es necesario recalcular la dosis. La pluma precargada SoloStar.
TOUJEO® 300 U/ML contiene 450 unidades. Esta pluma administra dosis entre 1 y 80 unidades por inyección, en pasos de 1 unidad.
Se les debe informar a los pacientes que TOUJEO® (300 U/mL) contiene el triple de insulina en 1 mL que la insulina estándar (100 U/mL).
Se les debe orientar a los pacientes que nunca usen una jeringa para retirar TOUJEO® 300 U/ML de la pluma.
Se les debe orientar a los pacientes que no reutilicen la aguja. Se debe colocar una aguja estéril nueva para cada inyección. La reutilización de agujas aumenta el riesgo de bloqueo de la aguja, lo que puede causar la administración de una dosis inferior o superior. El uso de una nueva aguja estéril para cada inyección también minimiza el riesgo de contaminación e infección. En caso de agujas tupidas, los pacientes deben seguir las instrucciones descritas en el Paso 3 de las Instrucciones de uso de TOUJEO® SoloStar.
EFECTO EN LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS:
Manejo de vehículos o realización de tareas peligrosas: La capacidad del paciente para concentrarse y reaccionar puede verse afectada como resultado, por ejemplo, de la hipoglucemia o hiperglucemia o, por ejemplo, como resultado de problemas visuales. Esto puede constituir un riesgo en situaciones donde estas capacidades sean de especial importancia (por ejemplo, al manejar un carro u operar maquinaria).
Se les debe recomendar a los pacientes que tomen precauciones para evitar la hipoglucemia mientras manejen. Esto es particularmente importante para aquellos pacientes con reducción o ausencia de los síntomas de advertencia de la hipoglucemia o que tengan episodios frecuentes de hipoglucemia. En estas circunstancias, se deberá evaluar la conveniencia de manejar.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Mutagenicidad-genotoxicidad: La insulina glargina no fue mutagénica en ensayos para detectar mutaciones génicas en bacterias y células de mamíferos (ensayos de Ames y HGPRT) ni en ensayos para detectar aberraciones cromosómicas (citogenética in vitro en células V79 e in vivo en hámster chino).
Toxicidad reproductiva:
Teratogenicidad: En un estudio de embriotoxicidad en ratas, ocurrió hipoglucemia pero no toxicidad materna. La insulina glargina no fue embriotóxica ni teratogénica.
En un estudio de embriotoxicidad en conejos, se observó toxicidad materna (choque hipoglucémico, muertes intrauterinas) y embriofetal debido a hipoglucemia, incluyendo anomalías aisladas en los grupos de dosis media y superior. Se obtuvieron efectos similares con una insulina comercial de acción intermedia.
Reducción de la fertilidad: En un estudio combinado de fertilidad y pre y posnatal en ratas, se observó toxicidad materna debido a hipoglucemia dependiente de la dosis. Ocurrieron algunas muertes y, consecuentemente, reducción del índice de cría, sólo en el grupo de dosis superior. Se obtuvieron efectos similares con una insulina comercial de acción intermedia.
REACCIONES ADVERSAS:
Las siguientes reacciones adversas se han observado durante estudios clínicos realizados con TOUJEO® 300 U/ML (consulte la sección de Eficacia clínica/Estudios clínicos) y durante la experiencia clínica con insulina glargina 100 U/mL.
Se usa la siguiente clasificación de frecuencia de CIOMS, cuando corresponde: Muy frecuente ≥10%; frecuente ≥1 y <10%; poco frecuente ≥0,1 y <1%; rara ≥0,01 y <0,1%; muy rara <0,01%; desconocida (no se puede estimar a partir de los datos disponibles).
Hipoglucemia: La hipoglucemia, en general la reacción adversa más frecuente de la terapia de insulina, puede ocurrir si la dosis de insulina es muy alta en relación con la necesidad de insulina.
Al igual que con todas las insulinas, los ataques hipoglucémicos graves, especialmente si son recurrentes, pueden llevar a daño neurológico grave. Los episodios hipoglucémicos prolongados o graves pueden ser una amenaza a la vida.
En muchos pacientes, los signos y síntomas de neuroglucopenia están precedidos por signos de contrarregulación adrenérgica. Generalmente, mientras mayor y más rápida es la disminución de la glucemia, es más destacable el fenómeno de contrarregulación y sus síntomas.
Para la incidencia de hipoglucemia en ensayos clínicos, consulte la tabla en la sección de Eficacia clínica/Estudios clínicos.
Ojos: Un cambio acentuado del control glucémico puede provocar trastornos visuales temporales, debido a la alteración temporal de la turgencia e índice de refracción del cristalino.
La mejora a largo plazo del control glucémico disminuye el riesgo de progresión de la retinopatía diabética. No obstante, al igual que para todos los regímenes de insulina, la intensificación de la terapia de insulina con mejora abrupta del control glucémico puede estar asociada con el empeoramiento temporal de la retinopatía diabética.
En pacientes con retinopatía proliferativa, en particular si no son tratados con fotocoagulación, los episodios hipoglucémicos graves pueden llevar a una amaurosis temporal.
Consulte la sección de Eficacia clínica/Estudios clínicos para información adicional sobre los resultados del estudio de retinopatía.
Trastornos de la piel y del tejido subcutáneo: Al igual que con cualquier otra terapia de insulina, puede ocurrir lipodistrofia en el lugar de la inyección y retrasar la absorción de insulina. En los estudios clínicos, con regímenes que incluían insulina glargina, se observó lipohipertrofia en el 1 al 2% de los pacientes, mientras que lipoatrofia fue poco frecuente.
Se ha producido amiloidosis cutánea localizada en el lugar de la inyección con insulinas. Se ha informado hiperglucemia con inyecciones repetidas de insulina en áreas de amiloidosis cutánea; se ha informado hipoglucemia con un cambio repentino en un lugar de inyección no afectado.
La rotación continua del lugar de la inyección en un área dada puede ayudar a reducir o prevenir estas reacciones.
Reacciones alérgicas:
Reacciones alérgicas en el lugar de la inyección: Al igual que con cualquier terapia de insulina, estas reacciones incluyen enrojecimiento, dolor, prurito, urticaria, hinchazón e inflamación. En los estudios clínicos de TOUJEO® 300 U/ML en pacientes adultos, la incidencia de reacciones en el lugar de la inyección en general fue similar en los pacientes tratados con TOUJEO® 300 U/ML (2,5%) y en los pacientes tratados con Lantus® (2,8%). La mayoría de las reacciones menores a la insulina se resuelven habitualmente de unos pocos días hasta unas pocas semanas.
Alergia sistémica: Las reacciones alérgicas de tipo inmediato son raras. Tales reacciones a la insulina (incluida la insulina glargina) o a los excipientes pueden, por ejemplo, asociarse con reacciones cutáneas generalizadas, angioedema, broncoespasmo e hipotensión y choque anafiláctico y pueden constituir una amenaza a la vida.
Otras reacciones: La administración de insulina puede provocar la formación de anticuerpos antiinsulina. En estudios clínicos comparando TOUJEO® 300 U/ML y Lantus®, se observaron frecuencias semejantes de anticuerpos antiinsulina en ambos grupos de tratamiento. Al igual que con todas las insulinas, en casos raros, la presencia de tales anticuerpos antiinsulina puede hacer necesario el ajuste de la dosis de insulina para corregir la tendencia a la hiperglucemia o a la hipoglucemia (consulte la sección de Eficacia clínica/Estudios clínicos).
La insulina, en algunos casos raros, puede causar retención de sodio y edema, en particular si el control metabólico anteriormente insuficiente se mejora mediante una terapia de insulina intensificada.
Población pediátrica: La seguridad y la eficacia de TOUJEO® 300 U/ML se ha demostrado en un estudio clínico en pacientes pediátricos ≥6 años y adolescentes <18 años. La frecuencia, el tipo y la gravedad de las reacciones adversas en la población pediátrica no indican diferencias con respecto a la experiencia en la población general con diabetes (ver sección de Eficacia clínica/estudios clínicos).
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacciones: Un número de sustancias que afecta el metabolismo de la glucosa y pueden necesitar de ajuste en la dosis de insulina y, en especial, de un monitoreo estrecho.
A continuación se encuentran ejemplos de sustancias que pueden aumentar el efecto hipoglucemiante y la susceptibilidad a la hipoglucemia: Productos antihiperglucémicos, inhibidores de la ECA, salicilatos, disopiramida; fibratos; fluoxetina, inhibidores de la MAO; pentoxifilina; propoxifeno; antibióticos sulfonamidas.
A continuación se encuentran ejemplos de sustancias que pueden reducir el efecto hipoglucemiante: Corticosteroides, danazol, diazóxido, diuréticos, agentes simpaticomiméticos (como la adrenalina, salbutamol, terbutalina); glucagón; isoniazida; derivados de la fenotiazina; somatropina; hormonas tiroideas; estrógenos, progestágenos (por ejemplo, en los anticonceptivos orales), inhibidores de proteasas y medicamentos antipsicóticos atípicos (por ejemplo, olanzapina y clozapina).
Los betabloqueadores, la clonidina, las sales de litio y el alcohol pueden potenciar o bien debilitar el efecto hipoglucemiante de la insulina. La pentamidina puede causar hipoglucemia, la cual puede a veces venir seguida de hiperglucemia.
Además, bajo la influencia de medicamentos simpaticolíticos como los betabloqueadores, la clonidina, la guanetidina y la reserpina, los signos de contrarregulación adrenérgica pueden reducirse o estar ausentes.
INCOMPATIBILIDADES:
Incompatibilidades/compatibilidades: Consulte la posología.
ESTUDIOS CLÍNICOS:
Eficacia clínica/estudios clínicos: La eficacia y seguridad generales de TOUJEO® 300 U/ML una vez al día para el control glucémico se compararon con las de Lantus® una vez al día en estudios abiertos, aleatorizados, con controles activos, paralelos de hasta 26 semanas de duración, que incluyeron 546 pacientes con diabetes mellitus tipo 1 (tabla 1) y 2,474 pacientes con diabetes mellitus tipo 2 (tabla 2).
Los resultados de todos los ensayos clínicos con TOUJEO® 300 U/ML indican que las reducciones en HbA1c respecto a la línea base al final del estudio no fueron inferiores a las de Lantus®.
La proporción de pacientes que alcanzaron el valor objetivo de HbA1c (por debajo del 7%) fue semejante en ambos grupos de tratamiento.
Las reducciones en la glucosa plasmática al final del ensayo con TOUJEO® 300 U/ML fueron semejantes a las de Lantus® con una reducción más gradual durante el periodo de titulación con TOUJEO® 300 U/ML. El control glucémico fue similar cuando TOUJEO® 300 U/ML se administró una vez al día por la mañana o por la noche.
El tiempo flexible de administración (en las 3 horas antes o después del momento de inyección habitual del paciente) no tuvo ningún efecto sobre el control glucémico.
Se observó un cambio promedio en el peso corporal de menos de 1 kg al final del periodo de 6 meses en los pacientes tratados con TOUJEO® 300 U/ML.
La mejora de la HbA1c no estuvo afectada por género, etnia, edad, duración de la diabetes (< 10 años y ≥ 10 años), valor basal de HbA1c (< 8% o ≥ 8%) ni índice de masa corporal (IMC).
Diabetes tipo 1 en adultos: (Tabla 1). En un estudio abierto y controlado (estudio A), los pacientes con diabetes tipo 1 (n = 546) se aleatorizaron a tratamiento de bolo basal con TOUJEO® 300 U/ML o Lantus® y se trataron durante 26 semanas. TOUJEO® 300 U/ML y Lantus® se administraron una vez al día por la mañana (periodo comprendido entre antes del desayuno hasta antes del almuerzo) o en la noche (periodo definido desde antes de la cena hasta la hora de acostarse). Se administró un análogo de insulina de acción rápida antes de cada comida. TOUJEO® 300 U/ML tuvo una reducción similar en HbA1c como Lantus®.
Las diferencias en el momento de administración de TOUJEO® 300 U/ML (por la mañana o por la noche) no tuvieron efecto sobre la HbA1c.
Tabla 1. Resumen de los principales resultados terapéuticos del estudio clínico sobre diabetes mellitus tipo 1
|
Estudio A |
TOUJEO® 300 U/ML |
Lantus® |
|
Duración del tratamiento |
26 semanas |
|
|
Tratamiento en combinación con |
Análogo de insulina de acción rápida |
|
|
Número de sujetos tratados (IDTmª) |
273 |
273 |
|
HbA1c |
||
|
Promedio en la línea base |
8,13 |
8,12 |
|
Variación promedio ajustada respecto a la línea base |
-0,40 |
-0,44 |
|
Diferencia promedio ajustadab |
0,04 |
|
|
[Intervalo de confianza del 95%] |
[-0,098 a 0,185] |
|
|
GPAc mmol/L |
||
|
Promedio en la línea base |
10,32 |
11,06 |
|
Variación promedio ajustada respecto a la línea base |
-0,95 |
-1,14 |
|
Diferencia promedio ajustadab |
0,19 |
|
|
[Intervalo de confianza del 95%] |
[-0,536 a 0,919] |
|
|
Dosis de insulina básicad (U/kg) |
||
|
Promedio en la línea base |
0,32 |
0,32 |
|
Variación promedio respecto a la línea base |
0,15 |
0,09 |
|
Dosis de insulina totald (U/kg) |
||
|
Promedio en la línea base |
0,64 |
0,64 |
|
Variación promedio respecto a la línea base |
0,19 |
0,10 |
|
Peso corporale (kg) |
||
|
Promedio en la línea base |
81,89 |
81,80 |
|
Variación promedio respecto a la línea base |
0,46 |
1,02 |
a IDTm: población intención de tratar modificada.
b Diferencia del tratamiento TOUJEO® 300 U/ML/Lantus®.
c GPA: Glucosa plasmática en ayunas.
d Variación de la línea base al mes 6 (caso observado).
e Variación de la línea base al último valor promedio observado dentro del tratamiento en los 6 meses.
Diabetes tipo 2 en adultos:
Estudios de TOUJEO® 300 U/ML en combinación con insulina en el horario de las comidas ± fármacos antidiabéticos orales, como terapia de base: (Tabla 2):
En un estudio abierto, controlado, de 26 semanas (Estudio B, n=804), los adultos con diabetes tipo 2 se aleatorizaron a tratamiento una vez al día por la noche con TOUJEO® 300 U/ML o Lantus®. También se administraron análogos de insulina en el horario de las comidas de acción corta, con o sin metformina. TOUJEO® 300 U/ML se asoció con una reducción de la HbA1c semejante a la de Lantus®
Estudios de TOUJEO® 300 U/ML en combinación con fármacos antihiperglucémicos no insulínicos, como terapia de base: (Tabla 2).
En dos estudios abiertos controlados (n = 1,670), los adultos con diabetes mellitus tipo 2 se aleatorizaron a TOUJEO® 300 U/ML o Lantus® una vez al día durante 26 semanas como parte de un régimen de terapia combinada con agentes antihiperglucémicos no insulínicos. En el momento de la aleatorización, 808 pacientes se estaban tratando con insulina básica por más de 6 meses (Estudio C) y 862 pacientes no habían recibido nunca insulina (Estudio D). TOUJEO® 300 U/ML se asoció con una reducción de la HbA1c semejante a la de Lantus®.
Tabla 2. Resumen de los principales resultados de eficacia del estudio clínico sobre diabetes mellitus tipo 2
|
Estudio B |
Estudio C |
Estudio D |
||||
|
Duración del tratamiento |
26 semanas |
26 semanas |
26 semanas |
|||
|
Tratamiento en combinación con |
Análogo de insulina en el horario de las comidas ± metformina |
Agentes antihiperglucémicos no insulínicos |
||||
|
TOUJEO® |
Lantus® |
TOUJEO® |
Lantus® |
TOUJEO® |
Lantus® |
|
|
Número de sujetos tratados (IDTmª) |
404 |
400 |
403 |
405 |
432 |
430 |
|
HbA1c |
||||||
|
Promedio en la línea base |
8,13 |
8,14 |
8,27 |
8,22 |
8,49 |
8,58 |
|
Variación promedio ajustada respecto a la línea base |
-0,90 |
-0,87 |
-0,73 |
-0,70 |
-1,42 |
-1,46 |
|
Diferencia promedio ajustadab |
-0,03 |
-0,03 |
0,04 |
|||
|
[Intervalo de confianza del 95%] |
[-0,144 a 0,083] |
[-0,168 a 0,099] |
[-0,090 a 0,174] |
|||
|
GPAc (mmol/L) |
||||||
|
Promedio en la línea base |
8,74 |
8,90 |
8,25 |
7,90 |
9,93 |
10,21 |
|
Variación promedio ajustada respecto a la línea base |
-1,63 |
-1,68 |
-1,03 |
-1,20 |
-3,41 |
-3,80 |
|
Diferencia promedio ajustadab |
-0,05 |
-0,17 |
0,39 |
|||
|
[Intervalo de confianza del 95%] |
[-0,293 a 0,386] |
[-0,180 a 0,519] |
[0,100 a 0,676] |
|||
|
Dosis de insulina básicad (U/kg) |
||||||
|
Promedio en la línea base |
1,19 |
1,19 |
- |
- |
- |
- |
|
Variación promedio respecto a la línea base |
0,35 |
0,27 |
- |
- |
- |
- |
|
Peso corporale (kg) |
||||||
|
Promedio en la línea base |
106,11 |
106,50 |
98,73 |
98,17 |
95,14 |
95,65 |
|
Variación promedio respecto a la línea base |
0,93 |
0,90 |
0,08 |
0,66 |
0,50 |
0,71 |
a IDTm: población intención de tratar modificada.
b Diferencia del tratamiento: TOUJEO® 300 U/ML/Lantus®.
c Glucosa plasmática en ayunas.
d Variación de la línea base al mes 6 (caso observado).
e Variación de la línea base al último valor promedio observado dentro del tratamiento en los 6 meses.
Se comparó el efecto de TOUJEO® 300 U/ML sobre el riesgo de hipoglucemia con el de Lantus® en ensayos clínicos en pacientes con diabetes mellitus tipo 1 y tipo 2 (Tabla 3).
En pacientes con diabetes tipo 2, los resultados de los ensayos clínicos demostraron que la incidencia de hipoglucemia confirmada y/o grave y la hipoglucemia sintomática documentada era menor en pacientes tratados con TOUJEO® 300 U/ML en comparación con los pacientes tratados con Lantus®.
La superioridad de TOUJEO® 300 U/ML sobre Lantus® en la reducción del riesgo de hipoglucemia nocturna confirmada y/o grave se evidenció en pacientes previamente tratados con agentes antihiperglucémicos orales (23% de reducción de riesgo) o insulina a la hora de las comidas (21% de reducción de riesgo) durante el intervalo de la semana 9 al final del estudio, comparado con Lantus®.
En pacientes pretratados con insulina, así como en pacientes que no habían recibido nunca insulina, se observó reducción del riesgo de hipoglucemia y la reducción fue mayor durante las primeras 8 semanas de tratamiento (periodo de inicialización).
En general, estos efectos sobre el riesgo hipoglucémico se observaron consistentemente, con independencia de la edad, género, etnia, índice de masa corporal (IMC) y duración de la diabetes (< 10 años y ≥ 10 años), en pacientes tratados con TOUJEO® 300 U/ML en comparación con los pacientes tratados con Lantus®.
En pacientes con diabetes tipo 1, la incidencia de hipoglucemia fue similar en pacientes tratados con TOUJEO® 300 U/ML en comparación con los pacientes tratados con Lantus®. No obstante, la incidencia de hipoglucemia nocturna fue menor en pacientes tratados con TOUJEO® 300 U/ML para todas las categorías de hipoglucemia durante el periodo de inicialización en comparación con los pacientes tratados con Lantus®.
Tabla 3. Resumen de los episodios hipoglucémicos del estudio clínico en pacientes con diabetes mellitus tipo 1 y tipo 2
|
Población diabética |
Diabetes mellitus tipo 1 Anteriormente con insulina básica |
Diabetes mellitus tipo 2 Anteriormente con insulina básica |
Diabetes mellitus tipo 2 |
||||
|
Tratamiento en combinación con |
Análogo de insulina a la hora de las comidas ± agentes antihiperglucémicos orales |
Análogo de insulina a la hora de las comidas ± metformina |
Agentes antihiperglucémicos no insulínicos |
||||
|
TOUJEO® 300 U/ML |
Lantus® |
TOUJEO® 300 U/ML |
Lantus® |
TOUJEO® 300 U/ML |
Lantus® |
||
|
Incidencia (%) de hipoglucemias gravesª (n/N Total) |
|||||||
|
Todo el periodo del estudioe |
6,6 (18/274) |
9,5 (26/275) |
5,0 (20/404) |
5,7 (23/402) |
1,0 (8/838) |
1,2 (10/844) |
|
|
CR*: 0,69 [0,39; 1,23] |
CR: 0,87 [0,48; 1,55] |
CR: 0,82 [0,33; 2,00] |
|||||
|
Pacientes ≥ 65 |
0 (0/29) |
11,3 (3/26) |
6,3 (8/127) |
8,4 (10/119) |
1,0 (2/200) |
1,9 (4/213) |
|
|
No estimado |
CR: 0,74 [0,30; 1,80] |
CR: 0,64 [0,16; 2,54] |
|||||
|
Período de inicialización |
3,3 (9/274) |
5,1 (14/275) |
1,5 (6/404) |
2,7 (11/402) |
0,2 (2/838) |
0,5 (4/844) |
|
|
CR: 0,65 [0,29; 1,45] |
CR: 0,54 [0,20; 1,45] |
CR: 0,60 [0,15; 2,52] |
|||||
|
Incidencia (%) de hipoglucemia grave y/o confirmadab (n/N total) |
|||||||
|
Todo el periodo del estudio |
93,1 (255/274) |
93,5 (257/275) |
81,9 (331/404) |
87,8 (353/402) |
57,6 (483/838) |
64,5 (544/844) |
|
|
CR: 1,00 [0,95; 1,04] |
CR: 0,93 [0,88; 0,99] |
CR: 0,89 [0,83; 0,96] |
|||||
|
Pacientes ≥ 65 |
86,2 (25/29) |
92,3 (24/26) |
82,7 (105/127) |
88,2 (105/119) |
64,5 (129/200) |
71,4 (152/213) |
|
|
CR: 0,91 [0,74; 1,13] |
CR: 0,94 [0,85; 1,05] |
CR: 0,92 [0,80; 1,04] |
|||||
|
Periodo de inicialización |
88,3 (242/274) |
90,2 (248/275) |
64,4 (260/404) |
75,1 (302/402) |
35,2 (295/838) |
44,1 (372/844) |
|
|
CR: 0,98 [0,92; 1,04] |
CR: 0,86 [0,78; 0,94] |
CR: 0,80 [0,71; 0,90] |
|||||
|
Incidencia (%) de hipoglucemia nocturna grave y/o confirmadad (n/N total) |
|||||||
|
Todo el periodo del estudio |
68,6 (188/274) |
70,2 (193/275) |
44,6 (180/404) |
57,5 (231/402) |
22,9 (192/838) |
31,4 (265/844) |
|
|
CR: 0,98 [0,88; 1,09] |
CR: 0,78 [0,68; 0,89] |
CR: 0,73 [0,62; 0,85] |
|||||
|
Pacientes ≥ 65 |
62,1 (18/29) |
61,5 (16/26) |
43,3 (55/127) |
63,9 (76/119) |
24,5 (49/200) |
34,3 (73/213) |
|
|
CR: 0,99 [0,61; 1,61] |
CR: 0,68 [0,53; 0,86] |
CR: 0,72 [0,53; 0,98] |
|||||
|
Periodo de inicialización |
46,7 (128/274) |
57,1 (157/275) |
26,2 (106/404) |
33,3 (134/402) |
10,1 (85/838) |
17,1 (144/844) |
|
|
CR: 0,82 [0,70; 0,96] |
CR: 0,79 [0,64; 0,98] |
CR: 0,59 [0,46; 0,76] |
|||||
|
Incidencia (%) de hipoglucemia sintomática documentadac (n/N total) |
|||||||
|
Todo el periodo del estudio |
85,0 (233/274) |
83,6 (230/275) |
70,0 (283/404) |
77,9 (313/402) |
39,7 (333/838) |
46,2 (390/844) |
|
|
CR: 1,02 [0,95; 1,09] |
CR: 0,90 [0,83; 0,98] |
CR: 0,86 [0,77; 0,96] |
|||||
|
Periodo de inicialización |
78,1 (214/274) |
77,1 (212/275) |
49,5 (200/404) |
61,7 (248/402) |
21,2 (178/838) |
28,3 (239/844) |
|
|
CR: 1,01 [0,93; 1,11] |
CR: 0,80 [0,71; 0,91] |
CR: 0,75 [0,64; 0,89] |
|||||
a Hipoglucemia grave: episodio que necesita de la asistencia de otra persona para administrar activamente carbohidratos, glucagón u otras acciones de reanimación.
b Cualquier hipoglucemia grave o/e hipoglucemia confirmada por valor de glucosa plasmática ≤ 70 mg/dL (3,9 mmol/L).
c Cualquier evento durante el cual los síntomas típicos de la hipoglucemia estuvieron acompañados por un concentración medida de glucosa plasmática ≤ 70 mg/dL (3,9 mmol/L).
d Hipoglucemia nocturna: episodio que ocurre entre las 00:00 y las 05:59 horas.
e Periodo de tratamiento de 6 meses.
*CR: coeficiente de riesgo estimado.
Flexibilidad en el horario de administración: (Tabla 4).
También se evaluaron la seguridad y eficacia de TOUJEO® 300 U/ML administrada con un horario de administración fijo o flexible en dos estudios clínicos abiertos aleatorizados durante tres meses. Los pacientes con diabetes tipo 2 (n = 194) recibieron TOUJEO® 300 U/ML una vez al día por la noche, bien en el mismo horario cada día (horario fijo de administración) o en hasta 3 horas antes o después del horario habitual de administración (horario flexible de administración). El horario flexible de administración se usó al menos 2 días por semana. El intervalo entre dos inyecciones de TOUJEO® 300 U/ML varió entre un mínimo de 18 y un máximo de 30 horas.
En ambos estudios, la administración una vez al día de TOUJEO® 300 U/ML, tanto con el horario fijo de administración como con flexible, tuvo efectos semejantes sobre la HbA1c, la GPA y la GPAM preinyección. Además, no se observó ninguna diferencia en la incidencia de hipoglucemia en cualquier momento del día ni de la hipoglucemia nocturna al administrar TOUJEO® 300 U/ML con un horario fijo o flexible de administración.
Tabla 4. Horario flexible de administración en diabetes tipo 2
|
Tratamiento |
TOUJEO® 300 U/ML |
TOUJEO® 300 U/ML |
||
|
Tratamiento en combinación con |
Análogo de insulina a la hora de las comidas ± metformina |
Agentes antihiperglucémicos no insulínicos |
||
|
Horario de administración |
Fijo (cada 24 horas) |
Flexible (cada horas horas) ± 24 3 |
Fijo (cada 24 horas) |
Flexible (cada 24 horas ± 3 horas) |
|
Número de sujetos tratados (población (IDTmª) |
53 |
55 |
42 |
44 |
|
HbA1c (%) |
||||
|
Línea base (promedio) |
7,17 |
7,21 |
7,47 |
7,41 |
|
Variación promedio ajustada respecto a la línea base |
0,15 |
0,21 |
-0,25 |
-0,12 |
|
Diferencia promedio ajustada* |
0,05 |
0,13 |
||
|
[Intervalo de confianza del 95%] |
[-0,189 a 0,298] |
[-0,152 a 0,415] |
||
|
GPAb (mmol/L) |
||||
|
Línea base (promedio) |
6,71 |
7,33 |
7,13 |
7,08 |
|
Variación promedio ajustada respecto a la línea base |
1,17 |
1,44 |
-0,25 |
-0,46 |
|
Diferencia promedio ajustada* |
0,27 |
-0,21 |
||
|
[Intervalo de confianza del 95%] |
[-0,590 a 1,128] |
[-1,200 a 0,784] |
||
|
GPAM preinyecciónc (mmol/L) |
||||
|
Línea base (promedio) |
8,51 |
8,60 |
10,53 |
9,98 |
|
Variación promedio ajustada respecto a la línea base |
-0,45 |
-0,66 |
-1,33 |
-1,1 |
|
Diferencia promedio ajustada* |
0,39 |
0,23 |
||
|
[Intervalo de confianza del 95%] |
[-0,241 a 1,016] |
[-0,576 a 1,039] |
||
|
Incidencia (%) de cualquier hipoglucemiad (n/N total) |
||||
|
En cualquier momento del día |
66,0 (33/53) |
57,1 (32/56) |
41,9 (18/43) |
36,4 (16/44) |
|
Hipoglucemia nocturnae |
22,6 (12/53) |
26,8 (15/56) |
23,3 (10/43) |
15,9 (7/44) |
* Diferencia del tratamiento: TOUJEO® 300 U/ML con horario fijo de administración en comparación con horario flexible
a IDTm: población intención de tratar modificada.
b GPA: glucosa plasmática en ayunas.
c GPAM preinyección promedio: glucosa plasmática auto-monitoreada era la glucosa plasmática medida por los pacientes en los 30 minutos antes de la inyección de insulina básica.
d Número (%) de pacientes con al menos un evento de hipoglucemia durante el periodo de estudio de 3 meses.
e La hipoglucemia nocturna se definió como la hipoglucemia que ocurría entre las 00:00 y las 05:59 horas.
Anticuerpos: Los resultados de los estudios comparando TOUJEO® 300 U/ML y Lantus® no indicaron ninguna diferencia con respecto al desarrollo de anticuerpos contra insulina en la eficacia, seguridad o dosis de insulina básica entre los pacientes tratados con TOUJEO® 300 U/ML y los tratados con Lantus® (consulte la sección Reacciones adversas).
Ensayo ORIGIN (Estudio 4032):
El ensayo ORIGIN (en inglés: Outcome Reduction with Initial Glargine INtervention; Reducción de resultados con intervención inicial de glargina) fue un estudio internacional, multicéntrico, aleatorizado, de diseño factorial 2x2 realizado con 12,537 participantes con alteración de la glucosa en ayunas (AGA), alteración de la tolerancia a glucosa (ATG) o diabetes mellitus tipo 2 y evidencia de enfermedad CV. Los participantes se aleatorizaron para recibir Lantus® (insulina glargina 100 U/mL) (n = 6264), titulado para una GPA de 95 mg/dL (5,3 mM) o menos, o Atención Estándar (n = 6273). En la línea base, los participantes tenían un promedio de edad de 63,5 años, duración promedio de la diabetes de 5,8 años en los que tenían diabetes preexistente y mediana de HbA1c del 6,4%. La mediana de la duración del seguimiento fue de aproximadamente 6,2 años.
Al final del ensayo, el 81% de los participantes aleatorizados para recibir insulina glargina 100 U/mL aún estaba recibiendo el tratamiento.
El valor de la mediana de HbA1c durante el tratamiento varió entre el 5,9 y el 6,4% en el grupo de insulina glargina 100 U/mL y del 6,2 al 6,6% en el grupo de Atención estándar a lo largo de la duración del seguimiento. La mediana de la GPA en el grupo Lantus® se mantuvo dentro del objetivo (≤ 95 mg/dL) a lo largo del estudio tras la titulación de dosis.
Las tasas de hipoglucemia grave (participantes afectados por cada 100 participante-años de exposición) fueron de 1,05 para insulina glargina y 0,30 para el grupo de Atención estándar. En general, se notificó hipoglucemia grave para el 3,7% de estos participantes a lo largo de este estudio de 6 años (aproximadamente 0,6% por participante-año). La mediana de la variación en el peso corporal respecto a la línea base en la última visita durante el tratamiento fue 2,2 kg mayor en el grupo de insulina glargina 100 unidades/mL que en el grupo de Atención estándar.
El objetivo principal de este ensayo fue examinar el efecto de la insulina glargina 100 U/mL en dos parámetros compuestos coprincipales de eficacia. El primero era el tiempo hasta la primera ocurrencia de muerte CV, infarto miocárdico (IM) no fatal o accidente cerebrovascular no fatal y el segundo era el tiempo hasta la primera ocurrencia de cualquiera de los primeros eventos coprincipales o procedimiento de revascularización (cardiaca, carotídea o periférica) u hospitalización por insuficiencia cardiaca.
Las variables de evaluación secundaria fueron:
• Mortalidad por todas las causas.
• Parámetro compuesto microvascular.
• Desarrollo de diabetes tipo 2 en los participantes con AGA y/o ATG en la línea base.
Los resultados de los parámetros principales y secundarios, así como los resultados para cada componente de los parámetros coprincipales, se muestran en las dos tablas siguientes (Tabla 5 para el análisis tiempo hasta el evento y Tabla 6 para el análisis no tiempo hasta el evento de desarrollo de diabetes).
Tabla 5. ORIGIN: tiempo hasta el inicio de cada variable de evaluación principal y secundaria
|
*Insulina glargina 100 U/mL N = 6264 |
Atención estándar N = 6273 |
*Insulina glargina 100 U/mL* vs. Atención estándar* |
|
|
Participantes con eventos N (%) |
Participantes con eventos N (%) |
Cociente de riesgos instantáneos (IC 95%) |
|
|
Variables de evaluación principales |
|||
|
Muerte CV, infarto miocárdico (IM) no fatal o accidente cerebrovascular no fatal |
1041 (16,6) |
1013 (16,1) |
1,02 (0,94; 1,11) |
|
Muerte CV, infarto miocárdico (IM) no fatal o accidente cerebrovascular no fatal u hospitalización por insuficiencia cardiaca o procedimiento de revascularización |
1792 (28,6) |
1727 (27,5) |
1,04 (0,97; 1,11) |
|
Variables de evaluación secundarias |
|||
|
Mortalidad por todas las causas |
951 (15,2) |
965 (15,4) |
0,98 (0,90; 1,08) |
|
Parámetro compuesto microvascular* |
1323 (21,1) |
1363 (21,7) |
0,97 (0,90; 1,05) |
|
Componentes de la variable de evaluación coprincipal |
|||
|
Muerte CV |
580 (9,3) |
576 (9,2) |
1,00 (0,89; 1,13) |
|
IM (fatal o no) |
336 (5,4) |
326 (5,2) |
1,03 (0,88; 1,19) |
|
Accidente cerebrovascular (fatal o no) |
331 (5,3) |
319 (5,1) |
1,03 (0,89; 1,21) |
|
Revascularizaciones |
908 (14,5) |
860 (13,7) |
1,06 (0,96; 1,16) |
|
Hospitalización por insuficiencia cardiaca |
310 (4,9) |
343 (5,5) |
0,90 (0,77; 1,05) |
* Con componentes de: fotocoagulación por láser o vitrectomía o ceguera por retinopatía diabética; progresión de la albuminuria o duplicación de la creatinina sérica o desarrollo de necesidad de terapia de reemplazo renal.
Tabla 6. Tasa de incidencia de diabetes en la PSOG de final del estudioª:
|
Tratamiento (N) |
* Insulina glargina 100 U/mL* (6264) |
Atención estándar (6273) |
|
Número de participantes** |
737 |
719 |
|
Número de participantes que desarrollaron diabetes (%) |
182 (24,7) |
224 (31,2) |
|
Razón de momios (IC 95%) |
0,72 (0,58 a 0,91) |
965 (15,4) |
* La PSOG de final del estudio se realizó de 3 a 4 semanas tras discontinuar la insulina glargina 100 unidades/mL.
** Participantes con prediabetes (AGA o ATG) en la línea base, según una PSOG realizada entonces.
No hubo diferencias significativas entre los grupos de tratamiento en la incidencia general de cáncer (todos los grupos combinados) ni de muertes por cáncer. El tiempo hasta el primer evento de cualquier cáncer o nuevo cáncer durante el estudio fue semejante entre ambos grupos de tratamiento con cocientes de riesgos instantáneos de 0,99 (0,88; 1,11) y 0,96 (0,85; 1,09).
La participación en ORIGIN durante una mediana de aproximadamente 6,2 años mostró que el tratamiento con insulina glargina 100 U/mL no alteró el riesgo de los parámetros cardiovasculares, de mortalidad por todas las causas ni de cáncer, en comparación con la terapia hipoglucemiante estándar. Además, el control metabólico se mantuvo en un menor nivel de glucemia, con una disminución del porcentaje de participantes que desarrollaron diabetes, a expensas de un ligero incremento de la hipoglucemia y el aumento de peso.
Retinopatía diabética: Los efectos de la insulina glargina 100 U/mL sobre la retinopatía diabética se evaluaron en un largo estudio de 5 años controlado con NPH en el cual se investigó la progresión de la retinopatía mediante fotografía de fondo de ojo usando un protocolo de clasificación derivado del Estudio de Tratamiento Precoz de Retinopatía Diabética (ETDRS, siglas en inglés). El parámetro principal en este estudio fue la progresión en 3 o más grados en la escala ETDRS en el criterio de evaluación del estudio. Los resultados de este análisis se muestran en la siguiente tabla, tanto para la población por protocolo (principal) como para la Intención de Tratar (IDT), e indican la no inferioridad de la insulina glargina 100 U/mL respecto a la NPH en la progresión de la retinopatía diabética evaluada por este parámetro (Tabla 7).
Tabla 7. Número de pacientes con progresión de 3 o más grados en la escala ETDRS en el criterio de evaluación
|
Insulina glargina 100 unidades/mL (%) |
NPH (%) |
Diferenciaa,b (SE) |
IC 95% para la diferencia |
|
|
Por protocolo |
53/374 (14,2%) |
57/363 (15,7%) |
-1,98% (2,57%) |
-7,02% al 3,06% |
|
Intención de tratar |
63/502 (12,5%) |
71/487 (14,6%) |
-2,10% (2,14%) |
-6,29% al 2,09% |
a: Diferencia = insulina glargina 100 unidades/mL–NPH.
b: Usando un modelo lineal generalizado (SAS GENMOD) con tratamiento y estratos de HbA1c basal como las variables independientes clasificadas y con distribución binomial y función de enlace de identidad.
Poblaciones especiales:
Género, etnia: En ensayos clínicos controlados en adultos (n = 3096, población de seguridad), el análisis de subgrupos basados en género y etnia no indicó ninguna diferencia en eficacia y seguridad entre TOUJEO® 300 U/ML y Lantus® (consulte la sección Poblaciones especiales).
Pacientes de edad avanzada: En ensayos clínicos controlados, un total de 716 pacientes (23% de la población de seguridad) con diabetes tipo 1 y 2 tenían ≥ 65 años de edad y 97 (3%) tenían ≥ 75 años de edad. No se observó ninguna diferencia general en eficacia o seguridad entre estos pacientes y los pacientes más jóvenes. En pacientes de edad avanzada con diabetes, la posología inicial, los incrementos de dosis y la dosis de mantenimiento deben ser conservadores para evitar las reacciones hipoglucémicas. Puede ser difícil reconocer la hipoglucemia en pacientes de edad avanzada. Se recomienda un monitoreo estrecho de la glucosa y la dosis de insulina debe ajustarse para cada paciente en particular (consulte las secciones Posología y administración-Poblaciones especiales, Precauciones y Poblaciones especiales).
Insuficiencia renal: En ensayos clínicos controlados (n = 3096, población de seguridad), el análisis de subgrupos basados en condición de la función renal (categoría de tasa de filtración glomerular estimada de < 60 o ≥ 60 mL/min/1,73 m2) no indicó ninguna diferencia en eficacia y seguridad entre TOUJEO® 300 U/ML y Lantus®. Se recomienda un monitoreo estrecho de la glucosa y la dosis de insulina debe ajustarse para cada paciente en particular (consulte las secciones Posología y administración-Poblaciones especiales, Precauciones y Poblaciones especiales).
Obesidad: En ensayos clínicos, el análisis de subgrupo basado en el IMC (hasta 63 kg/m2) no mostró ninguna diferencia en eficacia y seguridad entre TOUJEO® 300 U/ML y Lantus®.
Pacientes pediátricos: La eficacia y seguridad de TOUJEO® 300 U/ML han sido evaluadas en un estudio clínico, fase 3B, controlado aleatorizado, 1:1 en pacientes ≥ 6 años y adolescentes < 18 años con diabetes mellitus tipo 1, durante un periodo de seguimiento de 26 semanas (Estudio EDITION JUNIOR). Se incluyeron 463 pacientes: 233 pacientes en el brazo de insulina glargina 300 U/mL (TOUJEO® 300 U/ML) y 230 pacientes en el brazo de insulina glargina 100U/mL (Lantus®). Durante los 6 meses del periodo del tratamiento con insulina glargina 300 U/mL e insulina glargina 100U/mL (Lantus®), los pacientes fueron titulados mediante automonitoreo de glucosa plasmática (SMPG), buscando una meta de glucosa entre 90 a 130mg/dL (5.0 a 7,2 mmol/dL). El tratamiento con insulina glargina 100 U/mL Lantus® e insulina glargina 300 U/mL fueron administrados en combinación con un análogo de insulina rápida (ejemplo: glulisina, aspart o lispro), siendo administrada y titulada a discreción del investigador de acuerdo al label del producto. Los resultados de este estudio demostraron una no inferioridad de insulina glargina 300U/mL vs. Lantus en el cambio de HbA1c desde la línea de base a la semana 26, (diferencia de media [LS] HbA1c de insulina glargina 300 U/mL vs. Lantus® 0.004% [IC 95% -0.172 a -0.179]). La superioridad de insulina glargina 300 U/mL vs. Lantus® no fue demostrada (p = 0.965), ver Tabla 8.
Durante los seis meses del estudio, la mayoría de pacientes presentaron por lo menos un episodio de hipoglucemia a cualquier hora del día. La hipoglucemia fue similar en los dos grupos (insulina glargina 300 U/mL 97,9%; Lantus® 98,2%). El porcentaje de pacientes que presento al menos un episodio de hipoglucemia nocturna, también fue similar en los dos grupos de tratamiento (insulina glargina 300 U/mL 73,0%; Lantus® 71,9%).
La tasa de hipoglucemia severa a cualquier hora del día fue reportada en 14 pacientes (6%) en el grupo de insulina glargina 300 U/mL y en 20 pacientes (8.8%) en el grupo de Lantus®, siendo numéricamente menor en el grupo de insulina glargina 300 U/mL con un RR 0.68 (IC95% 0.35 a 1,30)(Tabla 9). Durante las primeras 8 semanas de tratamiento, correspondiente al periodo inmediatamente posterior al cambio de insulina, y cubriendo la titulación inicial de insulina glargina 300 U/mL y Lantus®, las tasas de hipoglucemia paciente-año fue numéricamente menor en el grupo glargina 300 U/mL (92.06) vs. el grupo con Lantus® (100.03), con un riesgo relativo (RR) de 0.90 (IC 95%: 0.76 a 1.07).
Durante los 6 meses de tratamiento el porcentaje de pacientes con eventos adversos fue similar en ambos grupos, 65,2 y 65,8% para insulina glargina 300 U/mL y Lantus® respectivamente. La proporción de pacientes con hiperglucemia con cetosis fue numéricamente menor en el grupo de insulina glargina 300 U/mL vs. Lantus® (6,4% [15 pacientes] vs. 11,8% [27 pacientes]).
Durante el estudio EDITION JUNIOR no se evidenciaron anticuerpos antiinsulina, desde la línea de base a la semana 26, que impactaran la eficacia del medicamento. No hubo relación entre títulos mayores de anticuerpos antiinsulina (AIA) y parámetros de eficacia, al igual que no se encontraron indicadores potenciales de resistencia a la insulina.
En conclusión, el tratamiento con insulina glargina 300 U/mL en niños y adolescentes con diabetes mellitus proporciona un control glucémico efectivo que es comparable con Lantus®. La seguridad y eficacia de insulina glargina 300 U/mL en la población pediátrica, independientemente de la edad y las etapas de la pubertad, según el estadio Tanner es consistente con lo observado en pacientes adultos con DM1 y DM2.
Tabla 8. Diabetes mellitus tipo 1: Pacientes pediátricos (TOUJEO® 300 U/ML más insulina a la hora de comer vs. Lantus® más insulina a la hora de comer)
|
TOUJEO® 300 U/ML más insulinaa la hora de comerc |
Lantus más insulina a la hora de comerc |
||
|
Duración del tratamiento |
26 semanas |
||
|
Tratamiento en combinación con |
Insulina análoga de acción rápida |
||
|
Número de sujetos tratados (ITTª) |
233 |
230 |
|
|
HbA1c |
|||
|
Media basal |
8,65 |
8,61 |
|
|
Cambio medio ajustado desde el iniciod |
-0,399 |
-0,402 |
|
|
Diferencia media ajustadab |
0,014 |
||
|
[Intervalo de confianza del 95%] |
[-0,172 a -0,179] |
||
|
Glucosa en plasma en ayunas mmol/L |
|||
|
Media basal |
11,25 |
11,35 |
|
|
Cambio medio ajustado desde el iniciod |
-0,48 |
-0,52 |
|
|
Diferencia media ajustadab |
0,014 |
||
|
[intervalo de confianza del 95%] |
[-1,030 a -1,002] |
||
a. ITT: intención de tratamiento.
b. Diferencia de tratamiento: TOUJEO® 300 U/ML/Lantus®.
c. "Insulina a la hora de comer" se refiere a insulina glulisina, insulina lispro o insulina asparta.
d. El método de imputación múltiple (1000 imputaciones) se utiliza para abordar los valores faltantes en la población de ITT. La estimación combinada de las medias de mínimos cuadrados (LS) y los errores estándar (SE) se obtienen combinando las medias de LS y las SE a partir del análisis de covarianza (ANCOVA) de los diferentes conjuntos de datos imputados, utilizando las fórmulas de Rubin. Los modelos ANCOVA incluyen el efecto categórico fijo del grupo de tratamiento, el estrato de aleatorización del grupo de edad en la visita de selección (< 12 años y ≥ 12 años), así como las covariables fijas continuas del valor basal de HbA1c.
Tabla 9. Número (%) de pacientes con diabetes mellitus tipo 1, experimentando al menos un episodio de hipoglucemia severa en el estudio clínico en población pediátrica a las 26 semanas
|
TOUJEO® (N = 233) |
Lantus® (N = 228) |
|
|
Hipoglucemia severa |
14 (6%) |
20 (8,8%) |
HALLAZGOS DE LABORATORIO CLÍNICO:
Interferencias con pruebas diagnósticas y de laboratorio: No se conoce ninguna.
PRECAUCIONES Y ADVERTENCIAS:
General: La terapia de insulina por lo general necesita de habilidades adecuadas de autocontrol de la diabetes, lo que incluye el monitoreo de la glucosa, una técnica adecuada de inyección y manejo de la hipo e hiperglucemia. Los pacientes deben ser instruidos sobre estos procedimientos de autocontrol. Además, los pacientes deben ser instruidos sobre cómo manejar situaciones especiales, como la administración de una dosis inadecuada de insulina o su omisión, la administración inadvertida de una dosis aumentada de insulina, ingesta alimentaria inadecuada o la omisión de comidas. El grado en el cual el paciente se involucra en el control de su diabetes es variable y generalmente es determinado por el médico.
El tratamiento con insulina requiere una atención constante a la posibilidad de hiper o hipoglucemia. Los pacientes y sus familiares deben conocer qué pasos seguir si ocurre o se sospecha hiperglucemia o hipoglucemia y deben saber cuándo informárselo al médico.
En caso de un control insuficiente de la glucosa o de una tendencia a episodios hiper o hipoglucémicos, se deberá revisar el cumplimiento del paciente con el régimen de insulina prescrito, los lugares de inyección y las técnicas adecuadas de inyección, el manejo de los dispositivos de inyección y el resto de los factores relevantes antes de considerar el ajuste de la dosis.
Se debe enseñar a los pacientes a realizar una rotación continua del lugar de inyección para reducir el riesgo de sufrir lipodistrofia y amiloidosis cutánea localizada. Hay un posible riesgo de retraso de la absorción de insulina y empeoramiento del control de la glucemia tras las inyecciones de insulina en lugares con estas reacciones. Se ha notificado que un cambio repentino en el lugar de inyección en una zona no afectada produce hipoglucemia. Se recomienda vigilar la glucosa en sangre después de cambiar el lugar de inyección y podrá considerarse el ajuste de las medicaciones antidiabéticas.
Hipoglucemia: El momento del caso de hipoglucemia depende de los perfiles de acción de los productos de insulina usados y, por lo tanto, puede alterarse al cambiarse los regímenes de tratamiento.
Al igual que con todos los productos de insulina, debe prestarse una atención particular, y es aconsejable reforzar el monitoreo de la glucemia, en el caso de pacientes cuyas secuelas derivadas de episodios hipoglucémicos podrían ser de una relevancia clínica destacada. Un ejemplo de esto pueden ser pacientes con estenosis significativa de las arterias coronarias o de los vasos sanguíneos que riegan el cerebro (riesgo de complicaciones cardiacas o cerebrales de la hipoglucemia), así como pacientes con retinopatía proliferativa, en particular si no se tratan con fotocoagulación (riesgo de amaurosis temporal tras la hipoglucemia).
No obstante, bajo ciertas condiciones, al igual que para todos los productos de insulina, pueden cambiar los síntomas de aviso de la hipoglucemia, ser menos marcados o estar ausentes, por ejemplo:
- Si mejora notablemente el control glucémico.
- Si la hipoglucemia se está desarrollando gradualmente.
- En pacientes de edad avanzada.
- Cuando está presente una neuropatía autónoma.
- En pacientes con antecedentes de larga data de diabetes.
- En pacientes que padecen una enfermedad psiquiátrica.
- En pacientes que reciben un tratamiento concomitante con otros fármacos específicos (consulte la sección Interacciones).
Tales situaciones pueden llevar a una hipoglucemia grave (y, posiblemente, a la pérdida de la consciencia) antes de que el paciente se dé cuenta de la hipoglucemia.
El efecto prolongado de TOUJEO® 300 U/ML por vía subcutánea puede retrasar la recuperación de la hipoglucemia:
Si se observan valores normales o disminuidos de hemoglobina glicosilada, se debe considerar la posibilidad de episodios de hipoglucemia recurrentes y no reconocidos (especialmente nocturnos).
Para reducir el riesgo de hipoglucemia, son esenciales el cumplimiento del paciente con la posología y régimen dietético, la administración correcta de la insulina y la atención a los síntomas de hipoglucemia.
La presencia de factores que aumentan la susceptibilidad a la hipoglucemia necesita en particular de un monitoreo estrecho y puede necesitar de ajustes de dosis. Entre estos factores están:
- Cambio en el área de inyección.
- Aumento de la sensibilidad de insulina (por ejemplo, al eliminar factores de estrés).
- Ejercicio físico aumentado, prolongado o inusual.
- Enfermedad intercurrente (por ejemplo, vómito, diarrea).
- Ingesta alimentaria inadecuada.
- Consumo de alcohol.
- Algunas enfermedades endocrinas no compensadas.
- Tratamiento concomitante con algunos medicamentos (consulte la sección Interacciones).
En pacientes con insuficiencia renal, puede haber disminución de la necesidad de insulina debido a la reducción del metabolismo de la insulina (consulte las secciones Posología y administración- Poblaciones especiales, Eficacia clínica/Estudios clínicos y Farmacocinética- Poblaciones especiales).
En pacientes de edad avanzada, el deterioro progresivo de la función renal puede llevar a una disminución constante de la necesidad de insulina (consulte las secciones Posología y administración- Poblaciones especiales, Eficacia clínica/Estudios clínicos y Farmacocinética- Poblaciones especiales).
En pacientes con insuficiencia hepática grave, puede haber disminución de la necesidad de insulina debido a la reducción de la capacidad gluconeogénica y del metabolismo de la insulina (consulte las secciones Posología y administración- Poblaciones especiales y Farmacocinética- Poblaciones especiales).
Usualmente, la hipoglucemia puede corregirse mediante la ingesta inmediata de glucosa. Para que esta acción correctiva inicial pueda tomarse inmediatamente, los pacientes deben llevar consigo como mínimo 20 gramos de carbohidratos todo el tiempo.
Enfermedad inter-recurrente: La enfermedad inter-recurrente necesita de un monitoreo metabólico reforzado. En muchos casos, se indican las pruebas de orina para cetonas y, a menudo, es necesario ajustar la dosis de insulina. Muchas veces disminuye la necesidad de insulina. En los pacientes con diabetes tipo 1, se debe mantener el suministro de carbohidratos, incluso si los pacientes sólo pueden ingerir poca o ninguna comida o está vomitando, etc.; en los pacientes con diabetes tipo 1, nunca debe retirarse la insulina por completo.
Prevención de errores de administración: Siempre debe verificarse la etiqueta de la insulina antes de cada inyección para evitar errores de administración entre TOUJEO® 300 U/ML y otras insulinas. Se han notificado errores de administración en los cuales se han administrado accidentalmente otras insulinas, en particular insulinas de acción corta, en vez de insulinas de acción prolongada (consulte la sección Información al paciente).
Para evitar errores de posología y sobredosis potenciales, también se les debe orientar a los pacientes que nunca usen una jeringa para retirar TOUJEO® 300 U/ML de la pluma precargada SoloStar hacia una jeringa (consulte las secciones de Administración, Sobredosis e Información al paciente).
También se les debe orientar a los pacientes que no reutilicen agujas. Antes de cada inyección debe colocarse una nueva aguja estéril. La reutilización de agujas aumenta el riesgo del bloqueo de la aguja, lo que puede causar la administración de una dosis inferior o superior. En caso de agujas bloqueadas, los pacientes deben seguir las instrucciones descritas en el Paso 3 de las Instrucciones de uso de TOUJEO® 300 U/ML SoloStar (consulte las secciones Administración e Información al paciente).
Al igual que con todas las plumas de insulina, los pacientes tienen que verificar visualmente el número de unidades seleccionadas en el contador de dosis de la pluma. Los pacientes ciegos o deficientes visuales deben recibir instrucciones para obtener ayuda o asistencia de otra persona con buena visión y que haya sido entrenada en el uso del dispositivo de insulina.
Excipientes: Este medicamento contiene menos de 1 mmol (23 mg) de sodio por dosis, por lo que se considera esencialmente “exento de sodio”.
Abuso y dependencia: No es probable que ocurra riesgo de abuso o dependencia con TOUJEO® 300 U/ML
DOSIS Y VÍA DE ADMINISTRACIÓN:
Posología y administración general: La insulina glargina 300 U/mL es un producto análogo recombinante de la insulina humana de acción prolongada.
Estas unidades son exclusivamente de TOUJEO® 300 U/ML/Lantus® y no son las mismas que las Unidades Internacionales, ni las unidades utilizadas para expresar la potencia de otros análogos de insulina.
TOUJEO® 300 U/ML exhibe un perfil hipoglucemiante más prolongado y constante que Lantus®.
TOUJEO® 300 U/ML se administra por vía subcutánea.
TOUJEO® 300 U/ML se administra una vez al día, en cualquier hora del día, de preferencia siempre a la misma hora de cada día.
TOUJEO® 300 U/ML permite una mayor flexibilidad en la administración una vez por día. En caso necesario, los pacientes pueden administrarse sus inyecciones hasta 3 horas antes o después de su hora habitual de administración.
Los niveles de glucemia deseados, así como las dosis y horario de los medicamentos antihiperglucémicos deben determinarse y ajustarse individualmente.
Se podría necesitar ajuste de dosis, por ejemplo, si hubiera alteración del peso o estilo de vida del paciente, si hubiera un cambio en el horario de la dosis de insulina o si surgieran otras circunstancias que aumentasen la susceptibilidad a hipo o hiperglucemia (consulte la sección Precauciones). Toda alteración de la dosis de insulina debe realizarse cuidadosamente y exclusivamente bajo supervisión médica.
TOUJEO® 300 U/ML no es la insulina de elección para el tratamiento de la cetoacidosis diabética. El tratamiento preferido es una inyección intravenosa de insulina de acción corta.
Para todos los pacientes con diabetes se recomienda el monitoreo de la glucemia.
Inicio de TOUJEO® 300 U/ML:
Pacientes con diabetes mellitus tipo 1: TOUJEO® 300 U/ML debe usarse una vez al día con la insulina a la hora de comer y necesita de ajustes individuales de dosis.
Pacientes con diabetes mellitus tipo 2: La dosis inicial recomendada es de 0,2 U/kg una vez al día, seguida de ajustes individuales de la posología.
Cambio de LANTUS (insulina glargina 100 U/mL) u otras insulinas básicas a TOUJEO® 300 U/ML: Al cambiar de un régimen de tratamiento con un producto de insulina de acción intermedia u otro de acción prolongada a un régimen con TOUJEO® 300 U/ML, será necesario ajustar la cantidad y horario del producto análogo de insulina de acción corta o rápida o de la dosis de cualquier fármaco antihiperglucémico.
- El cambio de productos de insulina básica una vez al día a TOUJEO® 300 U/ML una vez al día puede hacerse unidad por unidad con base en la dosis anterior de insulina básica.
- Al realizarse el cambio de productos de insulina básica dos veces al día a TOUJEO® 300 U/ML una vez al día, la dosis inicial recomendada de TOUJEO® 300 U/ML es del 80% de la dosis diaria total de la insulina básica que se está abandonando.
Se recomienda un programa de monitoreo metabólico estrecho bajo supervisión médica durante el cambio y en las semanas iniciales subsiguientes. Al igual que para todos los análogos de insulina, esto es particularmente cierto para pacientes que necesiten elevadas dosis de insulina debido a anticuerpos antiinsulina humana, los cuales pueden presentar una mejora destacable de la respuesta a insulina al utilizar insulina glargina.
Al mejorar el control metabólico y, como resultado, aumentar la sensibilidad a insulina (disminución de las necesidades de insulina) pueden necesitarse ajustes posteriores de las dosis de TOUJEO® 300 U/ML y otros productos de insulina o fármacos antihiperglucémicos no insulínicos en el régimen de tratamiento 35.
Cambio de TOUJEO® 300 U/ML a insulinas básicas 100 U/mL:
Se recomienda supervisión médica con un programa de monitoreo estrecho durante el cambio y en las semanas iniciales subsiguientes.
Consulte la información de prescripción del producto al cual el paciente se está cambiando.
Mezcla, dilución: TOUJEO® 300 U/ML no debe mezclarse con ningún otro producto de insulina. La mezcla altera el perfil de acción/tiempo de TOUJEO® 300 U/ML y provoca precipitación.
TOUJEO® 300 U/ML no debe diluirse. La dilución altera el perfil de acción/tiempo de TOUJEO® 300 U/ML.
Poblaciones especiales:
Niños: TOUJEO® 300 U/ML se puede utilizar en pacientes pediátricos a partir de los 6 años. Al cambiar de insulina basal a TOUJEO® 300 U/ML, la reducción de la dosis de insulina basal y en bolo debe considerarse de forma individual, para minimizar el riesgo de hipoglucemia.
La seguridad y eficacia de TOUJEO® 300 U/ML no se han establecido en pacientes pediátricos (menores de 6 años de edad) (consulte la sección Farmacocinética- Poblaciones especiales).
Personas de edad avanzada: TOUJEO® 300 U/ML puede usarse en pacientes de edad avanzada. Se recomienda un monitoreo estrecho de la glucosa y la dosis de insulina debe ajustarse de manera individual.
En pacientes de edad avanzada, el deterioro progresivo de la función renal puede llevar a una disminución constante de la necesidad de insulina (consulte las secciones Precauciones, Eficacia clínica- Estudios clínicos y Poblaciones especiales).
Insuficiencia renal: TOUJEO® 300 U/ML puede usarse en pacientes con insuficiencia renal. Se recomienda un monitoreo estrecho de la glucosa y la dosis de insulina debe ajustarse de manera individual.
En pacientes con insuficiencia renal, puede haber disminución de la necesidad de insulina debido a la reducción del metabolismo de la insulina (consulte las secciones Precauciones, Eficacia Clínica- Estudios Clínicos y Poblaciones Especiales).
Insuficiencia hepática: TOUJEO® 300 U/ML puede usarse en pacientes con insuficiencia hepática. Se recomienda un monitoreo estrecho de la glucosa y la dosis de insulina debe ajustarse de manera individual.
En pacientes con insuficiencia hepática, puede haber disminución de la necesidad de insulina debido a la reducción de la capacidad gluconeogénica y del metabolismo de la insulina (consulte las secciones Precauciones, Eficacia clínica- Estudios clínicos y Poblaciones especiales).
Administración: TOUJEO® 300 U/ML se administra mediante una inyección en el tejido subcutáneo.
Al igual que con todas las insulinas, los lugares de inyección en un área de inyección (abdomen, muslo o deltoides) deben rotarse de una inyección a la siguiente, para reducir el riesgo de lipodistrofia y amiloidosis cutánea localizada, no inyectar en áreas de lipodistrofia o amiloidosis cutánea localizada.
TOUJEO® 300 U/ML no se destina a la administración por vía intravenosa.
La duración prolongada de la actividad de la insulina glargina depende de su inyección en el tejido subcutáneo. La administración intravenosa de la dosis habitual subcutánea podría llevar a una hipoglucemia grave.
TOUJEO® 300 U/ML no se destina a la administración mediante una bomba de infusión de insulina.
TOUJEO® 300 U/ML es una solución transparente, no una suspensión. Por lo tanto, no necesita de resuspensión antes del uso.
Con la pluma precargada TOUJEO® 300 U/ML SoloStar, se puede inyectar una dosis de 1 a 80 unidades por inyección, con pasos de 1 unidad.
- El contador de dosis muestra el número de unidades de TOUJEO® 300 U/ML que se inyectarán. La pluma precargada TOUJEO® 300 U/ML SoloStar se ha diseñado específicamente para TOUJEO® 300 U/ML, por lo tanto, no es necesario recalcular la dosis (consulte la sección de Información al paciente).
- TOUJEO® 300 U/ML nunca debe extraerse del cartucho de la pluma precargada hacia una jeringa (consulte las secciones Precauciones e Información al Paciente).
- Los pacientes también deben ser orientados a no reutilizar las agujas. Se debe colocar una nueva aguja estéril antes de cada inyección. La reutilización de agujas aumenta el riesgo de bloqueo de la aguja, lo que puede provocar la administración de una dosis inferior o superior. El uso de una nueva aguja estéril para cada inyección también minimiza el riesgo de contaminación e infección (consulte las secciones Precauciones e Información al paciente).
MODO DE EMPLEO:
Preparación y manipulación: Inspeccione TOUJEO® 300 U/ML antes de usarla. TOUJEO® 300 U/ML sólo debe usarse si la solución está transparente, incolora, sin partículas sólidas visibles y si presenta consistencia acuosa.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Sobredosis: Un exceso de insulina, en comparación con la ingesta alimentaria, el gasto de energía o ambos, puede llevar a hipoglucemia grave y algunas veces prolongada y que pone en riesgo la vida.
Tratamiento: Los episodios leves de hipoglucemia por lo general pueden tratarse con carbohidratos orales. Puede ser necesario ajustar la posología del fármaco, los patrones alimenticios o el ejercicio.
Los episodios más graves que terminen en coma, convulsiones o trastornos neurológicos pueden tratarse con glucagón intramuscular o subcutáneo o glucosa concentrada intravenosa. Puede ser necesaria observación e ingesta sostenida de carbohidratos, debido a que la hipoglucemia puede reaparecer tras una recuperación clínica aparente.
Toxicidad aguda: La toxicidad aguda de la administración intravenosa y subcutánea de insulina glargina se estudió en ratones y ratas. La DL50 en cada especie estaba en el rango de ≥1000 UI/kg.
Toxicidad crónica: En estudios de toxicidad, dosis subcutáneas repetidas de insulina glargina en ratones, ratas y perros, sólo se observaron los efectos farmacodinámicos esperados.
PRESENTACIONES:
Solución para inyección en lapicera/pluma dosificadora prellenada (con cartucho con 1,5 mL) descartable.
1 lapicera/pluma × 450 unidades/1,5 mL.
3 lapiceras/plumas × 450 unidades /1,5 mL.
5 lapiceras/plumas × 450 unidades /1,5 mL.
No todas las presentaciones están disponibles en todos los países.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Condiciones de almacenamiento y vida útil:
Lapicera/Pluma precargada cerrada/no usada: TOUJEO® 300 U/ML debe almacenarse entre 2 °C (36 °F) y 8 °C (46 °F) (en un refrigerador) y protegido de la luz. No permita que la insulina se congele; deséchela si se congela.
No coloque TOUJEO® 300 U/ML cerca del congelador, ni de un paquete congelado.
Abierta/en uso: No permita que la insulina se congele; deséchela si se congela.
La pluma precargada abierta debe desecharse tras 42 días (6 semanas) desde su primer uso. La pluma precargada abierta de TOUJEO® 300 U/ML debe mantenerse alejada de la luz y el calor directos, a temperatura ambiente (no mayor a 30 °C [86 °F]).
Estas condiciones de almacenamiento se resumen en la siguiente tabla:
|
No en uso (cerrada) Refrigerada |
En uso (abierta) (consulte la temperatura abajo) |
|
|
Pluma precargada |
Hasta la fecha de expiración |
42 días (6 semanas) Sólo a temperatura ambiente (no refrigere) |
LEYENDAS DE PROTECCIÓN:
Mantener en su envase original, no debe utilizarse después de la fecha de caducidad indicada en el envase. Mantener todos los medicamentos fuera del alcance de los niños.
Fabricado en Alemania por:
Sanofi-Aventis Deutschland GmbH:
Industriepark Höchst, Brüningstraße 50
D-65926 Frankfurt am Main, Alemania
IMP./DISTR.:
SANOFI-AVENTIS DE COLOMBIA S.A.,
Bogotá
Venta bajo fórmula médica
Reg. San. INVIMA 2015M-0016708
Revisión local: 15/julio/2021
REFERENCIA:
CCDS V4_17.12.2018.
CCDS V5_LRC_10Sep2020_Revisión diciembre 2020
Acta 24 de 2020, 3.6.11.
Disponible en: https://www.ema.europa.eu/en/documents/product-information/TOUJEO® 300 U/ML-epar-product-information_en.pdf