
XELJANZ
TOFACITINIB
Tabletas
Caja , Blíster , 56 Tabletas
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada TABLETA Recubierta de 5 mg contiene 8,078 mg de citrato de tofacitinib equivalente a 5 mg de la base libre de tofacitinib.
El citrato de Tofacitinib (CP-690,550-10) tiene un peso molecular de 504,5 Daltons, o 312,4 Daltons, para la base libre de tofacitinib (CP 690,550). La fórmula molecular del citrato de tofacitinib es C16H20N6O•C6H8O7 y su estructura química se proporciona a continuación:
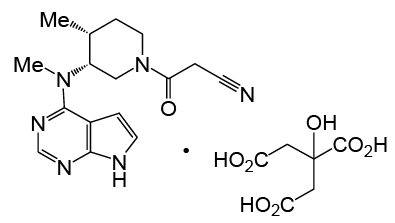
Excipientes con efecto conocido: Cada TABLETA de 5 mg contiene también 62,567 mg de lactosa monohidratada.
Para la lista completa de excipientes, ver Precauciones especiales de eliminación y otras formas de manipulación.
INDICACIONES TERAPÉUTICAS: XELJANZ® (tofacitinib) está indicado para el tratamiento de pacientes adultos con artritis reumatoide moderada a severamente activa que han presentado respuesta inadecuada a uno o más fármacos antirreumáticos modificadores de la enfermedad (DMARDs).
DATOS FARMACÉUTICOS
Incompatibilidades: No aplica.
Vida útil: 24 meses.
Precauciones especiales de almacenamiento: Este medicamento no requiere ninguna condición especial de almacenamiento con respecto a la temperatura o la exposición a la luz. Almacenar en el envase original.
Naturaleza y contenido del envase: Frascos de HDPE con desecante y tapas a prueba de niños.
Blísteres de papel aluminio/papel aluminio.
No todos los tamaños de empaque se pueden comercializar.
Precauciones especiales de eliminación y otras de manipulación: Ningún requisito especial.
Es posible que la información de prescripción de este producto haya sido revisada y actualizada después de la fecha de impresión del PLM 2016. Para obtener información más actualizada comuníquese con la Dirección Médica de Pfizer S.A.S Teléfono: (1) 6002300 Ext. 2509 Bogotá – Colombia.
FORMA FARMACÉUTICA: Tableta recubierta de liberación inmediata redonda blanca (tableta de 5 mg).
PROPIEDADES FARMACOLÓGICAS
Propiedades farmacodinámicas
Mecanismo de acción: Tofacitinib es un inhibidor potente y selectivo de la familia de quinasas JAK con un alto grado de selectividad con relación a otras quinasas del genoma humano. En los ensayos de quinasas, tofacitinib, inhibe JAK1, JAK2, JAK3, y en menor grado TyK2. En entornos celulares en los que las quinasas JAK señalizan en parejas, tofacitinib preferencialmente inhibe la señalización mediante receptores heterodiméricos asociados con JAK3 y/o JAK1 con selectividad funcional sobre los receptores que señalizan vía pares de JAK2. La inhibición de JAK1 y JAK3 mediante tofacitinib bloquea la señalización a través de receptores comunes que contienen cadenas gamma para varias citocinas, incluidas IL-2, -4,-7,-9, -15, y -21. Estas citocinas son integrales para la activación linfocítica, la proliferación y la función e inhibición de su señalización puede producir modulación de múltiples aspectos de la respuesta inmunitaria. Además, la inhibición de JAK1 producirá la atenuación de la señalización mediante la adición de citocinas proinflamatorias, tales como IL-6 e interferones Tipo I. A exposiciones mayores, podría presentarse inhibición de la señalización de eritropoyetina a través de la inhibición de la señalización de JAK2.
Efecto farmacodinámico: El tratamiento con XELJANZ® se asoció con reducciones dependientes de la dosis de linfocitos citolíticos naturales CD16/56+, con reducciones máximas estimadas a las aproximadamente 8-10 semanas después del inicio del tratamiento. Estos cambios generalmente se resuelven dentro de las 2-6 semanas después de la interrupción del tratamiento. El tratamiento con XELJANZ® estuvo asociado con aumentos dependientes de la dosis en los recuentos de células B. Los cambios en los recuentos de linfocitos T circulantes y los subconjuntos de linfocitos T (CD3+, CD4+ y CD8+) fueron pequeños e inconsistentes. Se desconoce la significancia clínica de estos cambios.
Los cambios en las concentraciones séricas totales de IgG, IgM, e IgA durante la administración de 6 meses en pacientes con artritis reumatoide fueron pequeños, no fueron dependientes de la dosis y fueron similares a los observados con placebo.
Después del tratamiento con XELJANZ® en pacientes con artritis reumatoide, se observaron disminuciones rápidas en la proteína C reactiva (PCR) sérica y se mantuvieron durante toda la administración. Los cambios en la PCR observados con el tratamiento con XELJANZ® no retrocedieron completamente dentro de las 2 semanas después de la interrupción indicando una duración prolongada de la actividad farmacodinámica en comparación con la semivida.
Eficacia clínica: La eficacia y la seguridad de XELJANZ® se evaluaron en cinco estudios multicéntricos, doble enmascarados, aleatorizados controlados con placebo en pacientes >18 años de edad con artritis reumatoide activa diagnosticados de acuerdo con los criterios del Colegio Americano de Reumatología (ACR por sus siglas en inglés). Los pacientes presentaron al menos 6 articulaciones sensibles a la palpación y 6 inflamadas al seleccionarlos aleatoriamente (4 articulaciones inflamadas y sensibles a la palpación para el estudio II). XELJANZ®, 5 o 10 mg dos veces al día, fue administrado como monoterapia (Estudio I) y combinado con DMARDs (Estudio II) en pacientes con una respuesta inadecuada a dichos medicamentos y combinado con MTX en pacientes con respuesta inadecuada a MTX (Estudio III y Estudio IV) o eficacia inadecuada o falta de tolerancia a al menos uno de los biológicos inhibidores del TNF aprobado (Estudio V).
El Estudio I fue un estudio de monoterapia de 6 meses en el que 610 pacientes con artritis reumatoide activa moderada a severa que presentaban una respuesta inadecuada a un DMARDS (no biológico o biológico) recibieron XELJANZ® 5 o 10 mg dos veces al día o placebo. En la visita del Mes 3, todos los pacientes asignados aleatoriamente al tratamiento con placebo avanzaron en una forma enmascarada a un segundo tratamiento preestablecido de XELJANZ 5 o 10 mg dos veces al día. Los criterios de valoración principal en el Mes 3 fueron la proporción de pacientes que obtuvieron una respuesta ACR20, cambios en el Cuestionario de Evaluación de la Salud - Índice de Discapacidad (CES-ID) y calificaciones del Puntaje de Actividad de la Enfermedad DAS28-4(ESR), <2,6.
El Estudio II fue un estudio de 12 meses con 792 pacientes con artritis reumatoide activa moderada a severa, que presentaron una respuesta inadecuada a un DMARDs no biológico y recibieron XELJANZ® 5 o 10 mg dos veces al día o placebo adicional al tratamiento con un DMARDs (excluidos tratamientos inmunosupresores potentes tales como azatriopina o ciclosporina). En la visita del Mes 3, los pacientes que no respondían al tratamiento, asignados aleatoriamente a placebo fueron avanzados en una forma enmascarada a un segundo tratamiento preestablecido con XELJANZ® 5 a 10 mg dos veces al día. Al final del Mes 6, todos los pacientes fueron avanzados a su segundo tratamiento preestablecido en una forma enmascarada. Los criterios de valoración principal fueron la proporción de pacientes que obtuvieron una respuesta ACR20 en el Mes 6, cambios en el CES-ID en el mes 3 y calificaciones DAS28-4(ESR) <2,6 en el Mes 6.
El Estudio III fue un estudio de 12 meses con 717 pacientes con artritis reumatoide activa moderada a severa que presentaron una respuesta inadecuada a MTX. Los pacientes recibieron XELJANZ® 5 o 10 mg dos veces al día, adalimumab 40 mg vía subcutánea una semana por medio o placebo adicionales a MTX. Los pacientes con placebo se avanzaron como en el Estudio II. Los criterios de valoración principal fueron la proporción de pacientes que obtuvieron una respuesta ACR20 en el Mes 6, CES-ID en el Mes 3 y DAS28-4(ESR) <2,6 en el Mes 6.
El Estudio IV es un estudio de 2 años en curso con un análisis planeado al año en el que 797 pacientes con artritis reumatoide activa moderada a severa que presentaban respuesta inadecuada a MTX recibieron XELJANZ® 5 o 10 mg dos veces al día o placebo adicionados a MTX. Los pacientes con placebo fueron avanzados como en el Estudio II. Los criterios de valoración principales fueron la proporción de pacientes que obtuvieron respuesta ACR20 en el Mes 6, el cambio medio desde el inicio del estudio en el Puntaje Sharp total modificado por van der Heijde Score (mTSS) en el Mes 6, CES-ID en el mes 3 y DAS28-4(ESR) <2,6 en el Mes 6.
El Estudio V fue un estudio de 6 meses en el que 399 pacientes con artritis reumatoide activa moderada a severa que presentaron respuesta inadecuada a al menos un biológico inhibidor del TNF aprobado recibieron XELJANZ® 5 o 10 mg dos veces al día o placebo adicionado a MTX. En la visita al Mes 3, todos los pacientes asignados aleatoriamente al tratamiento con placebo se avanzaron de forma enmascarada a un segundo tratamiento preestablecido de XELJANZ® 5 ó 10 mg dos veces al día. Los criterios de valoración principal en el Mes 3 fueron la proporción de pacientes que obtuvieron una respuesta ACR20, CES-ID, y DAS28-4(ESR) <2,6.
Respuesta clínica: Los porcentajes de pacientes tratados con XELJANZ® alcanzaron respuestas ACR20, ACR50 y ACR70 en los Estudios I, IV y V mostrados en la Tabla 5. En todos los estudios, los pacientes tratados con XELJANZ® 5 o 10 mg dos veces al día presentaron tasas de respuestas ACR20, ACR50 y ACR70 estadísticamente significativas en los Meses 3 y 6 versus los pacientes tratados con placebo.
En los Estudios I, II y V la mejora en las tasas de respuesta ACR20 versus placebo se observó dentro de las 2 semanas. En los Estudios II, III y IV, las tasas de respuestas ACR se mantuvieron a los 12 meses en los pacientes tratados con XELJANZ®. La respuesta ACR se mantuvo durante los 3 años en los estudios de extensión de etiqueta abierta en curso.
Durante las partes controladas de 3 meses (Estudios I y V) y 6 meses (Estudios II, III, y IV), de los estudios, los pacientes tratados con XELJANZ® a dosis de 10 mg dos veces al día generalmente presentaron tasas de respuestas mayores en comparación con los pacientes tratados con XELJANZ® 5 mg dos veces al día. En el Estudio III, los criterios de valoración principales fueron la proporción de pacientes que alcanzaron una respuesta ACR20 en el mes 6; el cambio en CES-ID en el Mes 3 y DAS28-4(ESR) <2,6 en el Mes 6. Los datos de estos criterios de valoración principal fueron 51,5, 52,6, 47,2 y 28,3%; -0,55, -0,61, -0,49 y -0,24; y 6,2%, 12,5%, 6,7% y 1,1% para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, adalimumab 40 mg vía subcutánea una semana por medio y el grupo de placebo, respectivamente. Para un criterio de valoración secundario preestablecido, las tasas de respuesta ACR70 en el mes 6 para los grupos de XELJANZ® 5 mg dos veces al día y 10 mg dos veces al día, fueron significativamente mayores que para adalimumab (19,9%, 21,9% y 9,1%, respectivamente).
El efecto del tratamiento fue similar en los pacientes independientemente del estado del factor reumatoide, la edad, el sexo, la raza, el número de tratamiento previos o la condición de la enfermedad. El tiempo hasta el inicio fue rápido (antes de la Semana 2 en los Estudios I, II y V) y la magnitud de la respuesta continuó mejorando con la duración del tratamiento. Como ocurrió con la respuesta ACR general en los pacientes tratados con XELJANZ® 5 mg o 10 mg dos veces al día, cada uno de los componentes de la respuesta ACR mejoró consistentemente desde el inicio del estudio incluidos: recuentos de articulaciones sensibles a la palpación e inflamadas; la evaluación global de los pacientes y el médico; los puntajes del índice de discapacidad; la evaluación del dolor y la PCR comparada con los pacientes que estaban recibiendo placebo más MTX u otro DMARDs en todos los estudios.
Los pacientes en los estudios de Fase 3 presentaron un Puntaje de Actividad de la Enfermedad (DAS28-4(ESR)) de 6,1–6,7 al inicio del estudio. Las reducciones significativas en el DAS28-4(ESR) desde el inicio del estudio (mejoría media) de 1,8–2,0 y 1,9-2,2 fueron observados en pacientes tratados con XELJANZ® 5 mg y 10 mg, respectivamente, comparados con los pacientes tratados con placebo (0,7–1,1) a los 3 Meses. La proporción de pacientes que alcanzaron una remisión clínica DAS28 (DAS28-4(ESR) <2,6) en los Estudios II, III y IV fueron significativamente mayores en los pacientes que estaban recibiendo XELJANZ® 5 mg o 10 mg (6–9% y 13–16%, respectivamente) comparados con 1–3% de pacientes con placebo a los 6 Meses. En el Estudio III, porcentajes similares de pacientes que alcanzaron DAS28-4(ESR) <2,6 fueron observados para adalimumab y XELJANZ® 5 mg dos veces al día y 10 mg dos veces al día en el Mes 6.
En un análisis combinado de los estudios de fase 3, la dosis 10 mg dos veces al día proporcionó mayor beneficio que la dosis de 5 mg dos veces al día en múltiples mediciones de signos y síntomas: mejoras desde el inicio del estudio (tasas de respuestas ACR20, ACR50 y ACR70), y la obtención de un estado de actividad de enfermedad objetivo (ya sea DAS28-4(ESR) <2,6 o < o igual a 3,2). Se observaron mayores beneficios de 10 mg versus 5 mg en los criterios de valoración más rigurosos (es decir las tasas de respuesta ACR70 y DAS28-4(ESR) <2,6).
|
Tabla 5. |
|||||||||
|
Porcentajes de Pacientes |
|||||||||
|
Monoterapia en Pacientes que Presentaron Respuesta Inadecuada a DMARDs No Biológicos o Biológicos |
Pacientes que Presentaron Respuesta inadecuada a MTX |
Pacientes que Presentaron Respuesta Inadecuada a Inhibidores del TNF |
|||||||
|
Estudio I |
Estudio IV |
Estudio V |
|||||||
|
Tasas de Rta. |
Placebo |
XELJANZ 5 mg dos veces al día N=241 |
XELJANZ 10 mg |
Placebo + MTX |
XELJANZ 5 mg dos veces al día + MTX |
XELJANZ |
Placebo |
XELJANZ 5 mg dos |
XELJANZ |
|
ACR20 |
|||||||||
|
Mes 3 Mes 6 Mes 12 |
27% NA NA |
60% 69% NA |
66% 71% NA |
27% 25% NA |
56% 51% 49% |
66% 62% 57% |
24% NA NA |
42% 52% NA |
48% 55% NA |
|
ACR50 |
|||||||||
|
Mes 3 Mes 6 Mes 12 |
13% NA NA |
31% 42% NA |
37% 47% NA |
8% 8% NA |
29% 32% 33% |
36% 44% 41% |
8% NA NA |
27% 37% NA |
28% 30% NA |
|
ACR70 |
|||||||||
|
Mes 3 Mes 6 Mes 12 |
6% NA NA |
15% 22% NA |
20% 29% NA |
3% 1% NA |
11% 15 % 19% |
17% 22% 28% |
2% NA NA |
14% 16% NA |
11% 16% NA |
Los resultados de los componentes de los criterios de respuesta ACR para los Estudios IV y V se presentan en la Tabla 6. Resultados similares fueron observados en los Estudios I, II y III.
|
Tabla 6. |
||||||||||||
|
Componente (media) |
Estudio IV |
Estudio V |
||||||||||
|
XELJANZ® 5 mg dos veces al día + MTX |
XELJANZ® |
Placebo + MTX |
XELJANZ® |
XELJANZ® |
Placebo + MTX |
|||||||
|
Inicio |
Mes |
Inicio |
Mes |
Inicio |
Mes |
Inicio |
Mes |
Inicio |
Mes |
Inicio |
Mes |
|
|
Número de articulaciones sensibles a la palpación (0-68) |
24 |
13 |
23 |
10 |
23 |
18 |
28 |
16 |
28 |
13 |
28 |
21 |
|
Número de articulaciones inflamadas (0-66) |
14 |
6 |
14 |
6 |
14 |
10 |
16 |
8 |
17 |
7 |
17 |
12 |
|
Dolora |
58 |
35 |
58 |
29 |
55 |
47 |
66 |
39 |
60 |
38 |
61 |
53 |
|
Evaluación global del pacientea |
58 |
35 |
57 |
29 |
54 |
47 |
65 |
41,2 |
59 |
37,2 |
62 |
53 |
|
Índice de discapacidad (CES-ID)b |
1,41 |
1,00 |
1,39 |
0,84 |
1,31 |
1,19 |
1,60 |
1,20 |
1,50 |
1,10 |
1,63 |
1,44 |
|
Evaluación global del Médicob |
59 |
30 |
58 |
25 |
56 |
43 |
65 |
35 |
59 |
31 |
64 |
44 |
|
PCR (mg/L) |
15,5 |
6,9 |
17,0 |
4,4 |
13,7 |
14,6 |
19,3 |
6,2 |
15,7 |
4,8 |
16,7 |
18,2 |
|
a Escala visual analógica: 0 = lo mejor, 100 = lo peor b Cuestionario de Evaluación de la Salud – Índice de Discapacidad: 0 = el mejor, 3 = el peor; 20 preguntas; categorías: vestirse y arreglarse, levantarse, alimentarse, caminar, higiene, alcanzar, agarrar y actividades |
||||||||||||
El porcentaje de pacientes que respondieron con ACR20 en la visita para el Estudio IV se presenta en la Figura 1. Se observaron respuestas similares en los Estudios I, II, III y V.
Figura 1. Porcentaje de Pacientes que Respondieron con ACR20 por Visita para el Estudio IV
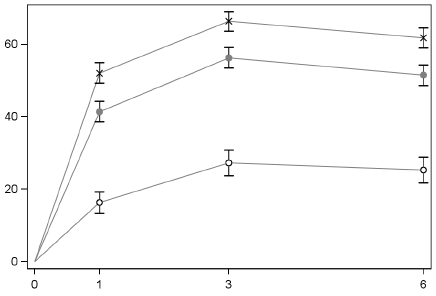
• XELJANZ 5 mg BID x XELJANZ 10 mg BID o
Se utilizó la imputación de no respondedores. Los pacientes que se retiraron del estudio fueron contados como fallas, puesto que fueron pacientes que no obtuvieron al menos 20% de mejoría en el recuento de las articulaciones.
Respuesta radiográfica: En el Estudio IV, el daño articular estructural se evaluó radiológicamente y se expresó como cambio en el puntaje mTSS y sus componentes, el puntaje de erosión y el puntaje de estrechamiento del espacio articular (EEA). Los resultados desde el inicio del estudio hasta el Mes 6 se presentan en el Tabla 7.
XELJANZ® 10 mg dos veces al día, inhibió el progreso del daño estructural en comparación con placebo más MTX a los 6 y 12 meses. Cuando se administra a dosis de 5 mg dos veces al día, XELJANZ® presenta efectos similares sobre el progreso medio del daño estructural a los 6 y 12 meses (estadísticamente no significativo). La proporción de pacientes sin ningún progreso radiográfico (definido como ?0,5 unidades de aumento desde el inicio del estudio en mTSS) en los Meses 6 y 12 fue significativamente mayor en los grupos de XELJANZ® 5 mg y 10 mg dos veces al día comparados con placebo.
|
Tabla 7. |
|||
|
Mes 6* |
Placebo + MTX |
XELJANZ® 5 mg dos veces al día + MTX |
XELJANZ® 10 mg dos veces al día + MTX |
|
Puntaje Total Sharp Media (EE) |
0,47 |
0,12 |
0,06 |
|
(0,16) |
(0,12) |
(0,11) |
|
|
Diferencia Media** (IC 95% ) |
-0,34 |
-0,40 |
|
|
(-0.73, 0,04) |
(-0,79, -0,02) |
||
|
Puntaje de Erosión, |
0,15 |
0,06 |
0,02 |
|
(0,08) |
(0,05) |
(0,05) |
|
|
Diferencia Media ** |
-0,09 |
-0,13 |
|
|
(-0.27, 0.09) |
(-0.31, 0.05) |
||
|
Puntaje de EEA |
0,31 |
0,06 |
0,04 |
|
(0,13) |
(0,09) |
(0,09) |
|
|
Diferencia Media ** |
-0,26 |
-0,28 |
|
|
(-0,57, 0,05) |
(-0,58, 0,03) |
||
|
Ningún Progreso radiológico (%)*** |
77,7 |
88,8 |
86,9 |
|
Diferencia Porcentual** |
11,11 |
9,19 |
|
|
(3,25, 18,96) |
(1,26, 17,13) |
||
|
* El análisis para el mes 6 utiliza extrapolación lineal después del avance hasta el tratamiento activo, el retiro o la pérdida del seguimiento |
|||
Respuestas de la función física y criterios de valoración relacionados con la salud: La mejora en la función física se midió mediante el CES-ID. Los pacientes que estaban recibiendo XELJANZ® 5 o 10 mg dos veces al día, demostraron mejoría significativamente mayor desde el inicio del estudio en la función física en comparación con placebo en el Mes 3 (Estudios I, II, III y V) y en el 6 (Estudios II y III). Los pacientes tratados con XELJANZ® 5 o 10 mg dos veces al día presentaron significativamente mayor mejoría en la función física en comparación con los pacientes tratados con placebo desde la Semana 2 en los Estudios I y II. En el Estudio III, las mejorías en el CES-ID medias se mantuvieron hasta los 12 meses en los pacientes tratados con XELJANZ®. Las mejorías medias de CES-ID se han mantenido durante los 36 meses en los estudios de extensión abiertos en curso. Comparados con los pacientes tratados con Adalimumab, en el Mes 3, los pacientes en el grupo de tofacitinib 5 mg dos veces al día presentaron disminuciones similares desde el inicio del estudio en los valores de CES-ID y los pacientes en el grupo de 10 mg dos veces al día presentaron disminuciones significativamente mayores en el CES-ID.
La calidad de vida relacionada con la salud se evaluó mediante la Encuesta del Estado de Salud Short Form (SF-36) en todos los 5 estudios. En estos estudios los pacientes que estaban recibiendo XELJANZ® 10 mg dos veces al día demostraron mejoría significativamente mayor desde el inicio del estudio en comparación con placebo en todos los 8 dominios de SF-36 así como en el Resumen del Componente Físico (PCS) y el Resumen del Componente Mental (MCS) en el Mes 3. Ambos grupos tratados con XELJANZ® presentaron mejorías significativamente mayores desde el inicio del estudio en comparación con placebo en todos los 8 dominios así como todos los PCS y MCS en el Mes 3 en los Estudios I, IV y V. En los Estudios III y IV, las mejorías medias de SF-36 se mantuvieron hasta los 12 meses en los pacientes tratados con XELJANZ®.
El aumento de la fatiga se evaluó utilizando la escala de Evaluación Funcional del Tratamiento de Enfermedades Crónicas-Fatiga (FACIT-F) en el Mes 3 en todos los estudios. Los pacientes que estaban recibiendo XELJANZ® 5 o 10 mg dos veces al día demostraron mejoría significativamente mayor desde el inicio del estudio en la fatiga en comparación con placebo en todos los 5 estudios. En los Estudios III y IV, los aumentos medios en FACIT-F se mantuvieron hasta los 12 meses en los pacientes tratados con XELJANZ®.
La mejoría en el sueño se evaluó utilizando las escalas resumidas del Índice I y II de problemas del sueño del Estudio de Resultados Médicos-Sueño (MOS-Sueño) medido en el Mes 3 en todos los estudios. Los pacientes que estaban recibiendo XELJANZ® 5 o 10 mg dos veces al día demostraron aumentos significativamente mayores con respecto al inicio del estudio en ambas escalas comparados con placebo en los Estudios II, III y IV. En los Estudios III y IV, los aumentos promedios en ambas escalas se mantuvieron hasta los 12 meses en los pacientes tratados con XELJANZ®.
La mejoría en la productividad se evaluó utilizando la escala del Cuestionario de Limitaciones del Trabajo (WLQ) al Mes 3 en todos los estudios. Los pacientes que estaban recibiendo XELJANZ® 10 mg dos veces al día demostraron mejoras significativamente mayores con respecto al inicio del estudio en toda la Escala Resumida de Rendimiento General en comparación con placebo en los Estudios III, IV y V. En los Estudios III y IV, los aumentos medios en el Rendimiento General se mantuvieron hasta los 12 meses en los pacientes tratados con XELJANZ® 10 mg dos veces al día.
Propiedades farmacocinéticas: El perfil farmacocinético de tofacitinib se caracteriza por absorción rápida (las concentraciones plasmáticas pico se alcanzaron dentro de las 0,5-1 hora), eliminación rápida (semivida de ~3 horas) y aumentos proporcionales a las dosis en la exposición sistémica. Las concentraciones de estado estable se lograron a las 24-48 horas con acumulación insignificante después de la administración dos veces al día.
Absorción y distribución: Tofacitinib se absorbe bien con una biodisponibilidad oral de 74%. La coadministración de XELJANZ® con una comida con alto contenido de grasa no produjo cambios en el ABC aunque la Cmax se redujo en 32%. En los ensayos clínicos, tofacitinib se administró sin tener en cuenta las comidas.
Después de la administración intravenosa, el volumen de distribución es de 87 L. La unión a proteínas de tofacitinib es ~40%. Tofacitinib se une predominantemente a la albúmina y no parece unirse a ?1-glucoproteína ácida. Tofacitinib se distribuye de manera igual entre los glóbulos rojos y el plasma.
Metabolismo y eliminación: Los mecanismos de depuración de tofacitinib son aproximadamente 70% a través del metabolismo hepático y 30% vía excreción renal del fármaco madre. El metabolismo de tofacitinib está mediado principalmente por CYP3A4 con contribución menor de CYP2C19. En un estudio en humanos marcado radioactivamente, más del 65% de la radioactividad circulante total correspondió al fármaco sin cambios, y el 35% restantes se atribuyó a 8 metabolitos, cada uno equivaliendo al 8% de de la radioactividad total. La actividad farmacológica de tofacitinib se atribuye a la molécula madre.
Los datos farmacocinéticos y las recomendaciones posológicas para poblaciones especiales y las interacciones medicamentosas se proporcionan en la Figura 2.
Farmacocinética en pacientes con AR: El análisis farmacocinético poblacional en pacientes con artritis reumatoide indicó que la exposición sistémica (ABC) de tofacitinib en los límites extremos del peso corporal (40 kg, 140 kg) fueron similares a los de los pacientes de 70 kg. En pacientes ancianos de 80 años de edad se estimó de <5% más que el ABC con respecto a la edad media de 55 años. En las mujeres se estimó 7% menor con respecto al ABC en comparación con los hombres. Los datos disponibles han demostrado también que no existe ninguna diferencia importante en el ABC de tofacitinib entre pacientes blancos, negros y asiáticos. Se observó una relación aproximadamente lineal entre el peso corporal y el volumen de distribución, lo que resultó en picos mayores (Cmax) y valles menores (Cmin) en las concentraciones en pacientes con menor peso. Sin embargo, esta diferencia no se considera clínicamente relevante. La variabilidad intersujeto (porcentaje del coeficiente de variación) en el ABC de XELJANZ® se estima de aproximadamente el 27%.
Insuficiencia renal: Los pacientes con insuficiencia renal leve, moderada y severa presentaron 37%, 43% y 123% mayor ABC, respectivamente, en comparación, con los pacientes sanos (ver Posología y método de administración). En los pacientes con nefropatía terminal, la contribución de la diálisis a la depuración total de tofacitinib fue relativamente pequeña.
Insuficiencia hepática: Los pacientes con insuficiencia hepática leve a moderada presentaron 3% y 65% mayor ABC, respectivamente en comparación con las personas sanas. Las personas con una insuficiencia hepática grave no fueron estudiadas (ver Posología y métodos de administración).
Población pediátrica: La farmacocinética, la seguridad y la eficacia de tofacitinib en pacientes pediátricos no se han establecido.
Figura 2. Recomendación Posológica con Base en los Datos Farmacocinéticos
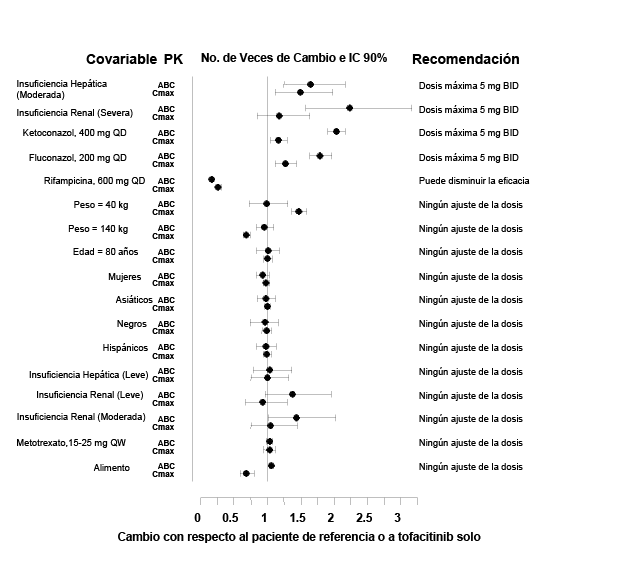
Los valores de referencia para las comparaciones de peso, edad, sexo y raza son 70 kg, 55 años, hombres y blancos, respectivamente; los grupos de referencia para los datos de insuficiencia renal y hepática son personas con función renal y hepática normal, respectivamente; el grupo de referencia para los estudios de interacción medicamentosa y efectos de los alimentos es la administración de tofacitinib solo.
CONTRAINDICACIONES: Hipersensibilidad al medicamento. No debe ser usado en combinación con fármacos modificadores de la enfermedad reumatoidea de origen biológico o inmunosupresores potentes tales como azatioprina y ciclosporina.
FERTILIDAD, EMBARAZO Y LACTANCIA: No existe ningún estudio adecuado y bien controlado sobre la utilización de XELJANZ® en mujeres embarazadas. Tofacitinib ha demostrado teratogenicidad en ratas y conejos, y presenta efectos en las ratas hembras en la fertilidad, parto y desarrollo perinatal y postnatal (ver Sección 5.3). XELJANZ® no debe utilizarse durante el embarazo a menos que sea claramente necesario.
Tofacitinib fue distribuido en la leche de las ratas lactantes (ver Datos preclínicos de seguridad). Se desconoce si tofacitinib se elimina en la leche materna. Las mujeres no deben lactar mientras estén en tratamiento con XELJANZ®.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y OPERAR MÁQUINAS: No se ha realizado ningún estudio sobre los efectos sobre la capacidad para conducir y operar máquinas.
EFECTOS ADVERSOS: Los siguientes datos incluyen 5 estudios multicéntricos, controlados y doble enmascarados. En estos estudios, los pacientes fueron asignados aleatoriamente y tratados a dosis de monoterapia de XELJANZ® 5 mg dos veces al día (243 pacientes) o 10 mg dos veces al día (245 pacientes) y a dosis de politerapia con DMARDs (incluido metotrexato) de XELJANZ® 5 mg dos veces al día (973 pacientes) o de 10 mg dos veces al día (969 pacientes).
De los 3030 pacientes que recibieron XELJANZ® en estos 5 estudios clínicos, incluidos los que avanzaron de placebo a XELJANZ® 1871 recibieron tratamiento durante al menos 6 meses y 580 durante al menos un año.
La población de seguridad a largo plazo incluye todos los pacientes que participaron en un estudio controlado, doble enmascarado (incluidos estudios iniciales de la fase de desarrollo) y que posteriormente participaron en uno de los dos estudios de seguridad a largo plazo.
De los 3227 pacientes que recibieron XELJANZ® en los estudios a largo plazo, 1689 recibieron tratamiento abierto durante al menos 6 meses, 970 durante al menos un año, 659 recibieron tratamiento durante al menos 2 años y 62 durante al menos 3 años.
Todos los pacientes en estos estudios presentaban artritis reumatoide moderada a severamente activa. La población del estudio tenía una edad media de 54 años y 84 % eran mujeres.
Experiencia de los ensayos clínicos: Las reacciones adversas serias más frecuentes fueron las infecciones serias (ver Advertencias y precauciones especiales de utilización).
Las reacciones adversas más frecuentemente reportadas durante los primeros 3 meses en los ensayos clínicos controlados (que ocurrieron en =2% los pacientes tratados con monoterapia con XELJANZ® o con politerapia con DMARDs) fueron infecciones en las vías respiratorias superiores, cefalea, nasofaringitis y diarrea.
La proporción de pacientes que interrumpieron el tratamiento debido a reacciones adversas durante los primeros tres meses de los estudios controlados con placebo, doble enmascarados fue 4,2% de los pacientes que estaban tomando XELJANZ® y 3,2% de los pacientes que fueron tratados con placebo. Las reacciones adversas más frecuentes que llevaron a la interrupción de XELJANZ® fueron las infecciones. Las infecciones más frecuentes que conllevaron a la interrupción del tratamiento del tratamiento fueron herpes zóster y neumonía.
Las Reacciones Adversas (RAM) listadas en la siguiente tabla se presentan por Sistema de Órganos (SOC) y las categorías de frecuencia, se definen utilizando la siguiente convención: muy frecuentes (=1/10); frecuentes (=1/100 y <1/10), poco frecuentes (=1/1.000 y <1/100) o raros (=1/10.000 y <1/1.000). Dentro de cada grupo de frecuencia, los efectos adversos se presentan en orden descendente de seriedad.
|
Tabla 4. |
||||
|
Clase de sistema de órganos |
Muy frecuente =1/10 |
Frecuente =1/100 a <1/10) |
Poco frecuente =1/1.000 a <1/100) |
Rara =1/10.000 a <1/1.000) |
|
Infecciones e infestaciones |
Nasofaringitis |
Neumonía, herpes zóster, bronquitis, gripe, sinusitis, infección del tracto urinario, faringitis |
Septicemia, neumonía bacteriana, neumonía neumocócica, pielonefritis, celulitis, gastroenteritis viral, infección viral, herpes simple |
Tuberculosis del sistema nervioso central, encefalitis, fascitis necrotisante, meningitis criptocóccica, tuberculosis diseminada, urosepticemia, neumonía por Pneumocystis jiroveci, bacteriemia estafilocócica, tuberculosis, artritis bacteriana, infección micobacteriana atípica, infección por Mycobacterium avium complex, infección por citomegalovirus, bacteriemia |
|
Investigaciones |
Aumento de enzimas hepáticas, aumento de creatinina fosfoquinasa sanguínea, aumento de lipoproteínas de baja densidad, aumento de colesterol sanguíneo, aumento de peso |
Aumento de transaminasas aumento de creatinina sanguínea, aumento de gamma-glutamiltransferasa, alteración de las pruebas de la función hepática. |
||
|
Trastornos Gastrointestinales |
Dolor abdominal, vómito, gastritis, diarrea, náuseas, dispepsia |
|||
|
Trastornos metabólicos y nutricionales |
Hiperlipidemia, dislipidemia |
Deshidratación |
||
|
Trastornos musculoesqueléticos y del tejido conectivo |
Dolor musculoesquelético, artralgia |
Tendinitis, inflamación de las articulaciones |
||
|
Trastornos sanguíneos y del sistema linfático |
Leucopenia, anemia |
Neutropenia, linfopenia |
||
|
Neoplasias benignas, malignas y no especificadas (incluidos quistes y pólipos) |
Cánceres de piel no melanocíticoste |
|||
|
Trastornos generales y condiciones en el sitio de administración |
Pirexia, fatiga, edema periférico |
|||
|
Trastornos del sistema nervioso |
Cefalea |
Parestesia |
||
|
Trastornos Psiquiátricos |
Insomnio |
|||
|
Trastornos Vasculares |
Hipertensión |
|||
|
Trastornos respiratorios, torácicos y del mediastino |
Disnea, tos |
Congestión de los senos |
||
|
Trastornos de la piel y el tejido subcutáneo |
Exantema |
Eritema, prurito |
||
|
Trastornos Hepatobiliares |
Esteatosis hepática |
|||
|
Lesión, intoxicación y complicaciones del procedimiento |
Esguince articulatorio |
Esguince muscular |
||
Infecciones generales: En el estudio clínico controlado de 6 meses, las tasas de infección en los grupos de monoterapia con XELJANZ® 5 mg dos veces al día y 10 mg dos veces al día fueron 16,5%, y 19,2%, respectivamente, en comparación con 18,9% en el grupo de placebo. En los estudios de 6 o 12 meses de duración sin DMARDs, las tasas de infección en los grupos de XELJANZ® de 5 mg dos veces al día y 10 mg dos veces al día más DMARDs fueron 20,9% y 21,7%, respectivamente, comparada con 18,2% en el grupo de placebo más DMARDs.
Las infecciones más frecuentemente reportadas fueron infecciones en las vías respiratorias superiores y nasofaringitis (4,1% y 3,4%, respectivamente).
La tasa general de infecciones con XELJANZ® en la población de seguridad a largo plazo a todas las exposiciones fue 41,5 eventos por 100 pacientes-año (31,5 y 66,9 eventos para 5 mg y 10 mg dos veces al día, respectivamente). Para los pacientes bajo monoterapia, las tasas fueron 35,5 y 55,8 eventos por 100 pacientes-año para 5 mg y 10 mg dos veces al día, respectivamente. Para los pacientes con DMARDs, las tasas fueron de 28,8 y 78,4 eventos por 100 pacientes años para 5 mg y 10 mg dos veces al día, respectivamente.
En el estudio clínico controlado de 6 meses, la tasa de infecciones serias en el grupo de monoterapia con XELJANZ® 5 mg dos veces al día fue 0,85 eventos por 100 pacientes-año. En el grupo de monoterapia con XELJANZ® 10 mg dos veces al día la tasa fue 3,5 eventos por 100 pacientes-años y la tasa fue 0 eventos por 100 pacientes-años para el grupo de placebo.
En los estudios de 6 o 12 meses de duración las tasas de infecciones serias en los grupos de XELJANZ® 5 mg dos veces al día y 10 mg dos veces al día más DMARDs fueron 3,6 y 2,9 eventos por 100 pacientes-año, respectivamente, comparados con 1,7 eventos por 100 pacientes-año en el grupo de placebo más DMARDs.
En la población de seguridad a largo plazo para todas las exposiciones, las tasas generales de infecciones serias fueron 2,3 y 4,9 eventos por 100 pacientes-año, para XELJANZ® 5 mg y 10 mg dos veces al día respectivamente. Las infecciones serias más frecuentes reportadas con XELJANZ® incluyeron neumonía, herpes zóster e infección en las vías urinarias. Se han reportado casos de infecciones oportunistas (ver Advertencias y precauciones especiales de utilización).
De los 3315 pacientes que participaron en los Estudios I a V, un total de 505 pacientes con artritis reumatoide eran de 65 años de edad o más, incluidos 71 pacientes de 75 o más años de edad. La frecuencia de la infección seria entre los pacientes tratados con XELJANZ® de 65 o más años de edad fue mayor que la de los menores de 65 años. Como existe una mayor incidencia de infecciones en la población de ancianos en general, deberá tenerse precaución cuando se trate a esta población.
Pruebas de laboratorio
Linfocitos: En los estudios clínicos controlados, las disminuciones confirmadas en el recuento de linfocitos menores de 500 células/mm3 ocurrieron en 0,21% de los pacientes para las dosis de 5 mg dos veces al día y 10 mg dos veces al día combinadas.
En la población de seguridad a largo plazo, las disminuciones confirmadas en los recuentos de linfocitos menores de 500 células/mm3 ocurrieron en 0,31% de los pacientes para las dosis de 5 mg dos veces al día y 10 mg dos veces al día combinadas.
Los recuentos de linfocitos confirmados <500 células/mm3 estuvieron asociados con mayor incidencia de infecciones tratadas y serias (ver Advertencias y precauciones especiales de utilización).
Neutrófilos: En los estudios clínicos controlados se confirmó la ocurrencia de disminución del RAN por debajo de 1000 células/mm3 en 0,08% de los pacientes para las dosis de XELJANZ® de 5 mg dos veces al día y 10 mg dos veces al día combinadas. No existió ninguna disminución confirmada en el RAN por debajo de 500 células/mm3 en ninguno de los grupos de tratamiento. No existió ninguna relación clara entre neutropenia y la ocurrencia de infecciones serias.
En la población de seguridad a largo plazo, el patrón y la incidencia de las disminuciones confirmadas en el RAN permaneció consistente con la observada en los estudios clínicos controlados (ver Advertencias y precauciones especiales de utilización).
Pruebas de enzimas hepáticas: Se observaron con poca frecuencia aumentos confirmados en las enzimas hepáticas de >3 veces el límite superior de normalidad (3 veces LSN). En los pacientes que experimentan elevación de las enzimas hepáticas, la modificación del régimen de tratamiento, como por ejemplo la reducción en la dosis de los DMARDs concomitantes, la interrupción de XELJANZ®, o la reducción de la dosis de XELJANZ®, produjo una disminución o normalización de las enzimas hepáticas.
En la parte controlada del estudio de monoterapia de fase 3 (0-3 meses), las elevaciones de la ALT >3 veces el LSN se observaron en 1,65%, 0,41%, y 0% de los pacientes que estaban recibiendo placebo, 5 mg y 10 mg dos veces al día, respectivamente. En este estudio, las elevaciones de la AST >3 veces el LSN fueron observadas en 1,65%, 0,41% y 0% de los pacientes que estaban recibiendo placebo, 5 mg y 10 mg dos veces al día, respectivamente.
En la parte controlada de los estudios de fase 3 con DMARDs concomitantes (0-3 meses), las elevaciones de la ALT >3 veces el LSN fueron observadas en 0,9%, 1,24% y 1,25% de los pacientes que estaban recibiendo placebo, 5 mg y 10 mg dos veces al día, respectivamente. En estos estudios, las elevaciones de la AST >3 veces el LSN fueron observadas en 0,72%, 0,5% y 0,42% pacientes que estaban recibiendo placebo, 5 mg y 10 mg dos veces al día, respectivamente.
Lípidos: Las elevaciones de los parámetros de los lípidos (colesterol total, colesterol LDL, colesterol HDL, triglicéridos) fueron evaluadas primero un mes después del inicio del tratamiento con XELJANZ® en los ensayos clínicos controlados doble enmascarados. Se observaron aumentos en este punto del tiempo y permanecieron estables de ahí en adelante.. Los cambios en los parámetros de los lípidos desde el inicio hasta el final del estudio (6-12 meses) en los estudios clínicos controlados se resumen a continuación:
• Aumento medio del colesterol LDL de 14% en el grupo de XELJANZ® 5 mg dos veces al día y 20% en el grupo de XELJANZ® 10 mg dos veces al día.
• Aumento medio del colesterol HDL de 16% en el grupo de XELJANZ® 5 mg dos veces al día y 18% en el grupo de XELJANZ® 10 mg dos veces al día.
• Los cocientes medios entre colesterol LDL/colesterol HDL esencialmente no cambiaron en los pacientes tratados con XELJANZ®.
• Los cocientes entre apolipoproteína B (ApoB)/ApoA1 esencialmente no cambiaron en los pacientes tratados con XELJANZ®.
En un ensayo clínico controlado, las elevaciones en el colesterol LDL y en ApoB disminuyeron a los niveles que estaban presentes antes del tratamiento como respuesta a la terapia con estatinas.
En la población de seguridad a largo plazo, las elevaciones en los parámetros de los lípidos permanecieron consistentes con las observadas en los estudios clínicos controlados.
INTERACCIÓN CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN
Interacciones que afectan la utilización de XELJANZ®: Debido a que tofacitinib se metaboliza por CYP3A4, es probable la interacción con medicamentos que inhiben o inducen CYP3A4. La exposición a tofacitinib aumenta cuando se coadministra con inhibidores potentes delcitocromo P450 (CYP) 3A4 (por ejemplo, ketoconazol) o cuando la administración de uno o más medicamentos concomitantes produce tanto inhibición moderada de CYP como inhibición potente de CYP2C19 (por ejemplo, fluconazol) (ver Posología y métodos de administración). La exposición a tofacitinib se disminuye cuando se coadministra con inductores potentes de CYP3A4 (por ejemplo rifampicina). Es improbable que los inhibidores de CYP2C19 solo o la glucoproteína-P alteren significativamente la farmacocinética de tofacitinib.
La administración concomitante con metotrexato (15-25 mg de MTX una vez a la semana) no afectó la farmacocinética de tofacitinib. La coadministración de ketoconazol, un inhibidor fuerte de CYP3A4, con una única dosis de tofacitinib aumentó el ABC y Cmax en 103% y 16%, respectivamente. La coadministración de fluconazol, un inhibidor moderado de CYP3A4 y un inhibidor fuerte de CYP2C19, aumentó el ABC y Cmax de tofacitinib en 79% y 27%, respectivamente. La coadministración de tacrolimus (Tac), un inhibidor leve de CYP3A4, aumentó el ABC de tofacitinib en 21% y disminuyó la Cmax de tofacitinib en 9%. La coadministración de ciclosporina (CsA), un inhibidor moderado de CYP3A4, aumentó el ABC de tofacitinib en 73% y disminuyó la Cmax de tofacitinib en 17%. La utilización combinada de dosis múltiples de tofacitinib con estos inmunosupresores potentes no se ha estudiado en pacientes con artritis reumatoide. La coadministración de rifampicina, un inductor fuerte de CYP3A4, disminuyó el ABC y Cmax de tofacitinib en 84% y 74%, respectivamente (ver Posología y métodos de administración).
Potencial de XELJANZ® para influir en la farmacocinética de otros medicamentos: Los estudios in vitro indican que tofacitinib no inhibe o induce significativamente la actividad de los principales CYP humanos que metabolizan medicamentos (CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, y CYP3A4) a concentraciones que superan 150 veces la Cmax de estado estable de una dosis de 10 mg de dos veces al día. Estos resultados in vitro fueron confirmados mediante un estudio humano de interacción de medicamentos que no mostró cambios en la farmacocinética de midazolam, un sustrato altamente sensible de CYP3A4, cuando se coadministraba con tofacitinib. Los datos in vitro indican que el potencial de tofacitinib para inhibir los transportadores como la glucoproteína-P, los transportadores aniónicos o catiónicos orgánicos a concentraciones terapéuticas fue también bajo.
La coadministración de tofacitinib no tuvo ningún efecto sobre la farmacocinética de los anticonceptivos orales, levonorgestrel y etinilestradiol, en mujeres voluntarias sanas.
La coadministración de tofacitinib con metotrexato 15-25 mg una vez a la semana disminuyó el ABC y la Cmax de metotrexato en 10% y 13% respectivamente. El grado de disminución en la exposición a metotrexato no justifica modificaciones individualizadas a las dosis de metotrexato.
La coadministración de XELJANZ® no tuvo efecto sobre la farmacocinética de metformina, lo que indica que tofacitinib no interfiere con el transportador catiónico orgánico (OCT2) en voluntarios sanos.
En los pacientes reumáticos, la depuración oral de tofacitinib no varió con el tiempo, indicando que tofacitinib no normaliza la actividad de las enzimas CYP en los pacientes con AR. Por lo tanto, no se espera que la coadministración con tofacitinib produzca aumentos clínicamente relevantes en el metabolismo de los sustratos de CYP en los pacientes con AR.
Población pediátrica: Se han realizado estudios únicamente con adultos.
DATOS PRECLÍNICOS DE SEGURIDAD: En los estudios preclínicos, se observaron efectos sobre los sistemas inmunitarios y hematopoyéticos que fueron atribuidos a las propiedades farmacológicas (inhibición de JAK) de tofacitinib. Los efectos secundarios de la inmunosupresión, como por ejemplo infecciones bacterianas y virales y linfoma se observaron a dosis clínicamente relevantes. Otros hallazgos a dosis muy por encima de la exposición humana incluyen efectos sobre los sistemas hepático y gastrointestinal.
Se observó linfoma en 3 de 8 monos adultos y 0 de 14 jóvenes administrados con tofacitinib a 5 mg/kg dos veces al día. La concentración sin efecto adverso observable para los linfomas fue 1 mg/kg dos veces al día. El ABC del fármaco no unido a proteínas a 1 mg/kg dos veces al día fue 341 ng•h/mL, que es aproximadamente la mitad del ABC del medicamento no unido a proteína a 10 mg dos veces al día y similar a el ABC del medicamento no unido a proteína a 5 mg dos veces al día en humanos.
Tofacitinib no es mutagénico o genotóxico con base en los resultados de una serie de pruebas in vitro e in vivo para mutaciones genéticas y aberraciones cromosómicas.
El potencial carcinógeno de tofacitinib se evaluó en estudios de carcinogenicidad en ratones transgénicos rasH2 de 6 meses y en estudios carcinogénicos en ratas de 2 años. Tofacitinib no fue carcinogénico en los ratones hasta una dosis de 200 mg/kg/día (ABC del fármaco no unido a proteína de ~19 veces el ABC para los humanos a 10 mg dos veces al día). Se observaron en ratas tumores celulares benignos de Leydig: los tumores celulares benignos de Leydig en ratas no están asociados con riesgos de tumores celulares de Leydig en humanos. Se observaron hibernomas (lipomas de tejido adiposo pardo) en ratas hembra a dosis =30 mg/kg (ABC del fármaco no unido a proteína de ~41 veces el ABC de los humanos a 10 mg dos veces al día). Se observaron timomas benignos en ratas hembra que recibieron únicamente la dosis de 100 reducida a 75 mg/kg/día (ABC del fármaco no unido a proteína ~94 veces el ABC para los humanos a 10 mg dos veces al día).
Tofacitinib no demostró teratogenicidad en ratas y conejos y tiene efectos en las ratas hembras sobre la fertilidad, el parto y el desarrollo peri/postnatal. Tofacitinib no presentó efectos sobre la fertilidad masculina, la motilidad espermática o la concentración de esperma. Tofacitinib se distribuyó en la leche de las ratas lactantes.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE UTILIZACIÓN
Infecciones serias: Se han reportado infecciones serias y algunas veces fatales debidas a patógenos bacterianos, micobacterianos, fúngicos invasivos, virales y otras infecciones oportunistas en pacientes con artritis reumatoide que estaban recibiendo inmunomoduladores, incluidos DMARDs y XELJANZ®. Las infecciones serias más frecuentemente reportadas con XELJANZ® incluyeron neumonía, celulitis, herpes zoster e infección de las vías urinarias. De las infecciones oportunistas se reportaron con XELJANZ®, tuberculosis y otras infecciones micobacterianas, cryptococcus, candidiasis esofágica, herpes zoster de múltiples dermatomas, citomegalovirus e infecciones por el virus BK. Algunos pacientes han presentado la enfermedad más diseminada que localizada y a menudo estaban tomando inmunomoduladores como metotrexato o corticoesteroides que, además de la artritis reumatoide pueden predisponerlos a infecciones. También pueden presentarse otras infecciones serias que no fueron reportadas en los estudios clínicos (por ejemplo histoplasmosis, coccidioidomicosis y listeriosis).
No debe iniciarse XELJANZ® en pacientes con infección activa, incluidas infecciones localizadas (ver Posología y método de administración). Los riesgos y los beneficios del tratamiento deben considerarse antes de iniciar XELJANZ® en pacientes con infecciones crónicas o recurrentes o en los que se han expuesto a tuberculosis o con antecedentes de infección seria u oportunista, o que han recibido o han viajado a áreas de tuberculosis endémica o micosis endémica o presentan condiciones subyacentes que pueden predisponerlos a infección.
Los pacientes deben controlarse estrictamente con relación al desarrollo de signos y síntomas de infección durante y después del tratamiento con XELJANZ®. Si un paciente desarrolla una infección seria, una infección oportunista o septicemia deberá interrumpirse XELJANZ®. Los pacientes que desarrollan una infección durante el tratamiento con XELJANZ® deben someterse inmediatamente a una prueba diagnóstica completa apropiada para pacientes inmunocomprometidos, deberá iniciarse el tratamiento antimicrobiano apropiado y el paciente deberá someterse a control estricto.
Debido a que existe mayor incidencia de infecciones en la población anciana en general, deberá tener precaución cuando se trate a ancianos (ver Efectos adversos).
Tuberculosis: Antes de la administración de XELJANZ® los pacientes deberán evaluarse y someterse a prueba para determinar si presentan infección latente o activa.
El tratamiento antituberculosis debe también considerarse antes de la administración de XELJANZ® en pacientes con antecedentes de tuberculosis latente o activa en los que el curso adecuado del tratamiento no se puede confirmar y en pacientes con prueba negativa de tuberculosis latente pero con factores de riesgo para infección de tuberculosis. Se recomienda la consulta con un profesional de la salud con experiencia y conocimiento en el tratamiento de la tuberculosis para ayudar en la decisión de si es apropiado iniciar o no el tratamiento antituberculosis para un paciente específico.
Los pacientes deben controlarse estrictamente con relación al desarrollo de signos y síntomas de tuberculosis, incluidos los pacientes con prueba negativa de infección de tuberculosis latente antes del inicio del tratamiento.
La incidencia de tuberculosis en los programas de desarrollo clínico internacionales de XELJANZ® es de 0,1%-0,2%. Antes de la administración de XELJANZ®, los pacientes con tuberculosis latente deben tratarse con terapia antimicobacteriana estándar.
Reactivación viral: Se ha reportado reactivación viral con el tratamiento con DMARDs y en los estudios clínicos de XELJANZ® se observaron casos de reactivación del virus herpes (por ejemplo herpes zóster). Se desconoce el impacto de XELJANZ® sobre la reactivación de la hepatitis viral crónica. Los pacientes que fueron hallados positivos para hepatitis B o C fueron excluidos para los ensayos clínicos. Deben realizarse estudios de detección de hepatitis viral conforme a las pautas clínicas antes de comenzar el tratamiento con tofacitinib.
Neoplasias malignas y trastorno linfoproliferativo (excluido el cáncer de piel no melanocítico [CPNM]): Existe posibilidad de que XELJANZ® afecte las defensas del huésped contra las neoplasias malignas. Se desconoce el impacto del tratamiento con XELJANZ® sobre el desarrollo y curso de las neoplasias malignas, sin embargo se observaron neoplasias malignas en los estudios clínicos.
En los estudios clínicos controlados en pacientes con artritis reumatoide, se diagnosticaron 13 neoplasias malignas (excluido CPNM) en pacientes que estaban recibiendo XELJANZ®/XELJANZ® más DMARDs, en comparación con 0 neoplasias malignas (excluido CPNM) en los pacientes del grupo de placebo/placebo más DMARDs. Se trataron más de 3000 pacientes (2098 pacientes-año de observación) con XELJANZ® durante periodos de hasta un año y aproximadamente 680 pacientes (203 pacientes-año de observación) fueron tratados con placebo durante un máximo de 6 meses. La tasa de incidencia ajustada a la exposición para neoplasias malignas fue 0,62 eventos por 100 pacientes-año en los grupos de XELJANZ®. Se han observado linfomas en los pacientes tratados con XELJANZ®. Aunque los pacientes con artritis reumatoide, particularmente los que tienen la enfermedad altamente activa, están en mayor riesgo que la población general(hasta varias veces), de desarrollar linfoma, se desconoce el papel, si existe, de la inhibición de la Janus quinasa (JAK) en el desarrollo de linfoma.
En la población de seguridad a largo plazo, la frecuencia de neoplasias malignas (excluidas CPNM) fue 1,12 eventos por 100 pacientes–años, consistente con la frecuencia observada en el periodo controlado.
Cáncer de piel no melanocítico: Se han informado cánceres de piel no melanocíticos (CPNM) en pacientes tratados con tofacitinib. Se recomienda examen de piel rutinario en pacientes con mayor riesgo de cáncer de piel.
Perforaciones gastrointestinales: Los eventos de perforación gastrointestinal se han reportado en los ensayos clínicos con pacientes con artritis reumatoide, aunque se desconoce el papel de la inhibición de la JAK en estos eventos. La tasa de incidencia de la perforación gastrointestinal en todos los estudios (fase 2, fase 3 y de extensión a largo plazo) fue 0,177 eventos por 100 pacientes-año con el tratamiento con XELJANZ®. Los eventos fueron principalmente reportados como perforación diverticular, peritonitis, acceso abdominal y apendicitis. Todos los pacientes que desarrollaron perforaciones gastrointestinales estaban tomando concomitantemente antiinflamatorios no esteroides (AINE) y/o corticoesteroides. Se desconoce la contribución relativa de estos medicamentos concomitantes con respecto a XELJANZ® para el desarrollo de perforaciones gastrointestinales.
XELJANZ® debe utilizarse con precaución en pacientes que pueden estar en mayor riesgo de perforación gastrointestinal (por ejemplo pacientes con antecedentes de diverticulitis).los pacientes que presentan apariciones nuevas de síntomas abdominales deben evaluarse inmediatamente para identificar de manera temprana si existe perforación gastrointestinal.
Parámetros de laboratorio
Linfocitos: Los recuentos de linfocitos <500 células/mm3 estuvieron asociados con aumento de la incidencia de infecciones tratadas y serias. No se recomienda iniciar tratamiento con XELJANZ® en pacientes con bajo recuento de linfocitos (es decir, <500 células/mm3). En pacientes que desarrollan recuento de linfocitos absolutos confirmado <500 células/mm3, no se recomienda el tratamiento con XELJANZ®. Los linfocitos deben controlarse al inicio y cada 3 meses de ahí en adelante. Para las modificaciones recomendadas con base en el recuento de linfocitos ver Posología y métodos de administración.
Neutrófilos: El tratamiento con XELJANZ® se asoció con aumento de la incidencia de neutropenia (<2000 células/mm3) en comparación con placebo. No se recomienda iniciar el tratamiento con XELJANZ® en pacientes con recuento bajo de neutrófilos (es decir, RAN <1000 células/mm3). Para los pacientes que desarrollan RAN persistente de 500-1000/células/mm3, deberá reducirse la dosis de XELJANZ® o interrumpirse la administración hasta que el RAN sea mayor a >1000 células/mm3. En los pacientes que desarrollan recuento absoluto de neutrófilos confirmado <500 células/mm3 no se recomienda el tratamiento con XELJANZ®. Los neutrófilos deben controlarse al inicio y después de 4 a 8 semanas de tratamiento y de ahí en adelante cada 3 meses (ver Posología y métodos de administración y Efectos adversos).
Hemoglobina: No se recomienda iniciar el tratamiento con XELJANZ® en pacientes con valores bajos de hemoglobina (es decir <9 g/dL). El tratamiento con XELJANZ® debe interrumpirse en pacientes que desarrollan niveles de hemoglobina <8 g/dL o cuyos niveles de hemoglobina disminuyen >2 g/dL durante el tratamiento. La hemoglobina debe controlarse al inicio del tratamiento y después de 4 a 8 semanas de tratamiento y de ahí en adelante cada 3 meses (ver Posología y métodos de administración y Efectos adversos).
Lípidos: El tratamiento con XELJANZ® fue asociado con el aumento de los parámetros de lípidos como por ejemplo el colesterol total, el colesterol de lipoproteínas de baja densidad (LDL) y el colesterol de lipoproteínas de alta densidad (HDL). Los efectos máximos fueron observados generalmente dentro de las 6 semanas. La evaluación de los parámetros de lípidos debe realizarse aproximadamente 4 a 8 semanas después del inicio del tratamiento con XELJANZ®. Los pacientes deben manejarse de acuerdo con las recomendaciones clínicas (por ejemplo las recomendaciones del Programa Nacional Educativo de Colesterol) para el tratamiento de la hiperlipidemia. Los aumentos en el colesterol total y LDL asociados con XELJANZ® podrían disminuirse a los niveles previos al tratamiento con terapia con estatinas.
Vacunaciones: No se encuentra disponible ningún dato sobre la respuesta a la vacunación o a la transmisión secundaria de infección a través de vacunas vivas a pacientes que estaban recibiendo XELJANZ®. Se recomienda que las vacunas vivas no se administren concurrentemente con XELJANZ®. Se recomienda que todos los pacientes se encuentren al día con todas las vacunas de acuerdo con las directrices de vacunación vigentes antes de iniciar el tratamiento con XELJANZ®.
En un ensayo clínico de 12 semanas, la respuesta humoral a la vacunación simultánea con la gripe y las vacunas de polisacáridos de neumococo en pacientes con artritis reumatoide iniciando tofacitinib 10 mg dos veces al día o placebo se evaluó. Un porcentaje similar de pacientes alcanzó una respuesta humoral satisfactoria a la vacunación contra la influenza (= aumento de 4 veces en = 2 de 3 antígenos) en el tofacitinib (57%) y placebo (62%) de los grupos de tratamiento. Se observó una reducción modesta en el porcentaje de pacientes que alcanzaron una respuesta humoral satisfactoria a la vacuna antineumocócica de polisacáridos (= aumento de 2 veces en = 6 de 12 serotipos) en los pacientes tratados con monoterapia de con tofacitinib (62%) y la monoterapia con metotrexato (62%) como en una comparación con el placebo (77%), con una mayor reducción en la tasa de respuesta de los pacientes que recibieron tanto ambos tofacitinib y metotrexato (32%). Se desconoce la significancia clínica.
Un estudio de la vacuna separada evaluó la respuesta humoral a la vacunación simultánea con la gripe y las vacunas de polisacáridos de neumococo en pacientes que recibieron 10 mg tofacitinib dos veces al día durante una media de aproximadamente 22 meses. Más de 60% de los pacientes tratados con tofacitinib (con o sin metotrexato) tuvieron respuestas satisfactorias a vacunas contra influenza y neumococo. En consistencia con el ensayo de 12 semanas, los pacientes que recibieron tanto tofacitinib y MTX tuvieron una menor de respuesta a la vacunación polisacárida neumocócica, en comparación con la monoterapia de tofacitinib (66% vs 89%).
Pacientes con insuficiencia renal: No se requiere ningún ajuste de la dosis en pacientes con insuficiencia renal leve o moderada. La dosis de XELJANZ® no debe superar los 5 mg dos veces al día en pacientes con insuficiencia renal severa (ver Posología y métodos de administración). En los ensayos clínicos, XELJANZ® no se evaluó en pacientes con valores de depuración de creatinina al inicio del estudio <40 mL/min (estimados mediante la ecuación de Cockroft-Gault) (ver Posología y métodos de administración y Propiedades farmacocinéticas).
Pacientes con insuficiencia hepática: No se requiere ningún ajuste de la dosis en pacientes con insuficiencia hepática leve. La dosis de XELJANZ® no debe superar los 5 mg dos veces al día en pacientes con insuficiencia hepática moderada (ver Posología y métodos de administración). El tratamiento con XELJANZ® no se recomienda en pacientes con insuficiencia hepática severa (ver Efectos adversos). En los ensayos clínicos, XELJANZ® no se evaluó en pacientes con insuficiencia hepática severa o en pacientes con serología positiva para VHB o VHC.
Combinación con otras terapias AR: No se ha estudiado XELJANZ® y su utilización debe evitarse en pacientes con AR combinado con DMARDs biológicos tales como antagonistas del TNF, antagonistas de RIL-1, antagonistas de RIL-6, anticuerpos monoclonales anti-CD20 y los moduladores selectivos coestimulación y inmunosupresores potentes como azatioprina y ciclosporina debido a la posibilidad de aumento de la inmunosupresión y el riesgo mayor de infección.
POSOLOGÍA Y MÉTODOS DE ADMINISTRACIÓN: XELJANZ® se puede utilizar como monoterapia o combinado con metotrexato (MTX) u otros DMARDs no biológicos. La dosis recomendada es 5 mg administrado dos veces al día.
No se ha estudiado XELJANZ® combinado con DMARDs biológicos como por ejemplo antagonistas del TNF, antagonistas de los receptores de interleuquinas-1, antagonistas de los receptores de interleuquinas-6 (RIL-6), anticuerpos monoclonales anti-CD20 y moduladores selectivos de coestimulación e inmunosupresores potentes como azatioprina, ciclosporina y tacrolimus y deberá evitarse su uso debido a la posibilidad de aumentar la inmunosupresión y el riesgo de infección.
El tratamiento con XELJANZ® debe interrumpirse si un paciente desarrolla una infección seria hasta que se controle la infección.
Ajustes de la dosis debido a alteraciones de laboratorio (ver Advertencias y precauciones especiales de utilización): Para el manejo de alteraciones de laboratorio relacionadas con la dosis, como por ejemplo linfopenia, neutropenia y anemia, podrían requerirse ajustes de la dosis o la interrupción de la administración en la forma descrita en las Tablas 1, 2 y 3.
Se recomienda que XELJANZ® no se inicie en pacientes con recuento de linfocitos menor de 500 células/mm3.
|
Tabla 1. |
|
|
Valor de laboratorio (células/mm3) |
Recomendación |
|
Recuento de linfocitos =500 |
Mantener la dosis |
|
Recuento de linfocitos <500 |
Interrumpir XELJANZ® |
Se recomienda que XELJANZ® no se inicie en pacientes con recuento absoluto de neutrófilos (RAN) < 1000 células/mm3.
|
Tabla 2. |
|
|
RAN bajo (verAdvertencias y Precauciones (Sección Advertencias y precauciones especiales de utilización) |
|
|
Valor de laboratorio (células/mm3) |
Recomendación |
|
RAN >1000 |
Mantener la dosis |
|
RAN500-1000 |
Para disminuciones persistentes en este intervalo, reduzca la dosis de XELJANZ® o interrumpa la administración hasta que el RAN sea >1000. |
|
Cuando el RAN sea >1000, reinicie XELJANZ 5 mg dos veces al día; aumente a 10 mg con base en la respuesta clínica. |
|
|
RAN <500 |
Interrumpa XELJANZ® |
Se recomienda que XELJANZ® no se inicie en pacientes con hemoglobina <9 g/dL.
|
Tabla 3. |
|
|
Valor bajo de hemoglobina (ver Advertencias y precauciones [Sección Advertencias y precauciones de utiilización]) |
|
|
Valor de laboratorio (g/dL) |
Recomendación |
|
Disminución =2 g/dL y =9,0 g/dL |
Mantener la dosis |
|
Disminución =2 g/dL o menor que 8,0 g/dL |
Interrumpir la administración de XELJANZ® hasta que los valores de la hemoglobina se normalicen |
Poblaciones especiales
Insuficiencia renal: No se requieren ajustes de la dosis en pacientes con insuficiencia renal leve a moderada. La dosis de XELJANZ® no debe superar los 5 mg dos veces al día en pacientes con insuficiencia renal severa (ver Advertencias y precauciones especiales de utilización y Propiedades farmacocinéticas).
Insuficiencia hepática: No se requiere ningún ajuste de la dosis en pacientes con insuficiencia hepática leve. No debe administrarse XELJANZ® a pacientes con insuficiencia hepática severa. La dosis de. XELJANZ® no debe exceder los 5 mg dos veces al día en pacientes con insuficiencia hepática moderada (ver Advertencias y precauciones especiales de utilización y Propiedades farmacocinéticas).
Pacientes que Reciben Inhibidores del Citocromo P450 (CYP3A4) y del Citocromo 2C19 (CYP2C19): La dosis de XELJANZ® no debe superar los 5 mg dos veces al día en pacientes que están recibiendo inhibidores potentes de citocromo P450 (CYP) 3A4 (por ejemplo ketoconazol). En pacientes que están recibiendo uno o más medicamentos concomitantes que produzcan tanto inhibición moderada de CYP3A4 como inhibición potente de CYP2C19 (por ejemplo fluconazol) la dosis de XELJANZ® no debe superar los 5 mg dos veces al día. La coadministración de XELJANZ® con inductores potentes de CYP (por ejemplo rifampicina) puede producir pérdida o reducción de la respuesta clínica (ver Interacción con otros medicamentos y otras formas de interacción).
Pacientes ancianos (=65 años de edad): En los pacientes de 65 o más años de edad no se requiere ningún ajuste de la dosis.
Población pediátrica: No se ha establecido la seguridad y eficacia de XELJANZ® en niños entre 0 y 18 años de edad.
Método de administración: XELJANZ® debe administrarse vía oral con o sin alimento.
SOBREDOSIS: No existe ninguna experiencia de sobredosis con XELJANZ®. No existe ningún antídoto específico para sobredosis con XELJANZ®. El tratamiento debe ser sintomático y de soporte. En caso de una sobredosis, se recomienda que se controlen signos y síntomas de reacciones adversas. Los pacientes que desarrollan reacciones adversas deben recibir tratamiento apropiado.
Los datos farmacocinéticos hasta la fecha que incluyen una única dosis de 100 mg en voluntarios sanos indican que más del 95% de la dosis administrada se eliminará dentro de las 24 horas.
PRESENTACIÓN: XELJANZ 5 mg (Reg. San. INVIMA 2013M-0014423).
Título del Documento de Producto: Tofacitinib
Fecha de la CDS reemplazada: 11 de Septiembre de 2013
Fecha efectiva: 08 de mayo de 2014
Versión CDS: 4.0
LLD_Tofa_Col_08May2014_CDSv4_Aprobado por Resol. 2015004511_13Abr2015
PFIZER S.A.S.