
XIGDUO XR
CLORHIDRATO DE METFORMINA, DAPAGLIFLOZINA
Tabletas de liberación prolongada
Tabletas recubiertas de liberación prolongada,
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
Y CUANTITATIVA: XIGDUO® tabletas de liberacion extendida (XR).
XIGDUO® XR 5 mg/1000 mg: Cada TABLETA RECUBIERTA contiene dapagliflozina 5 mg como dapagliflozina propanodiol y 1000 mg de metformina HCl de liberación extendida.
XIGDUO® XR 10 mg/1000 mg: Cada TABLETA RECUBIERTA contiene dapagliflozina 10 mg como dapagliflozina propanodiol y 1000 mg de metformina HCl de liberación extendida.
INDICACIONES TERAPÉUTICAS: XIGDUO® XR está indicado en adultos de 18 años en adelante que padezcan de diabetes mellitus del tipo 2 como complemento de la dieta y el ejercicio para mejorar el control glucémico:
En pacientes que no están controlados de manera adecuada en sus dosis máximas toleradas de metformina sola
En pacientes en sus dosis máximas toleradas de metformina junto con otros productos medicinales para reducir la glucosa, entre ellos la insulina, cuando estos no proporcionan un control adecuado de la glucemia.
En pacientes que ya reciben el tratamiento con la combinación de Dapagliflozina y metformina como tabletas separados
FORMA FARMACÉUTICA:XIGDUO® XR 5 mg/1000 mg son tabletas recubiertas, con forma ovalada, biconvexas, de color rosa a rosa oscuro con “1071” y “5/1000” grabado por un lado y sin texto por el lado opuesto.
XIGDUO® XR 10 mg/1000 mg son tabletas recubiertas, con forma ovalada, biconvexas, de color amarillo a amarillo oscuro con “1073” y “10/1000” grabado por un lado y sin texto por el lado opuesto.
Para excipientes, ver la sección Lista de excipientes.
Dapagliflozina: Dapagliflozina propanodiol es un inhibidor potente, altamente selectivo y oralmente activo para el cotransportador sodio-glucosa tipo 2 (SGLT2) renal, el principal transportador responsable de la reabsorción de la glucosa renal.
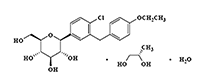
Dapagliflozina propanodiol se describe químicamente como 1,5-anhidro-1-C-[4-cloro-3-[(4-etoxifenil)metil]fenilo]-D-glucitol, (1S)-, compuesto con (2S)-1,2-propanodiol, hidrato (1:1:1). La fórmula empírica es C21H25ClO6 •C3H8O2 •H2O y el peso en la fórmula es de 502.98. La fórmula estructural es:
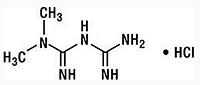
Clorhidrato de metformina: El clorhidrato de metformina (clorhidrato de diamida, N,N-dimetillimidodicarbonimidica) es una biguanida con efectos hipoglicemiantes. El clorhidrato de metformina es un compuesto cristalino blanco a blanquecino con una fórmula molecular de C4H11N5 • HCl y un peso molecular de 165.63. El clorhidrato de metformina es fácilmente soluble en agua, poco soluble en alcohol, y prácticamente insoluble en acetona, éter y cloroformo. El pKa de metformina es de 12.4. El pH de una solución acuosa al 1% de clorhidrato de metformina es de 6.68. La fórmula estructural es:
XIGDUO® XR Componentes del sistema y desempeño: Las combinaciones de dosis fijas (CDFs) XIGDUO® XR son tabletas de doble capa comprimidas con metformina de liberación prolongada como primera capa y dapagliflozina de liberación inmediata como segunda capa. La capa de metformina de liberación prolongada comprende un sistema de matriz de polímero hidrófilo dual. El clorhidrato de metformina está combinado con un polímero de control de liberación de medicamento para formar una fase “interna”, la cual después se incorpora como partículas discretas en una fase “externa” de un segundo polímero. Después de la administración oral, la capa de dapagliflozina se disuelve inmediatamente. La capa de metformina absorbe el líquido del tubo gastrointestinal (GI), lo que ocasiona que los polímeros se hidraten e hinchen. El medicamento se libera lentamente de la capa de metformina por medio de un proceso de difusión a través de la matriz de gel que es fundamentalmente independiente del pH. El sistema de polímero hidratado no es rígido y se espera que se rompa por medio de peristalsis normal en el tubo GI. Los componentes biológicamente inertes de la tableta pueden permanecer ocasionalmente intactos durante el tránsito GI y se eliminarán en las heces como una masa suave e hidratada.
PROPIEDADES FARMACOLÓGICAS
Mecanismo de acción: XIGDUO® XR combina dos agentes hipoglicemiantes con mecanismos complementarios de acción para mejorar tanto la glucosa plasmática en ayunas (GPA) y la glucosa plasmática postprandial (GPP) en pacientes con diabetes tipo 2: Dapagliflozina, un inhibidor de SGLT2, y clorhidrato de metformina, un miembro de la clase biguanida.
Dapagliflozina: La dapagliflozina es un inhibidor altamente potente, selectivo y reversible del cotransportador de glucosa sódica tipo 2 (SGLT2) que mejora el control glicémico en pacientes con diabetes mellitus tipo 2 reduciendo la reabsorción de glucosa renal que provoca la excreción urinaria del exceso de glucosa (glucosuria). Dapagliflozina está disponible oralmente y requiere una dosis de una vez al día.
SGLT2 se expresa selectivamente en el riñón sin expresión detectada en más de 70 tejidos diferentes incluyendo hígado, musculo esquelético, tejido adiposo, pecho, vesícula biliar y cerebro SGLT2 es el transportador predominante responsable de la reabsorción de glucosa del filtrado glomerular de regreso a la circulación. A pesar de la presencia de hiperglucemia en diabetes mellitus tipo 2, la reabsorción de glucosa filtrada continúa. Dapagliflozina reduce el transporte de glucosa tubular máxima un 55% y reduce la reabsorción glucosa renal de forma que la glucosa aparece en la orina en niveles normales de glucosa plasmática. Por lo tanto, dapagliflozina mejora los niveles de glucosa plasmática en ayunas y postprandial al reducir la reabsorción de glucosa renal que provoca la excreción urinaria de exceso de glucosa. Esta excreción de glucosa (efecto glucurético) se observa después de la primera dosis, es continua en un intervalo de dosificación de 24 horas, y sostenida durante todo el tratamiento. La cantidad de glucosa eliminada del riñón a través de este mecanismo depende de la concentración de glucosa en la sangre y VFG. De esta forma, en personas sanas con glucosa normal, dapagliflozina es poco propenso a ocasionar hipoglucemia.Dapagliflozina no altera la producción normal de glucosa endógena en respuesta a la hipoglucemia. Dapagliflozina actúa de forma independiente a la secreción de insulina y la acción insulínica. Con el tiempo, se ha observado una mejora en la función de las células beta (HOMA-2) en estudios clínicos con dapagliflozina.
La excreción de glucosa urinaria (glucosuria) inducida por dapagliflozina está asociada con pérdida calórica y reducción de peso. La mayor parte de la reducción de peso es la pérdida de grasa corporal, incluyendo grasa visceral en lugar de tejido magro o pérdida de fluido como se demostró por absorciometría de rayos X de energía dual (DXA) e imagenología por resonancia magnética. La inhibición de cotransporte sódico y de glucosa por dapagliflozina también está asociada con diuresis ligera y natriuresis transitoria.
Dapagliflozina no inhibe otros transportadores de glucosa importantes para el transporte de glucosa en tejidos periféricos y es 1400 veces más selectivo para SGLT2 que para SGLT1, el transportador más importante en el interior del abdomen para la absorción de glucosa.
Clorhidrato de metformina: La metformina es un agente hipoglicemiante que mejora la tolerancia a la glucosa en pacientes con diabetes tipo 2 y reduce la glucosa plasmática basal y postprandial. La metformina disminuye la producción de glucosa hepática, reduce la absorción intestinal de glucosa y mejora la sensibilidad a la insulina al incrementar la captación y uso de glucosa. A diferencia de las sulfonilúreas, la metformina no produce hipoglucemia ni en pacientes con diabetes tipo 2 ni en pacientes normales (excepto en circunstancias especiales, ver la sección Advertencias y precauciones especiales de uso) y no causa hiperinsulinemia. Con la terapia de metformina, la secreción de insulina permanece sin cambios mientras que la respuesta de los niveles de insulina en ayunas y la insulina plasmática del día pueden disminuir.
PROPIEDADES FARMACOCINÉTICAS
XIGDUO® XR: Se considera que las tabletas de combinación XIGDUO® XR son bioequivalentes a la coadministración de las dosis correspondientes de dapagliflozina y clorhidrato de metformina (XR ) administradas en conjunto como tabletas individuales.
Interacción con los alimentos
XIGDUO® XR: La administración de XIGDUO® XR en personas sanas después de una comida estándar en comparación con el ayuno resulta en el mismo grado de exposición para dapagliflozina y metformina XP. En comparación con el ayuno, la comida estándar resultó en una reducción de 35% y un retraso de 1 a 2 horas en las concentraciones plasmáticas pico de dapagliflozina. Este efecto de los alimentos no se considera clínicamente significativo.
Absorción
Dapagliflozina: Dapagliflozina se absorbe bien y rápidamente después de la administración oral y puede administrarse con o sin alimentos. Las concentraciones plasmáticas máximas de dapagliflozina (Cmáx) generalmente se logran dentro de las 2 horas posteriores a la administración en ayunas. Los valores de Cmáx y ABC aumentan proporcionalmente el incremento en la dosis de dapagliflozina. La biodisponibilidad oral absoluta de dapagliflozina después de la administración de una dosis de 10 mg es de 78%.
Clorhidrato de metformina XR: Después de una dosis oral individual de metformina de liberación prolongada, Cmáx se alcanza con un valor promedio de 7 horas y un intervalo de 4 a 8 horas. En estado estable, el ABC y la Cmáx son menores a la proporcionalidad de la dosis de metformina de liberación prolongada dentro de un intervalo de 500 a 2000 mg administrados una vez al día. Los niveles plasmáticos pico están aproximadamente en 0.6, 1.1, 1.4, y 1.8 µg/mL para dosis diarias de 500, 1000, 1500, y 2000, respectivamente.
Distribución
Dapagliflozina: Dapagliflozina está ligado a proteínas aproximadamente en 91%. La unión a proteínas no se altera en varias enfermedades (por ejemplo, insuficiencia renal o hepática).
Clorhidrato de metformina: No se han realizado estudios de distribución con metformina de liberación prolongada; sin embargo, el volumen aparente de distribución (V/F) de metformina después de las dosis orales individuales de metformina de liberación inmediata de 850 mg tiene un promedio de 654 ± 358 L. Metformina está unida mínimamente a las proteínas plasmáticas, en contraste con las sulfonilúreas, que están unidas a las proteínas en más de 90%. Metformina se divide en eritrocitos, muy probablemente como una función de tiempo.
Metabolismo
Dapagliflozina: Dapagliflozina es un C-glucósido, lo que significa que el componente de aglicona está unido a la glucosa por unión carbono-carbono, lo que en consecuencia confiere estabilidad contra las enzimas de glucosidasa. La vida media terminal plasmática promedio (t1/2) para dapagliflozina es de 12.9 horas después de una dosis oral única de dapagliflozina 10 mg en personas sanas. Dapagliflozina se metaboliza ampliamente con la intención primaria de producir dapagliflozina 3-O-glucuronido, un metabolito inactivo. Dapagliflozina 3-O-glucuronido representa el 61% de una dosis de dapagliflozina-[14C] 50 mg y es el componente predominante relacionado al medicamento en el plasma humano, que representa el 42% (con base en el ABC[0-12 h]) de la radioactividad plasmática total, similar a la contribución de 39% del medicamento madre. Con base en el ABC, ningún otro metabolito representa >5% de la radioactividad plasmática total. Dapagliflozina 3-O-glucuronido u otros metabolitos no contribuyen a los efectos de reducción de glucosa. La formación de dapagliflozina 3-O-glucuronido está mediada por UGT1A9, una enzima presente en el hígado y el riñón, y el metabolismo mediado por CYP es una vía de depuración menor en humanos.
Clorhidrato de metformina: Los estudios de dosis única intravenosa en pacientes normales demuestran que la metformina se excreta sin cambio en la orina y no es sometida a metabolismo hepático (no se han identificado metabolitos en humanos) o excreción biliar.
No se han realizado estudios de metabolismo con tabletas de metformina de liberación prolongada.
Eliminación
Dapagliflozina: La dapagliflozina y los metabolitos relacionados se eliminan principalmente por excreción urinaria, de la cual menos del 2% es dapagliflozina sin cambio Después de la administración de la dosis de [14C]-dapagliflozina 50 mg, 96% es recuperado, 75% en la orina y 21% en las heces. En las heces, aproximadamente 15% de la dosis se excreta como medicamento madre.
Clorhidrato de metformina: La depuración renal es aproximadamente 3.5 veces mayor que la depuración de creatinina, lo cual indica que la secreción tubular es la mejor vía de eliminación de metformina. Después de la administración oral, aproximadamente 90% del medicamento absorbido se elimina por vía renal dentro de las primeras 24 horas, con una vida media de eliminación de plasma de aproximadamente 6.2 horas. En la sangre, la vida media de eliminación es de aproximadamente 17.6 horas, lo que sugiere que la masa de eritrocitos puede ser un compartimiento de distribución.
Poblaciones especiales
Insuficiencia renal: No debe usarse XIGDUO® XR en pacientes con insuficiencia renal de moderada a grave (CrCl <60 mL/min) (ver secciones Contraindicaciones y Advertencias y precauciones especiales de uso).
Dapagliflozina: Para conocer las recomendaciones de dosis para los pacientes con insuficiencia renal de moderada a grave ver la sección Posología y método de administración. En estado estable (20 mg una vez al día de dapagliflozina durante 7 días), los pacientes con diabetes tipo 2 e insuficiencia renal leve, moderada o grave (como se determina por depuración de iohexol) tuvieron exposiciones sistémicas promedio a la dapagliflozina de 32%, 60% y 87% más altas, respectivamente, que los pacientes con diabetes tipo 2 y función renal normal. Con dapagliflozina 20 mg una vez al día, la alta exposición sistemática a la dapagliflozina en pacientes con diabetes mellitus tipo 2 e insuficiencia renal no provocó una depuración de glucosa renal o excreción de glucosa de 24 horas mayor que correspondiera. La depuración de glucosa renal y la excreción de glucosa de 24 horas fue menor en pacientes con insuficiencia renal moderada o grave en comparación con pacientes con insuficiencia renal normal y leve. La en excreción de glucosa urinaria de 24 horas en estado estable dependió estrechamente de la función renal y se excretaron 85, 52, 18, y 11 g de glucosa/día en pacientes con diabetes mellitus tipo 2 y función renal normal o insuficiencia renal leve, moderada o grave, respectivamente. No hubo diferencias en la unión a proteínas de dapagliflozina entre los grupos de insuficiencia renal o en comparación con personas sanas. No se conoce el impacto de la hemodiálisis en la exposición a la dapagliflozina.
Clorhidrato de metformina: En pacientes con disminución de la función renal (con base en la depuración medida de creatinina), la vida media plasmática y sanguínea de metformina es prolongada y la depuración renal disminuye proporcionalmente a la reducción en la depuración de creatinina.
Insuficiencia hepática
Dapagliflozina: Para conocer las recomendaciones de dosificación en pacientes con insuficiencia hepática de moderada a grave ver la sección Posología y método de administración. Se realizó un estudio clínico farmacológico de dosis única (10 mg) de dapagliflozina en pacientes con insuficiencia hepática leve, moderada o grave (Child-Pugh clases A, B, y C, respectivamente) y controles sanos correspondientes para comparar las características farmacocinéticas de dapagliflozina entre estas poblaciones. No hubo diferencias en la unión a proteínas de dapagliflozina entre pacientes con insuficiencia hepática en comparación con personas sanas. En pacientes con insuficiencia hepática leve o moderada la Cmáx y el ABC promedio de dapagliflozina fueron hasta 12% y 36% mayor, respectivamente, en comparación con las personas sanas del control correspondiente. No se consideró que estas diferencias fueran clínicamente significativas y no se propuso un ajuste de dosis de la dosis normal propuesta de 10 mg una vez al día para dapagliflozina para estas poblaciones. En pacientes con insuficiencia hepática grave (Child-Pugh clase C), la Cmáx y el ABC promedio de dapagliflozina fueron hasta 40% y 67% mayor que los controles sanos correspondientes, respectivamente. No se requiere ajuste de dosis para pacientes con insuficiencia hepática grave. Sin embargo, el beneficio: Debe valorarse individualmente el riesgo del uso de dapagliflozina en pacientes con insuficiencia hepática grave ya que no se ha estudiado específicamente la seguridad y eficacia de dapagliflozina en esta población.
Clorhidrato de metformina: No se han realizado estudios farmacocinéticos de metformina en pacientes con insuficiencia hepática.
Edad
Dapagliflozina: No se recomienda ajustar la dosis de dapagliflozina de la dosis de 10 mg una vez al día según la edad. Se evaluó el efecto de la edad (jóvenes: =18 a <40 años [n=105] y adultos mayores: =65 años [n=224]) como una covariable en un modelo farmacocinético de población y se comparó con pacientes de =40 a <65 años utilizando datos de estudios de pacientes y sujetos sanos). La exposición sistémica promedio a dapagliflozina (ABC) en pacientes jóvenes se calculó 10.4% menor que el grupo de referencia (IC al 90%: 87.9, 92.2%) y 25% mayor en pacientes de edad avanzada en comparación con el grupo de referencia (IC al 90%: 123, 129%). Estas diferencias en exposición sistémica no se consideraron como clínicamente significativas.
Clorhidrato de metformina: Datos limitados de estudios farmacocinéticos controlados de metformina en personas sanas de edad avanzada sugieren que la depuración plasmática total de metformina disminuye, la vida media se prolonga, y la Cmáx incrementa, en comparación con pacientes jóvenes sanos. A partir de estos datos, parece que el cambio en la farmacocinética de metformina con la edad se debe principalmente al cambio en la función renal.
Pacientes pediátricos y adolescentes
Dapagliflozina: No se ha estudiado la farmacocinética en la población pediátrica y adolescente.
Clorhidrato de metformina: Después de la administración de una tableta única oral de metformina 500 mg con alimentos, el promedio geométrico de la Cmáx y el ABC de metformina difirió menos de 5% entre los pacientes pediátricos con diabetes tipo 2 (12-16 años de edad) y adultos sanos de peso y género correspondiente (20-45 años de edad), todos con función renal normal.
Género
Dapagliflozina: No se recomienda ajustar la dosis diaria de dapagliflozina 10 mg según el género. El género se evaluó como una covariable en un modelo farmacocinético de población utilizando datos de estudios de pacientes y sujetos sanos. El ABCss promedio de dapagliflozina en mujeres (n=619) se calculó como 22% mayor que en hombres (n=634), (IC al 90%: 117,124).
Clorhidrato de metformina: Los parámetros farmacocinéticos de metformina no difirieron significativamente entre pacientes normales y pacientes con diabetes tipo 2 cuando se analizó conforme al género (hombres=19, mujeres=16). De manera similar, en estudios clínicos controlados en pacientes con diabetes tipo 2, el efecto hipoglicemiante de metformina fue comparable en hombres y mujeres.
Raza
Dapagliflozina: No se recomienda ajustar la dosis diaria de dapagliflozina 10 mg con base en la raza. La raza (negra, blanca, o asiática) se evaluó como una covariable en un modelo farmacocinético de población utilizando datos de estudios de pacientes y sujetos sanos. Las diferencias de exposición sistémica entre estas razas fueron pequeñas. En comparación con los blancos (n=1147), los pacientes asiáticos (n=47) no presentaron diferencia en exposiciones sistemáticas promedio estimadas de dapagliflozina (IC al 90% 3.7% menor, 1% mayor). En comparación con los blancos, los pacientes negros (n=43) presentaron exposiciones sistemáticas promedio a dapagliflozina estimadas 4.9% menores [IC al 90% 7.7% menor, 3.7% menor).
Clorhidrato de metformina: No se han realizado estudios de parámetros farmacocinéticos de metformina conforme a la raza. En estudios clínicos controlados de metformina en pacientes con diabetes tipo 2, el efecto hipoglicemiante fue comparable en blancos (n=249), negros (n=51), e hispanos (n=24).
Peso corporal: No se recomienda ajustar la dosis propuesta diaria de dapagliflozina 10 mg con base en el peso.
En un análisis farmacocinético de población con datos de estudios de pacientes y sujetos sanos, las exposiciones sistemáticas en pacientes con alto peso corporal (=120 kg, n=91) se calcularon en 78.3% (IC al 90%: 78.2, 83.2%) de los pacientes de referencia con un peso corporal de entre 75 y 100 kg. Esta diferencia se considera pequeña, por lo que no se recomienda ningún ajuste de dosis de la dosis propuesta diaria de dapagliflozina 10 mg en pacientes con diabetes mellitus tipo 2 con alto peso corporal (=120 kg).
Los pacientes con bajo peso corporal (<50 kg) no estuvieron bien representados en los estudios de pacientes y sujetos sanos utilizados en el análisis farmacocinético de población. Por lo tanto, las exposiciones sistémicas de dapagliflozina se simularon con un gran número de pacientes. Las exposiciones sistémicas promedio simuladas de dapagliflozina en pacientes con bajo peso corporal se calcularon 29% mayores que en los pacientes con el peso corporal del grupo de referencia. Esta diferencia se considera pequeña, y con base en estos hallazgos no se recomienda ningún ajuste de dosis de la dosis propuesta diaria de dapagliflozina 10 mg en pacientes con diabetes mellitus tipo 2 con bajo peso corporal (<50 kg).
PROPIEDADES FARMACODINÁMICAS
General
Dapagliflozina: Se observaron incrementos en la cantidad de glucosa excretada en la orina en personas sanas y en pacientes con diabetes mellitus tipo 2 después de la administración de dapagliflozina (Figura 1). Se excretaron aproximadamente 70 g de glucosa en la orina al día (correspondiente a 280 kcal/día) en una dosis de dapagliflozina de 10 mg/día en pacientes con diabetes mellitus tipo 2 durante 12 semanas. Esta velocidad de eliminación de glucosa se acercó a la excreción máxima de glucosa observada con 20 mg/día de dapagliflozina. Se observó evidencia de excreción sostenida de glucosa en pacientes con diabetes mellitus tipo 2 con dapagliflozina 10 mg/día durante hasta 2 años.
Esta excreción de glucosa en la orina con dapagliflozina también provocó diuresis osmótica en el volumen urinario. Los incrementos de volumen urinario en pacientes con diabetes mellitus tipo 2 con dapagliflozina 10 mg fueron sostenidos a las 12 semanas y con una cantidad aproximada de 375 mL/día. El incremento en el volumen urinario se asoció con un incremento pequeño y transitorio en la excreción sódica urinaria que no se asoció con los cambios en las concentraciones sódicas séricas.
La excreción de ácido urinario úrico también incrementó de forma transitoria (durante 3-7 días) y se acompañó de una reducción en la concentración ácida úrica sérica. En 24 semanas, las reducciones en las concentraciones ácidas úricas séricas variaron de 0.33 mg/dL a 0.87 mg/dL.
FIGURA 1. Diagrama de dispersión y curva de ajuste del cambio a partir del valor inicial en la cantidad de glucosa urinaria de 24 horas frente a la dosis de dapagliflozina en personas sanas y pacientes con DMT2 (Diagrama semilogarítmico)

Electrofisiología cardiaca: Dapagliflozina no se asoció con la prolongación clínicamente significativa del intervalo QTc en dosis diarias superiores a 150 mg (15 veces la dosis recomendada) en un estudio de personas sanas. Adicionalmente, no se observó ningún efecto clínicamente significativo en QTc después de dosis individuales de más de 500 mg (50 veces la dosis recomendada) de dapagliflozina en personas sanas.
CONTRAINDICACIONES
XIGDUO® XR está contraindicado en:
• Pacientes con insuficiencia renal moderada a severa (p.ej., niveles de creatinina sérica de =1.5 mg/dL [hombres], =1.4 mg/dL [mujeres] o TFGe <60 mL/min/1.73 m2 o DepCr <60 mL/min depuración anormal de creatinina), la cual también puede ser provocada por condiciones tales como colapso cardiovascular (shock), infarto de miocardio agudo y septicemia (ver sección Advertencias y precauciones especiales de uso).
• Acidosis metabólica aguda o crónica, incluyendo cetoacidosis diabética, con o sin coma. La cetoacidosis diabética debe tratarse con insulina.
• Hipersensibilidad a los principios activos o a cualquiera de los excipientes.
• Menores de 18 años.
EMBARAZO Y LACTANCIA
Embarazo: XIGDUO® XR no debe utilizarse en el segundo y tercer trimestre del embarazo. En el periodo correspondiente al segundo y tercer trimestre del embarazo en relación con la madurez renal humana, la exposición materna a la dapagliflozina en estudios con ratas se asoció con incidencia y/o gravedad incrementada de dilataciones tubulares y pélvicas renales en la progenie (ver sección Datos de seguridad preclínica).
En estudios convencionales de desarrollo embrionario y fetal en ratas y conejos, la dapagliflozina se administró por intervalos que coincidían con el primer trimestre de organogénesis no renal en humanos.No se observó toxicidad del desarrollo en conejos en ninguna dosis probada (1191 veces la dosis máxima recomendada humana [MRHD]). En ratas, la dapagliflozina no fue embrioletal ni teratógena (1441 veces la MRHD) en ausencia de toxicidad materna.
La determinación de concentraciones fetales demostró una barrera placentaria parcial a la metformina.
No existen estudios adecuados y bien controlados de XIGDUO® XR en mujeres embarazadas. Cuando se detecta un embarazo, debe descontinuarse XIGDUO® XR.
Lactancia: XIGDUO® XR no debe ser administrado a mujeres que estén amamantando.
No se han llevado a cabo estudios en animales lactantes con los componentes combinados de XIGDUO® XR. En estudios realizados con componentes individuales, tanto la dapagliflozina como la metformina se excretan en la leche de las ratas lactantes.
La exposición directa e indirecta de dapagliflozina en ratas jóvenes recién destetadas y durante etapas de embarazo tardías están asociadas con una incidencia y/o severidad incrementada de dilataciones tubulares y pélvicas renales en la progenie, si bien las consecuencias funcionales a largo plazo de estos efectos se desconocen.Estos periodos de exposición coinciden con una ventana crucial de madurez renal en las ratas. Como la maduración funcional en los riñones de los humanos continúa en los primeros 2 años de vida, la dapagliflozina asociada con túbulos y pelvis renal dilatada observada en ratas jóvenes puede constituir un riesgo potencial para la madurez renal humana durante los 2 primeros años de vida. Adicionalmente, los efectos negativos en el aumento de peso corporal asociados con la exposición durante la lactancia en ratas jóvenes recién destetadas sugiere que debe evitarse la dapagliflozina durante los 2 primeros años de vida (ver sección Datos de seguridad preclínica).
No se sabe si la dapagliflozina o la metformina se secretan en la leche materna.
EFECTOS EN LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS: No se han realizado estudios sobre los efectos de XIGDUO® XR en la capacidad para conducir y utilizar máquinas.
EFECTOS NO DESEADOS
Experiencia clínica
Dapagliflozina y clorhidrato de metformina: Se utilizaron los datos de un grupo preespecificado de pacientes de 8 estudios a corto plazo controlados con placebo de dapagliflozina coadministrada con metformina de liberación inmediata o prolongada para evaluar los datos de seguridad. Este análisis incluyó varios estudios de adición (metformina sola y en combinación con un inhibidor de DPP4 y metformina, o insulina y metformina, 2 estudios de combinación de inicio con metformina, y 2 estudios de pacientes con enfermedad cardiovascular (ECV) y diabetes tipo 2 que recibieron su tratamiento normal (con metformina como terapia de base). Para los estudios que incluyeron terapia de base con y sin metformina, solo se incluyeron pacientes que recibieron metformina en el grupo de 8 estudios controlados con placebo.En los 8 estudios se trató a 983 pacientes una vez al día con 10 mg dapagliflozina y metformina y 1185 recibieron placebo y metformina. Estos 8 estudios proporcionaron una duración promedio de exposición de 23 semanas.La edad promedio de la población fue de 57 años y 2% fueron mayores a 75 años. Cincuenta y cuatro por ciento (54%) de la población era de sexo masculino; 88% blanca, 6% asiática, y 3% negra o afroamericana. Al inicio, la población había padecido de diabetes durante un promedio de 8 años, la hemoglobina promedio A1c (HbA1c) fue de 8.4% y la función renal fue normal o ligeramente insuficiente en 90% de los pacientes y moderadamente insuficiente en 10% de los pacientes.
La incidencia general de eventos adversos para el análisis de 8 estudios a corto plazo controlados con placebo en pacientes tratados con 10 mg dapagliflozina y metformina fue de 60.3% en comparación con 58.2% para el grupo de placebo y metformina.La suspensión de la terapia debido a eventos adversos en pacientes que recibieron 10 mg dapagliflozina y metformina fue de 4% en comparación con 3.3% para el grupo de placebo y metformina. Los eventos más comúnmente reportados que incitaron a la suspensión y que se reportaron en al menos 3 pacientes tratados con 10 mg dapagliflozina y metformina fue insuficiencia renal (0.7%), incremento de creatinina en la sangre (0.2%), reducción en la depuración de creatinina renal (0.2%) e infección de las vías urinarias (0.2%).
Las reacciones adversas reportadas en el grupo combinado de 8 estudios a corto plazo controlados con placebo (sin importar la valoración de causalidad del investigador) en =2% de pacientes tratados con dapagliflozina 10 mg y metformina, y =1% más frecuentemente en pacientes tratados con placebo y metformina, se muestran en la Tabla 1.
|
Tabla 1. Reacciones adversas (sin importar la valoración de causalidad del investigador) en estudios de controlados con placebo* reportados en =2% de los pacientes tratados con dapagliflozina 10 mg y metformina, y =1% más frecuentemente que en pacientes tratados con placebo y metformina (excluyendo hipoglucemia)† |
|
|
Grupo sistémico |
dapagliflozina 10 mg y metformina |
|
Infecciones e infestaciones Infección genital ‡ |
Común |
|
Infecciones e infestaciones Infección de las vías urinarias § |
Común |
|
Trastornos urinarios Poliuria¶ |
Común |
|
* Los 8 estudios controlados con placebo incluyeron 2 combinaciones de inicio con metformina, 2 adiciones a la metformina, 1 adición a la insulina, 1 adición a la sitagliptina, y 2 estudios con terapia de adición en combinación. La tabla muestra los datos de hasta 24 semanas (corto plazo) independientemente del rescate glicémico. † Para obtener información sobre hipoglucemia ver la subsección Hipoglucemia. ‡ Infección genital incluye los siguientes términos preferidos, enumerados en orden de frecuencia de reporte: Infección micótica vulvovaginal, balanitis, infección vaginal, micosis genital, infección genital, candidiasis vulvovaginal, balanitis candidiásica, vulvovaginitis, candidiasis genital, vulvitis, balanopostitis, infección genital masculina, infección del tracto genitourinario, absceso peneano, infección peneano, postitis, absceso vulvar y vaginitis bacteriana. § Infección de las vías urinarias incluye los siguientes términos preferidos, enumerados en orden de frecuencia de reporte: Infección de las vías urinarias, cistitis, infección de las vías urinarias por Escherichia, infección del tracto genitourinario, pielonefritis, trigonitis, uretritis, infección renal y prostatitis. ¶ Poliuria incluye los términos preferidos, enumerados en orden de frecuencia de reporte: Polaquiuria, poliuria y micción incrementada. |
|
Dapagliflozina: Se utilizaron dos grupos a gran escala de pacientes para evaluar las reacciones adversas con 10 mg dapagliflozina frente a un control, un grupo de estudio controlado con placebo y un grupo a mayor escala de estudios activos controlados con placebo.
Estudios controlados con placebo: El primero es un grupo preespecificado de pacientes de 13 estudios a corto plazo controlados con placebo utilizados para evaluar y presentar todos los datos de seguridad para dapagliflozina con la excepción de afecciones, pruebas hepáticas e hipoglucemia (evaluados por medio de un estudio individual). Este análisis incluyó estudios de monoterapia, varios estudios de adición (metformina, sulfonilúrea, pioglitazona, inhibidor de DPP4, insulina, y dos estudios con una combinación de terapias de adición), y un estudio de combinación inicial de metformina. En los 13 estudios se trató a 2360 pacientes una vez al día con dapagliflozina 10 mg y a 2295 con placebo (ya sea como monoterapia o en combinación con otras terapias antidiabéticas).
Estos 13 estudios proporcionan una duración promedio de exposición de 22 semanas. La edad promedio de la población fue de 59 años y 4% fueron mayores de 75 años. Cincuenta y ocho por ciento (58%) de la población fue de sexo masculino; 84% blanca, 9% asiática y 3% negra o afroamericana. Al inicio, la población había padecido de diabetes durante un promedio de 9 años, el promedio de HbA1c era de 8.2% y la función renal era normal o ligeramente insuficiente en 88% de los pacientes y moderadamente insuficiente en 11% de los pacientes.
Estudios activos y controlados con placebo: El segundo es un grupo de pacientes de 21 estudios activos controlados con placebo utilizados para evaluar y presentar los datos por afecciones y pruebas hepáticas. En este grupo, 5936 pacientes fueron tratados con dapagliflozina 10 mg y 3403 con el control (ya sea como monoterapia o en combinación con otras terapias antidiabéticas).
Estos 21 estudios proporcionaron una duración de exposición promedio a dapagliflozina 10 mg de 55 semanas (6247 años paciente). En ambos grupos de tratamiento, la edad promedio de la población fue de 58 años y 3.5% fue mayor a 75 años. Cincuenta y seis por ciento (56%) de la población era de sexo masculino; 77% era blanca, 16% era asiática y 4% era negra o afroamericana. Al inicio, la población había padecido e diabetes durante un promedio de 7 años, 34% de los pacientes tenía antecedentes de enfermedad cardiovascular, el HbA1c promedio era de 8.2%, y la función renal inicial era normal o ligeramente insuficiente en 89% de los pacientes y moderadamente insuficiente en 11% de los pacientes.
También se evaluó dapagliflozina a 5 mg en un grupo de pacientes de 12 estudios a corto plazo controlados con placebo que incluyeron 1145 pacientes tratados con 5 mg dapagliflozina como monoterapia o en combinación con otra terapia antidiabética (exposición promedio = 22 semanas) y 1393 pacientes tratados con placebo como monoterapia o en combinación con otra terapia antidiabética (exposición promedio = 21 semanas).Todos los datos de seguridad presentados en dapagliflozina a 5 mg pertenecen a este análisis.
La incidencia general de eventos adversos para el análisis de 13 estudios a corto plazo controlados con placebo (tratamiento a corto plazo) en pacientes tratados con dapagliflozina 10 mg fue de 60.0% en comparación con 55.7% para el grupo de placebo. La suspensión de la terapia debido a eventos adversos en pacientes que habían recibido dapagliflozina 10 mg fue de 4.3% en comparación con 3.6% para el grupo de placebo. Los eventos reportados más comúnmente que provocaron la suspensión y reportados en al menos 3 pacientes tratados con dapagliflozina 10 mg fueron insuficiencia renal (0.8%), reducción en la depuración de creatinina (0.6%), creatinina sanguínea incrementada (0.3%), infecciones de las vías urinarias (0.2%) y micosis vulvovaginal (0.1%).
Las reacciones adversas reportadas en este grupo de 13 estudios controlados con placebo (sin importar la valoración de causalidad del investigador) en =2% de los pacientes tratados con 10 mg de dapagliflozina, y =1% más frecuentemente que en pacientes tratados con placebo, se muestran en la Tabla 2.
|
Tabla 2. Reacciones adversas (sin importar la valoración de causalidad del investigador) en estudios controlados con placebo reportados en =2% de los pacientes tratados con XIGDUO 10 mg, y =1% más frecuentemente que en pacientes tratados con placebo y metformina (excluyendo hipoglucemia)*,† |
|
|
Grupo sistémico |
XIGDUO® 10 mg N=2360 |
|
Infecciones e infestaciones Infección genital ‡ |
Común |
|
Infecciones e infestaciones Infección de las vías urinarias§ |
Común |
|
Trastornos musculoesqueléticos y de tejido conjuntivo Dolor en espalda |
Común |
|
Trastornos urinarios Poliuria¶ |
Común |
|
* Los 13 estudios controlados con placebo incluyeron 3 monoterapias, 1 combinación de inicio con metformina, 2 adiciones a la metformina, 2 adiciones a la insulina, 1 adición a la pioglitazona, 1 adición a la sitagliptina, 1 adición a la glimepirida, y 2 estudios con terapia de adición en combinación. La tabla muestra los datos de hasta 24 semanas (corto plazo) sin importar el rescate glicémico. † Para obtener información sobre hipoglucemia ver la subsección Hipoglucemia. ‡ Infección genital incluye los siguientes términos preferidos, enumerados en orden de frecuencia de reporte: Infección micótica vulvovaginal, balanitis, infección vaginal, micosis genital, infección genital, candidiasis vulvovaginal, balanitis candidiásica, vulvovaginitis, candidiasis genital, vulvitis, balanopostitis, infección genital masculina, infección del tracto genitourinario, absceso peneano, infección peneana, postitis, absceso vulvar y vaginitis bacteriana. § Infección de las vías urinarias incluye los siguientes términos preferidos, enumerados en orden de frecuencia de reporte: Infección de las vías urinarias, cistitis, infección de las vías urinarias por Escherichia, infección del tracto genitourinario, pielonefritis, trigonitis, uretritis, infección renal y prostatitis. ¶ Poliuria incluye los términos preferidos, enumerados en orden de frecuencia de reporte: Polaquiuria, poliuria y micción incrementada. |
|
Se revisaron, por esquema de tratamiento, reacciones adversas adicionales en =5% de los pacientes tratados con dapagliflozina 10 mg, =1% más que pacientes en placebo/comparador, y reportadas en al menos tres pacientes más tratados con dapagliflozina 10 mg sin importar la relación con dapagliflozina reportada por el investigador. El único estudio con un componente de tratamiento de metformina que cumple con este criterio fue la adición a la metformina: Cefalea (5.3% dapagliflozina 10 mg y 3.1% placebo).
En un estudio específico de pacientes con insuficiencia renal moderada, se reportaron 13 pacientes con un evento adverso de fractura ósea hasta la Semana 104, 8 de los cuales ocurrieron en el grupo de dapagliflozina 10 mg. Ocho (8) de estas 13 fracturas fueron en pacientes que presentaban una VFGe de 30 a 45 mL/min/1.73 m2 y 11 de estas 13 fracturas se reportaron dentro de las primeras 52 semanas. No hubo un patrón aparente en relación con el sitio de fractura. En la Semana 52 y de forma continua hasta la Semana 104, en este estudio se observaron mayores incrementos los niveles medios de hormona paratiroidea (HPT) y fósforo sérico para pacientes tratados con dapagliflozina 10 mg en comparación con placebo, donde los valores iniciales de estos analitos fueron mayores.
Hipovolemia: Se reportaron eventos relacionados con la hipovolemia (incluyendo reportes de deshidratación, hipovolemia o hipotensión) en 1.1% y 0.7% de los pacientes que recibieron dapagliflozina 10 mg y placebo, respectivamente, en el análisis de 13 estudios a corto plazo controlados con placebo. Ocurrieron eventos graves en =0.2% de pacientes en los 21 estudios activos controlados con placebo (dapagliflozina como monoterapia o en combinación con otras terapias antidiabéticas) con similar incidencia para dapagliflozina 10 mg y el comparador. En los análisis de subgrupos de pacientes que recibían diuréticos de asa o de =65 años de edad en el grupo de 13 estudios controlados con placebo, la proporción de pacientes con eventos relacionados con la hipovolemia fue ligeramente mayor en pacientes tratados con dapagliflozina 10 mg que en aquellos tratados con placebo (eventos en pacientes con diuréticos de asa: 2.5% frente a 1.5%; eventos en pacientes de =65 años de edad: 1.7% frente a 0.8%, respectivamente).
Los eventos relacionados con la hipovolemia se reportaron en 0.6% de pacientes que recibieron dapagliflozina 5 mg en comparación con 0.4% que recibieron placebo en el análisis de 12 estudios a corto plazo controlados con placebo. Ningún paciente con diuréticos de asa y solo 1 paciente de =65 años de edad (0.5%) presentaron un evento relacionado con la hipovolemia durante el tratamiento con dapagliflozina 5 mg en comparación con 1 paciente en diuréticos de asa (1.8%) y 1 paciente de =65 años de edad (0.4%) tratados con placebo (ver secciones Posología y método de administración y Advertencias y precauciones especiales de uso).
Adicionalmente, en el subgrupo de pacientes con insuficiencia renal moderada con eGHR de =45 a <60 mL/min/1.73 m2, la proporción de pacientes con eventos relacionados con la hipovolemia fue mayor en pacientes tratados con dapagliflozina 10 mg (4.7%) y dapagliflozina 5 mg (2.3%) que en aquellos tratados con placebo (1.4%).
Infecciones genitales: Se reportaron eventos de infecciones genitales en 5.5% y 0.6% de los pacientes que recibieron dapagliflozina 10 mg y placebo, respectivamente, en el análisis de 13 estudios a corto plazo controlados con placebo. Los eventos de infecciones genitales reportados en pacientes tratados con dapagliflozina 10 mg fueron de leves a moderados. La mayoría de los eventos de infecciones genitales respondieron a un ciclo inicial de tratamiento estándar y rara vez provocaron la suspensión del estudio (0.2% con dapagliflozina 10 mg frente a 0% con placebo). Las infecciones fueron reportadas más frecuentemente en mujeres (8.4% con dapagliflozina 10 mg frente a 1.2% con placebo) que en hombres (3.4% con dapagliflozina 10 mg frente a 0.2% con placebo). Las infecciones vaginales más frecuentemente reportadas fueron micosis vulvovaginales en mujeres y balanitis en hombres.
En 9 de los 13 estudios del grupo de control con placebo se contó con datos de tratamiento a largo plazo. Para este grupo de control con placebo a corto plazo y a largo plazo (la duración promedio del tratamiento fue de 439.5 días para dapagliflozina 10 mg y 419.0 días para placebo), las proporciones de pacientes con eventos de infecciones genitales fueron 7.7% (156/2026) en el grupo de dapagliflozina 10 mg y 1.0% (19/1956) en el grupo de placebo. De los 156 pacientes tratados con dapagliflozina 10 mg que tuvieron una infección, 106 (67.9%) tuvieron solo una y 17 (10.9%) tuvieron tres o más. De los 19 pacientes tratados con placebo que tuvieron una infección, 17 (89.5%) tuvieron solo una y ninguno tuvo 3 o más.
En el análisis de 13 estudios a corto plazo controlados con placebo, durante el estudio, los pacientes que tenían antecedentes de infección genital recurrente fueron más propensos a presentar un evento de infección genital (33.3% de los pacientes con antecedentes de infección tratada con dapagliflozina 10 mg y 9.5% de pacientes con antecedentes de infección en placebo) que aquellos sin antecedentes de infección (5.2% con dapagliflozina 10 mg y 0.5% con placebo).
En general, el tratamiento con 5 mg dapagliflozina fue similar al tratamiento con XIGDUO®10 mg.
Infecciones de las vías urinarias: Se reportaron eventos de infecciones de las vías urinarias en 4.7% y 3.5% de pacientes que recibieron dapagliflozina 10 mg y placebo, respectivamente, en el análisis de 13 estudios a corto plazo controlados con placebo. La mayoría de los eventos de infecciones de las vías urinarias reportados en pacientes tratados con dapagliflozina 10 mg fueron leves o moderados. La mayoría de los pacientes respondieron a un ciclo inicial de tratamiento estándar, y las infecciones de las vías urinarias raramente incitaron a la suspensión del estudio (0.2% dapagliflozina 10 mg frente a 0.1% placebo). Las infecciones se reportaron más frecuentemente en mujeres (8.5% dapagliflozina 10 mg frente a 6.7% placebo) que en hombres (1.8% dapagliflozina 10 mg frente a 1.3% placebo).
En 9 de los 13 estudios del análisis de control con placebo, se contó con los datos del tratamiento a largo plazo. Para este análisis de control con placebo a corto plazo y a largo plazo (la duración promedio del tratamiento fue de 439.5 días para dapagliflozina 10 mg y 419.0 días para placebo), las proporciones de pacientes con eventos de infecciones de las vías urinarias fueron 8.6% (174/2026) en el grupo de dapagliflozina 10 mg y 6.2% (121/1956) en el grupo de placebo. De los 174 pacientes tratados con dapagliflozina 10 mg que presentaron una infección, 135 (77.6%) tuvieron solo una y 11 (6.3%) tuvieron 3 o más. De los 121 pacientes tratados con placebo que presentaron una infección, 94 (77.7%) tuvieron solo una y 12 (9.9%) tuvieron 3 o más.
En el análisis de 13 estudios a corto plazo controlados con placebo, los pacientes que tenían antecedentes de infección recurrente de las vías urinarias fueron más propensos a presentar un evento de infección de las vías urinarias (6.0% de pacientes con antecedentes de infección tratados con dapagliflozina 10 mg y 5.9% de pacientes con antecedentes de infección en placebo) durante el estudio que aquellos sin antecedentes de infección (4.4% con dapagliflozina 10 mg y 3.0% con placebo).
En general, el tratamiento con dapagliflozina 5 mg fue similar al tratamiento con dapagliflozina 10 mg.
Hipoglucemia: La frecuencia de hipoglucemia dependía del tipo de terapia de base utilizada en cada estudio. Los estudios de dapagliflozina que incluyeron sulfonilúrea o insulina como terapia de adición o de base tuvieron velocidades mayor incidencia de hipoglucemia con el tratamiento de dapagliflozina que con el tratamiento de placebo (ver sección Advertencias y precauciones especiales de uso).
En estudios de dapagliflozina en terapia combinada inicial con metformina, adicionada a metformina sola o añadida a sitagliptina (con o sin metformina), o en combinación con saxagliptina y metformina, la frecuencia de pacientes con episodios menores de hipoglicemia fue similar (<5%) entre los grupos de tratamiento, incluyendo placebo, hasta por 102 semanas de tratamiento. A través de todos los estudios de dapagliflozina y metformina que no incluyeron una sulfonilúrea o insulina, solo ocurrió un evento mayor de hipoglicemia en un paciente que recibió dapagliflozina 10 mg y sitagliptina (sin metformina).
En el estudio de adición a la combinación, con metformina y una sulfonilúrea hasta por 52 semanas, no hubo episodios de hipoglicemia mayor reportada. Se reportaron episodios menores de hipoglicemia en el 15.6% de pacientes tratados con dapagliflozina 10 mg más metformina y una sulfomilúrea, y 4.6% de pacientes tratados con placebo más metformina y una sulfonilúrea.
En el estudio de adición a la metformina que comparó dapagliflozina a glipizida durante 208 semanas, hubo 3 episodios (0.7%) de hipoglucemia importante en pacientes tratados con glipizida más metformina y ninguno de los pacientes tratados con dapagliflozina más metformina. Se reportaron episodios menores de hipoglucemia en 3.2% de los pacientes tratados con dapagliflozina más metformina y 45.6% de pacientes tratados con glipizida más metformina.
En el estudio de adición a la insulina (con o sin 2 agentes adicionales orales antidiabéticos incluyendo metformina) que comparó dapagliflozina 10 mg más insulina con placebo más insulina durante 24 semanas, hubo 1 (0.5%) episodio de hipoglucemia importante en un paciente tratado con dapagliflozina 10 mg más insulina y 1 (0.5%) episodio en un paciente tratado con placebo más insulina. En la Semana 104, se reportaron episodios importantes de hipoglucemia en 1.0% y 0.5% de los pacientes tratados con dapagliflozina 10 mg o placebo como adición a la insulina, respectivamente. Se reportaron episodios menores en 40.3% de los pacientes tratados con dapagliflozina 10 mg más insulina y en 34% de los pacientes tratados con placebo más insulina durante 24 semanas. En la Semana 104, se reportaron episodios menores en 53.1% y 41.6% de los pacientes tratados con dapagliflozina 10 mg o placebo como adición a la insulina, respectivamente. En 2 estudios adicionales que también incluyeron una gran proporción de pacientes que recibieron insulina como terapia de base (sola o con uno o más tratamientos orales antidiabéticos) (ver sección Propiedades farmacodinámicas), la incidencia de episodios menores de hipoglucemia también incrementó en pacientes tratados con dapagliflozina 10 mg en comparación con aquellos tratados con placebo.
Tumores: En el análisis de 21 estudios activos controlados con placebo (dapagliflozina como monoterapia o en combinación con otras terapias antidiabéticas), la proporción general de pacientes con tumores malignos o no especificados fue similar entre aquellos tratados con dapagliflozina (1.50%) y placebo/comparador (1.50%), y no hubo señal de carcinogenia o mutagenia en datos de animales (ver sección Datos de seguridad preclínica). Cuando se consideran los casos de tumores que ocurren en los diferentes grupos sistémicos, el riesgo relativo asociado con dapagliflozina estuvo por arriba de 1 para algunos tipos de tumor (por ejemplo, vesícula biliar, y pecho) y por debajo de 1 para otros (por ejemplo, sangre y sistema linfático, ovarios, tubo renal). Ni el incremento ni la reducción del riesgo fueron significativos estadísticamente en ninguno de los grupos sistémicos. Considerando la falta de hallazgos de tumor en estudios no clínicos así como la latencia corta entre la primera exposición al medicamento y el diagnóstico de tumor, se considera improbable una relación causal con cualquier tipo de tumor específico.
Pruebas de función hepática: En el análisis de 21 estudios activos controlados con placebo (dapagliflozina como monoterapia o en combinación con otras terapias antidiabéticas), no hubo desequilibrio en los grupos de tratamiento en la incidencia de elevaciones de aminotransferasa de alanina sérica (ALT) o aminotransferasa de aspartato (AST). Se reportó aminotransferasa de alanina (ALT) >3 veces el LSN en 1.2% de los pacientes tratados con dapagliflozina 10 mg y 1.6% tratados con el comparador. Se reportó aminotransferasa de alanina o AST >3 veces el LSN y bilirrubina >2 veces el LSN en 7 pacientes (0.1%) en cualquier dosis de dapagliflozina, 5 pacientes (0.2%) con dapagliflozina 10 mg, y 4 pacientes (0.1%) con el comparador.
Eventos relacionados con función renal disminuida: En el conjunto de 13 estudios a corto plazo, placebo-controlados, se agruparon los términos reportados referentes a eventos relacionados con función renal disminuida (por ej., depuración de creatinina renal disminuida, daño renal, aumento de la creatinina sérica, y disminución del índice de filtración glomerular). Este grupo de eventos fue reportado en 3.2% y 1.8% de pacientes que recibieron dapagliflozina 10 mg y placebo, respectivamente. En pacientes con función renal normal, o daño renal leve (eGFR 30 =60 mL/min/1.73m2) se reportaron eventos relacionados con función renal disminuida en 1.3% y 0.8% de pacientes que recibieron dapagliflozina 10 mg y placebo, respectivamente. Los eventos relacionados con función renal disminuida fueron más frecuentes en pacientes con eGFR =30 y <60 mL/min/1.73m2 (18.5% dapagliflozina 10 mg vs. 9.3% placebo).
La creatinina sérica se evaluó adicionalmente en aquellos pacientes con eventos relacionados con función renal disminuida, y la mayoría de incrementos en la creatinina fueron =0.5 mg/dL a partir del nivel basal. Los incrementos en la creatinina fueron por lo general transitorios durante el tratamiento continuo, o reversibles después de descontinuar el tratamiento.
En el conjunto de 13 estudios a corto plazo, placebo-controlados, los niveles promedio de creatinina sérica aumentaron una pequeña cantidad a la Semana 1 (cambio promedio desde el nivel basal: 0.041 mg/dL dapagliflozina vs. -0.008 mg/dL placebo) y disminuyeron hacia el nivel basal hacia la Semana 24 (cambio promedio desde el nivel basal: 0.019 mg/dL dapagliflozina 10 mg vs. 0.008 mg/dL placebo). No se produjeron más cambios hasta la Semana 102.
Seguridad cardiovascular: Se realizó un metanálisis de eventos cardiovasculares a lo largo de 21 estudios activos controlados con placebo (dapagliflozina como monoterapia o en combinación con otras terapias antidiabéticas). Los eventos cardiovasculares se adjudicaron por medio de un comité independiente de adjudicación. El criterio de valoración primario fue el momento del primer evento de los siguientes resultados: Muerte cardiovascular, accidente vascular cerebral, infarto de miocardio, y hospitalización por angina inestable. Los eventos primarios ocurrieron a una proporción de 1.62 por 100 años paciente en pacientes tratados con dapagliflozina y 2.06 en pacientes tratados con el comparador por cada 100 años/paciente. La relación de riesgo de dapagliflozina frente a la del comparador fue de 0.79 (intervalo de confianza al 95%; 0.58, 1.07). El tratamiento con dapagliflozina no está asociado con un incremento en el riesgo cardiovascular en pacientes con diabetes mellitus tipo 2.
Monoterapia-clorhidrato de metformina: Las reacciones adversas más comunes en ensayos clínicos controlados con placebo reportados en >5% de los pacientes tratados con clorhidrato de metformina de liberación prolongada y más comúnmente que en los pacientes tratados con placebo incluyeron diarrea y náusea/vómito (ambos muy comunes).
Experiencia posterior a la comercialización: No aplica.
Signos vitales
Dapagliflozina: En el análisis de 13 estudios controlados con placebo, se observó una reducción de la presión en pacientes tratados con dapagliflozina 10 mg (cambio promedio en la presión arterial sistólica en sedestación a partir del valor inicial en la Semana 24 de -3.7 mmHg y cambio promedio en la presión arterial diastólica en sedestación de -1.8 mmHg para dapagliflozina 10 mg frente al cambio en la presión arterial sistólica de -0.5 mmHg y diastólica -0.5 mm para el grupo de placebo). La medición de la presión arterial postural reveló hipotensión ortostática en 13.1% de los pacientes tratados con dapagliflozina 10 mg frente a 11.3% de pacientes tratados con placebo durante un periodo de tratamiento de 24 semanas. Adicionalmente, en 2 estudios de pacientes con diabetes tipo 2 e hipertensión, la medición de presión arterial postural reveló hipotensión ortostática en 3.2% de los pacientes tratados con dapagliflozina 10 mg frente a 1.7% de los pacientes tratados con placebo en los 2 estudios durante un periodo de tratamiento de 12 semanas (ver sección Propiedades farmacodinámicas).
No se han observado otros cambios clínicamente significativos en los signos vitales de pacientes tratados con dapagliflozina.
Hallazgos de laboratorio
Hematocrito
Dapagliflozina: En el análisis de 13 estudios controlados con placebo, se observaron incrementos a partir del valor inicial en los valores promedio de hematocrito en pacientes tratados con dapagliflozina comenzando en la Semana 1 y continuando hasta la Semana 16, cuando se observó la diferencia promedio máxima a partir del valor inicial. En la Semana 24, los cambios promedio a partir del valor inicial en hematocrito fueron de 2.30% en el grupo de dapagliflozina 10 mg frente a -0.33% en el grupo de placebo. En la Semana 102, los cambios promedio fueron de 2.68% frente a -0.46%, respectivamente. Para la Semana 24, los valores de hematocrito de >55% se reportaron en 1.3% de los pacientes tratados con dapagliflozina 10 mg frente a 0.4% de los pacientes tratados con placebo. Los resultados fueron similares durante la fase a corto plazo y a largo plazo (la mayoría de los pacientes estuvieron expuestos al tratamiento durante más de un año).
Fósforo inorgánico sérico
Dapagliflozina: En el análisis de 13 estudios controlados con placebo, se reportaron incrementos a partir del valor inicial en los niveles promedio de fósforo sérico en la Semana 24 en pacientes tratados con dapagliflozina 10 mg en comparación con los pacientes tratados con placebo (incrementos promedios de 0.13 mg/dL frente a -0.04 mg/dL, respectivamente). Se observaron resultados similares en la Semana 102. Se reportaron mayores proporciones de pacientes con anomalías marcadas de laboratorio de hiperfosfatemia (=5.6 mg/dL si la edad era de 17 a 65 o =5.1 mg/dL si la edad era de =66) en el grupo de dapagliflozina 10 mg frente a placebo en la Semana 24 (1.7% frente a 0.9%, respectivamente) y durante la fase a corto plazo y a largo plazo (3.0% frente a 1.6%, respectivamente). Se desconoce la importancia clínica de estos hallazgos.
Lípidos
Dapagliflozina: En el análisis de 13 estudios controlados con placebo, se reportaron pequeños cambios a partir del valor inicial en los valores promedio de lípidos en la Semana 24 en pacientes tratados con dapagliflozina 10 mg en comparación con pacientes tratados con placebo. El cambio porcentual promedio a partir del valor inicial en la Semana 24 para dapagliflozina 10 mg frente a placebo, respectivamente, fue el siguiente: Colesterol total, 2.5% frente a 0.0%; colesterol HDL, 6.0% frente a 2.7%; colesterol LDL, 2.9% frente a -1.0%; triglicéridos, -2.7% frente a -0.7%. El cambio porcentual promedio a partir del valor inicial en la Semana 102 para dapagliflozina 10 mg frente a placebo, respectivamente, fue el siguiente: Colesterol total, 2.1% frente a -1.5%; colesterol HDL, 6.6% frente a 2.1%; colesterol LDL, 2.9% frente a -2.2%; triglicéridos, -1.8% frente a -1.8% La proporción entre el colesterol LDL y HDL disminuyó para ambos grupos de tratamiento en la Semana 24.
Niveles de vitamina B12
Clorhidrato de metformina: En ensayos clínicos controlados de metformina con una duración de 29 semanas, se observó una disminución a niveles subnormales de los niveles de vitamina B12 sérica previamente normales, sin manifestaciones clínicas, en aproximadamente 7% de los pacientes. Sin embargo, tal reducción, posiblemente causada por la interferencia con la absorción de B12 del complejo de factor intrínseco B12, muy raramente se asocia con anemia y parece ser reversible rápidamente con la suspensión de metformina o suplemento de vitamina B12 (ver sección Advertencias y precauciones especiales de uso).
INCOMPATIBILIDADES: No aplica.
Vida útil: Ver empaque del producto.
Almacenamiento: Este medicamento no requiere condiciones especiales de almacenamiento. Ver el empaque.
Venta con fórmula médica. Mantener fuera del alcance de los niños.
INTERACCIÓN CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN
Interacción con dapagliflozina y metformina: La coadministración de dosis múltiples de dapagliflozina y metformina no alteró significativamente la farmacocinética ni de dapagliflozina ni de metformina en personas sanas.
No ha habido estudios formales de interacción para XIGDUO® XR o XIGDUO® IR. Las siguientes declaraciones reflejan la información disponible sobre las sustancias activas individuales.
Interacciones medicamentosas con dapagliflozina: El metabolismo de dapagliflozina es mediado principalmente por la conjugación glucurónida dependiente de UGT1A9. El metabolito principal, dapagliflozina 3-O-glucurónido, no es un inhibidor de SGLT2.
En los estudios in vitro, ni dapagliflozina ni dapagliflozina 3-O-glucurónido inhibieron CYP 1A2, 2C9, 2C19, 2D6, 3A4, ni indujeron CYP1A2, 2B6 o 3A4. Por lo tanto, no se espera que dapagliflozina altere la depuración metabólica de medicamentos coadministrados que se metabolizan por medio de estas enzimas, y no se espera que los medicamentos que inhiben o inducen estas enzimas alteren la depuración metabólica de dapagliflozina. Dapagliflozina es un sustrato débil del transportador activo de glicoproteína-P (P-gp) y dapagliflozina 3-O-glucurónido es un sustrato para el transportador activo OAT3. Dapagliflozina y dapagliflozina 3-O-glucurónido no inhibieron significativamente a los transportadores activos P-gp, OCT2, OAT1, u OAT3. En general, es poco probable que dapagliflozina afecte la farmacocinética de los medicamentos administrados simultáneamente que sean sustratos P-gp, OCT2, OAT1, u OAT3.
Efecto de otros medicamentos en dapagliflozina: En estudios realizados en personas sanas, la farmacocinética de dapagliflozina no se vio alterada por pioglitazona (un sustrato de CYP2C8 [mayor] y CYP3A4 [menor], sitagliptina (un sustrato de hOAT-3 y sustrato de P-glicoproteína), glimepirida, voglibosa, hidroclorotiazida, bumetanida, valsartán, o simvastina. Después de la coadministración de dapagliflozina con rifampicina (un inductor de varios transportadores activos y enzimas metabolizadoras de medicamentos) o ácido mefenámico (un inhibidor de UGT1A9), se observó una reducción de 22% y un incremento de 51%, respectivamente, en la exposición sistémica de dapagliflozina, pero sin un efecto clínicamente significativo en la excreción urinaria de glucosa de 24 horas para ninguno de estos casos.
Pioglitazona: La coadministración de una dosis de dapagliflozina (50 mg) y pioglitazona (45 mg), un sustrato de CYP2C8 (mayor) y CYP3A4 (menor), no alteró la farmacocinética de dapagliflozina. Por lo tanto, no se esperan interacciones significativas de dapagliflozina con otros sustratos de CYP2C8.
Sitagliptina: La coadministración de una dosis de dapagliflozina (20 mg) y sitagliptina (100 mg), un sustrato de hOAT-3, no alteró la farmacocinética de dapagliflozina. Por lo tanto no se esperan interacciones significativas de dapagliflozina con otros sustratos de hOAT-3.
Glimepirida: La coadministración de una dosis de dapagliflozina (20 mg) y glimepirida (4 mg), un sustrato de CYP2C9, no alteraron la farmacocinética de dapagliflozina. Por lo tanto no se esperan interacciones significativas de dapagliflozina con otros sustratos de CYP2C9.
Voglibosa (inhibidor de a-glucosidasa): La coadministración de una dosis de dapagliflozina (10 mg) y voglibosa (0.2 mg tres veces al día) no alteraron la farmacocinética de dapagliflozina.
Hidroclorotiazida: La coadministración de una dosis de dapagliflozina (50 mg) e hidroclorotiazida (25 mg) no alteró la farmacocinética de dapagliflozina.
Bumetanida: La coadministración de dosis múltiples una vez al día de dapagliflozina (10 mg) y dosis múltiples una vez al día de bumetanida (1 mg) no alteraron la farmacocinética de dapagliflozina. La coadministración de dapagliflozina y bumetanida no alteró de forma significativa el efecto farmacodinámico de dapagliflozina para incrementar la excreción de glucosa urinaria en personas sanas.
Valsartán: La coadministración de una dosis de dapagliflozina (20 mg) y valsartán (320 mg) no alteró la farmacocinética de dapagliflozina.
Simvastatina: La coadministración de una dosis de dapagliflozina (20 mg) y simvastatina (40 mg), un sustrato de CYP3A4, no alteró la farmacocinética de dapagliflozina. Por lo tanto no se esperan interacciones significativas de dapagliflozina con otros sustratos de CYP3A4.
Rifampina: La coadministración de una dosis de dapagliflozina (10 mg) y rifampina (rifampicina), un inductor de varios transportadores activos y enzimas metabolizadoras de medicamentos, dosificadas a un estado estable (600 mg/día) provocó una reducción de la Cmáx y del ABC de dapagliflozina de 7% y 22%, respectivamente. La cantidad promedio de glucosa excretada en la orina durante 24 horas después de la dapagliflozina sola (51 g) no se vio afectada notablemente por la coadministración de rifampina (45 g). No se recomienda ajustar la dosis de dapagliflozina cuando la dapagliflozina se coadministre con rifampina.
Ácido mefenámico: La coadministración de una dosis única de dapagliflozina (10 mg) y ácido mefenámico, un inhibidor de UGT1A9, dosificada a un estado estable (250 mg cada 6 horas) provocó un incremento de la Cmáx y el ABC de dapagliflozina en 13% y 51%, respectivamente. La cantidad promedio de glucosa excretada en la orina durante 24 horas después de la administración de dapagliflozina sola no se vio afectada notablemente por la coadministración de ácido mefenámico. No se recomienda ajustar la dosis de dapagliflozina cuando la dapagliflozina se coadministre con ácido mefenámico.
Efecto de dapagliflozina en otros medicamentos: En estudios realizados en personas sanas, como se describe a continuación, la dapagliflozina no alteró la farmacocinética de pioglitazona, sitagliptina, glimepirida, hidroclorotiazida, bumetania, valsartán, simvastatina, digoxina o warfarina.
Pioglitazona: La coadministración de una dosis de dapagliflozina (50 mg) y pioglitazona (45 mg), un sustrato de CYP2C8 (mayor) y CYP3A4 (menor), no alteró la farmacocinética de pioglitazona. Por lo tanto dapagliflozina no inhibe significativamente el metabolismo mediado por CYP2C8.
Sitagliptina: La coadministración de una dosis de dapagliflozina (20 mg) y sitagliptina (100 mg), un sustrato de hOAT-3, no alteró la farmacocinética de sitagliptina. Por lo tanto, dapagliflozina no es un inhibidor de vías de transporte de hOAT-3.
Glimepirida: La coadministración de una dosis de dapagliflozina (20 mg) y glimepirida (4 mg), un sustrato de CYP2C9, no alteró la farmacocinética de glimepirida. Por lo tanto, dapagliflozina no es un inhibidor del metabolismo mediado por CYP2C9.
Hidroclorotiazida: La coadministración de una dosis de dapagliflozina (50 mg) e hidroclorotiazida (25 mg) no alteró la farmacocinética de hidroclorotiazida.
Bumetanida: La coadministración de una dosis múltiple una vez al día de dapagliflozina (10 mg) y dosis múltiples una vez al día de bumetanida (1 mg) incrementó el valor tanto de la Cmáx como del ABC de bumetanida un 13%. La coadministración de dapagliflozina no alteró significativamente las respuestas farmacodinámicas en estado estable (excreción urinaria sódica, volumen de orina) a la bumetanida en personas sanas.
Valsartán: La coadministración de una dosis única de dapagliflozina (20 mg) y valsartán (320 mg) no alteró la farmacocinética de valsartán.
Simvastatina: La coadministración de una dosis única de dapagliflozina (20 mg) y simvastatina (40 mg), un sustrato de CYP3A4, no afectó la Cmáx de simvastatina pero incrementó el ABC un 20%, lo cual no se consideró clínicamente relevante. Por lo tanto dapagliflozina no inhibe significativamente el metabolismo mediado por CYP3A4.
Digoxina: La coadministración de dapagliflozina (10 mg una vez al día después de una dosis de saturación de 20 mg) y una dosis única de digoxina (0.25 mg), un sustrato de P-glucoproteína, no afectó la farmacocinética de digoxina. Por lo tanto, dapagliflozina no inhibe o induce significativamente el transporte mediado por P-gp.
Warfarina: La coadministración de dapagliflozina (10 mg una vez al día después de una dosis inicial de saturación de 20 mg) y una dosis única de warfarina (25 mg) no afectó la farmacocinética de S-warfarina, un sustrato de CYP2C19. Por lo tanto, dapagliflozina no inhibe o induce significativamente el metabolismo mediado por CYP2C19. Dapagliflozina tampoco afectó la farmacocinética de R-warfarina ni la actividad anticoagulante de warfarina como se midió por medio del tiempo de protrombina (Relación Normalizada Estándar [INR]).
Interacciones medicamentosas con metformina
Medicamentos catiónicos
Clorhidrato de metformina: Los medicamentos catiónicos (p.ej., amilorida, digoxina, morfina, procainamida, quinidina, quinina, ranitidina, triamtereno, trimetoprima o vancomicina) que se eliminan por secreción tubular renal teóricamente tienen el potencial para interactuar con metformina al competir por sistemas comunes de transporte tubular renal. Se ha observado dicha interacción entre metformina y cimetidina oral en voluntarios sanos normales en estudios de interacción medicamentosa demetformina-climetidina tanto de dosis única como múltiple, con un incremento de 60% en el plasma de metformina pico y concentraciones sanguíneas totales y un incremento de 40% del ABC de metformina plasmática y sanguínea total. No hubo cambio en vida media de eliminación en el estudio de dosis única. La metformina no afectó la farmacocinética de cimetidina. Si bien dichas interacciones siguen siendo teóricas (excepto para cimetidina), se recomienda monitorear de cerca a los pacientes y ajustar la dosis de metformina y/o el medicamento de interferencia en pacientes que estén tomando medicamentos catiónicos que se excretan por medio del sistema de secreción tubular renal proximal.
Gliburida
Clorhidrato de metformina: En un estudio de interacción de dosis única en pacientes con diabetes tipo 2, la coadministración de metformina y gliburida no provocó ningún cambio en la farmacocinética o farmacodinamia de metformina. Se observaron disminuciones en el ABC y la concentración máxima (Cmáx) de gliburida, pero variaban constantemente. La naturaleza de dosis única de este estudio y la falta de correlación entre los niveles sanguíneos de gliburida y los efectos farmacodinámicos tornan incierta la importancia clínica de esta interacción.
Furosemida
Clorhidrato de metformina: Un estudio de interacción medicamentosa de metformina-furosemida de dosis única en personas sanas demostró que los parámetros farmacocinéticos de ambos compuestos se vieron afectados por la coadministración. La furosemida incrementó la Cmáx plasmática sanguínea de metformina un 22% y el ABC sanguínea un 15%, sin ningún cambio significativo en la depuración renal de metformina. Cuando se administró con metformina, la Cmáx y el ABC de furosemida fueron 31% y 12% menores, respectivamente, que cuando se administró sola, y la vida media terminal disminuyó 32%, sin ningún cambio significativo en la depuración renal de furosemida. No hay información disponible acerca de la interacción de metformina y furosemida cuando se administró crónicamente.
Nifedipina
Clorhidrato de metformina: Un estudio de interacción medicamentosa de metformina-nifedipina de dosis única en voluntarios sanos normales demostró que la coadministración de nifedipina incrementó la Cmáx y el ABC plasmática de metformina en 20% y 9%, respectivamente, e incrementó la cantidad excretada en la orina. El Tmáx y la vida media no se vieron afectados. Nifedipina parece mejorar la absorción de metformina. La metformina tuvo efectos mínimos en nifedipina.
Uso con otros medicamentos
Clorhidrato de metformina: Ciertos medicamentos tienden a producir hiperglucemia y pueden generar pérdida del control glicémico. Estos medicamentos incluyen las tiazidas y otros diuréticos, corticosteroides, fenotiazinas, productos para la tiroides, estrógenos, anticonceptivos orales, fenitoina, ácido nicotínico, simpaticomiméticos, medicamentos bloqueadores de los canales de calcio, e isoniazida. Cuando dichos medicamentos se administran a un paciente que recibe metformina, se debe observar de cerca al paciente para evitar una pérdida de control de la glucosa en la sangre. Cuando dichos medicamentos se le retiran a un paciente que reciben metformina, debe observarse de cerca al paciente para evitar hipoglucemia.
En voluntarios sanos, la farmacocinética de metformina y propranolol, y metformina e ibuprofeno no se vio afectada cuando se coadministraron en estudios de interacción de dosis única.
La metformina está mínimamente unida a las proteínas plasmáticas y, por lo tanto, es poco probable que interactúe con medicamentos altamente unidos a proteínas tales como los salicilatos, sulfonamidas, cloranfenicol, y probenecida, en comparación con las sulfonilúreas, que están considerablemente unidas a las proteínas séricas.
Otras interacciones: No se han estudiado específicamente los efectos del tabaquismo, la alimentación, los productos herbarios y el consumo de alcohol en la farmacocinética de dapagliflozina.
Interferencia con la prueba de 1,5-anhidroglucitol (1,5 AG): No se recomienda supervisar el control de la glucemia con la prueba de 1,5-AG puesto que las mediciones de 1,5-AG no son fiables para evaluar el control de la glucemia en pacientes que toman inhibidores de SGLT2. Utilice métodos alternativos para hacerlo.
DATOS DE SEGURIDAD PRECLÍNICA
Carcinogenia, mutagenia, problemas de fertilidad
Dapagliflozina: Dapagliflozina no indujo tumores en ratones o ratas en ninguna de las dosis evaluadas en los estudios de carcinogenia a dos años. Las dosis orales en ratones consistieron en 5, 15, y 40 mg/kg/día en machos y 2, 10, y 20 mg/kg/día en hembras, y las dosis orales en ratas fueron de 0.5, 2, y 10 mg/kg/día tanto para machos como para hembras. Las dosis más altas evaluadas en ratones fueron equivalentes a múltiples de exposición de ABC de aproximadamente 72 (machos) y 105 (hembras) veces el ABC humano con una MRHD de 10 mg/día. En ratas, las exposiciones de ABC fueron de aproximadamente 131 (machos) y 186 (hembras) veces el ABC humano a la MRHD.
La dapagliflozina obtuvo un resultado negativo en la valoración de mutagenia de Ames y fue positiva en una valoración de clastogenia in vitro, pero solo en presencia de activación S9 y a concentraciones de =100 µg/mL. Notablemente, dapagliflozina obtuvo un resultado negativo para clastogenia in vivo en una serie de estudios que evaluaron micronúcleos o la reparación de ADN en ratas con múltiples de exposición de >2100 veces la exposición humana con una MRHD.Estos estudios, junto con la ausencia de hallazgos de tumor en los estudios de carcinogenia en ratas y ratones, sustentan que dapagliflozina no representa un riesgo genotóxico para los humanos.
Se evaluaron los cambios de transcripción de genes relacionados con la dapagliflozina en el riñón, hígado, tejido adiposo, y músculo esquelético de ratas Zucker obesas diabéticas (ZDF, por sus siglas en inglés) tratadas diariamente con dapagliflozina durante 5 semanas. Estos órganos fueron específicamente seleccionados ya que representan órganos objetivo en el tratamiento de la diabetes. No hubo evidencia de que la dapagliflozina ocasionara cambios transcripcionales que predigan los promotores de tumores.
Dapagliflozina y su metabolito humano principal (3-O-glucurónido) no incrementaron el crecimiento in vitro de seis líneas celulares de carcinomas de células de transición de la vejiga humana (TCC) a concentraciones de =100 veces la Cmáx humana con la MRHD. En un estudio de xenoinjerto de ratón, dapagliflozina administrada diariamente a ratones machos y hembras sin pelaje implantados con tumores TCC humanos no incrementó significativamente el tamaño de los tumores en exposiciones de hasta 75 veces y hasta 0.9 veces las exposiciones clínicas a la MRHD para dapagliflozina y su metabolito 3-O-glucurónido, respectivamente. Estos estudios proporcionaron evidencia de que dapagliflozina y su metabolito humano primario no incrementan el crecimiento de los tumores en la vejiga.
En un estudio fenotípico de 15 meses, no hubo evidencia de ninguna diferencia en sobrevivencia, peso corporal, parámetros patológicos clínicos, o hallazgos histopatológicos observados entre ratones KO SGLT2 y sus contrapartes de tipo silvestre (WT). Los ratones KO SGLT2 tenían glucosuria, a diferencia de los ratones WT. A pesar de una vida de glucosuria, no hubo evidencia de ninguna alteración de la función renal o cambios proliferativos observados en los riñones o vejigas de los ratones KO SGLT2. Estos datos sugieren fuertemente que altos niveles de glucosa en la orina no inducen tumores de las vías urinarias o aceleran las patologías de las vías urinarias relacionadas con la edad.
En un estudio de fertilidad y desarrollo embrionario temprano en ratas, se administraron dosis de 15, 75, o 300/210 mg/kg/día de dapagliflozina en machos (la dosis de 300 mg/kg/día se redujo a 210 mg/kg/día después de 4 días); y se administraron dosis de 3, 15, o 75 mg/kg/día en hembras. Dapagliflozina no tuvo efectos en el apareamiento, fertilidad o desarrollo embrionario temprano en machos o hembras tratados con cualquier dosis probada (en múltiplos de exposición de =1708 y 998 veces la MRHD en machos y hembras, respectivamente). Sin embargo, a 300/210 mg/kg/día, se redujo el peso de la vesícula seminal y epidídimo; la motilidad y los recuentos de espermáticos se redujeron; y hubo números bajos de esperma morfológicamente anormal.
Clorhidrato de metformina: Se han realizado estudios de carcinogenia a largo plazo en ratas (duración de la dosificación de 104 semanas) y ratones (duración de la dosificación de 91 semanas) hasta e incluyendo 900 mg/kg/día y 1500 mg/kg/día, respectivamente. Estas dosis eran aproximadamente 4 veces la dosis máxima diaria recomendada para humanos de 2000 mg con base en comparaciones cuerpo-superficie-área. No se encontró evidencia de carcinogenia con metformina en ratones macho o hembra. De forma similar, no se observó potencial tumorígeno con metformina en ratas macho. Sin embargo, hubo evidencia incrementada de pólipos uterinos del estroma benignos en ratas hembras tratadas con 900 mg/kg/día.
No hubo evidencia de un potencial mutagénico de metformina en las siguientes pruebas in vitro: Prueba de Ames (S. typhimurium), prueba de mutación de genes (células linfomatosas de ratones), o prueba de aberraciones cromosómicas (linfocitos humanos). Los resultados de la prueba de micronúcleos de ratones in vivo también resultó negativa.
La fertilidad de las ratas macho y hembras no se vio afectada por la metformina cuando se administró en dosis tan altas como 600 mg/kg/día, lo cual es aproximadamente 3 veces la dosis máxima diaria recomendada para humanos con base en comparaciones cuerpo-superficie-área.
Teratogenia e insuficiencia del desarrollo temprano
Dapagliflozina: La administración directa de dapagliflozina en ratas jóvenes recién destetadas, y la exposición indirecta durante el embarazo tardío y la lactancia (periodos correspondientes al segundo y tercer trimestre del embarazo en relación con la madurez renal humana), están asociadas con una incidencia y/o gravedad incrementada de dilataciones tubulares y pélvicas renales en la progenie.
En un estudio de toxicidad juvenil, cuando dapagliflozina se administró directamente a ratas jóvenes desde el día posnatal (DPN) 21 hasta el DPN 90 en dosis de 1, 15, o 75 mg/kg/día, se reportaron dilataciones tubulares y pélvicas renales en todos los niveles de dosis; las exposiciones de cachorros probadas en la dosis más baja fueron =15 veces la MRHD. Estos hallazgos se asociaron con incrementos relacionados con la dosis en el peso del riñón y agrandamiento macroscópico de riñón que se observó en todas las dosis. Las dilataciones tubulares y pélvicas renales observadas en animales jóvenes no se invirtieron completamente dentro del periodo de recuperación de aproximadamente 1 mes.
En otro estudio de desarrollo prenatal y posnatal, las ratas maternales recibieron dosis a partir del día de gestación (DG) 6 hasta el DPN 21 (también con 1, 15, o 75 mg/kg/día), los cachorros estuvieron expuestos indirectamente in utero y durante la lactancia. (Se realizó un estudio satelital para valorar las exposiciones de dapagliflozina en la leche y los cachorros.) Se volvió a observar un incremento en la incidencia o la gravedad de la dilatación pélvica renal en crías adultas de madres que recibieron tratamiento, si bien únicamente se observó con 75 mg/kg/día (las exposiciones asociadas de las madres y los cachorros a dapagliflozina fueron 1415 y 137 veces, respectivamente, los valores humanos a la MRHD). La toxicidad del desarrollo adicional se limitó a las reducciones relacionadas con la dosis en los pesos corporales de los cachorros, y se observaron solo en dosis de =15 mg/kg/día (asociados con las exposiciones de los cachorros que son =29 veces los valores humanos a la MRHD). La toxicidad materna fue evidente únicamente a 75 mg/kg/día y se limitó a las reducciones transitorias en el peso corporal y el consumo de alimentos al inicio de la dosis. El nivel de efectos no adversos (NOAEL) para toxicidad del desarrollo, 1 mg/kg/día, está asociado con el múltiplo de exposición sistémica materna que es aproximadamente 19 veces el valor humano a la MRHD.
En estudios adicionales de desarrollo embrio-fetal en ratas y conejos, dapagliflozina se administró en intervalos que coinciden con los periodos principales de organogénesis en cada especie. No se observó toxicidad materna ni del desarrollo en conejos en ninguna dosis probada (20, 60, 0 180 mg/kg/día); 180 mg/kg/día se asocia con un múltiplo de exposición sistémica de aproximadamente 1191 veces la MRHD. En ratas, dapagliflozina no fue embrioletal ni teratógena en dosis de hasta 75 mg/kg/día (1441 veces la MRHD). Las dosis de =150 mg/kg/día (=2344 veces los valores humanos a la MRHD) se asociaron con las toxicidades materna y del desarrollo. La toxicidad materna incluye mortalidad, señales clínicas adversas, y reducciones en el peso corporal y el consumo de alimentos. La toxicidad del desarrollo consistió en letalidad embrio-fetal incrementada, incidencias incrementadas de deformidades fetales y variaciones esqueléticas, así como pesos corporales fetales reducidos. Las deformidades incluyeron una baja incidencia de deformidades mayores de los vasos sanguíneos, fusiones de costillas y centros de la columna vertebral, y duplicación de manubrio y centro esternal. Las variaciones fueron principalmente osificaciones reducidas.
Clorhidrato de metformina: La metformina no fue teratógena en ratas y conejos en dosis de hasta 600 mg/kg/día. Esto representa una exposición de aproximadamente 2 y 6 veces la dosis máxima diaria recomendada para humanos de 2000 mg con base en el área de la superficie corporal para ratas y conejos, respectivamente. La determinación de concentraciones fetales demostró una barrera placentaria parcial a la metformina.
Toxicología animal: Se realizó un estudio de 3 meses en ratas con la combinación de dapagliflozina y metformina. No se observó toxicidad en exposiciones de ABC de 52 y 1.4 veces la MRHD para dapagliflozina y metformina, respectivamente.
Dapagliflozina: La mayoría de los efectos observados en los estudios pivotales de toxicidad de dosis repetida en ratas y perros se consideraron como secundarios a los incrementos farmacológicamente mediados en la glucosa en la orina e incluyeron reducciones en el peso corporal y/o aumentos en el peso corporal, consumo incrementado de alimentos, e incrementos en los volúmenes de orina debido a diuresis osmótica. Dapagliflozina fue bien tolerada cuando se le administró oralmente a ratas de hasta 6 meses en dosis de =25 mg/kg/día (=346 veces las exposiciones humanas a la MRHD) y en perros de hasta 12 meses en dosis de =120 mg/kg/día (=3200 veces las exposiciones humanas a la MRHD). Adicionalmente, los estudios de dosis individual con dapagliflozina indicaron que el metabolito dapagliflozina 3-O-glucurónido se habría formado en los estudios de toxicidad en ratas y perros en niveles de exposición (ABC) mayores que o aproximadamente iguales a las exposiciones anticipadas de dapagliflozina 3-O-glucurónido en humanos después de la administración de dapagliflozina a la MRHD. En ratas, el hallazgo de toxicidad no clínico más notorio de mineralización de tejido y óseo trabecular incrementado (asociado con calcio sérico incrementado) solo se observó en múltiplos altos de exposición (=2100 veces con base en exposiciones humanas a la MRHD). A pesar de lograr múltiplos de exposición de =3200 veces la exposición humana a la MRHD, no hubo toxicidades limitantes de dosis o de órganos objetivo identificadas en el estudio de 12 meses en perros.
PROPIEDADES FARMACÉUTICAS
Lista de excipientes: Cada tableta recubierta de XIGDUO® XR contiene 5 mg o 10 mg de dapagliflozina y 1000 mg de metformina, asì como los siguientes ingredientes inactivos:
Capa de dapagliflozina para CDFs de 5 mg y 10 mg: Celulosa microcristalina, lactosa anhidra, crospovidona, dióxido de silicio y estearato de magnesio.
Capa de metformina para CDFs de 1000 mg: Carboximetilcelulosa sódica, Hipromelosa 2208, dióxido de silicio y estearato de magnesio.
Cubierta: Alcohol de polivinilo, dióxido de titanio, polietilenglicol, talco y óxidos de hierro (5/1000 y 10/1000).
INFORMACIÓN DE ESTUDIOS CLÍNICOS: La coadministración de dapagliflozina y metformina XR se ha estudiado en pacientes controlados inadecuadamente con dieta y ejercicio únicamente. La coadministración de dapagliflozina y metformina IR o XR se ha estudiado en pacientes con diabetes tipo 2 cuyo control ha sido inadecuado con metformina, metformina más una sulfonilúrea, inhibidores de DPP4 (con o sin metformina), o insulina (con o sin otra terapia antidiabética oral), y en comparación con una sulfonilúrea combinada con metformina en pacientes con control glicémico inadecuado con solo metformina. El tratamiento con dapagliflozina más metformina a todas las dosis, produjo mejorías clínicamente relevantes y estadísticamente significativas en el cambio promedio desde el nivel basal hasta la Semana 24 en la HbA1c, y glucosa plasmática en ayunas (GPA) comparado el control.
Se ha estudiado la coadministración de dapagliflozina y metformina IR tabletas en terapia inicial concomitante con saxagliptina en pacientes con diabetes tipo 2 controlados inadecuadamente con metformina, la cual produjo mejorías clínicamente relevantes y estadísticamente significativas en el cambio promedio desde el nivel basal hasta la Semana 24 en la HbA1c, en comparación con el control. Estos efectos glicémicos clínicamente relevantes fueron sostenidos en todas las extensiones a largo plazo hasta 208 semanas. Se observaron reducciones de la HbA1c a lo largo de subgrupos que incluyeron género, edad, raza, duración de la enfermedad, e IMC basal. Adicionalmente, a la Semana 24, se observaron reducciones clínicamente relevantes y estadísticamente significativas en los cambios promedio desde el nivel basal en el peso corporal con tratamientos combinados de dapagliflozina y metformina comparados con el control. Las reducciones en el peso corporal se mantuvieron en extensiones a largo plazo hasta 208 semanas.
En un estudio clínico específico, la reducción del peso se atribuyó principalmente a la reducción de masa corporal medida por DXA. El tratamiento de dapagliflozina dos veces al día como adición a la metformina demostró ser eficaz y seguro en pacientes con diabetes tipo 2.
Además, dapagliflozina 10 mg o placebo se estudiaron en pacientes con diabetes tipo 2 y enfermedad cardiovascular (aproximadamente 37% de pacientes a lo largo de 2 estudios recibieron dapagliflozina 10 mg o placebo más metformina sola [con o sin insulina]), y pacientes con diabetes tipo 2 e hipertensión (aproximadamente 90% de pacientes a lo largo de 2 estudios recibieron dapagliflozina 10 mg o placebo más metformina.En dos estudios de dapagliflozina 10 mg en pacientes con diabetes tipo 2 con enfermedad cardiovascular, se observaron mejoras estadísticamente significativas de HbA1c y reducciones significativas de peso corporal y presión arterial sistólica en sedestación en la Semana 24 en pacientes tratados con dapagliflozina 10 mg en comparación con aquellos tratados con placebo, y se sostuvieron hasta la Semana 104. En dos estudios de dapagliflozina 10 mg en pacientes con diabetes tipo 2 con hipertensión, también se observaron reducciones estadísticamente significativas en la presión arterial sistólica en sedestación promedio en pacientes tratados con dapagliflozina 10 mg en combinación con otros ADO y tratamientos antihipertensivos (ECA o BRA en un estudio y ECA o BRA más un tratamiento adicional antihipertensivo en otro estudio) en comparación con aquellos tratados con placebo en la Semana 12.
No ha habido estudios de eficacia clínica realizados con XIGDUO® XR; sin embargo XIGDUO® XR se considera equivalente a las tabletas coadministradas de dapagliflozina y clorhidrato de metformina de liberación inmediata (ver sección Propiedades farmacocinéticas).
Coadministración de dapagliflozina con metformina en pacientes sin tratamiento previo
Tratamiento de combinación inicial con metformina XR: Un total de 1,241 pacientes sin tratamiento previo con diabetes tipo 2 controlada inadecuadamente (HbA1c de =7.5% y =12%) participaron en dos estudios activos controlados de 24 semanas de duración para evaluar la eficacia y seguridad de la terapia inicial con dapagliflozina 5 mg o 10 mg en combinación con una formulación de liberación prolongada de metformina (LP).
En un estudio, 638 pacientes fueron asignados al azar a uno de los tres grupos de tratamiento después de un periodo de inducción de 1 semana: Dapagliflozina 10 mg más metformina XR (hasta 2000 mg por día), dapagliflozina 10 mg más placebo, o metformina XR (hasta 2000 mg por día) más placebo. La dosis de metformina se tituló semanalmente en incrementos de 500 mg, de acuerdo con la tolerancia, con una mediana de dosis de 2000 mg.
El tratamiento de combinación de dapagliflozina 10 mg más metformina proporcionó mejoras significativas en HbA1c y GPA, en comparación con los tratamientos de monoterapia y reducciones significativas en el peso corporal en comparación con la metformina sola. (Tabla 4, Figuras 2 y 3). Dapagliflozina 10 mg como monoterapia también proporcionó mejoras significativas en GPA y una reducción significativa en el peso corporal en comparación con metformina sola y no fue inferior a la monoterapia de metformina para reducir HbA1c. La proporción de pacientes que fueron rescatados o descontinuados por la falta de control glicémico durante el periodo de tratamiento doble ciego de 24 semanas (ajustado al valor inicial de HbA1c) fue mayor para el tratamiento con metformina más placebo (13.5%) que para dapagliflozina 10 mg más placebo y dapagliflozina 10 mg más metformina (7.8%, y 1.4%).
|
Tabla 4. Resultados en la Semana 24 (LOCF*) en un estudio controlado activo de tratamiento de combinación inicial de dapagliflozina con metformina XR |
|||
|
Parámetro de eficacia |
Dapagliflozina 10 mg + Metformina XR N=211† |
Dapagliflozina 10 mg N=219† |
Metformina XR N=208† |
|
HbA1c (%) |
|||
|
Valor inicial (promedio) |
9.10 |
9.03 |
9.03 |
|
Cambio a partir del valor inicial (promedio ajustado‡) |
-1.98 |
-1.45 |
-1.44 |
|
Diferencia de dapagliflozina (promedio ajustado‡) (IC al 95%) |
-0.53§ (-0.74, -0.32) |
||
|
Diferencia de metformina (promedio ajustado‡) (IC al 95%) |
-0.54§ (-0.75, -0.33) |
-0.01¶ |
|
|
Porcentaje de pacientes que lograron HbA1c de <7% ajustado al valor inicial |
46.6%# |
31.7% |
35.2% |
|
Cambio a partir del valor inicial en HbA1c en pacientes con HbA1c inicial de =9% (promedio ajustado‡) |
-2.59# |
-2.14 |
-2.05 |
|
GPA (mg/dL) |
|||
|
Valor inicial (promedio) |
189.6 |
197.5 |
189.9 |
|
Cambio a partir del valor inicial (promedio ajustado‡) |
-60.4 |
-46.4 |
-34.8 |
|
Diferencia de dapagliflozina (promedio ajustado‡) (IC al 95%) |
-13.9§ (-20.9, -7.0) |
||
|
Diferencia de metformina (promedio ajustado‡) (IC al 95%) |
-25.5§ (-32.6, -18.5) |
-11.6¶ (-18.6, -4.6) |
|
|
Peso corporal (kg) |
|||
|
Valor inicial (promedio) |
88.56 |
88.53 |
87.24 |
|
Cambio a partir del valor inicial (promedio ajustado‡) |
-3.33 |
-2.73 |
-1.36 |
|
Diferencia de metformina (promedio ajustado‡) (IC al 95%) |
-1.97§ (-2.64, -1.30) |
-1.37§ (-2.03, -0.71) |
|
|
* LOCF: última observación considerada (previa al rescate de los pacientes rescatados). † Todos los pacientes asignados al azar que tomaron al menos una dosis del medicamento del estudio doble ciego durante el periodo a corto plazo doble ciego. ‡ Promedio de mínimos cuadrados ajustado al valor inicial. § valor p <0.0001. ¶ No inferior frente a metformina. # valor p <0.05. |
|||
FIGURA 2. Cambio promedio paulatino ajustado a partir del valor inicial (LOCFa) en HbA1c (%) en un estudio controlado activo de 24 semanas de tratamiento de combinación inicial de dapagliflozina con metformina XR
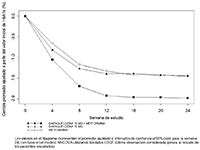
FIGURA 3. Cambio promedio paulatino ajustado a partir del valor inicial (LOCFa) en peso corporal total (kg) en un estudio controlado activo de 24 semanas de tratamiento de combinación inicial de dapagliflozina con metformina XR

Otro estudio de 24 semanas que evaluó dapagliflozina 5 mg más metformina XR mostró mejoras clínicamente importantes y estadísticamente significativas en los parámetros glicémicos frente a la monoterapia de dapagliflozina 5 mg y la monoterapia de metformina XR.
Adición de dapagliflozina a metformina LI: Un total de 546 pacientes con diabetes tipo 2 con control glicémico inadecuado (HbA1c de =7% y =10%) participaron en un estudio controlado con placebo de 24 semanas con un periodo de extensión ciego controlado de 78 semanas para evaluar dapagliflozina en combinación con metformina. Los pacientes con metformina con una dosis de al menos 1500 mg por día fueron asignados al azar después de completar el periodo ciego de inducción de placebo de 2 semanas. Después del periodo de inducción, los pacientes fueron asignados al azar para dapagliflozina 2.5 mg, 5 mg o 10 mg, o placebo además de su dosis actual de metformina.
Como tratamiento de adición a la metformina, dapagliflozina 10 mg proporcionó mejoras significativas en HbA1c, y GPA, y una reducción significativa en el peso corporal en comparación con placebo en la semana 24 (Tabla 5). A la Semana 102, el cambio promedio ajustado a partir del valor inicial en HbA1c (Figura 4), GPA, y el peso corporal fue de -0.78%, -24.5 mg/dL, y -2.81 kg, respectivamente, para pacientes tratados con dapagliflozina 10 mg más metformina y 0.02%, -10.4 mg/dL, y -0.67 kg para pacientes tratados con placebo más metformina con base en el análisis longitudinal de medidas repetidas excluyendo los datos después del rescate.La proporción de pacientes que fueron rescatados o descontinuados por falta de control glicémico durante el periodo de tratamiento doble ciego de 24 semanas (ajustado al valor inicial de HbA1c) fue mayor que en el grupo de placebo más metformina (15.0%) que en el grupo de dapagliflozina 10 mg más metformina (4.4%). Para la semana 102 (ajustado al valor inicial de HbA1c), más pacientes tratados con placebo más metformina (60.1%) requirieron tratamiento de rescate que los pacientes tratados con dapagliflozina 10 mg más metformina (44.0%).
|
Tabla 5. Resultados de un estudio controlado con placebo de 24 semanas (LOCF*) de dapagliflozina en combinación de adición con metformina |
||
|
Parámetro de eficacia |
Dapagliflozina 10 mg + Metformina N=135† |
Placebo + Metformina N=137† |
|
HbA1c (%) |
||
|
Valor inicial promedio |
7.92 |
8.11 |
|
Cambio a partir del valor inicial (promedio ajustado‡) |
-0.84 |
-0.30 |
|
Diferencia de placebo (promedio ajustado‡) (IC al 95%) |
-0.54§ |
|
|
Porcentaje de pacientes que lograron HbA1c de <7% ajustado al valor inicial |
40.6%¶ |
25.9% |
|
Cambio a partir del valor inicial en HbA1c en pacientes con HbA1c inicial de =9% (promedio ajustado‡) |
-1.32¶ (N= 18) |
-0.53 (N= 22) |
|
GPA (mg/dL) |
||
|
Valor inicial promedio |
156.0 |
165.6 |
|
Cambio a partir del valor inicial a la semana 24 (promedio ajustado‡) |
-23.5 |
-6.0 |
|
Diferencia de placebo (promedio ajustado‡) (IC al 95%) |
-17.5§ |
|
|
Cambio a partir del valor inicial a la semana 1 (promedio ajustado‡) |
-16.5§ |
1.2 |
|
Peso corporal (kg) |
||
|
Valor inicial promedio |
86.28 |
87.74 |
|
Cambio a partir del valor inicial (promedio ajustado‡) |
-2.86 |
-0.89 |
|
Diferencia de placebo (promedio ajustado‡) (IC al 95%) |
-1.97§ |
|
|
* LOCF: última observación considerada (previa al rescate de los pacientes rescatados). † Todos los pacientes asignados al azar que tomaron al menos una dosis del medicamento del estudio doble ciego durante el periodo a corto plazo doble ciego. ‡ Promedio de mínimos cuadrados ajustado al valor inicial. § valor p <0.0001 frente a placebo + metformina. ¶ valor p <0.05 frente a placebo + metformina. |
||
FIGURA 4. Cambio promedio paulatino ajustado a partir del valor inicial en HbA1c (%) en un estudio controlado con placebo de 102 semanas de dapagliflozina en combinación con metformina (análisis longitudinal de medidas repetidas, excluyendo los datos después del rescate)
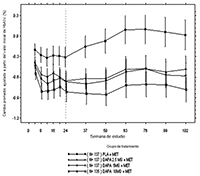
Las barras de error representan intervalos de confianza al 95% para el cambio promedio ajustado a partir del valor inicial
Dapagliflozina dos veces al día añadida a la metformina LI: Un total de 399 pacientes con diabetes tipo 2 y control glicémico inadecuado de metformina sola fueron asignados al azar en este estudio controlado con placebo de 16 semanas para evaluar dapagliflozina 2.5 mg dos veces al día y 5 mg dos veces al día como tratamiento de adición a la metformina. El reclutamiento se estratificó por HbA1c de <7.0% (aproximadamente 15% de los pacientes) y HbA1c de =7.0% (aproximadamente 85% de pacientes) por aleatorización. Los pacientes que recibieron metformina a una dosis de al menos 1500 mg al día fueron asignados al azar, después de un periodo de inducción ciego con placebo de 4 semanas, a dapagliflozina 5 mg, dapagliflozina 2.5 mg o placebo dos veces al día. Un grupo de tratamiento doble ciego adicional del estudio incluyó pacientes que recibieron dapagliflozina 10 mg una vez al día coadministrados con metformina como “control positivo”, una medida de valoración de sensibilidad. La eficacia y seguridad en este grupo de tratamiento de dapagliflozina una vez al día se comparó únicamente con placebo coadministrado con metformina.
Como tratamiento de adición a la metformina, dapagliflozina 5 mg dos veces al día proporcionó mejoras significativas en HbA1c y GPA, y una reducción significativa en el peso corporal en comparación con placebo dos veces al día a la Semana 16 y fue consistente con los cambios glicémicos y de peso corporal observados con el tratamiento de dapagliflozina 10 mg una vez al día (ver Tabla 6). El tratamiento de dapagliflozina 2.5 mg más metformina dos veces al día también mejoró significativamente el HbA1c (-0.52%) en comparación con el tratamiento de placebo más metformina dos veces al día (-0.30%) a la Semana 16 (p< 0.05).
|
Tabla 6. Resultados de un estudio controlado con placebo de 16 semanas (LOCF*) de dapagliflozina dos veces al día en combinación de adición con metformina |
||
|
Parámetro de eficacia |
Dapagliflozina 5 mg BID + Metformina |
Placebo BID |
|
HbA1c (%) |
||
|
Valor inicial promedio |
7.79 |
7.94 |
|
Cambio a partir del valor inicial (promedio ajustado‡) |
-0.65 |
-0.30 |
|
Diferencia de placebo (promedio ajustado‡) (IC al 95%) |
-0.35§ (-0.52, -0.18) |
|
|
Porcentaje de pacientes con HbA1c de <7.0% a partir del valor inicial que lograron HbA1c de <7% ajustado al valor inicial a la Semana 16 |
38.2¶ (N=90) |
21.4 (N=87) |
|
GPA (mg/dL) |
||
|
Valor inicial promedio |
155.3 |
157.8 |
|
Cambio a partir del valor inicial en la semana 16 (promedio ajustado‡) |
-25.6 |
-10.4 |
|
Diferencia de placebo (promedio ajustado‡) (IC al 95%) |
-15.3§ (-21.4, -9.1) |
|
|
Cambio a partir del valor inicial a la semana 1 (promedio ajustado‡) |
-14.7 |
2.0 |
|
Peso corporal (kg) |
||
|
Valor inicial promedio |
93.62 |
88.82 |
|
Cambio a partir del valor inicial (promedio ajustado‡) |
-2.74 |
-0.86 |
|
Diferencia de placebo (promedio ajustado‡) (IC al 95%) |
-1.88# (-2.52, -1.24) |
|
|
* LOCF: última observación considerada (previa al rescate de pacientes rescatados. † Todos los pacientes asignados al azar que tomaron al menos una dosis del medicamento del estudio doble ciego durante el periodo a corto plazo doble ciego. ‡ Promedio de mínimos cuadrados ajustado al valor inicial. § valor p <0.0001 frente a placebo + metformina. ¶ valor p <0.05 frente a placebo + metformina. # El cambio porcentual en el peso corporal fue analizado como criterio de valoración secundario clave (valor p <0.0001), el cambio en el peso corporal absoluto en kg fue analizado con un valor p nominal (valor p <0.001). |
||
La proporción de pacientes a los que se suspendió por falta de control glicémico durante el periodo del tratamiento doble ciego de 16 semanas (ajustado al valor inicial de HbA1c) fue mayor en el grupo de placebo dos veces al día más metformina (5.0%) que en el grupo de dapagliflozina 2.5 mg dos veces al día más metformina (1%). Ningún paciente en el grupo de dapagliflozina 5 mg dos veces al día fue suspendido debido a un control glicémico inadecuado.
Estudio controlado de glipizida activa añadida a la metformina LI: Un total de 816 pacientes con diabetes tipo 2 con control glicémico inadecuado (HbA1c de >65% y =10%) fueron asignados al azar en un estudio de no inferioridad controlado con glipizida de 52 semanas con un periodo de extensión de 156 semanas para evaluar a dapagliflozina como terapia de adición a la metformina. Los pacientes con metformina en dosis de al menos 1500 mg por día fueron asignados al azar después de un periodo de inducción con placebo de 2 semanas para glipizida o dapagliflozina (5 mg o 2.5 mg, respectivamente) y fueron titulados ascendentemente durante 18 semanas hasta un efecto glicémico óptimo (GPA <110 mg/dL, <6.1 mmol/L) o al nivel más alto de dosis (hasta glipizida 20 gm y dapagliflozina 10 mg) según la tolerancia de los pacientes. Posteriormente, las dosis se mantuvieron constantes, excepto por la titulación descendente para evitar hipoglucemia. En este estudio no estuvo disponible rescate en caso de falta de control glicémico hasta la Semana 104, pero estuvo disponible entre las Semanas 105 y 208.
Al final del periodo de titulación, 87% de los pacientes tratados con dapagliflozina habían sido titulados a la dosis máxima de estudio (10 mg), frente a 73% tratados con glipizida (20 mg). Dapagliflozina provocó una reducción promedio similar en HbA1c a partir del valor inicial a la Semana 52, en comparación con glipizida, con lo que demostró no inferioridad (Tabla 7). El tratamiento de dapagliflozina provocó una reducción significativa del peso corporal a partir del valor inicial en la semana 52 en comparación con un incremento promedio en el peso corporal en el grupo de glipizida.
A las semanas 104 y 208, la media ajustada de los cambios desde el nivel basal en la HbA1c fue de -0.32% y -0.10%, y los cambios en el peso corporal fueron -3.70 kg y -3.95 kg, respectivamente, para pacientes tratados con dapagliflozina; la media ajustada de los cambios desde el nivel basal en la HbA1c fue de -0.14% y 0.20%, respectivamente, y los cambios en el peso corporal fueron 1.36 kg y 1.12 kg, respectivamente, para pacientes tratados con glipizida, según el análisis longitudinal de mediciones repetidas (Figuras 6 y 7). El porcentaje de pacientes que obtuvieron una pérdida de peso =5% (adjustado) a las Semanas 104 y 208 fue de 23.8% y 10.2%, respectivamente, para pacientes tratados con dapagliflozina, y 2.8% y 1.8%, respectivamente, para pacientes tratados con glipizida.
Para las Semanas 52, 104 y 208, la proporción de pacientes que descontinuaron o se les administró rescate por falta de control glicémico (ajustada según HbA1c) fue más alta para glipizida más metformina (3.6%, 21.6% y 44.9%, respectivamente) que para XIGDUO más metformina (.02%, 14.5% y 39.4%, respectivamente). A las 52, 104 y 208 semanas, respectivamente, una proporción significativamente más baja de pacientes tratados con dapagliflozina (3.5%, 4.3% y 5.0%) experimentaron por lo menos un evento de hipoglicemia, comparada con glipizida (40.8%, 47.0% y 50.0%).
|
Tabla 7. Resultados a la Semana 52 (LOCF*) en un estudio activo controlado de comparación |
||
|
Parámetro de eficacia |
Dapagliflozina +Metformina |
Glipizida + Metformina |
|
HbA1c (%) |
||
|
Valor Inicial (promedio) |
7.69 |
7.74 |
|
Cambio a partir del valor inicial (promedio ajustado ‡) |
-0.52 |
-0.52 |
|
Diferencia de Glipizida+Metformina (promedio ajustado‡) |
0.00§ |
|
|
(IC al 95%) |
(-0.11, 0.11) |
|
|
Peso corporal (kg) |
||
|
Valor Inicial (promedio) |
88.44 |
87.60 |
|
Cambio a partir del valor inicial (promedio ajustado‡) |
-3.22 |
1.44 |
|
Diferencia de Glipizida+Metformina (promedio ajustado‡) |
-4.65¶ |
|
|
(IC al 95%) |
(-5.14, -4.17) |
|
|
Porcentaje de pacientes que lograron reducción de peso =5% (ajustado) (IC al 95%) |
33.3%¶ (28.7, 37.9) |
2.5% (1.0, 4.0) |
|
* LOCF: última observación considerada. † Pacientes con una medición de eficacia al inicio y al menos una posterior al inicio asignados al azar y tratados. ‡ Promedio de mínimos cuadrados ajustado al valor inicial. § No inferior a glipizida + metformina ¶ valor p <0.0001. |
||
FIGURA 5. Cambio promedio paulatino ajustado a partir del valor inicial en HbA1c (%) en un estudio activo controlado de 208 semanas de comparación de dapagliflozina con glipizida como adición a la metformina (análisis longitudinal de medidas repetidas)
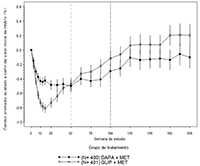
Las barras de error representan intervalos de confianza al 95% para el cambio promedio ajustado a partir del valor inicial
FIGURA 6. Cambio promedio paulatino ajustado a partir del valor inicial en peso corporal (kg) en un estudio activo controlado de 208 semanas de comparación de dapagliflozina a glipizida como adición a metformina (análisis longitudinal de medidas repetidas)
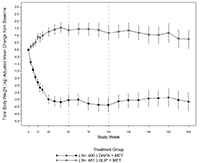
Las barras de error representan intervalos de confianza al 95% para el cambio promedio ajustado a partir del valor inicial.
Terapia combinada añadida con metformina IR o XR y una sulfonilurea: Un total de 218 pacientes con diabetes tipo 2 y control glicémico inadecuado (HbA1c =7% y =10.5%) participaron en un estudio de 24 semanas, placebo-controlado, con un periodo de extensión de 28 semanas, para evaluar a dapagliflozina en combinación con metformina y una sulfonilurea.Los pacientes que estaban recibieron una dosis estable de metformina (formulaciones de liberación inmediata o prolongada) =1500 mg/día, más la dosis máxima tolerada, que debe ser por lo menos la mitad de la dosis máxima, de una sulfonilúrea durante por lo menos 8 semanas previamente al enrolamiento, fueron aleatorizados, después de un periodo de inducción de 8 semanas con placebo, a recibir dapagliflozina 10 mg o placebo. No se permitió la titulación de la dosis de dapagliflozina o metformina durante el periodo de tratamiento de 24 semanas. Se permitió la titulación descendente de la sulfonilúrea para prevenir hipoglicemia, pero no se permitió titulación ascendente.
Como tratamiento adicional a la combinación de metformina y una sulfonilúrea, el tratamiento con dapagliflozina 10 mg proporcionó mejorías significativas en la HbA1c y GPA, y reducciones significativas en el peso corporal, comparado con placebo a la Semana 24 (Tabla 8). También se observó reducción significativa en la presión arterial sistólica en posición sentada a la Semana 8 en pacientes tratados con dapagliflozina 10 mg comparada con placebo. Los efectos en la HbA1c, GPA y peso corporal observados a la Semana 24 se mantuvieron a la Semana 52.
A la Semana 24, ningún paciente tratado con dapagliflozina 10 mg combinada con metformina y una sulfonilúrea y 10 pacientes (9.3%) tratados con placebo combinado con metformina y una sulfonilúrea recibieron rescate o descontinuaron por falta de control glicémico (ajustado según HbA1c basal).
Para la semana 52 (ajustada según HbA1c basal) más pacientes que estaban recibiendo placebo combinado con metformina y una sulfonilúrea (44.4%) recibieron rescate por falta de control glicémico que pacientes que estaban recibiendo XIGDUO (9.3%). A ningún paciente se le descontinuó el medicamento del estudio debido a control glicémico inadecuado.
|
Tabla 8. Resultados de un estudio de 24 semanas placebo-controlado de dapagliflozina en combinación adicionada con metformina y sulfonilúrea |
||
|
Parámetros de eficacia |
Dapaglifozina 10 mg |
Placebo |
|
N=108† |
N=108† |
|
|
HbA1c (%)‡‡ |
||
|
Media a nivel basal |
8.08 |
8.24 |
|
Cambio desde el nivel basal (media ajustada‡) |
-0.86 |
-0.17 |
|
Diferencia con el placebo (media ajustada‡) (IC 95%) |
-0.69§ |
|
|
Porcentaje de pacientes que lograron HbA1c <7% ajustada según nivel basal |
31.8%§ |
11.1% |
|
GPA (mg/dL)* |
||
|
Media a nivel basal |
167.4 |
180.3 |
|
Cambio desde el nivel basal a la Semana 24 (media ajustada‡) |
-34.2 |
-0.8 |
|
Diferencia con el placebo (media ajustada‡) (IC 95%) |
-33.5§ |
|
|
Peso corporal (kg)* |
||
|
Media a nivel basal |
88.57 |
90.07 |
|
Cambio desde el nivel basal (media ajustada‡) |
-2.65 |
-0.58 |
|
Diferencia con el placebo (media ajustada‡) (IC 95%) |
-2.07§ |
|
|
Presión arterial sistólica en posición sentada a la Semana 8 (mmHg)* |
||
|
Media a nivel basal |
134.7 |
136.3 |
|
Cambio desde el nivel basal a la Semana 8 (media ajustada‡) |
-4.0 |
-0.3 |
|
Diferencia c.on el placebo (media ajustada‡) (IC 95%) |
-3.8** |
|
|
† Pacientes aleatorizados y tratados con medición de eficacia a nivel basal y por lo menos 1 post-nivel basal. ‡‡ LRM: Análisis longitudinal de mediciones repetidas. * LOCF: última observación (previa a rescate en pacientes que recibieron rescate) llevada a cabo. ‡ Media de mínimos cuadrados ajustada según valor en el nivel basal. § valor p <0.0001 versus placebo. ** valor p <0.05 versus placebo. |
||
Adición a la sitagliptina sola o en combinación con metformina LI: Un total de 452 pacientes con diabetes tipo 2 que no habían recibido tratamiento previamente, o que fueron tratados al inicio con metformina o un inhibidor de DPP4 solo o en combinación, y que tenía un control glicémico inadecuado (HbA1c de =7.0% y =10.0% en la aleatorización), fueron asignados al azar en un estudio controlado con placebo de 24 semanas con un periodo de extensión de 24 semanas para evaluar dapagliflozina en combinación con sitagliptina (un inhibidor de DPP4) con o sin metformina.
Se estratificó a los pacientes candidatos con base en la presencia o ausencia de una terapia de base de metformina (=1500 mg/día) y dentro de cada estrato se asignaron al azar a dapagliflozina 10 mg más sitagliptina 100 mg una vez al día o placebo más sitagliptina 100 mg una vez al día. Doscientos veintiséis (226) pacientes fueron analizados en el estrato de sitagliptina con metformina, 113 pacientes recibieron dapagliflozina 10 mg más sitagliptina y metformina, y 113 pacientes recibieron placebo más sitagliptina y metformina. No se permitió titular las dosis de dapagliflozina, sitagliptina o metformina durante el estudio.
Para los pacientes que recibieron sitagliptina y metformina, dapagliflozina 10 mg proporcionó mejoras significativas en HbA1c, HbA1c en pacientes con un valor inicial de HbA1c de =8%, y GPA, y una reducción significativa en el peso corporal, en comparación con el grupo de placebo a la Semana 24 (Tabla 9).
A la Semana 48, el cambio promedio ajustado a partir del valor inicial en HbA1c, HbA1c en pacientes con HbA1c inicial de =8% (sin ajustar), GPA, GPP, y el peso corporal fueron de -0.44%, -1.05%, -23.7 mg/dL, -47.2 mg/dL, y -2.53 kg, respectivamente, para pacientes tratados con dapagliflozina 10 mg más sitagliptina con metformina, y 0.15%, -0.54%, 6.3 mg/dL, -18.6 mg/dL, y -0.45 kg para pacientes tratados con placebo más sitagliptina con metformina con base en el análisis longitudinal de medidas repetidas excluyendo los datos después del rescate.
|
Tabla 9. Resultados de un estudio controlado con placebo de 24 semanas (LOCF*) de dapagliflozina de adición en combinación con sitagliptina (estratos con metformina) |
||
|
Parámetro de eficacia |
Dapagliflozina 10 mg |
Placebo |
|
N=113† |
N=113† |
|
|
HbA1c (%) |
||
|
Valor inicial (promedio) |
7.80 |
7.87 |
|
Cambio a partir del valor inicial (promedio ajustado‡) |
-0.43 |
-0.02 |
|
Diferencia de placebo (promedio ajustado‡) (IC al 95%) |
-0.40§ (-0.58, -0.23) |
|
|
Cambio a partir del valor inicial en HbA1c en pacientes con HbA1c inicial de =8% (promedio ajustado‡) |
-0.79§ (N=39) |
0.0 (N=43) |
|
GPA (mg/dL) |
||
|
Valor inicial (promedio) |
165.9 |
164.7 |
|
Cambio a partir del valor inicial en la Semana 24 (promedio ajustado‡) |
-26.2 |
3.0 |
|
Diferencia de placebo (promedio ajustado‡) (IC al 95%) |
-29.2§ (-38.0, -20.4) |
|
|
Peso corporal (kg) |
||
|
Valor inicial (promedio) |
93.95 |
94.17 |
|
Cambio a partir del valor inicial (promedio ajustado‡) |
-2.35 |
-0.47 |
|
Diferencia de placebo (promedio ajustado‡) |
-1.87§ (-2.61, -1.13) |
|
|
PAS en sedestación a la Semana 8 en pacientes con PAS inicial en sedestación de =130 mmHg (mmHg) |
||
|
Valor inicial (promedio) |
141.9 |
140.3 |
|
Cambio a partir del valor inicial (promedio ajustado‡) |
-5.3 |
-5.5 |
|
Diferencia de placebo (promedio ajustado‡) |
0.2 (-3.85, 4.32) |
|
|
GPP¶ de dos horas (mg/dL) |
||
|
Valor inicial (promedio) |
230.2 |
221.0 |
|
Cambio a partir del valor inicial (promedio ajustado‡) |
-48.9 |
-7.2 |
|
Diferencia de placebo (promedio ajustado‡) (IC al 95%) |
-41.6 (-55.4, -27.8) |
|
|
Pacientes con disminución de HbA1c de = 0.7% (% ajustado) |
28.0 |
16.0 |
|
* LOCF: última observación considerada (previa al rescate de los pacientes rescatados). † Pacientes con una medición de eficacia al inicio y al menos una posterior al inicio asignados al azar y tratados. ‡ Promedio de mínimos cuadrados ajustado al valor inicial. § valor p <0.0001 frente a placebo. ¶ Nivel de GPP de 2 horas como respuesta a una prueba de tolerancia a la glucosa oral de 75 gramos (OGTT por sus siglas en inglés). |
||
Terapia de adición en combinación con insulina: Un total de 808 pacientes con diabetes tipo 2 que tuvo un control glicémico inadecuado (HbA1c de =7.5% y =10.5%) fueron asignados al azar en un estudio controlado con placebo de 24 semanas con un periodo de extensión de 80 semanas para evaluar dapagliflozina como terapia adicional a la insulina. Los pacientes con un esquema estable de insulina, con una dosis mínima de al menos 30 UI de insulina inyectable por día, durante un periodo de al menos 8 semanas antes y un máximo de dos ADO incluyendo metformina fueron asignados al azar después de completar un periodo de inscripción de 2 semanas para recibir dapagliflozina 2.5 mg, 5 mg o 10 mg, o placebo además de su dosis actual de insulina y otros ADO, según corresponda. Los pacientes se estratificaron de acuerdo con la presencia o ausencia de antecedentes de ADO. Se permitió la titulación ascendente o descendente de insulina solo durante la fase de tratamiento en pacientes que no cumplieron con las metas glicémicas específicas. No se permitieron las modificaciones a las dosis de medicamento del estudio ciego o ADO durante la fase de tratamiento, con excepción de ADO en reducción donde no hubo problemas de hipoglucemia después de suspender la terapia de insulina.
En este estudio, el 50% de los pacientes estaba recibiendo 1 o 2 antidiabéticos orales (OADs) además de insulina; de estos, el 80% estaba recibiendo solo metformina y 14% metformina más otro OAD. A la Semana 24, la dosis de dapagliflozina 10 mg proporcionó mejoría significativa en la HbA1c, GPA y dosis promedio de insulina, y reducción significativa del peso corporal comparada con placebo en combinación con insulina, con o sin hasta 2 OADs (Tabla 10); el efecto de dapagliflozina en la HbA1c fue similar en pacientes tratados con solo insulina y en pacientes que estaban recibiendo insulina más OADs. A las Semanas 48 y 104, la media ajustada de los cambios desde el nivel basal en la HbA1c fue de -93%% y -0.71%, los cambios en la GPA fueron de -21.5 mg/dL y -18.2 mg/dL, y los cambios en el peso corporal fueron de -1.79 kg y -1.97 kg, respectivamente para pacientes tratados con dapagliflozina 10 mg más insulina; la media ajustada de los cambios desde el nivel basal en la HbA1c fue de -0.43% y -0.06%, los cambios en la GPA fueron de -4.4 mg/dL y -11.2 mg/dL, y los cambios en el peso corporal fueron de -0.18 kg y 0.91 kg, respectivamente, para pacientes tratados con placebo más insulina (véase Figura 7).
A la semana 24, una proporción significativamente alta de pacientes que reciben dapagliflozina 10 mg redujeron su dosis de insulina al menos en 10% en comparación con placebo. La proporción de pacientes que requirieron titulación ascendente de la dosis de insulina o la suspendieron debido a la falta de control glicémico (ajustado al valor inicial de HbA1c) fue mayor para placebo más insulina (29.2%) que para dapagliflozina 10 mg más insulina (9.7%). En las Semanas 48 y 104, la dosis de insulina permaneció estable en comparación con el valor inicial en pacientes tratados con dapagliflozina 10 mg con una dosis promedio de 76 UI/día, pero continuó incrementando (incremento promedio de 10.5 UI/día y 18.3 UI/día, respectivamente, para el valor inicial) en los pacientes tratados con placebo.Para las Semanas 48 y 104 (ajustadas al valor inicial de HbA1c), más pacientes tratados con placebo (42.8% y 50.4%, respectivamente) requirieron titulación ascendente con insulina para mantener los niveles glicémicos o la suspendieron debido a la falta de control glicémico que los pacientes tratados con dapagliflozina 10 mg (15.3% y 25.5%, respectivamente).
En un análisis distinto de pacientes que reciben insulina más metformina LI sola, se observaron mejoras similares a las de la población total del estudio en pacientes tratados con dapagliflozina más insulina con metformina en HbA1c, peso corporal y dosis promedio de insulina en comparación con placebo más insulina con metformina en la Semana 24 (Tabla 10).
|
Tabla 10. Resultados del estudio controlado con placebo de 24 semanas (LOCF*) de dapagliflozina en combinación con insulina con o sin hasta 2 tratamientos orales antidiabéticos |
||
|
Parámetro de eficacia |
Dapagliflozina 10 mg |
Placebo |
|
Población con intención de tratar |
N=194†‡ |
N=193†‡ |
|
HbA1c (%) |
||
|
Valor inicial (promedio) |
8.58 |
8.46 |
|
Cambio a partir del valor inicial (promedio ajustado§) |
-0.90 |
-0.30 |
|
Diferencia de placebo (promedio ajustado§) |
-0.60¶ |
|
|
Pacientes que recibieron insulina + metformina sola** |
N=83 |
N=77 |
|
HbA1c (%) |
||
|
Valor inicial (promedio) |
8.52 |
8.43 |
|
Cambio a partir del valor inicial (promedio ajustado§) |
-0.93 |
-0.31 |
|
Diferencia de placebo (promedio ajustado§) |
-0.61 (-0.83, -0.40) |
|
|
Población con intención de tratar |
N=194†‡ |
N=193†‡ |
|
Dosis diaria promedio de insulina (UI)†† |
||
|
Valor inicial (promedio) |
77.96 |
73.96 |
|
Cambio a partir del valor inicial (promedio ajustado§) |
-1.16 |
5.08 |
|
Diferencia de placebo |
-6.23¶ |
|
|
Porcentaje de pacientes con reducción de dosis diaria promedio de insulina de al menos 10% ajustado al valor inicial |
19.7%# |
11.0% |
|
Pacientes que recibieron insulina + metformina sola** |
N=83 |
N=77 |
|
Dosis diaria promedio de insulina (UI) †† |
||
|
Valor inicial (promedio) |
79.75 |
82.14 |
|
Cambio a partir del valor inicial (promedio ajustado§) |
-1.70 |
3.46 |
|
Diferencia de placebo |
-5.15 |
|
|
Porcentaje de pacientes con reducción de dosis diaria promedio de insulina de al menos 10% ajustado al valor inicial |
19.0% |
13.1% |
|
Población con intención de tratar |
N=194†‡ |
N=193†‡ |
|
GPA (mg/dL) |
||
|
Valor inicial (promedio) |
173.7 |
170.0 |
|
Cambio a partir del valor inicial (promedio ajustado§) |
-21.7 |
3.3 |
|
Diferencia de placebo (promedio ajustado§) |
-25.0¶ |
|
|
Pacientes que recibieron insulina + metformina sola** |
N=83 |
N=77 |
|
GPA (mg/dL) |
||
|
Valor inicial (promedio) |
173.8 |
166.3 |
|
Cambio a partir del valor inicial (promedio ajustado§) |
-25.7 |
11.4 |
|
Diferencia de placebo (promedio ajustado§) |
-37.1 |
|
|
Población con intención de tratar |
N=194†‡ |
N=193†‡ |
|
Peso corporal (kg) |
||
|
Valor inicial (promedio) |
94.63 |
94.21 |
|
Cambio a partir del valor inicial (promedio ajustado§) |
-1.67 |
0.02 |
|
Diferencia de placebo (promedio ajustado§) (IC al 95%) |
-1.68¶ |
|
|
Pacientes que recibieron insulina + metformina sola** |
N=83 |
N=77 |
|
Peso corporal (kg) |
||
|
Valor inicial (promedio) |
95.68 |
98.69 |
|
Cambio a partir del valor inicial (promedio ajustado§) |
-1.77 |
-0.06 |
|
Diferencia de placebo (promedio ajustado§) (IC al 95%) |
-1.71 |
|
|
* LOCF: última observación considerada (previa al rescate de los pacientes rescatados). † Pacientes con una medición de eficacia al inicio y al menos una posterior al inicio asignados al azar y tratados. ‡ 50% de los pacientes recibieron monoterapia de insulina al inicio. § Promedio de mínimos cuadrados ajustado al valor inicial. ** Análisis retrospectivo. ¶ valor p <0.0001 frente a placebo. # valor p <0.05 frente a placebo. |
||
FIGURA 7. Cambio promedio paulatino ajustado a partir del valor inicial en HbA1c (%) en un estudio controlado con placebo de 104 semanas de dapagliflozina en combinación con insulina con o sin hasta 2 terapias orales antidiabéticas excluyendo los datos después de la titulación ascendente de la insulina
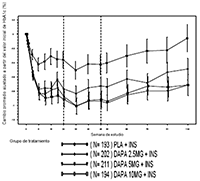
Las barras de error representan intervalos de confianza al 95% para el cambio promedio ajustado a partir del valor inicial
Inicio concomitante de saxagliptina y dapagliflozina en pacientes controlados inadecuadamente con metformina: Un total de 534 pacientes adultos con diabetes mellitus tipo 2 y control glicémico inadecuado con solo metformina (HbA1c =8% y =12%) participaron en este estudio de superioridad de 24 semanas, aleatorizado, doble-ciego, controlado con comparador activo, para comparar la combinación de saxagliptina y dapagliflozina adicionada simultáneamente a metformina, versus saxagliptina (inhibidor DPP4) o dapagliflozina adicionada a metformina. Los pacientes se aleatorizaron a uno de tres grupos de tratamiento doble-ciego a recibir saxagliptina 5 mg y dapagliflozina 10 mg adicionadas a metformina XR, saxagliptina 5 mg y placebo añadidos a metformina XR, o dapagliflozina 10 mg y placebo adicionados a metformina XR.
El grupo que recibió la combinación de saxagliptina y dapagliflozina logró reducciones significativamente mayores en la HbA1c versus el grupo saxagliptina o el grupo dapagliflozina a las 24 semanas. El cuarenta y uno por ciento (41%) de pacientes en el grupo de combinación de saxagliptina y dapagliflozina logró niveles de HbA1c menores de 7% comparado con el 18% de pacientes en el grupo saxagliptina, y 22% de pacientes en el grupo dapagliflozina.
|
Tabla 11. Hb1c a la Semana 24 (LRM*) en el estudio activo-controlado que comparó la combinación de saxagliptina y dapagliflozina adicionada simultáneamente a metformina, con saxagliptina o dapagliflozina adicionada simultáneamente a metformina |
|||
|
Parámetro de eficacia |
Saxagliptina 5 mg + Dapaglifozina 10 mg + Metformina XR |
Saxagliptina 5 mg + Metformina XR |
Dapaglifozina 10 mg + Metformina XR |
|
HbA1c (%) en la semana 24 (LMR)* |
|||
|
Nivel basal (media) |
8.93 |
9.03 |
8.87 |
|
Cambio desde el nivel basal (media ajustada‡) |
-1.47 (-1.62, -1.31) |
-0.88 (-1.03, -0.72) |
-1.20 (-1.43, -1.04) |
|
Diferencia con saxagliptina + metformina (media ajustada‡) |
-0.59§ (-0.81, -0.37) |
- |
- |
|
Diferencia con dapaglifozina + metformina (media ajustada‡) |
-0.27¶ (-0.48, -0.05) |
- |
- |
|
* LRM = Mediciones longitudinales repetidas (usando valores prefios a rescate). † Pacientes aleatorizados y tratados con medición de eficacia a nivel basal y por lo menos 1 post-nivel basal. ‡ Media de mínimos cuadrados ajustada según valor en el nivel basal. § valor p <0.0001. ¶ valor p =0.0166. |
|||
La media ajustada del cambio en el peso corporal a las 24 semanas fue de -2.05 kg (IC 95%[-2.52, -1.58]) en el grupo saxagliptina y FORXIGA® más metformina y -2.39 kg (IC 95% [-2.87, -1.91]) en el grupo FORXIGA® más metformina. La media ajustada del cambio en el peso corporal en el grupo saxagliptina más metformina no tuvo cambio 0.00 kg (IC 95% [-0.48, 0.49]).
Terapia adicional con dapagliflozina en pacientes controlados inadecuadamente con saxagliptina más metformina: Un estudio de 24 semanas, aleatorizado, doble-ciego, placebo-controlado, comparó la adición secuencial de 10 mg de dapagliflozina a 5 mg de saxagliptina y metformina, con la adición de placebo a 5 mg de saxagliptina (inhibidor DPP4) y metformina en pacientes con diabetes mellitus tipo 2 y control glicémico inadecuado (HbA1c =7% y =10.5%). Se aleatorizaron 320 sujetos en forma equitativa al grupo de tratamiento con dapagliflozina adicionada a saxagliptina más metformina, o al grupo de tratamiento con placebo más saxagliptina más metformina.
El grupo tratado con dapagliflozina adicionada secuencialmente a saxagliptina y metformina alcanzó mayores reducciones estadísticamente significativas (valor p <0.0001) en la HbA1c versus el grupo tratado con placebo añadido secuencialmente a saxagliptina más metformina a las 24 semanas (véase Tabla 12).
|
Tabla 12. Resultados de un estudio de 24 semanas (LRM*) placebo-controlado de dapagliflozina en combinación adicionada a saxaagliptina y metformina |
||
|
Parámetro de eficacia |
Dapagliflozina 10 mg + Saxagliptina 5 mg + Metformina (N=160)† |
Placebo + Saxagliptina 5 mg + Metformina (N=160)† |
|
HbA1c (%) a la semana 24* |
||
|
Nivel basal (media) |
8.24 |
8.16 |
|
Cambio desde el nivel basal (media ajustada‡) (IC 95%) |
-0.82 (-0.96, 0.69) |
-0.10 (-0.24, 0.04) |
|
Comparación de FORXIGA® adicionada a saxa + met vs. placebo + saxa + met: Media ajustada* IC 95% |
-0.72 (-0.91, 0.53) § |
|
|
GPA (mg/dL) |
||
|
Nivel basal (media) |
178.5 |
176.6 |
|
Cambio desde el nivel basal (media ajustada‡) (IC 95%) |
-32.7 (-38.3, -27.2) |
-5.3 (-11.1, 0.6) |
|
Comparación de FORXIGA® adicionada a saxa + met vs. placebo + saxa + met: Media ajustada* IC 95% |
-27.5 (-35.4, -19.6) § |
|
|
GPP¶ a las 2 horas (mg/dL) |
||
|
Nivel basal (media) |
239.8 |
241.3 |
|
Cambio desde el nivel basal (media ajustada‡) (IC 95%) |
-73.5 (-81.5, -65.5) |
-38.0 (-46.1, -29.9) |
|
Comparación de FORXIGA® adicionada a saxa + met vs. placebo + saxa + met: Media ajustada¶ IC 95% |
-35.5§ (-46.3, -24.7) |
|
|
* LRM = Mediciones longitudinales repetidas (usando valores previos a rescate). † Pacientes aleatorizados y tratados con medición de eficacia a nivel basal y por los menos 1 post-nivel basal. ‡ Media de mínimos cuadrados ajustada según valor de nivel basal. ¶ LOCF: última observación (previa a rescate para pacientes que recibieron rescate) llevada a cabo. § valor p <0.0001 versus placebo. saxa= saxagliptina; met=metformina |
||
La proporción de pacientes que lograron una HbA1c <7.0% a la Semana 24 fe mayor en el grupo saxagliptina más dapagliflozina más metformina 38.0% (IC 95% [30.9, 45.1]) comparado con el grupo placebo más saxagliptina más metformina 12.4% (IC 95% [7.0, 17.9]).
Los cambios ajustados desde el nivel basal a la Semana 24 en el peso corporal fueron de -1.91 kg (IC 95% [-2.34, -1.48]), en el grupo FORXIGA® más saxagliptina más metformina y -0.41 kg (IC 95% [-0.86, -0.04]), en el grupo placebo más saxagliptina más metformina.
Los efectos en la HbA1c, GPA y peso corporal observados a la Semana 24 se mantuvieron a la Semana 52. La media ajustada de cambio desde el nivel basal en la HbA1c, GPA y peso corporal fue de -0.74% (IC 95% [-0.90, -0.57]), -26.8 mg/dL (IC 95% [-34.2, -19.4]) y -2.13 kg (IC 95% [ -2.70, -1.56]), respectivamente, para pacientes tratados con FORXIGA® 10 mg más saxagliptina con metformina, y 0.07% (IC 95% [-0.13, 0.27]), 10.2 mg/dL (IC 95% [ 1.6, 18.8]) y -0.37 kg (IC 95% [-1.01, 0.26]) para pacientes tratados con placebo más saxagliptina con metformina según el análisis longitudinal de mediciones repetidas, excluyendo datos después de rescate.
Estudios de apoyo
Uso en pacientes con diabetes tipo 2 e hipertensión: En dos estudios controlados con placebo de 12 semanas, se trató a un total de 1062 pacientes con control inadecuado de diabetes tipo 2 e hipertensión con dapagliflozina 10 mg o placebo. Fueron aptos para estos estudios los pacientes con hipertensión controlada inadecuadamente (presión arterial sistólica en sedestación de =140 y <165 mmHg, presión arterial diastólica en sedestación de =85 y <105 mmHg, y una presión arterial promedio de 24 horas de =130/80 mmHg) a pesar del tratamiento estable preexistente con un inhibidor de enzimas convertidoras de angiotensina (ECA) o un bloqueador de receptores de angiotensina (BRA) (sola [Estudio 1] o en combinación con una antihipertensivo adicional [Estudio 2]) así como un control glicémico inadecuado (HbA1c de =7.0% y =10.5%) a pesar del tratamiento estable preexistente con ADO (incluyendo metformina de liberación inmediata o liberación prolongada) o insulina (sola o en combinación) antes de comenzar. Durante los estudios, no se permitió ningún ajuste de medicamentos antidiabéticos y antihipertensivos. En los 2 estudios, 527 pacientes fueron tratados con dapagliflozina 10 mg y 535, con placebo.Aproximadamente 90% de los pacientes tratados con dapagliflozina 10 mg o placebo también recibieron metformina de liberación inmediata o prolongada además de otros ADO. Los pacientes tratados con dapagliflozina 10 mg o placebo también recibieron los siguientes medicamentos para el control de la presión arterial, los cuales fueron balanceados entre los grupos de tratamiento: ECA (64%), BRA (36%), diuréticos de tiazida (16%), bloqueadores de los canales de calcio (9%), y beta bloqueadores (6%).
En la Semana 12 para ambos estudios, dapagliflozina 10 mg más el tratamiento normal proporcionaron una mejora significativa en HbA1c y una reducción significativa en la presión arterial sistólica en sedestación en comparación con placebo más el tratamiento normal (ver Tabla 13). Se observaron reducciones consistentes en la presión arterial sistólica ambulatoria de 24 horas promedio en pacientes tratados con dapagliflozina 10 mg en comparación con placebo. Hubo una ligera reducción en la presión arterial diastólica en sedestación promedio en pacientes tratados con dapagliflozina 10 mg que no fue estadísticamente significativa en comparación con placebo.
|
Tabla 13. Resultados a la Semana 12 en 2 estudios controlados con placebo de dapagliflozina en pacientes con diabetes tipo 2 e hipertensión |
||||
|
Estudio 1 |
Estudio 2 |
|||
|
Parámetro de eficacia |
Dapagliflozina 10 mg + Tratamiento normal N=302† |
Placebo + Tratamiento normal N=311† |
Dapagliflozina 10 mg + Tratamiento normal N=225† |
Placebo N=224† |
|
HbA1c (%) (LMR)* |
||||
|
Valor inicial (promedio) |
8.1 |
8.0 |
8.1 |
8.0 |
|
Cambio a partir del valor inicial (promedio ajustado‡) |
-0.6 |
-0.1 |
-0.6 |
0.0 |
|
Diferencia de placebo (promedio ajustado‡) (IC al 95%) |
-0.5§ (-0.6, -0.3) |
-0.6§ (-0.8, -0.5) |
||
|
PAS en sedestación (mmHg) (LMR) * |
||||
|
Valor inicial (promedio) |
149.8 |
149.5 |
151.0 |
151.3 |
|
Cambio a partir del valor inicial (promedio ajustado‡) |
-10.4 |
-7.3 |
-11.9 |
-7.6 |
|
Diferencia del (promedio ajustado‡) |
-3.1¶ (-4.9, -1.2) |
-4.3¶ (-6.5, -2.0) |
||
|
* LMR: Análisis longitudinal de medidas repetidas. † Todos los pacientes asignados al azar que tomaron al menos una dosis del medicamento del estudio doble ciego durante el periodo doble ciego a corto plazo. ‡ Promedio de mínimos cuadrados ajustado al valor inicial. § valor p <0.0001. ¶ valor p <0.05. # LOCF: última observación considerada. |
||||
Uso en Pacientes con Diabetes Tipo 2 y Enfermedad Cardiovascular: En dos estudios controlados con placebo de 24 semanas con periodos de extensión de 80 semanas, un total de 1887 pacientes con diabetes tipo 2 y ECV fueron tratados con dapagliflozina 10 mg o placebo.
Los pacientes con ECV establecida y control glicémico inadecuado (HbA1c de =7.0% y =10.0%), a pesar del tratamiento estable preexistente con ADO o insulina (sola o en combinación) antes del inicio, fueron aptos para estos estudios y se estratificaron de acuerdo con la edad (<65 años o =65 años), uso de insulina (sí o no), y tiempo del evento cardiovascular más reciente admisible (>1 año o <1 año antes de la inscripción). En los 2 estudios, 942 pacientes fueron tratados con dapagliflozina 10 mg y 945, con placebo. Noventa y seis por ciento (96%) de los pacientes tratados con dapagliflozina 10 mg en los 2 estudios padecieron hipertensión al inicio, la mayoría durante más de 10 años; los eventos cardiovasculares admisibles más comunes fueron cardiopatía isquémica (75%) y accidente cerebral vascular (22%). Aproximadamente 19% de los pacientes recibieron diuréticos de asa al inicio y 15% presentó insuficiencia cardiaca congestiva (2% presentó NYHA Clase III). Aproximadamente 37% de los pacientes tratados con dapagliflozina 10 mg también recibieron metformina más un ADO adicional (sulfonilúrea, tiazolidinediona, inhibidor de DPP4, u otro ADO con o sin insulina al inicio), 39% recibieron insulina más al menos un ADO, y 18% recibieron insulina sola.
En la Semana 24 para ambos estudios, cuando se añadió a tratamientos antidiabéticos preexistentes, el tratamiento con dapagliflozina 10 mg proporcionó una mejora significativa en los criterios de valoración coprimarios de HbA1c y un beneficio clínico compuesto en comparación con placebo. El beneficio clínico compuesto se definió como la proporción de pacientes con una disminución absoluta a partir del valor inicial de 0.5% en HbA1c, y una disminución relativa a partir del valor inicial de al menos 3% en el peso corporal total, y una disminución absoluta a partir del valor inicial de al menos 3 mmHg en la presión arterial sistólica en posición en sedestación (Tabla 14). También se observaron reducciones significativas en el peso corporal total y la presión arterial sistólica en sedestación en pacientes tratados con dapagliflozina 10 mg en comparación con placebo.
En otro análisis de pacientes con metformina sola (con o sin insulina) en estos dos estudios, se observaron mejoras similares en HbA1c y una reducción del porcentaje del peso corporal que en la población total del estudio en pacientes tratados con dapagliflozina 10 mg más metformina sola en comparación con placebo más metformina sola a la Semana 24. Se observó una reducción promedio en la presión arterial sistólica en sedestación, consistente con la observada en la población total del estudio, en pacientes tratados con dapagliflozina 10 mg más metformina sola en comparación con placebo más metformina sola en la Semana 24 en el estudio 1, pero no en el estudio 2.
En la Semana 52 y la Semana 104 del Estudio 1, el cambio promedio ajustado a partir del valor inicial de HbA1c, la presión arterial sistólica en sedestación, y el cambio porcentual ajustado a partir del valor inicial en el peso corporal fueron de -0.44% y -0.41%, -3.40 mmHg y -2.64 mmHg, y -2.89% y -3.53%, respectivamente, para pacientes tratados con dapagliflozina 10 mg más el tratamiento normal con base en el análisis longitudinal de medidas repetidas. Las cifras correspondientes para los pacientes tratados con placebo más el tratamiento normal fueron 0.22% y 0.50%, 0.18 mmHg y 1.54 mmHg, y -0.29% y -0.02%. En la Semana 52 y la Semana 104, el porcentaje del beneficio clínico compuesto fue aún mayor en el grupo de dapagliflozina 10 mg (6.6% y 3.8%) que en el grupo de placebo (0.7% y 0.5%).
En la Semana 24, Semana 52, y Semana 104 para el Estudio 1, la proporción de pacientes que fueron rescatados por falta de control glicémico (ajustado al valor inicial de HbA1c) fue mayor en el grupo de placebo más tratamiento normal (24.0%, 51.8%, y 57.3%, respectivamente) que en el grupo de dapagliflozina 10 mg más el tratamiento normal (7.8%, 24.6%, y 31.8%, respectivamente).
En la Semanas 52 y 104 para el Estudio 2, el cambio promedio ajustado a partir del valor inicial en HbA1c, la presión arterial sistólica en sedestación, y el cambio porcentual ajustado a partir del valor inicial en el peso corporal fueron de -0.47% y -0.37%, -3.56 mmHg y -1.96 mmHg, y -3.20% y -3.51%, respectivamente, para pacientes tratados con dapagliflozina 10 mg más el tratamiento normal con base en el análisis longitudinal de medidas repetidas. Las cifras correspondientes para los pacientes tratados con placebo más el tratamiento normal fueron 0.03% y -0.18%, -0.91 mmHg y -0.37 mmHg, y -1.12% y -0.65%. En la Semanas 52 y 104, el beneficio porcentual clínico compuesto fue aún mayor en el grupo de dapagliflozina 10 mg (10.6% y 4.2%) que en el grupo de placebo (3.1% y 1.1%).
En la Semana 24, Semana 52, y Semana 104 para el Estudio 2, la proporción de pacientes que fueron rescatados por falta de control glicémico (ajustados al valor inicial de HbA1c) fue mayor en el grupo de placebo más el tratamiento normal (22.3%, 43.6%, y 50.5%, respectivamente) que en el grupo de dapagliflozina 10 mg más el tratamiento normal (7.6%, 18.7%, y 27.5%, respectivamente).
|
Tabla 14. Resultados de dos estudios controlados con placebo en la Semana 24 (LOCF*) de comparación de dapagliflozina con placebo en pacientes con diabetes tipo 2 y enfermedad cardiovascular |
||||
|
Estudio 1 |
Estudio 2 |
|||
|
Parámetro de eficacia |
Dapagliflozina 10 mg + Tratamiento normal |
Placebo + Tratamiento normal |
Dapagliflozina 10 mg + Tratamiento normal |
Placebo + Tratamiento normal |
|
N=455† |
N=459† |
N=480† |
N=482† |
|
|
HbA1c (%) |
||||
|
Valor inicial promedio |
8.18 |
8.08 |
8.04 |
8.07 |
|
Cambio a partir del valor inicial (promedio ajustado‡) |
-0.38 |
0.08 |
-0.33 |
0.07 |
|
Diferencia de placebo (promedio ajustado‡) (IC al 95%) |
-0.46§ (-0.56, -0.37) |
-0.40§ (-0.50, -0.30) |
||
|
Respondedores al beneficio clínico compuesto (%) |
11.7 |
0.9 |
10.0 |
1.9 |
|
Diferencia de placebo (ajustado%) |
9.9§ |
7.0§ |
||
|
Componentes del criterio de valoración compuesto (%) |
||||
|
Pacientes con reducción absoluta HbA1c =0.5% (% ajustado) |
46.2 |
19.7 |
42.2 |
21.2 |
|
Pacientes con disminución del peso corporal de al menos 3% a partir del valor inicial (% ajustado) |
40.0 |
13.9 |
41.3 |
15.4 |
|
Pacientes con reducción absoluta en PAS =3 mmHg (% ajustado) |
49.1 |
41.6 |
46.2 |
40.9 |
|
Peso corporal (kg) |
||||
|
Valor inicial promedio |
92.63 |
93.59 |
94.53 |
93.22 |
|
Cambio a partir del valor inicial (porcentaje ajustado‡) |
-2.56 |
-0.30 |
-2.53 |
-0.61 |
|
Diferencia de placebo (porcentaje ajustado‡) (IC al 95%) |
-2.27§ (-2.64, -1.89) |
-1.93§ (-2.31, -1.54) |
||
|
Disminución del peso corporal de al menos 5% en pacientes con IMC inicial de =27 kg/m2 (%) |
16.5§ |
4.0 |
18.4§ |
4.8 |
|
PAS en sedestación (mmHg) |
||||
|
Cambio a partir del valor inicial en la Semana 24 (promedio ajustado‡) |
-2.99 |
-1.03 |
-2.70 |
0.32 |
|
Diferencia de placebo (promedio ajustado‡) (IC al 95%) |
-1.95¶ (-3.56, -0.34) |
-3.02¶ (-4.59, -1.46) |
||
|
Cambio de la PAS en sedestación inicial (mmHg) a la semana 8 en pacientes con PAS inicial de =130 mmHg (promedio ajustado‡) |
- |
- |
-5.33¶ |
-1.89 |
|
* LOCF: última observación considerada. † Pacientes con una medición de eficacia al inicio y al menos una posterior al inicio asignados al azar y tratados. ‡ Promedio de mínimos cuadrados ajustado al valor inicial. § valor p <0.0001. ¶ valor p <0.05. |
||||
En la Semana 24, los pacientes tratados con dapagliflozina 10 mg en los grupos de edad predefinida (<65 y =65 años de edad) también mostraron mejoras significativas en los criterios de valoración coprimarios de HbA1c y beneficio clínico compuesto en comparación con placebo en ambos estudios. También se observó una reducción significativa en el peso total corporal en ambos grupos de edad y una reducción significativa de la presión arterial sistólica en sedestación en pacientes de <65 años tratados con dapagliflozina 10 mg en comparación con placebo a la Semana 24. Estos efectos se mantuvieron en la Semana 52 y la Semana 104.
Absorciometría de rayos X de doble energía de dapagliflozina en pacientes diabéticos: Debido al mecanismo de acción de dapagliflozina, se realizó un estudio para evaluar la composición corporal y la densidad mineral ósea en 182 pacientes con diabetes tipo 2. El tratamiento con dapagliflozina 10 mg añadida a metformina LI durante un periodo de 24 semanas proporcionó mejoras significativas en comparación con placebo más metformina, respectivamente, en peso corporal (cambio promedio a partir del valor inicial: -2.96 kg frente a -0.88 kg), circunferencia de la cintura (cambio promedio a partir del valor inicial: -2.51 cm vs. -0.99 cm), y masa de grasa corporal medida por DXA (cambio promedio a partir del valor inicial -2.22 kg vs. -0.74 kg) en lugar de tejido magro o pérdida de fluidos. El tratamiento de dapagliflozina más metformina mostró una reducción numérica en el tejido adiposo visceral en comparación con el tratamiento de placebo más metformina (cambio promedio a partir del valor inicial: -322.6 cm3 frente a -8.7 cm3) en un subestudio con MRI. La Semana 24 se analizó utilizando el análisis de la última observación considerada incluyendo los datos posteriores al rescate.
En la Semana 24, 2 pacientes (2.2%) en el grupo de placebo más metformina y ningún paciente en el grupo de dapagliflozina 10 mg más metformina fueron rescatados por falta de control glicémico.
En la Semana 50 y en la Semana 102, las mejoras fueron sostenidas en el grupo de dapagliflozina 10 mg añadida a la metformina en comparación con el grupo de placebo más metformina para el peso corporal (cambio promedio ajustado a partir del valor inicial en la Semana: -4.39 kg frente a -2.03 kg; el cambio promedio ajustado a partir del valor inicial en la Semana 102: -4.54 kg frente a -2.12 kg), circunferencia de la cintura (cambio promedio ajustado a partir del valor inicial en la Semana 50: -5.0 cm frente a -3.0 cm; cambio promedio ajustado a partir del valor inicial en la Semana 102: -5.0 cm frente a -2.9 cm), y masa de grasa corporal medida por DXA en la Semana 102 (cambio promedio a partir del valor inicial: -2.80 kg frente a -1.46 kg) con base en el análisis longitudinal de medidas repetidas incluyendo los datos posteriores al rescate. En un subestudio con MRI en las Semanas 50 y 102, el tratamiento de dapagliflozina más metformina mostró una reducción numérica en el tejido adiposo visceral en comparación con el tratamiento de placebo más metformina (cambio promedio ajustado a partir del valor inicial en la Semana 50: -120.0 cm3 frente a 61.5 cm3; cambio promedio ajustado a partir del valor inicial en la Semana 102: -214.9 cm3 frente a -22.3 cm3).
La proporción de pacientes en la Semana 50 (no ajustada al valor inicial de HbA1c) y la Semana 102 (ajustada al valor inicial de HbA1c) que fueron rescatados o suspendidos por falta de control glicémico fue mayor en el grupo de placebo más metformina (6.6% y 33.2%, respectivamente) que en el grupo de dapagliflozina 10 mg más metformina (2.2% y 13.5%, respectivamente).
En una extensión de este estudio para la Semana 50, no se observó cambio en la densidad mineral ósea (DMO) en la columna lumbar, el cuello femoral, o la cadera completa en ningún grupo de tratamiento (disminución promedio de <0.5% a partir del valor inicial para todas las regiones anatómicas). Tampoco hubo cambio en la DMO en ningún grupo de tratamiento hasta la Semana 102 (disminución promedio de <1.0% a partir del valor inicial para todas las regiones anatómicas). No hubo cambios clínicamente significativos en los marcadores de resorción ósea o formación ósea.
Estudio UKPDS de metformina: El estudio prospectivo aleatorizado (UKPDS) estableció el beneficio a largo plazo de un control intensivo de glucosa en la sangre en la diabetes tipo 2. Se mostró el análisis de los resultados para pacientes con sobrepeso tratados con metformina después de un fracaso con pura dieta:
reducción significativa del riesgo absoluto de cualquier complicación relacionada con la diabetes en el grupo de metformina (29.8 eventos/1,000 años-paciente) frente a solo dieta (43.3 eventos/1,000 años-pacientes), (p=0.0023), y frente a los grupos de sulfonilúrea combinada y monoterapia de insulina (40.1 eventos/1,000 años-paciente), (p=0.0034);
• Reducción significativa del riesgo absoluto de cualquier mortalidad relacionada con la diabetes: Metformina 7.5 eventos/1,000 años-paciente, dieta sola 12.7 eventos/1,000 años-paciente, (p=0.017);
• Reducción significativa del riesgo absoluto de mortalidad general: Metformina 13.5 eventos/1,000 años-paciente frente a dieta sola 20.6 eventos/1,000 años-paciente, (p=0.011), y frente a los grupos de sulfonilúrea combinada y monoterapia de insulina 18.9 eventos/1,000 años-paciente (p=0.021);
• Reducción significativa en el riesgo absoluto de infarto de miocardio: Metformina 11 eventos/1,000 años-paciente, dieta sola 18 eventos/1,000 años-paciente, (p=0.01).
ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE USO
General: XIGDUO® XR no debe usarse en pacientes con diabetes tipo 1 ni para tratar la cetoacidosis diabética.
Acidosis láctica
Clorhidrato de metformina: La acidosis láctica es una complicación metabólica rara, pero grave, que puede ocurrir debido a la acumulación de metformina durante el tratamiento con XIGDUO® XR; cuando esto ocurre, es mortal en aproximadamente 50% de los casos. La acidosis láctica también puede ocurrir en relación con cierto número de padecimientos fisiopatológicos, incluyendo diabetes mellitus, y siempre que existan hipoxemia e hipoperfusión tisular significativas. La acidosis láctica se caracteriza por niveles elevados de lactato en la sangre (>5 mmol/L), reducción de pH en la sangre, alteraciones electrolíticas con diferencia aniónica incrementada, y una proporción incrementada de lactato/piruvato. Cuando la metformina está implicada como la causa de acidosis láctica, generalmente se encuentran niveles plasmáticos de metformina de >5 µg/mL.
La incidencia reportada de acidosis láctica en pacientes que reciben clorhidrato de metformina es muy baja (aproximadamente 0.03 casos/1000 años-paciente, con aproximadamente 0.015 casos fatales/1000 años-paciente). En más de 20,000 años-paciente de exposición a la metformina en ensayos clínicos, no hubo reportes de acidosis láctica. Los casos reportados han ocurrido principalmente en pacientes diabéticos con significativa insuficiencia renal, incluyendo tanto hipoperfusión renal como nefropatía intrínseca, generalmente en un contexto de múltiples problemas quirúrgicos/médicos concomitantes y múltiples medicamentos concomitantes. Los pacientes con insuficiencia cardiaca congestiva que requieren un tratamiento farmacológico, en particular aquellos con insuficiencia cardiaca congestiva inestable o aguda que están en riesgo de hipoperfusión e hipoxemia, tienen un riesgo incrementado de acidosis láctica. El riesgo de acidosis láctica aumenta con el grado de disfunción renal y la edad del paciente. Por lo tanto, el riesgo de acidosis láctica puede reducirse significativamente con un monitoreo regular la función renal en pacientes que ingieren metformina y por medio del uso de la dosis mínima efectiva de metformina. Se debe monitorear más particularmente la función renal de los adultos mayores en tratamiento. No debe administrarse tratamiento con metformina a pacientes =80 años de edad a menos que la medición de depuración de creatinina demuestre que la función renal no está reducida, debido a que estos pacientes son más susceptibles a desarrollar acidosis láctica. Adicionalmente, la metformina debe retirarse rápidamente en presencia de cualquier padecimiento asociado con hipoxemia, deshidratación, o sepsis. Debido a que la función hepática insuficiente puede limitar significativamente la capacidad de eliminar lactato, generalmente debe evitarse la metformina en pacientes con evidencia clínica o de laboratorio de enfermedad hepática. Se debe advertir a los pacientes sobre la ingesta excesiva de alcohol, ya sea aguda o crónica, cuando se ingiere metformina puesto que el alcohol incrementa los efectos del clorhidrato de metformina en el metabolismo de lactato. Además, la metformina debe descontinuarse de forma temporal antes de cualquier estudio de radiocontraste intravascular y para cualquier procedimiento quirúrgico.
El inicio de la acidosis láctica generalmente es sutil y está acompañado únicamente de síntomas no específicos tales como malestar, mialgias, insuficiencia respiratoria, aumento de somnolencia y malestar abdominal no especificado. Se puede asociar la hipotermia, hipotensión y bradiarritmias resistentes con una acidosis más marcada. El paciente y su médico deben estar conscientes de la posible importancia de dichos síntomas y se le debe instruir al paciente notificarle a su médico inmediatamente si éstos ocurren. La metformina debe retirarse hasta que se aclare la situación. Pueden ser útiles los electrolitos séricos, las cetonas, la glucemia, y si se indica, pH sanguíneo, niveles de lactato e incluso niveles de metformina en sangre. Una vez que se ha estabilizado al paciente en cualquier nivel de dosis de metformina, es poco común que haya síntomas gastrointestinales relacionados con el medicamento, los cuales son comunes al inicio de la terapia. La aparición posterior de síntomas gastrointestinales puede deberse a acidosis láctica u otras enfermedades graves.
Los niveles de lactato plasmático venoso en ayunas por arriba del límite superior de la normalidad, pero menores a 5 mmol/L, en pacientes que toman metformina no indican necesariamente acidosis láctica inminente y pueden explicarse por otros mecanismos tales como diabetes u obesidad mal controlada, actividad física vigorosa o problemas técnicos en el manejo de la muestra.
Se debe sospechar acidosis láctica en cualquier paciente diabético con acidosis metabólica sin evidencia de cetoacidosis (cetonuria y cetonemia).
La acidosis láctica es una emergencia médica que debe tratarse en un hospital. En un paciente con acidosis láctica que ingiera metformina, debe descontinuarse inmediatamente el medicamento y deben llevarse a cabo medidas generales de apoyo. Ya que el clorhidrato de metformina se puede dializar (con depuración de hasta 170 mL/min bajo buenas condiciones hemodinámicas), se recomienda hemodiálisis inmediata para corregir la acidosis y retirar la metformina acumulada. Este manejo generalmente resulta en una inversión oportuna de los síntomas y recuperación.
Uso en pacientes con insuficiencia renal
Dapagliflozina: La eficacia de dapagliflozina depende de la función renal. XIGDUO® XR no debe utilizarse en pacientes con insuficiencia renal moderada a grave (CrCl <60 mL/min por Cockcroft-Gault). Por lo tanto, como con todos los pacientes diabéticos, la función renal debe evaluarse antes de empezar a administrar XIGDUO® XR y posteriormente de manera periódica (ver sección Posología y método de administración, Contraindicaciones, Advertencias y precauciones especiales de uso y Efectos no deseados).
No se ha estudiado dapagliflozina en pacientes con insuficiencia renal grave (VFGe de <30 mL/min/1.73m2 por MDRD o CrCl =30 mL/min por Cockcroft-Gault) o nefropatía terminal (NT) y por lo tanto, no debe utilizarse en esta población.
Clorhidrato de metformina: La metformina es conocida por ser excretada sustancialmente por el riñón y el riesgo de acumulación de metformina y acidosis láctica incrementa con el grado de insuficiencia de la función renal. Por lo tanto, los pacientes con niveles de creatinina sérica por arriba del límite superior de la normalidad para su edad no deberían recibir XIGDUO® XR. En los adultos mayores, XIGDUO® XR debe titularse cuidadosamente para establecer la dosis mínima para el efecto glicémico adecuado porque la edad está asociada con una función renal disminuida. En pacientes adultos mayores, particularmente aquellos =80 años de edad, la función renal debe monitorearse regularmente y, generalmente, XIGDUO® XR no debe titularse a la dosis máxima del componente de metformina.
Antes de iniciar la terapia de XIGDUO® XR, y al menos anualmente después, la función renal debe valorarse y verificarse como normal. En pacientes en los que es anticipado el desarrollo de la disfunción renal, la función renal debe evaluarse con mayor frecuencia y XIGDUO® XR debe descontinuarse si existe evidencia de insuficiencia renal.
Uso en pacientes con insuficiencia hepática
Clorhidrato de metformina: Debido a que la función hepática insuficiente se ha asociado con algunos casos de acidosis láctica, XIGDUO® XR generalmente debe evitarse en pacientes con evidencia clínica o de laboratorio de enfermedad hepática.
Dapagliflozina: La seguridad y eficacia de dapagliflozina no ha sido estudiada específicamente en pacientes con insuficiencia hepática severa o falla hepática.
Ingesta de alcohol
Clorhidrato de metformina: El alcohol es conocido por incrementar el efecto de la metformina en el metabolismo del lactato. Por lo tanto, los pacientes deben estar informados sobre la ingesta excesiva de alcohol, aguda o crónica, mientras reciben XIGDUO® XR.
Cetoacidosis: Se han realizado informes posteriores a la comercialización sobre cetoacidosis, incluida la cetoacidosis diabética, en pacientes con diabetes mellitus tipo 1 y tipo 2 que toman XIGDUO® XR y otros inhibidores de SGLT2, aunque no se ha establecido una relación causal. XIGDUO® XR no está indicado para el tratamiento de pacientes con diabetes mellitus tipo 1.
Los pacientes tratados con XIGDUO® XR que presentan signos y síntomas consistentes con cetoacidosis, tales como náuseas, vómitos, dolor abdominal, malestar general y disnea, se deben evaluar para determinar si padecen cetoacidosis, incluso si los niveles de glucemia se encuentran por debajo de 14 mmol/l (250 mg/dl). Si se sospecha de la presencia de cetoacidosis, debe considerarse la discontinuación o interrupción temporal de XIGDUO® XR, y el paciente debe ser evaluado de inmediato.
Factores de predisponentes para la cetoacidosis incluyen una baja reserva funcional de células beta producto de enfermedades pancreáticas (p. ej., diabetes tipo 1, antecedentes de pancreatitis o cirugía pancreática), una reducción de la dosis de insulina, baja ingestión calórica o aumento de los requerimientos de insulina como consecuencia de infecciones, enfermedades o intervención quirúrgica, y el alcoholismo. XIGDUO® XR debe utilizarse con precaución en estos pacientes.
Niveles de vitamina B12
Clorhidrato de metformina: En ensayos clínicos controlados de metformina con una duración de 29 semanas, se observó una reducción a niveles subnormales de los niveles previamente normales de vitamina B12 sérica, sin manifestaciones clínicas, en aproximadamente 7% de los pacientes. Sin embargo, tal disminución, posiblemente causada por la interferencia con la absorción de B12 del complejo de factor intrínseco B12, se asocia rara vez con anemia y parece invertirse rápidamente con la suspensión de la metformina o el aporte adicional de vitamina B12. Se aconseja la medición de parámetros hematológicos de forma anual en pacientes que toman XIGDUO® XR y cualquier anomalía aparente debe investigarse y manejarse adecuadamente (ver sección Efectos no deseados).
Ciertas personas (aquellas con ingesta o absorción inadecuada de vitamina B12 o calcio) parecen estar predispuestos a desarrollar niveles subnormales de vitamina B12. En estos pacientes, pueden ser útiles las mediciones de rutina de vitamina B12 sérica en intervalos de 2 a 3 años.
Procedimientos quirúrgicos
Clorhidrato de metformina: Debe suspenderse temporalmente el uso de XIGDUO® XR para cualquier procedimiento quirúrgico (excepto procedimientos menores no asociados con ingesta restringida de alimentos o líquidos) y no debe reiniciarse hasta que la ingesta oral del paciente se haya reanudado y la función renal se haya evaluado y resultado normal.
Cambio en el estado clínico de los pacientes con diabetes tipo 2 previamente controlada
Clorhidrato de metformina: Un paciente con diabetes tipo 2 previamente bien controlada con XIGDUO® XR que desarrolla anomalías de laboratorio o enfermedad clínica (especialmente enfermedad vaga o pobremente definida) debe evaluarse inmediatamente para obtener evidencia de acidosis láctica. La evaluación debe incluir electrolitos séricos y cetonas, glucemia y, si se indica, pH sanguíneo, lactato, piruvato y niveles de metformina. Si ocurre acidosis, debe suspenderse inmediatamente XIGDUO® XR e iniciar otras medidas correctivas pertinentes.
Medicamentos concomitantes que afectan la función renal o la disposición de metformina
Clorhidrato de metformina: Se deben utilizar con precaución los medicamentos concomitantes que pueden afectar la función renal o provocar un cambio hemodinámico significativo o que pueden interferir con la disposición de metformina, tales como los medicamentos catiónicos (ver sección Interacciones con otros medicamentos y otras formas de interacción) que pueden eliminarse por medio de secreción tubular renal.
Estudios radiológicos con materiales de contraste yodado intravascular
Clorhidrato de metformina: Los estudios de contraste intravascular con materiales yodados puede alterar agudamente la función renal y se han asociado con acidosis láctica en pacientes que reciben metformina. Por lo tanto, en pacientes en quienes no se ha planeado ningún estudio, XIGDUO® XR debe descontinuarse temporalmente al momento de o antes del procedimiento, y retirarse durante 48 horas posteriores al procedimiento y reinstituido hasta que se haya vuelto a evaluar la función renal y se haya encontrado normal.
Estados hipóxicos
Clorhidrato de metformina: El colapso cardiovascular (shock) por cualquier causa, insuficiencia cardiaca congestiva aguda, infarto de miocardio agudo, y otros padecimientos caracterizados por hipoxemia se han asociado con acidosis láctica y pueden causar también azotemia prerrenal. Cuando dichos eventos ocurren en pacientes en terapia de XIGDUO® XR, el medicamento debe descontinuarse inmediatamente.
Pérdida de control de la glucemia
Clorhidrato de metformina: Cuando un paciente estabilizado en cualquier esquema diabético está expuesto a estrés tal como fiebre, traumatismo, infección o cirugía, puede ocurrir una pérdida temporal del control glicémico. En dichas ocasiones, puede ser necesario retirar XIGDUO® XR y administrar insulina temporalmente. XIGDUO® XR puede reinstituirse después de resolver un episodio agudo.
Uso en pacientes con riesgo de hipovolemia
Dapagliflozina: El efecto diurético de dapagliflozina reduce el volumen intravascular.
Para pacientes en riesgo de hipovolemia debido a padecimientos coexistentes, puede ser adecuada una dosis inicial de dapagliflozina de 5 mg una vez al día como XIGDUO® XR. Debe considerarse suspender temporalmente el uso de XIGDUO® XR para pacientes que presentan hipovolemia (ver sección Efectos no deseados).
Uso con medicamentos conocidos por ocasionar hipoglucemia: La insulina y los secretagogos de insulina, tales como las sulfonilúreas, ocasionan hipoglucemia. Por lo tanto, puede requerirse una dosis menor de insulina o el secretagogo de insulina para reducir el riesgo de hipoglucemia cuando se usa en combinación con dapagliflozina (ver sección Efectos no deseados).
No ocurre hipoglucemia en pacientes que reciben metformina sola en circunstancias normales de uso, pero podría ocurrir cuando la ingesta calórica es insuficiente, cuando el ejercicio vigoroso no se compensa por medio de suplementos calóricos, o durante el uso concomitante con otros agentes reductores de glucosa (tales como las sulfonilúreas y la insulina) o el etanol. Los pacientes que son adultos mayores, o están debilitados o malnutridos, y aquellos con insuficiencia adrenal o hipofisaria, o intoxicación alcohólica son particularmente susceptibles a los efectos hipoglicémicos. La hipoglucemia puede ser difícil de reconocer en los adultos mayores y en personas que estén tomando medicamentos bloqueadores beta-adrenérgicos
Urosepsis y pielonefritis: Ha habido informes posteriores a la comercialización acerca de infecciones urinarias graves, entre las que se incluyen urosepsis y pielonefritis, que requirieron hospitalización en pacientes que recibían XIGDUO® XR y otros inhibidores de SGLT2. El tratamiento con inhibidores de SGLT2 aumenta el riesgo de infecciones urinarias. Evalúe a los pacientes para detectar signos y síntomas de infecciones urinarias y tratelas oportunamente, si está indicado (consulte la sección Efectos no deseados)
Uso pediátrico: No se ha establecido la seguridad y eficacia de XIGDUO® XR en pacientes pediátricos.
Uso geriátrico: No se recomienda el inicio de terapia con dapagliflozina en pacientes mayores de 75 años debido a la limitada experiencia terapéutica.
Debido a que la metformina se elimina a través del riñón, y debido a que los pacientes que son adultos mayores son más propensos a tener una función renal disminuida, XIGDUO® XR debe utilizarse con precaución conforme la edad aumenta.
Dapagliflozina: No se recomiendan cambios en la dosis de dapagliflozina con base en la edad. Un total de 2403 (26%) de los 9339 pacientes tratados tenían 65 años o más y 327 (3.5%) pacientes tenían 75 años y más en el análisis de 21 estudios doble ciego, controlados, de seguridad y eficacia clínica de dapagliflozina como monoterapia o en combinación con otras terapias antidiabéticas. Después de controlar el nivel de la función renal (VFGe), no hubo evidencia concluyente que sugiera que la edad es un factor independiente que afecta la eficacia. En general, la proporción de pacientes que reportaron eventos adversos fue consistente entre aquellos =65 y <65 años de edad. En pacientes =65 años de edad, una proporción mayor de pacientes tratados con dapagliflozina presentó eventos relacionados con disfunción o insuficiencia renal en comparación con placebo. Los eventos adversos reportados más frecuentemente relacionados con la disfunción o insuficiencia renal en pacientes de =65 años de edad para cualquier grupo de tratamiento fueron la reducción de la depuración renal de creatinina, insuficiencia renal y creatinina sanguínea incrementada.
Los pacientes de mayor edad son más propensos a padecer insuficiencia renal. Las recomendaciones de función renal proporcionadas para todos los pacientes también aplican para los pacientes de edad avanzada (ver sección Advertencias y precauciones especiales de uso y Efectos no deseados).
Clorhidrato de metformina: Los estudios clínicos controlados de metformina no incluyen suficientes pacientes de edad avanzada para determinar si responden de forma diferente en los pacientes jóvenes, aunque otra experiencia clínica reportada no ha identificado diferencia en las respuestas entre los pacientes mayores y jóvenes. La metformina se conoce por ser excretada sustancialmente por el riñón y debido a que el riesgo de reacciones adversas graves al medicamento es mayor en pacientes con insuficiencia renal, la metformina debe utilizarse solamente en pacientes con función renal normal. La dosis inicial y de mantenimiento de metformina debe ser conservadora en pacientes de edad avanzada debido al potencial de función renal reducida en esta población. Cualquier ajuste en la dosis de XIGDUO® XR debe basarse en una valoración cuidadosa de la función renal.
Resultados macrovasculares: No ha habido estudios clínicos que establezcan evidencia concluyente sobre la reducción del riesgo macrovascular con XIGDUO® XR o XIGDUO® IR o cualquier otro medicamento antidiabético. En un metanálisis prospectivo de 21 estudios clínicos, el uso de dapagliflozina no se asoció con un riesgo incrementado para eventos adversos cardiovasculares (ver sección Efectos no deseados).
Insuficiencia renal
Dapagliflozina
Pacientes con insuficiencia renal leve (VFGe de =60 a <90 mL/min/1.73m2): El grupo de 21 estudios clínicos doble ciego, activos y controlados con placebo de seguridad y eficacia de dapagliflozina como monoterapia o en combinación con otras terapias antidiabéticas incluyeron 53% (4906/9339) de pacientes con insuficiencia renal leve. La eficacia se valoró en un análisis combinado de 9 estudios clínicos de dapagliflozina que constaron de 2226 pacientes con insuficiencia renal leve. El cambio promedio a partir del valor inicial de hemoglobina A1c (HbA1c) y el cambio promedio de HbA1c a 24 semanas corregido con placebo fue de -1.03% y -0.54% respectivamente para dapagliflozina de 10 mg (n=562). El perfil de seguridad en pacientes con insuficiencia renal leve es similar al de la población en general.
Uso en pacientes con diabetes y enfermedad cardiovascular: En dos estudios de 24 semanas controlados con placebo con periodos de extensión de 80 semanas, se trató a un total de 1887 pacientes con diabetes tipo 2 y enfermedad cardiovascular (ECV) con dapagliflozina 10 mg o placebo. Los pacientes con ECV establecida y control glicémico inadecuado (HbA1c =7.0% y =10.0%), a pesar del tratamiento estable preexistente con terapia antidiabética oral (ADO) o insulina (sola o en combinación) antes del inicio, fueron candidatos para estos estudios y se estratificaron de acuerdo a la edad (<65 o =65 años), uso de insulina (sí o no), y tiempo desde el evento cardiovascular más reciente (>1 año o <1 año antes de la inscripción). A lo largo de los 2 estudios, 942 pacientes fueron tratados con dapagliflozina 10 mg y 945 con placebo. Noventa y seis por ciento (96%) de los pacientes tratados con dapagliflozina en los 2 estudios padecían hipertensión al inicio, la mayoría durante más de 10 años; los eventos cardiovasculares más frecuentes fueron cardiopatía coronaria (75%) y accidente vascular cerebral (22%). Aproximadamente 19% de los pacientes recibieron diuréticos de asa al inicio y 15% presentaron insuficiencia cardiaca congestiva (2% presentó NYHA Clase III). Aproximadamente 37% de los pacientes tratados con dapagliflozina 10 mg también recibieron metformina más un ADO adicional al inicio, (sulfonilúrea, tiazolidinediona, inhibidor de DPP4, u otro ADO con o sin insulina al inicio) 38% recibieron insulina más al menos un ADO y 18% recibieron insulina sola.
El tratamiento con dapagliflozina 10 mg añadida a tratamientos antidiabéticos preexistentes durante 24 semanas proporcionó una mejora significativa en criterios de valoración coprimarios de HbA1c y beneficio clínico compuesto en comparación con placebo en esta población. También se observaron reducciones significativas en peso total corporal y presión arterial sistólica en sedestación (ver sección Propiedades farmacodinámicas).Estos beneficios se prolongaron hasta 104 semanas de tratamiento. El perfil de seguridad de dapagliflozina en estos estudios fue consistente con el de dapagliflozina en la población del estudio clínico general durante las 104 semanas de tratamiento (ver sección Efectos no deseados).
En un análisis distinto de pacientes con metformina sola (con o sin insulina) en estos dos estudios se observaron mejoras en HbA1c y una reducción del porcentaje de peso corporal similares a las observadas en la población total del estudio en pacientes tratados con dapagliflozina 10 mg más metformina sola en comparación con placebo más metformina sola en la Semana 24. Se observó una reducción promedio en la presión arterial sistólica en sedestación, consistente con la observada en la población del estudio total, en pacientes tratados con dapagliflozina 10 mg más metformina sola en comparación placebo más metformina sola en la Semana 24 en el estudio 1, pero no en el estudio 2.
Infecciones Urinarias
Dapagliflozina: Teniendo en cuenta la potencial ocurrencia de infecciones urinarias se debe advertir a los pacientes de consultar con su médico si se presentan síntomas de infecciones del tracto urinario.
Falla Cardiaca
Dapagliflozina: La experiencia en NYHA clase I-II es limitada y no hay experiencia en estudios clínicos con dapagliflozina en NYHA clase III-IV.
POSOLOGÍA Y MÉTODO DE ADMINISTRACIÓN
Dosis recomendada: La dosis de la terapia hipoglicemiante con XIGDUO® XR debe ajustarse al esquema actual del paciente, su eficacia y tolerancia mientras no exceda la dosis máxima recomendada de dapagliflozina 10 mg y metformina 2000 mg de liberación prolongada.
XIGDUO® XR generalmente debe ser tomado una vez al día por la noche con alimentos.
Si se considera adecuada una terapia con una tableta de combinación que contiene dapagliflozina y metformina, la dosis recomendada de dapagliflozina es de 10 mg una vez al día. La dosis de XIGDUO® XR debe ser individualizada con base en el régimen actual, la efectividad y tolerabilidad del paciente. Se recomienda la administración de XIGDUO® XR una vez al día con la comida de la noche, con titulación de dosis gradual para reducir los efectos colaterales gastrointestinales asociados con la metformina.
La dosis máxima de XIGDUO® XR es de dapagliflozina 10 mg/metformina 2000 mg de liberación prolongada ingerida como dos tabletas de 5 mg/1000 mg una vez al día.
En pacientes tratados con metformina, la dosis de XIGDUO® XR deberá proporcionar metformina en una dosis ya tomada, o la dosis más cercana adecuada terapéuticamente. Posterior a un cambio de metformina de liberación inmediata a metformina de liberación prolongada, debe vigilarse de cerca el control glicémico y deben realizarse los ajustes de dosis necesarios.
Los pacientes que necesitan dapagliflozina 5 mg en combinación con metformina de liberación prolongada pueden ser tratados con XIGDUO® XR 5 mg/1000 mg. Los pacientes que necesiten dapagliflozina 5 mg que requieran una dosis de metformina mayor a 1000 mg deben utilizar los componentes individuales.
No se han realizado estudios que examinen específicamente la seguridad y eficacia de XIGDUO® XR en pacientes previamente tratados con otros agentes hipoglicemiantes y que cambiaron a XIGDUO® XR. Cualquier cambio en la terapia de diabetes tipo 2 debe llevarse a cabo con cuidado y con un monitoreo adecuado ya que pueden ocurrir cambios en el control glicémico.
Se le debe informar a los pacientes que las tabletas XIGDUO® XR deben ingerirse enteras y nunca deben romperse, cortarse o masticarse. En algunas ocasiones, los ingredientes inactivos de XIGDUO® XR se eliminarán en las heces como una masa suave e hidratada que puede parecerse a la tableta original.
Poblaciones especiales
Pacientes con insuficiencia renal: No se requiere ajuste de dosis de XIGDUO® XR para pacientes con insuficiencia renal leve. XIGDUO® XR no debe utilizarse en pacientes con insuficiencia renal de moderada a grave (eGFR <60 mL/min/1.73 m2 or depuración de creatinina [CrCl] < 60 mL/min) o nefropatía terminal (NT) (ver sección Contraindicaciones y sección Advertencias y precauciones especiales de uso).
Pacientes con insuficiencia hepática: Ya que la función hepática insuficiente se ha asociado a algunos casos de acidosis láctica en pacientes que toman metformina, generalmente se debe evitar XIGDUO® XR en pacientes con evidencia clínica o de laboratorio de insuficiencia hepática (ver sección Contraindicaciones).
Pacientes pediátricos y adolescentes: No se han establecido la seguridad y efectividad de XIGDUO® XR en pacientes pediátricos y adolescentes.
Pacientes geriátricos: Ya que la metformina se elimina a través del hígado, y debido a que los pacientes adultos mayores son más propensos a tener una función renal disminuida, XIGDUO® XR debe utilizarse con precaución conforme incrementa la edad (ver sección Advertencias y precauciones especiales de uso).
Pacientes con riesgo de hipovolemia: Para pacientes con riesgo de hipovolemia debido a condiciones coexistentes, puede ser adecuada una dosis inicial de dapagliflozina 5 mg (ver sección Advertencias y precauciones especiales de uso y Efectos no deseados).
SOBREDOSIS
Dapagliflozina: Se ha demostrado que la dapagliflozina administrada oralmente es segura y bien tolerada en personas sanas en dosis individuales de hasta 500 mg (50 veces la MRHD). Estos pacientes tenían glucosa detectable en la orina durante un periodo relacionado con la dosis (al menos 5 días para la dosis de 500 mg), sin reportes de deshidratación, hipotensión o desbalance de electrolitos, y sin efecto clínicamente significativo en el intervalo QTc. La incidencia de hipoglucemia para pacientes tratados con dapagliflozina era similar con placebo. En estudios clínicos donde se administraron dosis diarias de hasta 100 mg (10 veces la MRHD) de dapagliflozina durante 2 semanas en personas sanas y pacientes con diabetes tipo 2, la incidencia de hipoglucemia para pacientes con administración de dapagliflozina fue ligeramente mayor que con placebo y no se relacionó con la dosis.Los índices de eventos adversos incluyendo deshidratación o hipotensión para pacientes tratados con dapagliflozina fueron similares con placebo, y no hubo cambios clínicamente significativos relativos a la dosis en los parámetros de laboratorio, incluyendo electrolitos séricos y marcadores biológicos de la función renal.
En caso de una sobredosis, debe iniciarse un tratamiento de apoyo adecuado conforme al estado clínico del paciente. No se ha estudiado la eliminación de dapagliflozina por hemodiálisis.
Clorhidrato de metformina: La sobredosis o riesgos concomitantes de metformina pueden provocar acidosis láctica. La acidosis láctica es una emergencia médica y debe tratarse en un hospital. El método más eficaz para eliminar el lactato y la metformina es la hemodiálisis. Se han reportado eventos de hipoglucemia con sobredosis de metformina, aunque no se ha establecido una asociación causal.
PRESENTACIÓN: XIGDUO® XR 5 mg/1000 mg. Tabletas recubiertas de liberación prolongada. (Reg. San. INVIMA 2015M-0016543).
XIGDUO® XR 10 mg/1000 mg. Tabletas recubiertas de liberación prolongada. (Reg. San. INVIMA 2015M-0016615).
Fuente: Doc ID-002321578 Version 3.
Texto basado en: CDS 28 Octubre 2015.
IPP clave: 3-2015.
Fecha de preparación de la versión: Diciembre de 2015.
Mayor información Departamento Médico de
AstraZeneca Colombia S.A.S.
Bogotá, D.C.,Colombia