
ZINNAT
CEFUROXIMA
Suspensión
Caja , Frasco(s) , Suspensión , 70 Mililitros
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: La formulación ZINNAT en Suspensión contiene gránulos de cefuroxima axetil para elaborar una suspensión oral. Cuando se realiza según las instrucciones, la reconstitución de los frascos de dosis múltiples produce una suspensión que contiene 125 mg ó 250 mg de cefuroxima (como cefuroxima axetil) por cada 5ml.
La formulación ZINNAT en Sobres contiene 125 mg , 250 mg ó 500 mg de cefuroxima en gránulos (como cefuroxima axetil) para la administración de una dosis simple una vez que se realiza la reconstitución.
INDICACIONES: ZINNAT es un profármaco oral del antibiótico bactericida cefuroxima perteneciente a la clase de las cefalosporinas, el cual es resistente a la mayoría de las b(beta)-lactamasas y
es activo contra una amplia gama de microorganismos gramnegativos y grampositivos.
Se indica en el tratamiento de infecciones ocasionadas por bacterias sensibles. La susceptibilidad a ZINNAT variará geográficamente y con el tiempo, y deberían consultarse los datos de susceptibilidad local donde se encuentren disponibles (véase Propiedades Farmacológicas, Farmacodinámica).
Entre las indicaciones se incluyen:
— infecciones de las vías respiratorias superiores, por ejemplo: infecciones del oído, nariz y garganta, como otitis media, sinusitis, amigdalitis y faringitis.
— infecciones de las vías respiratorias inferiores, por ejemplo: neumonía, bronquitis aguda y exacerbaciones agudas de bronquitis crónica.
— infecciones de las vías genitourinarias, por ejemplo: pielonefritis, cistitis y uretritis.
— infecciones de la piel y de las partes blandas, por ejemplo: furunculosis, pioderma e impétigo.
— gonorrea, uretritis gonocócica aguda sin complicaciones y cervicitis
— tratamiento de la enfermedad de Lyme en etapa temprana y prevención subsiguiente de la etapa tardía de la enfermedad de Lyme en adultos y niños a partir de 3 meses de edad y mayores.
CARACTERÍSTICAS FARMACÉUTICAS:
Lista de excipientes: Aspartame, goma xantan, acesulfame potásico, povidona K30, ácido esteárico, sacarosa, sabor a tutti frutti.
|
Cantidad de sacarosa (g por dosis) |
||||
|
Suspensión de 125 mg/5 ml |
Suspensión de 250 mg/5 ml |
Sobre de 125 mg |
Sobre de 250 mg |
Sobre de 500 mg |
|
3.062 g |
2.289 g |
3.062 g |
6.124 g |
12.248 g |
FARMACOCINÉTICA:
Absorción: Después de su administración oral, ZINNAT es absorbido de la vía gastrointestinal e hidrolizado rápidamente en la mucosa intestinal y en la sangre, liberando cefuroxima en la circulación.
La absorción de la cefuroxima se ve optimizada en presencia de alimentos.
Siguiendo a la administración de ZINNAT tabletas, los niveles pico séricos (2.1mg/l para dosis de 125 mg, 4.1 mg/l para dosis de 250 mg, 7.0 mg/l para dosis de 500 mg y 13.6 mg/l para dosis de 1 g) ocurre aproximadamente 2 a 3 horas después de la administración con alimentos.La tasa de absorción de la cefuroxima, a partir de la formulación en suspensión comparada con las tabletas, es reducida y conduce a una disminución ulterior en las concentraciones séricas máximas y en la biodisponibilidad sistémica (4-17% menos).
Distribución: La unión a las proteínas es variable entre 33-50% dependiendo de la metodología usada.
Metabolismo: La cefuroxima no es metabolizada.
Eliminación: La vida media en el suero es de 1 - 1.5 horas.
La cefuroxima se excreta por filtración glomerular y secreción tubular. La administración concurrente de probenecid aumenta el área por debajo de la curva del tiempo de concentración sérica media en un 50%.
Insuficiencia renal: Se ha investigado la farmacocinética de cefuroxima en pacientes con varios grados de insuficiencia renal. La vida media de eliminación de cefuroxima aumenta cuando disminuye la función renal y sirve de base para las recomendaciones de ajustes de dosis en este grupo de pacientes (véase Dosis y Administración). En pacientes bajo hemodiálisis, cuando menos el 60% de la cantidad total de cefuroxima presente en el cuerpo al inicio de la diálisis será removida durante un periodo de diálisis de 4 horas.
Por lo tanto, debe administrarse una dosis adicional de cefuroxima después de completarse la hemodiálisis.
FARMACODINAMIA: La prevalencia de resistencia adquirida es variable geográficamente y con el tiempo, y para algunas especies selectas puede ser muy alta. La información local de resistencia es deseable, particularmente cuando se trata infecciones graves.
Sensibilidad in vitro de microorganismos frente a cefuroxima: En los casos donde se ha demostrado la eficacia de cefuroxima axetil en estudios clínicos, se indica con un asterisco (*).
Especies comúnmente sensibles:
Aerobios gram positivos:
Staphylococcus aureus (meticilina susceptible)*
Staphylococcus coagulasa negativo (meticilina susceptible)
Streptococcus pyogenes*
Estreptococo beta-hemolítico *
Aerobios gram negativos:
Haemophilus influenzae* incluyendo cepas resistentes a la ampicilina
Haemophilus parainfluenzae*
Moraxella catarrhalis*
Neisseria gonorrhoea* incluyendo cepas productoras y no productoras de penicilinasa
Anaerobios gram positivos:
Peptostreptococcus spp.
Propionibacterium spp.
Espiroquetas:
Borrelia burgdorferi*
Especies cuya resistencia adquirida puede ser un problema:
Aerobios gram positivos:
Streptococcus pneumoniae*
Aerobios gram negativos:
Citrobacter spp. no incluyendo C. freundii
Enterobacter spp. no incluyendo E. aerogenes y E. cloacae
Escherichia coli*
Klebsiella spp. incluyendo Klebsiella pneumoniae*
Proteus mirabilis
Proteus spp. no incluyendo P. penneri y P. vulgaris
Providencia spp.
Anaerobios gram positivos:
Clostridium spp. no incluyendo C. difficile
Anaerobios gram negativos:
Bacteroides spp. no incluyendo B. fragilis
Fusobacterium spp.
Microorganismos con resistencia intrínseca:
Aerobios gram positivos:
Enterococcus spp. incluyendo E. faecalis y E. faecium
Listeria monocytogenes:
Aerobios gram negativos:
Acinetobacter spp.
Burkholderia cepacia
Campylobacter spp.
Citrobacter freundii
Enterobacter aerogenes
Enterobacter cloacae
Morganella morganii
Proteus penneri
Proteus vulgaris
Pseudomonas spp. incluyendo Pseudomonas aeruginosa
Serratia spp.
Stenotrophomonas maltophilia
Anaerobios gram positivos:
Clostridium difficile
Anaerobios gram negativos:
Bacteroides fragilis
Otros:
Chlamydia especies
Mycoplasma especies
Legionella especies
CONTRAINDICACIONES: Pacientes con hipersensibilidad conocida a los antibióticos de la clase de las cefalosporinas.
EMBARAZO Y LACTANCIA: No existen indicios experimentales de efectos embriopáticos o teratogénicos atribuibles a ZINNAT pero, al igual que todos los fármacos, debe administrarse con precaución durante los primeros meses de embarazo. La formulación ZINNAT se excreta en la leche materna, por lo cual se debe tener precaución al administrar ZINNAT a madres lactantes.
EFECTOS SOBRE LA CAPACIDAD DE CONDUCIR Y OPERAR MAQUINARIA: Como este medicamento es capaz de ocasionar mareos, se debe advertir a los pacientes que sean precavidos al conducir vehículos u operar maquinaria.
EFECTOS ADVERSOS:
Por lo general, los efectos adversos medicamentosos de la ZINNAT son leves y de naturaleza transitoria.
Las categorías de frecuencia asignadas a los efectos adversos que se listan a continuación son estimados, ya que para la mayoría de las reacciones no se dispuso de información adecuada (por ejemplo, de estudios controlados con placebo) para calcular la incidencia.
Además, existe la posibilidad de que la incidencia de los efectos adversos asociados con la ZINNAT varíe con respecto a la indicación.
Se emplearon datos obtenidos de estudios clínicos a gran escala para determinar la frecuencia de incidencia de los efectos adversos muy comunes, comunes, no comunes y raros.
Las frecuencias de incidencia asignadas a todos los demás efectos adversos (es decir, aquellos que ocurren en <1/1000) se determinaron principalmente utilizando datos posteriores a la comercialización y se refieren a una tasa de comunicaciones más que a una frecuencia verdadera. No se dispuso de datos obtenidos de pruebas controladas con placebo. Cuando las incidencias se calcularon a partir de datos obtenidos de pruebas clínicas, éstas se basaron en datos relacionados con el fármaco (evaluados por el investigador).
Se ha utilizado la siguiente convención para la clasificación de la frecuencia de incidencia:
muy común ≥1/10
común ≥1/100 a <1/10
no común ≥1/1000 a <1/100
rara ≥1/10,000 a <1/1000
muy rara <1/10,000
Infecciones e infestaciones
Común: Proliferación de Candida
Trastornos sanguíneos y del sistema linfático
Común: Eosinofilia
No comunes: Prueba de Coombs positiva, trombocitopenia, leucopenia (en ocasiones intensa)
Muy raro: Anemia hemolítica
Vistas como una clase, las cefalosporinas tienden a ser absorbidas en la superficie de las membranas de los eritrocitos y reaccionan con los anticuerpos dirigidos contra el fármaco, produciendo una prueba de Coombs positiva (que puede interferir con las pruebas cruzadas de sangre) y, en muy raras ocasiones, anemia hemolítica.
Trastornos del sistema inmunitario
Reacciones de hipersensibilidad que incluyen
No comunes: Exantemas
Raros: Urticaria, prurito
Muy raros: Fiebre medicamentosa, enfermedad del suero, anafilaxia
Trastornos del sistema nervioso
Comunes: Cefalea, mareos
Trastornos gastrointestinales
Comunes: Trastornos gastrointestinales que incluyen diarrea, náuseas, dolor abdominal
No común: Vómito
Raro: Colitis seudomembranosa (véase Advertencias y Precauciones)
Trastornos hepatobiliares
Comunes: Aumentos transitorios en las concentraciones de enzimas hepáticas, [ALAT (SGPT), ASAT (SGOT), LDH]
Muy raros: Ictericia (predominantemente colestásica), hepatitis
Trastornos de la piel y del tejido subcutáneo
Muy raros: Eritema multiforme, síndrome de Stevens-Johnson, necrólisis epidérmica tóxica (necrólisis exantemática)
También véase Trastornos del sistema inmunitario.
INCOMPATIBILIDADES: Ninguna.
INTERACCIONES: Los fármacos que reducen la acidez gástrica son capaces de ocasionar una disminución en la biodisponibilidad de la cefuroxima, en comparación con la que se observa en estado de ayuno, y tienden a cancelar el efecto de la absorción mejorada posterior a la administración de los alimentos.
Al igual que otros antibióticos, ZINNAT es capaz de afectar la microflora intestinal, produciendo una disminución en la reabsorción de estrógenos y reduciendo la eficacia de los anticonceptivos orales combinados.
Como existe la posibilidad de que se produzca un resultado negativo falso en la prueba del ferrocianuro, se recomienda emplear los métodos de glucosa oxidasa o hexocinasa para determinar las concentraciones sanguíneas/plasmáticas de glucosa en los pacientes que reciben tratamiento con ZINNAT. Este antibiótico no interfiere en el análisis de picrato alcalino para la creatinina.
DATOS PRECLÍNICOS DE SEGURIDAD: Los estudios de toxicidad realizados en animales indicaron que la cefuroxima exhibe un grado bajo de toxicidad, sin la existencia de hallazgos significativos.
ADVERTENCIAS Y PRECAUCIONES: Se indica un cuidado especial en aquellos pacientes que hayan experimentado alguna reacción alérgica a las penicilinas o a otros agentes betalactámicos.
Como ocurre con otros antibióticos, el uso de ZINNAT podría ocasionar la proliferación de Candida. El uso prolongado puede resultar en proliferación de organismos no sensibles (p.j. enterococos y Clostridium difficile) lo cual podría demandar la interrupción del tratamiento.
Al utilizar antibióticos, han surgido comunicaciones de colitis seudomembranosa y puede variar en gravedad desde leves hasta que amenacen la vida. Por lo cual es importante considerar su diagnóstico en aquellos pacientes que desarrollen diarrea grave durante o después del uso de antibióticos. Si ocurre diarrea prolongada o significativa o el paciente experimenta calambres abdominales, se de descontinuar inmediatamente el tratamiento y continuar con el estudio del paciente.
Al tratar a pacientes diabéticos, se debe tomar en cuenta el contenido de sacarosa de las formulaciones ZINNAT en suspensión y en gránulos (véase Lista de excipientes) y, asimismo, se deben hacer recomendaciones adecuadas.
Después de proporcionar un tratamiento de la enfermedad de Lyme con ZINNAT, se ha observado la reacción Jarisch-Herxheimer. Se produce directamente de la actividad bactericida de ZINNAT sobre el microorganismo que ocasiona la enfermedad de Lyme, la espiroqueta Borrelia burgdorferi. Se debe tranquilizar a los pacientes haciéndoles saber que esta reacción representa una consecuencia común y de resolución espontánea del tratamiento antibiótico de la enfermedad de Lyme.
La formulación ZINNAT en suspensión contiene aspartame, la cual es una fuente de fenilalanina, por lo que debe utilizarse con precaución en aquellos pacientes con fenilcetonuria.
Dosis y Administración: El ciclo ordinario de la terapia es de siete días (varía de 5 a 10 días).
Para propiciar una absorción óptima, ZINNAT debe tomarse con alimentos.
Adultos:
La mayoría de las infecciones: 250 mg dos veces al día.
Infecciones urinarias: 250 mg dos veces al día.
Infecciones de las vías respiratorias inferiores de grado leve a moderado, p.ej., bronquitis: 250 mg dos veces al día.
Infecciones de las vías respiratorias inferiores de grado más severo, o en caso de sospecharse neumonía: 500 mg dos veces al día.
Pielonefritis: 250 mg dos veces al día.
Gonorrea sin complicaciones: Dosis simple de 1g.
Enfermedad de Lyme en adultos y niños mayores de 12 años de edad: 500 mg dos veces al día durante 14 días (rango de 10- 21 días).
Niños: Cuando sea preferible prescribir una dosis fija, la dosis recomendada para la mayoría de las infecciones consistirá en 125 mg administrados dos veces al día. En niños de dos años de edad o mayores que padezcan otitis media, o que presenten infecciones más severas según sea adecuado, la dosis consiste en 250mg administrados dos veces al día, hasta un máximo de 500 mg al día. En niños de 3 meses a 12 años de edad con enfermedad de Lyme, la dosis es 250 mg dos veces al día hasta un máximo de 500 mg al día por 14 días (rango de 10 a 21 días).
No se dispone de datos de pruebas clínicas concernientes al uso de ZINNAT en niños menores de 3 meses de edad.
En lactantes y niños, podría ser preferible ajustar la dosificación de acuerdo con el peso corporal o la edad. En los lactantes y niños de 3 meses a 12 años de edad, la dosis consiste en 10 mg/kg administrados dos veces al día para el tratamiento de la mayoría de las infecciones, hasta un máximo de 250mg al día. En el tratamiento de la otitis media, o infecciones de grado más severo, la dosis recomendada consiste en 15 mg/kg administrados dos veces al día, hasta un máximo de 500mg al día. En enfermedad de Lyme, la dosis recomendada es 15 mg/ kg dos veces al día hasta un máximo de 500 mg al día por 14 días (rango de 10 a 21 días).
Las siguientes dos tablas, divididas por grupos de edad y peso corporal, sirven como directriz para practicar una administración simplificada de la suspensión para dosis múltiples de 125 mg/ 5 ml ó 250 mg/5 ml, mediante cucharas medidoras (5 ml), y de los sobres para dosis simples de 125 mg ó 250 mg.
|
Dosificación de 10 mg/kg para el tratamiento de la mayoría de las infecciones |
||||
|
Edad |
Intervalo de peso corporal aproximado (kg) |
Dosis en mg administrados dos veces al día |
No. de cucharas medidoras (5 ml) o sobres por dosis |
|
|
125 mg |
250 mg |
|||
|
3 - 6 meses |
4-6 |
40-60 |
1/2 |
- |
|
6 meses 2 años |
6-12 |
60-120 |
1/2-1 |
- |
|
2 - 12 años |
12 -más de 20 |
125 |
1 |
1/2 |
|
Dosificación de 15 mg/kg para el tratamiento de la otitis media, infecciones más graves y enfermedad de Lyme |
||||
|
Edad |
Intervalo de peso corporal aproximado (kg) |
Dosis en mg administrados dos veces al día |
No. de cucharas medidoras (5 ml) o sobres por dosis |
|
|
125 mg |
250 mg |
|||
|
3 - 6 meses |
4-6 |
60-90 |
1/2 |
- |
|
6 meses 2 años |
6-12 |
90-180 |
1-11/2 |
1/2 |
|
2 - 12 años |
12 -más de 20 |
180-250 |
11/2-2 |
1/2-1 |
Para optimizar el cumplimiento terapéutico y mejorar la precisión de la dosificación de los niños muy pequeños, existe la posibilidad de suministrar una jeringa dosificadora con un frasco de dosis múltiples que contenga 50 ml de suspensión. Sin embargo, la dosificación mediante cucharadas debe considerarse como una opción más favorable si el niño es capaz de tomar el medicamento a través de la cuchara.
Si se requiere, también se puede emplear la jeringa dosificadora en niños más grandes (favor de referirse a las tablas de dosificación que se muestran a continuación).
Las dosis recomendadas para administrarse a través de la jeringa dosificadora para uso pediátrico se expresan en ml o mg y, asimismo, se agrupan en las siguientes tablas con respecto al peso corporal 10 mg/kg/dosis (Jeringa dosificadora para uso pediátrico)
|
10 mg/kg/dosis (jeringa dosificadora para uso pediátrico) |
|||
|
Peso corporal del niño (kg) |
Dosis administrada dos veces al día (mg) |
Dosis de 125 mg/5 ml administrados dos veces al día (ml) |
Dosis de 250 mg/5 ml administrados dos veces al día (ml) |
|
4 |
40 |
1.6 |
0.8 |
|
6 |
60 |
2.4 |
1.2 |
|
8 |
80 |
3.2 |
1.6 |
|
10 |
100 |
4.0 |
2.0 |
|
12 |
120 |
4.8 |
2.4 |
|
14 |
140 |
5.6 |
2.8 |
|
15 mg/kg/dosis (jeringa dosificadora para uso pediátrico) |
|||
|
Peso corporal del niño (kg) |
Dosis administrada dos veces al día (mg) |
Dosis de 125 mg/5 ml administrados dos veces al día (ml) |
Dosis de 250 mg/5 ml administrados dos veces al día (ml) |
|
4 |
60 |
2.4 |
1.2 |
|
6 |
90 |
3.6 |
1.8 |
|
8 |
120 |
4.8 |
2.4 |
|
10 |
150 |
6.0 |
3.0 |
|
12 |
180 |
7.2 |
3.6 |
|
14 |
210 |
8.4 |
4.2 |
La formulación ZINNAT también se encuentra disponible como sal sódica (ZINACEF) para administración parenteral. Esto permite reemplazar la terapia parenteral con ZINNAT por una terapia oral, en aquellas situaciones donde se indique clínicamente un cambio de tratamiento parenteral a tratamiento oral.
Insuficiencia renal: La cefuroxima es primariamente excretada por riñón. En pacientes con insuficiencia renal importante se recomienda que se reduzca la dosis de cefuroxima para compensar su excreción mas lenta (véase la tabla siguiente).
|
Aclaramiento de creatinina |
T1/2 (horas) |
Dosis recomendada |
|
≥30 ml/min |
1.4-2.4 |
No es necesario un ajuste de dosis (la dosis estándar de 125 mg a 500 mg dos veces al día) |
|
10-29 ml/min |
4.6 |
La dosis estándar individual dada cada 24 horas |
|
<10 ml/min |
16.8 |
La dosis estándar individual dada cada 48 horas |
|
Durante hemodiálisis |
2-4 |
Una dosis estándar individual adicional debe darse al final da cada diálisis |
SOBREDOSIS:
Signos y síntomas: La sobredosificación de cefalosporinas puede ocasionar irritación cerebral que conduzca a convulsiones.
Tratamiento: Las concentraciones séricas de cefuroxima se pueden reducir mediante hemodiálisis y diálisis peritoneal.
VIDA DE ANAQUEL: La fecha de caducidad de los gránulos se indica en el empaque.
Cuando se refrigera a una temperatura de entre 2 y 8°C, la suspensión reconstituida puede mantenerse hasta por 10 días.
PRESENTACIÓN: ZINNAT SUSPENSIÓN gránulos secos, de color blanco a hueso y con sabor a tutti-frutti, para elaborar una suspensión oral (Reg. San. No. INVIMA 2018M-010278-R2).
Versión número: GDS26/IPI06
Fecha de emisión: 25 agosto 2016
ZINNAT y ZINACEF son marcas registradas del grupo de compañías GSK.
GLAXOSMITHKLINE COLOMBIA S.A.
NATURALEZA Y CONTENIDO DEL EMPAQUE
Frascos de dosis múltiples: La formulación ZINNAT en Suspensión se suministra en frascos de vidrio ámbar Tipo III, de acuerdo con la PhEur, con una membrana sellada por inducción de calor. Éstos contienen 125mg/5ml ó 250mg/5ml de producto. Se proporcionan jeringas dosificadoras con los frascos de dosis múltiples de ambas potencias.
Sobres: La formulación ZINNAT en Suspensión contenida en sobres para uso oral se suministra en sobres laminados de papel/polietileno/aluminio/ionómero de ácido etileno-ácido metacrílico. Cuando se reconstituye según las instrucciones, proporciona un equivalente de 125 mg, 250 mg ó 500 mg de ZINNAT (como cefuroxima axetil) por sobre.
Instrucciones para su uso/manejo:
• Instrucciones de constitución/administración.
• La suspensión de cefuroxima axetil se provee en una botella empacada en una caja de cartón tanto con una taza medidora, una cuchara o una jeringa dosificadoras e inserto.
Instrucciones para reconstituir la suspensión en botellas multidosis:
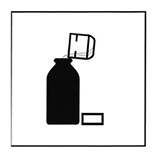
Agite el frasco para esparcir el contenido. Todos los gránulos deben fluir libremente en la botella. Remueva la tapa y la membrana de garantía. Si esta última se encuentra dañada o no está presente, regrese el producto al farmacéutico.
Agregue una cantidad de agua fría hasta la línea presente en la taza incluida. Si el agua se hirvió previamente debe dejar que se enfríe a la temperatura ambiente antes de agregarse. No mezcle la suspensión oral de ZINNAT con líquidos calientes o tibios. Debe usarse agua fría para evitar que la suspensión se espese demasiado.
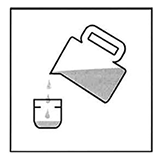
Vierta la cantidad total de agua fría en la botella. Coloque la tapa. Ponga la botella en reposo para permitir que el agua se absorba completamente a través de los gránulos; esto debe tomar alrededor de un minuto.
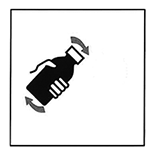
Invierta el frasco y agítelo vigorosamente (por cuando menos 15 segundos) hasta que todos los gránulos se hayan mezclado en el agua.
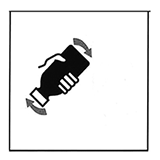
Vire el frasco a una posición vertical y agítelo vigorosamente por al menos un minuto hasta que todos los gránulos se hayan disuelto en el agua.
• Inmediatamente coloque la suspensión de cefuroxima axetil a una temperatura entre 2 y 8°C (no congele) y déjela en reposo por al menos una hora antes de tomar la primera dosis. La suspensión reconstituida puede conservarse en refrigeración hasta por 10 días a una temperatura entre 2 y 8°C.
• Siempre agite vigorosamente la botella antes de tomar la medicación. Se provee una jeringa o una cuchara dosificadora para la administración de cada dosis.
• Si se desea, la suspensión de cefuroxima axetil en botellas multidosis, puede ser diluida en jugos de fruta fríos, o leche fría y debe tomarse inmediatamente después de mezclarse.
Instrucciones para utilizar la jeringa dosificadora:
1. Retire la tapa del frasco e inserte el ensamble jeringa-collar en el cuello del frasco. Presiónelo completamente hacia abajo hasta que el collar se ajuste firmemente en el cuello. Invierta la botella y la jeringa.
2. Tire del émbolo hacia arriba del barril de la jeringa, hasta que el reborde de éste coincida con la marca del émbolo correspondiente a la dosis requerida.
3. Voltee la botella y la jeringa a una posición hacia arriba. Sujetando la jeringa y el émbolo para asegurar que el émbolo no se mueva, retire la jeringa del frasco dejando el collar plástico en el cuello del frasco.
4. Con el paciente sentado en posición erecta, coloque la punta de la jeringa en el interior de su boca, dirigiéndola a la parte interna de la mejilla.
5. Presione lentamente el émbolo de la jeringa para expulsar el medicamento sin ocasionar atragantamiento.
6. Después de administrar la dosis, coloque nuevamente la tapa del frasco sin retirar el collar de plástico. Desmonte la jeringa y lávela minuciosamente en agua Deje que el émbolo y el barril se sequen naturalmente.
Instrucciones para reconstituir los sobres:
1. Vacíe los gránulos del sobre en un vaso.
2. Adicione un pequeño volumen de agua fría.
Si se desea, los gránulos de cefuroxima axetil en sobres, pueden ser diluidos en jugos de fruta fríos, o leche fría y debe tomarse inmediatamente después de mezclarse.
Mezcle bien y beba inmediatamente.
No todas las presentaciones se encuentran disponibles en todos los países.
PRECAUCIONES ESPECIALES DE ALMACENAMIENTO: Almacenar a temperaturas inferiores a 30°C en su envase y empaque original. Una vez reconstituida la suspensión puede almacenarse por 10 días en refrigeración a temperaturas entre 2°C - 8°C. No congelar. Manténgase fuera del alcance de los niños.