
ZINTREPID 10/10 - 10/20 - 10/40
EZETIMIBA, SIMVASTATINA
Tabletas
, Caja,14 Tabletas,10/10 mg/mg
, Caja,14-28 Tabletas,10/20 mg/mg
, Caja,14-28 Tabletas,10/40 mg/mg
, Caja,14-28 Tabletas,10/80 mg/mg
Caja , 7, 21 - 28 Tabletas , 10/10 mg/mg
Caja , 7 - 21 Tabletas , 10/20 mg/mg
Caja , 7 - 21 Tabletas , 10/40 mg/mg
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
PRINCIPIOS ACTIVOS: ZINTREPID® se presenta en tabletas para administración por vía oral que contienen 10 mg de ezetimiba y 10 mg de simvastatina (ZINTREPID® 10/10), 20 mg de simvastatina (ZINTREPID® 10/20) o 40 mg de simvastatina (ZINTREPID® 10/40).
INDICACIONES:
Hipercolesterolemia primaria: ZINTREPID® está indicado como terapia adyuvante a la dieta para la reducción del colesterol total elevado (C-total), colesterol de lipoproteína de baja densidad (C-LDL), apolipoproteína B (Apo B), triglicéridos (TG), y colesterol de lipoproteína no de alta densidad (C-no HDL), y aumento del colesterol de lipoproteína de alta densidad (C-HDL) en adultos y adolescentes (10 a 17 años de edad) con hipercolesterolemia primaria (familiar heterocigótica y no familiar) o hiperlipidemia mixta.
Se puede agregar Fenofibrato a ZINTREPID® en pacientes adultos con hiperlipidemia mixta que requieren reducción adicional en TG y C-no HDL y aumento en el C-HDL.
Hipercolesterolemia familiar homocigótica (HoFH): ZINTREPID® está indicado para la reducción de los niveles de colesterol total y C-LDL en adultos y adolescentes (10 a 17 años de edad) con HoFH. Los pacientes también pueden recibir tratamientos adyuvantes (por ejemplo, aféresis del LDL).
Prevención secundaria de enfermedad cardiovascular en pacientes con enfermedad coronaria: ZINTREPID® está indicado para reducir el riesgo de eventos cardiovasculares (muerte cardiovascular, infarto de miocardio no fatal, accidente cerebrovascular no fatal, hospitalización por angina inestable, o la necesidad de revascularización), en pacientes con enfermedad coronaria (EC).
CLASE TERAPÉUTICA: ZINTREPID® (ezetimiba/simvastatina) es un medicamento hipolipemiante que inhibe selectivamente la absorción intestinal del colesterol y de esteroles vegetales relacionados e inhibe la síntesis endógena de colesterol.
USO PEDIATRICO: La seguridad y efectividad de ZINTREPID® en pacientes de 10 a 17 años de edad con hipercolesterolemia familiar heterocigótica han sido evaluadas en estudios controlados en niños y niñas adolescentes que tuvieran por lo menos un año de post menarquia. Los pacientes adolescentes tratados con ZINTREPID® tuvieron un perfil de eventos adversos similar al de los adultos tratados con ZINTREPID®. Las dosis mayores a 10/40 mg/día no han sido evaluadas en esta población. En este estudio controlado, no se detectaron efectos sobre el crecimiento o maduración sexual en los niños y niñas adolescentes, así como tampoco se detectaron efectos en la duración del ciclo menstrual en las niñas. ZINTREPID® no ha sido estudiado en pacientes menores de 10 años de edad, ó en niñas pre menárquicas. (Ver Dosis y administración; efectos secundarios).
CONTRAINDICACIONES:
• Hipersensibilidad a cualquiera de los componentes de este producto.
• Enfermedad hepática activa o aumento persistente inexplicable de las transaminasas séricas.
• Embarazo y lactancia (ver Embarazo y Madres lactantes).
• Cuando se administre ZINTREPID® con fenofibrato, por favor referirse a la información para prescripción de fenofibrato.
• La administración concomitante de inhibidores potentes del CYP3A4 (p.ej., itraconazol, ketoconazol, posaconazol, voriconazol, Inhibidores de la proteasa de HIV, boceprevir, telaprevir, eritromicina, claritromicina, telitromicina nefazodona, y medicamentos que contienen cobicistat) (Ver Advertencias yprecauciones, miopatia/rabdomiólisis e Interacciones farmacológicas).
• La administración concomitante de gemfibrozilo, ciclosporina, o danazol (Ver Advertencias y precauciones, miopatia/rabdomiólisis e Interacciones farmacológicas).
USO EN PACIENTES DE EDAD AVANZADA: Debido a que la edad avanzada (≥ 65 años) es un factor predisponente para miopatía, ZINTREPID® debe ser administrado con precaución en estos pacientes. En un estudio clínico en el que se trató a pacientes con simvastatina 80 mg, los pacientes ≥ 65 años de edad tuvieron un aumento en el riesgo de miopatía en comparación con los pacientes < 65 años.
EMBARAZO: La aterosclerosis es un proceso crónico, y suspender la administración de medicamentos reductores de los lípidos durante el embarazo debe tener poco efecto sobre el riesgo a largo plazo asociado con la hipercolesterolemia primaria.
ZINTREPID® está contraindicado durante el embarazo.
Simvastatina: No se ha determinado la seguridad de simvastatina en mujeres embarazadas, ni se han hecho estudios clínicos comparativos con simvastatina en ellas. Se han recibido escasos reportes de anomalías congénitas tras la exposición intrauterina a inhibidores de la HMG-CoA reductasa, pero en un estudio prospectivo de unos 200 embarazos en los que hubo exposición del feto durante el primer trimestre a simvastatina o a otro inhibidor de la HMG-CoA reductasa muy relacionado con simvastatina, la incidencia de anomalías congénitas fue similar a la observada en la población general. Ese número de embarazos fue estadísticamente suficiente para excluir un aumento de las anomalías congénitas de 2.5 veces o más sobre su incidencia en la población general.
Aunque no hay ninguna evidencia de que la incidencia de anomalías congénitas en los hijos de pacientes que han tomado simvastatina u otro inhibidor de la HMG-CoA reductasa muy relacionado con ella difiera de la observada en la población general, el tratamiento de las mujeres embarazadas con simvastatina puede disminuir las concentraciones fetales de mevalonato, que es un precursor en la síntesis de colesterol. Por lo tanto, no se debe usar ZINTREPID® en mujeres embarazadas, que están tratando de embarazarse o que pueden estar embarazadas. El tratamiento con ZINTREPID® se debe suspender durante todo el embarazo o hasta que se haya comprobado que la paciente no está embarazada (Ver Contraindicaciones).
Ezetimiba: No hay datos clínicos sobre la administración de ezetimiba a mujeres embarazadas.
Cuando se administró ezetimiba con simvastatina a ratas embarazadas en estudios sobre el desarrollo embriofetal, no se observó ningún efecto teratogénico. En conejas embarazadas hubo una baja incidencia de malformaciones esqueléticas.
MADRES LACTANTES: Los estudios en ratas han mostrado que ezetimiba es excretada con la leche. No se sabe si los componentes activos de ZINTREPID® son excretados con la leche materna, por lo que no se debe administrar ZINTREPID® a mujeres que estén en período de lactancia.
EFECTOS SECUNDARIOS: Se ha evaluado la seguridad de ZINTREPID® (o la coadministración de ezetimiba y simvastatina equivalente a las formulaciones de ZINTREPID®) en estudios clínicos sobre más de 12000 pacientes. ZINTREPID® fue generalmente bien tolerado.
Las siguientes experiencias adversas comunes (≥1/100, <1/10) o no comunes (≥1/1000, <1/100) relacionadas con el uso del medicamento fueron reportadas en pacientes tomando ZINTREPID® (n=2404) con una mayor incidencia que el placebo (n=1340):
• Investigaciones:
— Comunes: Incremento de ALT y/o AST; Incremento de la creatinaquinasa CK sanguínea
— No comunes: Incremento en la bilirrubina sanguínea; incremento del acido úrico sanguíneo; incremento de la gamma-glutamiltransferasa; incremento de la razón normalizada internacional, presencia de proteínas en la orina, disminución de peso.
• Trastornos del sistema nervioso:
— No comunes: Mareos, cefalea.
• Trastornos gastrointestinales:
— No comunes: Dolor abdominal, malestar abdominal, dolor en la parte superior del abdomen, dispepsia, flatulencias, nauseas y vomito.
• Trastornos de piel y tejidos subcutáneos:
— No comunes: Prurito, rash.
• Trastornos músculo esqueléticos y de tejidos conectivos:
— No comunes: Artralgia, espasmos musculares, debilidad muscular, molestias músculo-esqueléticas, dolor en el cuello, dolor en extremidades.
• Trastornos generales y del lugar de administración:
— No comunes: Astenia, fatiga, malestar, edema periférico
• Trastornos psiquiátricos:
— No comunes: Desórdenes del sueño
Las siguientes experiencias adversas comunes (≥1/100, <1/10) o no comunes (≥1/1000, <1/100) relacionadas con el uso fueron reportadas en pacientes tomando ZINTREPID® (n=9595) con una mayor incidencia que con administración de estatinas solas (n=8883):
• Investigaciones:
— Comunes: Incremento de ALT y/o AST.
— No comunes: Incremento en la bilirrubina sanguínea; incremento de la CPK sanguíneo; incremento de la gamma-glutamiltransferasa.
• Trastornos del sistema nervioso:
— No comunes: Cefalea, parestesia.
• Trastornos gastrointestinales:
— No comunes: Distensión abdominal, diarrea, boca seca, dispepsia, flatulencias, reflujo gastroesofágico y vomito.
• Trastornos de piel y tejidos subcutáneos:
— No comunes: Prurito, rash, urticaria.
• Trastornos músculo esqueléticos y de tejidos conectivos:
— Comunes: Mialgia.
— No comunes: Artralgia, dolor de espalda, espasmos musculares, debilidad muscular, dolor músculo-esquelético, dolor en extremidades.
• Trastornos generales y del lugar de administración:
— No comunes: Astenia, dolor en el pecho, fatiga, edema periférico
• Trastornos psiquiátricos:
— No comunes: Insomnio.
ZINTREPID® co-administrado con fenofibrato: En un estudio clínico controlado, el perfil de reacciones adversas reportado en administración concomitante de ZINTREPID® y Fenofibrato, fue consistente con aquel reportado por ZINTREPID® y/o fenofibrato solo.
Pacientes pediátricos: En un estudio realizado con pacientes adolescentes (10 a 17 años) con hipercolesterolemia heterocigótica familiar, (n=248), el perfil de tolerabilidad y seguridad del grupo tratado con ZINTREPID® fue similar al realizado en pacientes adultos con ZINTREPID®. (Ver Uso pediatrico).
Pacientes con enfermedad cardiaca coronaria: En el estudio IMPROVE-IT, que involucró a 18.144 pacientes tratados con ZINTREPID® 10/40 mg (n=9067; de quienes al 6% se les aumentó la dosis a ZINTREPID® 10/80 mg) o simvastatina 40 mg (n=9077; de quienes al 27% se les aumentó la dosis a simvastatina 80 mg), los perfiles de seguridad fueron similares durante una mediana del periodo de seguimiento de 6,0 años. Las tasas de descontinuación debido a experiencias adversas fueron de 10,6% para los pacientes tratados con ZINTREPID® y 10,1% para los pacientes tratados con simvastatina. La incidencia de miopatía fue de 0,2% para ZINTREPID® y 0,1% para simvastatina, donde miopatía se definió como una debilidad o dolor muscular inexplicable con una CK sérica ≥10 veces el ULN o dos observaciones consecutivas de CK ≥5 y <10 veces el ULN. La incidencia de rabdomiólisis fue de 0,1% para ZINTREPID® y 0,2% para simvastatina, donde rabdomiólisis se definió como una debilidad o dolor muscular inexplicable con una CK sérica ≥10 veces el ULN con evidencia de lesión renal, ≥5 X ULN y <10 X ULN sobre dos ocasiones consecutivas con evidencia de daño renal o CK ≥10.000 U/L sin evidencia de daño renal. La incidencia de elevaciones consecutivas de las transaminasas (≥3 X ULN) fue de 2,5% para ZINTREPID® y 2,3% para simvastatina. (Ver Advertencias y precauciones.) Los efectos adversos relacionados con la vesícula biliar se reportaron en 3,1% frente a 3,5% de los pacientes asignados a ZINTREPID® y simvastatina, respectivamente. La incidencia de hospitalizaciones por colecistectomía fue del 1,5% en ambos grupos de tratamiento. Cáncer (definido como cualquier malignidad nueva) se diagnosticó durante el estudio en 9,4% frente a 9,5%, respectivamente.
Pacientes con Enfermedad Renal Crónica: En el estudio del corazón y protección renal (SHARP), de 9000 pacientes tratados con ZINTREPID® 10/20 mg diarios (n=4650), o placebo (n=4620), los perfiles de seguridad fueron comparables durante un seguimiento promedio de 4.9 años. En este estudio, fueron tenidos en cuenta solo eventos adversos serios y descontinuación del tratamiento debido a algún evento adverso. Las tasas de deserción del tratamiento debido a eventos adversos fueron comparables (10.4% en pacientes tratados con ZINTREPID®, 9.8% en pacientes tratados con placebo).(Ver Advertencias y precauciones) La incidencia de miopatía/rabdomiólisis fue 0.2% en pacientes tratados con ZINTREPID® y 0.1 en pacientes tratados con placebo. La elevación sucesiva de transaminasas (Mayor o igual a tres veces el límite superior normal) ocurrió en 0.7% pacientes tratados con ZINTREPID®, comparado con 0.6% de pacientes tratados con placebo. En este estudio no hubo incremento estadístico significativo en la incidencia de eventos adversos predeterminados, incluyendo cáncer (9.4% para ZINTREPID®, 9.5% para placebo), hepatitis, colecistectomía o complicaciones de cálculos biliares o pancreatitis.
Experiencia post-mercadeo: Los siguientes eventos adversos han sido reportados después del mercadeo de ZINTREPID® o durante los estudios clínicos post-mercadeo con uno de los componentes individuales. Los eventos adversos reportados por uso de ZINTREPID® son consistentes a aquellos previamente reportados por ezetimiba y/o simvastatina.
Investigaciones: Evaluación anormal de la función del hígado
Trastornos de la sangre y del sistema linfático: Trombocitopenia y anemia.
Trastorno del sistema nervioso: Neuropatía periférica.
Trastornos respiratorios, del tórax y del mediastino: Tos y enfermedad pulmonar intersticial.
Trastornos gastrointestinales: Constipación, pancreatitis, gastritis.
Trastornos de la piel y tejidos subcutáneos: Alopecia, reacciones de hipersensibilidad, incluido rash, urticaria, anafilaxis, angioedema y eritema multiforme.
Trastornos músculo-esqueléticos y del tejido conectivo: Calambres musculares, miopatía/rabdomiolisis (ver Advertencias y precauciones, miopatía/rabdomiólisis).
Se han reportado casos muy raros de miopatía necrotizante mediada por inmunidad (IMNM, por sus siglas en inglés), una miopatía autoinmune, asociada con el uso de estatinas. IMNM se caracteriza por: debilidad muscular proximal y elevación de la creatina quinasa sérica, que persiste a pesar de la interrupción del tratamiento con estatinas; la biopsia muscular que muestra miopatía necrotizante sin inflamación significativa, mejora con agentes inmunosupresores (Ver Advertencias y precauciones, miopatía/rabdomiólisis).
Trastornos del metabolismo y nutrición: Disminución del apetito.
Trastornos vasculares: Sofocos, hipertensión.
Trastornos generales y condiciones del sitio de administración: Dolor.
Trastornos Hepato-biliares: Hepatitis/ictericia; falla hepática fatal y no fatal, colelitiasis, colecistitis.
Trastornos del sistema reproductor y seno: Disfunción eréctil.
Trastornos psiquiátricos: Depresión.
Un aparente síndrome de hipersensibilidad ha sido reportado raramente, el cual ha incluido algunas de las siguientes características: Angioedema, síndrome similar al lupus, polimialgia reumática, dermatomiositis, vasculitis, trombocitopenia, eosinofilia, incremento del ESR, artritis y artralgia, urticaria, foto-sensibilidad, fiebre, ruboración, disnea y malestar.
Han habido raros reportes postmercadeo de daño cognitivo (p.ej., pérdida de memoria, olvido, amnesia, daño de la memoria, confusión) asociados con el uso de las estatinas. Estos eventos cognitivos han sido reportados para todas las estatinas. Los reportes generalmente no son graves, y son reversibles con la descontinuación de las estatinas, con tiempos variables de inicio de los síntomas (1 día a años) y resolución de los síntomas (promedio de 3 semanas).
Ezetimiba coadministrada con fenofibrato: En un estudio clínico multicéntrico, doble-ciego, de placebo controlado, en pacientes con hiperlipidemia mixta, 625 pacientes fueron tratados hasta por 12 semanas y 576 hasta por 1 año. Este estudio no fue diseñado para comparar grupos de tratamiento para eventos poco frecuentes. Las tasas de incidencia (95% Cl) para elevaciones importantes (mayor o igual a tres veces el limite superior normal, consecutivo) de transaminasas séricas fueron 4.5% (1.9, 8.8) y 2.7 (1.2, 5.4) para monoterapia de fenofibrato y ezetimiba coadministrado con fenofibrato, respectivamente, ajustado por la exposición al tratamiento. Correspondientes tasas de incidencia de colecistectomía fueron 0,6% (0.0, 3.1) y 1.7% (0.6, 4.0) para monoterapia de fenofibrato y ezetimiba coadministrado con fenofibrato, respectivamente (ver Advertencias y precauciones). No hubo aumentos de CPK mayores a diez veces el límite superior normal en ningún grupo de tratamiento en el estudio.
Valores de laboratorio: En estudios clínicos controlados, la incidencia de aumentos clínicamente importantes de las transaminasas séricas (de la ALT y/o la AST al triple o más del límite superior normal, de manera consecutiva) fue de 1.7% en los pacientes tratados con ZINTREPID®. Esos aumentos fueron generalmente asintomáticos, no se asociaron con colestasis, y cesaron al suspender o al continuar el tratamiento. (Ver Advertencias y precauciones.)
Se observaron aumentos clínicamente importantes de la creatinaquinasa (CK) (a diez o más veces más el límite superior de los valores normales) en 0.2% de los pacientes tratados con ZINTREPID®.
Se ha reportado el incremento en HbA1c y niveles de glucosa sérica en ayunas con estatinas, incluyendo simvastatina.
INTERACCIONES CON OTROS MEDICAMENTOS:
ZINTREPID®: No se observó ninguna interacción farmacocinética de importancia clínica cuando se coadministraron ezetimiba y simvastatina.
ZINTREPID® es bioequivalente a la coadministración de ezetimiba y simvastatina.
Medicamentos Contraindicados: El uso concomitante de los siguientes medicamentos está contraindicado:
Inhibidores Potentes del CYP3A4: Los estudios preclínicos han mostrado que ezetimiba no induce las enzimas metabolizadoras de medicamentos del citocromo P450. No se ha observado ninguna interacción farmacocinética de importancia clínica entre ezetimiba y medicamentos que son metabolizados por los citocromos P450 1A2, 2D6, 2C8, 2C9 y 3A4 o por la N-acetiltransferasa. Simvastatina es metabolizada por la CYP3A4, pero no inhibe su actividad; por lo tanto, no es de esperarse que afecte las concentraciones plasmáticas de otros medicamentos metabolizados por la CYP3A4. Los siguientes inhibidores potentes de la CYP3A4 aumentan el riesgo de miopatía al disminuir la eliminación del componente simvastatina de ZINTREPID®: El uso concomitante de medicamentos etiquetados como que tienen un efecto inhibidor potente en el CYP3A4 (p.ej., itraconazol, ketoconazol, posaconazol, voriconazol, eritromicina, claritromicina, telitromicina, inhibidores de la proteasa de HIV, boceprevir, telaprevir, nefazodona) está contraindicado. (Ver Contraindicaciones, advertencias y precauciones, miopatía/rabdomiólisis).
Gemfibrozilo, ciclosporina o Danazol (Ver Contraindicaciones y advertencias y precauciones, miopatía/rabdomiólisis).
Gemfibrozilo: En un estudio farmacocinético, la administración concomitante de gemfibrozilo incrementó las concentraciones totales de ezetimiba en aproximadamente 1.7 veces. Este incremento no se considera clínicamente significativo. No hay datos clínicos disponibles. (Ver Contraindicaciones y advertencias y precauciones, miopatía/rabdomiólisis).
Ciclosporina: En un estudio de ocho pacientes post-transplante renal con una depuración de creatinina de >50mL/min en una dosis estable de ciclosporina, una dosis sencilla de ezetimiba de 10 mg resultó en un incremento de 3.4 veces (rango 2.3 a 7.9 veces) en la media del ABC para la ezetimiba total comparado con una población control saludable de otro estudio (n=17). En un estudio diferente un paciente de transplante renal con insuficiencia renal grave (depuración de creatinina de 13.2 mL/min/1.73m2) que había recibido muchos medicamentos, incluyendo ciclosporina, demostró una exposición mayor a 12 veces a la ezetimiba total comparada con los controles concurrentes. En un estudio cruzado de dos periodos en doce sujetos sanos, la administración diaria de 20 mg de ezetimiba por 8 días con una dosis sencilla de 100 mg de ciclosporina en el día 7 resultó en una media de 15% de incremento en el ABC de ciclosporina (rango de disminución de 10% a un incremento del 51%) comparado con un dosis sencilla de 100 mg de ciclosporina sola (Ver Contraindicaciones y advertencias y precauciones, miopatía/rabdomiólisis).
Otras interacciones con medicamentos:
Fenofibrato: En un estudio clínico, en el cual fueron coadministrados ZINTREPID® 10/20 mg/día y fenofibrato 160 mg/día en 183 pacientes por más de 12 semanas, no hubo reportes de miopatía y ningún paciente experimentó eventos relacionados con la vesícula biliar. (Ver Advertencias y precauciones, miopatía/rabdomiólisis).
En un estudio farmacocinético, la administración concomitante de fenofibrato incrementó las concentraciones totales de ezetimiba aproximadamente 1.5 veces. Este incremento no se considera clínicamente significativo. La seguridad y efectividad de ezetimiba coadministrada con fenofibrato ha sido evaluada en un estudio clínico (Ver Efectos secundarios).
Otros fibratos: La seguridad y efectividad de ZINTREPID® administrado con fibratos, excepto fenofibrato, no ha sido estudiada. Los fibratos pueden incrementar la excreción biliar de colesterol, llevando a la colelitiasis.
La administración de ezetimiba con otros fibratos no ha sido estudiada: En un estudio preclínico en perros, la ezetimiba aumentó el colesterol en la vesícula biliar. Aunque la relevancia de este hallazgo preclínico en humanos es desconocida, la coadministración de ZINTREPID® con fibratos, que no sean fenofibrato, no es recomendada hasta que el uso en pacientes sea estudiado.
Ácido fusídico: El riesgo de miopatía/rabdomiólisis puede ser incrementado por la administración concomitante de ácido fusídico. (Ver Advertencias y precauciones, miopatía/rabdomiólisis).
Amiodarona: El riesgo de miopatía/rabdomiólisis aumenta cuando se coadministran amiodarona con ZINTREPID® (Ver Dosis y administración, advertencias y precauciones, miopatía/rabdomiólisis).
Colestiramina: La administración concomitante de colestiramina disminuyó 55% aproximadamente el promedio del área bajo la curva (ABC) de concentración de Ezetimiba total (Ezetimiba + glucurónido de Ezetimiba). Esa interacción puede hacer que sea menor la disminución adicional del C-LDL debida a la coadministración de ZINTREPID® y colestiramina.
Bloqueadores de los canales de calcio: El riesgo de miopatía/rabdomiólisis se incrementa por la administración concomitante de verapamilo, diltiazem, o amlodipino (Ver Dosis y administración, advertencias y precauciones, miopatía/rabdomiólisis).
Lomitapida: El riesgo de miopatía/rabdomiólisis puede ser incrementado por la administración concomitante de Lomitapida (Ver Dosis y administración y advertencias y precauciones, miopatía/rabdomiólisis).
Inhibidores moderados del CYP3A4: Los pacientes que toman otros medicamentos etiquetados como que tienen un efecto inhibitorio moderado en el CYP3A4 concomitantemente con ZINTREPID®, particularmente en las dosis más altas, pueden tener un riesgo incrementado de miopatía. (Ver Advertencias y precauciones, miopatía/rabdomiólisis).
Inhibidores del Transportador de Proteína OATP1B1: Simvastatina ácida es un sustrato del transportador de proteína OATP1B1. La administración concomitante de medicamentos que son inhibidores del transportador de proteína OATP1B1 puede llevar a elevación de las concentraciones plasmáticas de simvastatina ácida y un riesgo aumentado de miopatía. (Ver Contraindicaciones; advertencias y precauciones, miopatía/rabdomiolisis).
Inhibidores de la proteína resistente al Cáncer de mama (BCRP): La simvastatina es un sustrato de la proteína transportadora BCRP. La administración concomitante de productos que son inhibidores de BCRP (por ejemplo, elbasvir y grazoprevir) puede dar lugar a un aumento de las concentraciones plasmáticas de simvastatina y un aumento del riesgo de miopatía. Cuando se coadministra simvastatina con un inhibidor de BCRP, puede ser necesario un ajuste de la dosis de ZINTREPID® (véase Dosis y administración; precauciones, miopatía/rabdomiólisis).
Niacina: En un estudio realizado en 15 sujetos sanos, la administración concomitante de ZINTREPID® (10/20 mg/día por 7 días) provocó un aumento leve en el promedio de las ABCs de niacina (22%) y ácido nicotinúrico (19%) administrado como NIASPAN tabletas de liberación sostenida (1000 mg por 2 días y 2000 mg por 5 días después de un desayuno bajo en grasa). En el mismo estudio, la administración concomitante de NIASPAN aumento ligeramente el promedio de las ABCs de ezetimiba (9%), ezetimiba total (26%), simvastatina (20%) y simvastatina ácida (35%).
Han sido observados casos de miopatía/rabdomiólisis con simvastatina en administración concomitante con dosis modificantes de lípidos (≥1g/día) de niacina (Ver Advertencias y precauciones, miopatía/rabdomiólisis).
Colchicina: Han habido reportes de miopatía y rabdomiólisis con la administración concomitante de colchicina y ZINTREPID® en pacientes con insuficiencia renal. Se recomienda hacer un monitoreo cercano de los pacientes que toman esta combinación.
Otras interacciones: El jugo de toronja contiene uno o más componentes que inhiben la CYP3A4 y pueden aumentar las concentraciones plasmáticas de los medicamentos metabolizados por la CYP3A4. El efecto del consumo típico de jugo de toronja (250 ml al día) es mínimo (aumento de 13% de la actividad inhibidora de la HMG-CoA reductasa en el plasma, medida por el ABC) y no tiene ninguna importancia clínica. Sin embargo, dado que grandes cantidades de jugo de toronja aumentan significativamente la actividad inhibidora de la HMG-CoA reductasa en el plasma, el jugo de toronja se debe evitar durante el tratamiento con ZINTREPID® (Ver Advertencias y precauciones, miopatía/rabdomiólisis).
Anticoagulantes: En dos estudios clínicos, uno en voluntarios sanos y el otro en pacientes hipercolesterolémicos, 20-40 mg diarios de simvastatina potenciaron ligeramente el efecto de anticoagulantes cumarínicos. El tiempo de protrombina, reportado como la Razón Normalizada Internacional (INR), aumentó sus valores iniciales de 1.7 a 1.8 en los voluntarios sanos y de 2.6 a 3.4 en los pacientes con hipercolesterolemia. En los pacientes que están tomando anticoagulantes cumarínicos se debe determinar el tiempo de protrombina antes de iniciar el tratamiento con ZINTREPID® y con suficiente frecuencia durante el principio del tratamiento para asegurarse de que no ocurra ninguna alteración significativa del tiempo de protrombina. Una vez que se haya comprobado que el tiempo de protrombina es estable, se puede seguir vigilando a los intervalos usualmente recomendados en los pacientes tratados con anticoagulantes cumarínicos. Si se cambia la dosificación o se suspende la administración de ZINTREPID® se debe repetir ese mismo procedimiento. El tratamiento con simvastatina no se ha asociado con sangrado o con cambios del tiempo de protrombina en pacientes que no están tomando anticoagulantes.
La administración concomitante de ezetimiba (10 mg una vez al día) no tuvo efecto significativo en la biodisponibilidad de warfarina y el tiempo de protombina en un estudio de 12 hombres adultos sanos. Han habido reportes post-comercialización de un Rango Internacional Normalizado elevado en pacientes a quienes se les adicionó ezetimiba con warfarina o fluindiona. La mayoría de estos pacientes también estaban tomando otros medicamentos (Ver Advertencias y precauciones).
El efecto de ZINTREPID® sobre el tiempo de protrombina no ha sido estudiado.
Antiácidos: La administración concomitante de antiácidos disminuyó la tasa de absorción de ezetimiba, pero no tuvo ningún efecto sobre su biodisponibilidad. Esa disminución de la tasa de absorción de ezetimiba no se considera clínicamente importante.
INTERACCIONES FARMACOLÓGICAS:
• Debido a que ZINTREPID® contiene simvastatina, el riesgo de miopatía/rabdomiolisis aumenta por el uso concomitante de ZINTREPID® con:
Medicamentos Contraindicados
• Inhibidores potentes de la CYP3A4: El uso concomitante con medicamentos etiquetados como que tienen un efecto inhibitorio potente en el CYP3A4 a dosis terapéuticas (p. ej., itraconazol, ketoconazol, posaconazol, voriconazol, eritromicina, claritromicina, telitromicina, inhibidores de la proteasa del VIH, boceprevir, telaprevir, nefazodona, o medicamentos que contengan cobicistat) está contraindicado. Si el tratamiento a corto plazo con inhibidores potentes del CYP3A4 es inevitable, la terapia con ZINTREPID® debe ser suspendida durante el curso del tratamiento. (Ver Contraindicaciones, Interacciones con otros medicamentos).
• Gemfibrozilo, ciclosporina, o danazol: El uso concomitante de estos medicamentos con ZINTREPID® está contraindicado (Ver Contraindicaciones, Interacciones con otros medicamentos).
Otros medicamentos:
• Ácido fusídico: Los pacientes que estén siendo tratados con ácido fusídico de forma concomitante con simvastatina pueden tener un riesgo incrementado de miopatía/rabdomiólisis (Ver Interacciones farmacológicas, Interacciones con otros medicamentos); No se recomienda la administración concomitante con ácido fusídico. En pacientes en los cuales el uso de ácido fusídico sistémico se considera esencial, ZINTREPID® debe descontinuarse durante todo el tratamiento con ácido fusídico. En circunstancias excepcionales, donde es necesario el uso sistémico prolongado del ácido fusídico, p.ej., para el tratamiento de infecciones graves, la necesidad de la administración concomitante de ZINTREPID® y el ácido fusídico debe ser considerada solo en una base de caso por caso bajo estrecha supervisión médica
• Amiodarona: En un estudio clínico se reportó miopatía en 6% de los pacientes que recibieron 80 mg diarios de simvastatina y amiodarona. La dosis de ZINTREPID® no debe exceder 10/20 mg al día en pacientes que estén recibiendo medicación concomitante con amiodarona. (Ver Interacciones farmacológicas).
• Bloqueadores de los canales de calcio
Verapamilo o Diltiazem: Los pacientes en tratamiento con Diltiazem tratados concomitantemente con simvastatina en dosis de 80 mg tienen un riesgo incrementado de miopatía. La dosis de ZINTREPID® no debe exceder 10/20 mg al día en pacientes que reciben medicación concomitante con verapamilo o diltiazem. (Ver Interacciones con otros medicamentos).
Amlodipino: En un estudio clínico, los pacientes que están en tratamiento con amlodipino concomitantemente con simvastatina 80 mg tienen un riesgo ligeramente incrementado de miopatía. (Ver Interacciones con otros medicamentos). La dosis de ZINTREPID® no debe exceder 10/40 mg al día en pacientes que reciben de forma concomitante medicación con amlodipino.
• Lomitapide: La dosis de ZINTREPID® no debe exceder 10/40 mg al día en pacientes con HoFH que reciben de forma concomitante medicamentos con Lomitapida (Ver Interacciones con otros medicamentos).
• Inhibidores moderados del CYP3A4: Los pacientes que están tomando otros medicamentos etiquetados como que tienen un efecto inhibitorio del CYP3A4 moderado concomitantemente con ZINTREPID®, particularmente las dosis más altas de ZINTREPID®, pueden tener un riesgo incrementado de miopatía. Cuando se administra de forma concomitante ZINTREPID® con un inhibidor moderado del CYP3A4, puede ser necesario un ajuste de la dosis de ZINTREPID®.
• Inhibidores de la proteína resistente de Cáncer de Mama (BCRP): La administración concomitante de productos que son inhibidores de BCRP (por ejemplo, elbasvir y grazoprevir) pueden dar lugar a un aumento de las concentraciones plasmáticas de simvastatina y un aumento del riesgo de miopatía; por lo tanto, puede ser necesario un ajuste de la dosis de ZINTREPID®. La coadministración de elbasvir y grazoprevir con simvastatina no se ha estudiado; sin embargo, la dosis de ZINTREPID® no debe exceder de 10/20 mg al día en pacientes que reciben medicación concomitante con productos que contengan elbasvir o grazoprevir. (Vea las Interacciones medicamentosas, otras interacciones de medicamentos).
• Fenofibrato: En un estudio en el cual fue coadministrado ZINTREPID® 10/20 mg al día y fenofibrato 160 mg al día en 183 pacientes por más de 12 semanas, no hubo reportes de miopatía. Las dosis por encima de 10/20 mg de ZINTREPID® y fenofibrato no han sido estudiadas. Se debe tener precaución cuando se prescribe ZINTREPID® y fenofibrato, ya que el fenofibrato puede ocasionar miopatía cuando se administra solo. En otro estudio de 12 semanas, en el cual 411 pacientes recibieron simvastatina 20 mg/día y fenofibrato 160 mg/día, la coadministración también fue bien tolerada. Si se sospecha colelitiasis en un paciente que recibe ZINTREPID® y fenofibrato, los estudios de la vesícula biliar están indicados y puede considerarse una terapia alternativa de reducción de lípidos. (Ver. EFECTOS SECUNDARIOS e Información para prescribir de fenofibrato).
• Otros Fibratos: La seguridad y efectividad de ZINTREPID® administrado con fibratos, excepto fenofibrato no han sido estudiadas. Por tanto, el uso concomitante de ZINTREPID® y fibratos, excepto fenofibrato, debería evitarse. El uso concomitante de gemfibrozilo está contraindicado (Ver Contraindicaciones).
• Niacina (≥1g/día): Se han observado casos de miopatía/rabdomiólisis con simvastatina coadministrada con dosis modificadoras de lípidos (≥1g/día) de niacina. En un estudio clínico (mediana de seguimiento de 3.9 años) que involucró pacientes en alto riesgo de enfermedad cardiovascular y con niveles bien controlados de LDL-C con simvastatina 40mg/día con o sin ezetimiba 10 mg, no hubo un incremento en el beneficio de los resultados cardiovasculares con la adición de dosis modificantes de lípidos (≥1g/día) de niacina. Por tanto, el beneficio del uso combinado de simvastatina con niacina debe ser cuidadosamente sopesado contra los riesgos potenciales de la combinación. En adición, en este estudio, la incidencia de miopatía fue aproximadamente 0.24% para pacientes Chinos tomando simvastatina 40 mg o ezetimiba/simvastatina 10/40 mg en comparación con 1.24% para pacientes Chinos tomando simvastatina 40 mg o ezetimiba/simvastatina 10/40 mg administrados de forma concomitante con niacina/laropiprant 2g/40 mg. Dado que la única población Asiática evaluada en este estudio fue China, y que la incidencia de miopatía es más alta en pacientes Chinos, que en pacientes no Chinos. La administración concomitante de ZINTREPID® con dosis modificantes de lípidos de niacina (≥1g/día) no se recomienda en pacientes Asiáticos. (Ver Interacciones farmacológicas).
• Anticoagulantes: Si ZINTREPID® se añade a la terapia con warfarina, otro anticoagulante cumarínico, o fluindiona, el Radio Normalizado Internacional (INR, por sus siglas en inglés) debe ser monitoreado de forma apropiada (Ver Interacciones farmacológicas).
Enzimas hepáticas: En estudios controlados en pacientes a los que se les coadministraron ezetimiba y simvastatina se han observado aumentos sucesivos de las transaminasas (al triple o más del límite superior de sus valores normales). (Ver Efectos secundarios.)
En IMPROVE-IT, 18.144 pacientes con ECC se aleatorizaron para recibir ZINTREPID® 10/40 mg diarios (n=9067) o simvastatina 40 mg diarios (n=9077). Durante una mediana de seguimiento de 6,0 años, la incidencia de elevaciones consecutivas de las transaminasas (≥3 X ULN) fue de 2,5% para ZINTREPID® y 2,3% para simvastatina. (Vea Efectos secundarios.).
En un estudio clínico de 9000 pacientes con enfermedad renal crónica, fueron elegidos al azar, para la administración de ZINTREPID® 10/20 mg/día (n=4650) o placebo (n=4620) (seguimiento promedio de 4.9 años), la incidencia de aumentos sucesivos de las transaminasas (al triple o mas del limite superior de sus valores normales) fue de 0.7% para ZINTREPID® y del 0.6% para el placebo. (Ver Efectos secundarios)
Se recomienda hacer pruebas del funcionamiento hepático antes de iniciar el tratamiento con ZINTREPID®, y después cuando esté clínicamente indicado. Se debe prestar especial atención a los pacientes que presenten aumentos de las concentraciones de las transaminasas séricas; en ellos, las mediciones se deben repetir tempranamente y con mayor frecuencia. Si las concentraciones de las transaminasas siguen aumentando, particularmente si llegan al triple del límite normal superior y son persistentes, se debe suspender la administración del medicamento. Note que ALT puede ser producida por el músculo, sin embargo el aumento de ALT con CK puede indicar miopatía. (Ver Advertencias y precauciones, miopatía/rabdomiólisis).
Ha habido raros reportes postmercadeo de falla hepática fatal y no fatal en pacientes que toman estatinas, incluyendo simvastatina. Si ocurre daño hepático grave con síntomas clínicos y/o hiperbilirrubinemia o ictericia durante el tratamiento con ZINTREPID®, interrumpa de inmediato la terapia. Si no se encuentra una etiología alternativa no reinicie ZINTREPID®.
ZINTREPID® se debe usar con precaución en los pacientes que toman cantidades considerables de alcohol o que tienen antecedentes de enfermedad hepática. Las enfermedades hepáticas activas y los aumentos persistentes de las transaminasas son contraindicaciones para el uso de ZINTREPID®.
Insuficiencia hepática: Debido a que se desconocen los efectos de la exposición aumentada a ezetimiba en los pacientes con insuficiencia hepática moderada o severa, no se recomienda tratar con ZINTREPID® a esos pacientes.
ESTUDIOS CLÍNICOS: En estudios clínicos controlados, ZINTREPID® redujo significativamente el colesterol total (C-total), colesterol de lipoproteína de baja densidad (C-LDL), apolipoproteína B (Apo B), triglicéridos (TG), y colesterol de lipoproteína no de alta densidad (C-no HDL), y aumento del colesterol de lipoproteína de alta densidad (C-HDL) en pacientes con hipercolesterolemia.
Prevención secundaria de enfermedad cardiovascular en pacientes con enfermedad coronaria:
En el estudio Reducción Mejorada de los Desenlaces: Ensayo Internacional sobre la Eficacia de ZINTREPID (IMPROVE-IT) fue un estudio multicéntrico, aleatorizado, doble ciego, de control activo de 18.144 pacientes enrolados dentro de los 10 días de hospitalización por síndrome coronario agudo (SCA; ya fuera infarto de miocardio [IM] agudo o angina inestable [AI]. Los pacientes tenían un C-LDL ≤125 mg/dL (≤3,2 mmol/L) en el momento de la presentación con el SCA si no estaban tomando terapia hipolipemiante, o ≤100 mg/dL (≤2,6 mmol/L) si estaban recibiendo terapia hipolipemiante. Todos los pacientes se aleatorizaron en una proporción de 1:1 para recibir ZINTREPID® 10/40 mg (n=9067) o simvastatina 40 mg (n=9077) y se les hizo seguimiento durante una mediana de 6,0 años.
Los pacientes tenían una edad media de 63,6 años; el 76% eran de sexo masculino, el 84% eran caucásicos, y el 27% diabéticos. El valor C-LDL promedio en el momento del evento que califica para el estudio fue de 80 mg/dL (2,1 mmol/L) para aquellos en la terapia hipolipemiante (n=6390) y 101 mg/dL (2,6 mmol/L) para aquellos que no se encontraban en terapia hipolipemiante previa (n=11594). Previo a la hospitalización para el evento de SCA que califica, el 34% de los pacientes se encontraban en terapia de estatina. En un año, el C-LDL promedio para los pacientes que continuaron en terapia fue de 53,2 mg/dL (1,4 mmol/L) para el grupo de ZINTREPID® y 69,9 mg/dL. (1,8 mmol/L) para el grupo de monoterapia de simvastatina. Los valores lipídicos se obtuvieron generalmente para pacientes que permanecieron en la terapia del estudio.
El punto final primario fue un compuesto de muerte cardiovascular, eventos coronarios mayores (ECM; definido como infarto de miocardio no fatal, angina inestable documentada que requirió hospitalización, o cualquier procedimiento de revascularización coronario que ocurriera al menos 30 días después de la asignación del tratamiento aleatorizado) y accidente cerebrovascular no fatal. El estudio demostró que el tratamiento con ZINTREPID® proporcionó un beneficio incremental en reducir el punto final compuesto primario de muerte cardiovascular, ECM, y accidente cerebrovascular no fatal comparado con simvastatina sola (reducción del riesgo relativo de 6,4%, p=0,016). El punto final primario ocurrió en 2572 de 9067 pacientes (índice de Kaplan-Meier [KM] de 7 años 32,72%) en el grupo de ZINTREPID® y 2742 de 9077 pacientes (índice de KM de 7 años de 34,67%) en el grupo de simvastatina sola. (Vea la Figura 1 y Tabla 1.)
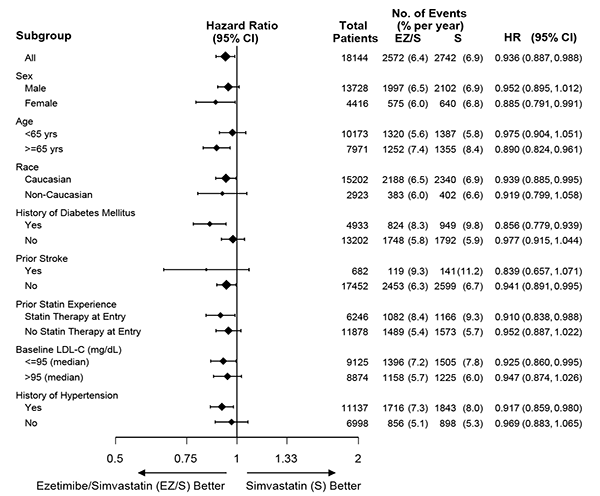
El efecto del tratamiento de ZINTREPID® fue generalmente consistente con los resultados generales a través de muchos subgrupos, incluyendo sexo, edad, raza, historia médica de diabetes mellitus, niveles lipídicos basales, terapia previa de estatina, accidente cerebrovascular previo, e hipertensión (vea la Figura 1).
Figura 1: Efecto de ZINTREPID® en el punto final compuesto primario de muerte cardiovascular, evento coronario mayor, o accidente cerebrovascular no fatal
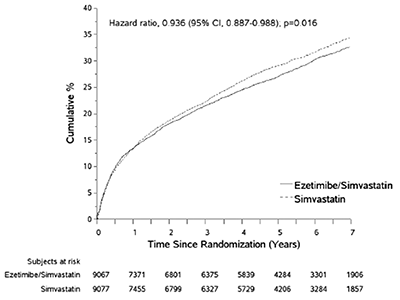
Figura 2: Análisis de subgrupo de punto final compuesto primario de muerte cardiovascular, evento coronario mayor, o accidente cerebrovascular no fatal
|
Tabla 1. Eventos cardiovasculares mayores por grupo de tratamiento en todos los pacientes aleatorizados en IMPROVE-IT |
||||||
|
Desenlace |
ZINTREPID® 10/40 mg* (N=9067) |
Simvastatina 10/40 mg† (N=9077) |
(IC 95%) |
Valor p |
||
|
n |
K-M %‡ |
n |
K-M %‡ |
|||
|
Punto final de eficacia compuesto primario (Muerte CV, eventos coronarios mayores y accidente cerebrovascular no fatal) |
2572 |
0.3272 |
2742 |
0.3467 |
0,936 (0,887, 0,988) |
0.016 |
|
Puntos finales de eficacia compuestos secundarios |
||||||
|
Muerte EC, IM no fatal, revascularización coronaria urgente después de 30 días |
1322 |
0.1752 |
1448 |
0.1888 |
0,912 (0,847, 0,983) |
0.016 |
|
ECM, accidente cerebrovascular no fatal, muerte (todas las causas) |
1322 |
0.1752 |
1448 |
0.1888 |
0,912 (0,847, 0,983) |
0.016 |
|
ECM, accidente cerebrovascular no fatal, muerte (todas las causas) |
3089 |
0.3865 |
3246 |
0.4025 |
0,948 (0,903, 0,996) |
0.035 |
|
Muerte CV, IM no fatal, angina inestable que requiere hospitalización, cualquier accidente cerebrovascular no fatal |
2716 |
0.3449 |
2869 |
0.362 |
0,945 (0,897, 0,996) |
0.035 |
|
Componentes del punto final compuesto primario y puntos finales de eficacia selectos (primeras ocurrencias del evento especificado en cualquier momento) |
||||||
|
Muerte cardiovascular |
537 |
0.0689 |
538 |
0.0684 |
1,000 (0,887, 1,127) |
0.997 |
|
Evento coronario mayor: |
||||||
|
IM no fatal |
945 |
0.1277 |
1083 |
0.1441 |
0,871 (0,798, 0,950) |
0.002 |
|
Angina inestable que requiere hospitalización |
156 |
0.0206 |
148 |
0.0192 |
1,059 (0,846, 1,326) |
0.618 |
|
Revascularización coronaria después de 30 días |
1690 |
0.2184 |
1793 |
0.2336 |
0,947 (0,886, 1,012) |
0.107 |
|
Accidente cerebrovascular no fatal |
245 |
0.0349 |
305 |
0.0424 |
0,802 (0,678, 0,949) |
0.010 |
|
Todos los IM (fatales y no fatales) |
977 |
0.1313 |
1118 |
0.1482 |
0,872 (0,800, 0,950) |
0.002 |
|
Todos los accidentes cerebrovasculares (fatales y no fatales) |
296 |
0.0416 |
345 |
0.0477 |
0,857 (0,734, 1,001) |
0.052 |
|
Accidente cerebrovascular no hemorrágico§ |
242 |
0.0348 |
305 |
0.0423 |
0,793 (0,670, 0,939) |
0.007 |
|
Accidente cerebrovascular hemorrágico |
59 |
0.0077 |
43 |
0.0059 |
1,377 (0,930, 2,040) |
0.110 |
|
Muerte por cualquier causa |
1215 |
0.1536 |
1231 |
0.1528 |
0,989 (0,914, 1,070) |
0.782 |
|
* al 6% se les aumentó la dosis a ezetimiba/simvastatina 10/80 mg. † al 27% se les aumentó la dosis a simvastatina 80 mg. ‡ cálculo de Kaplan-Meier a los 7 años. § incluye accidente cerebrovascular isquémico o accidente cerebrovascular de tipo indeterminado. |
||||||
Hipercolesterolemia primaria: Se reportaron cinco estudios multicéntricos, doble ciego realizado con ZINTREPID® en pacientes con hipercolesterolemia primaria: dos fueron comparaciones con simvastatina, dos fueron comparaciones con atorvastatina, y uno fue una comparación con rosuvastatina.
En un estudio multicéntrico, doble ciego, controlado con placebo, de 12 semanas de duración, 887 pacientes hipercolesterolémicos se aleatorizaron a uno de los diez grupos de tratamiento: placebo, ezetimiba (10 mg), simvastatina (10 mg, 20 mg, 40 mg, o 80 mg), o la coadministración de ezetimiba y simvastatina equivalente a ZINTREPID® (10/10, 10/20, 10/40, y 10/80). Cuando los pacientes que recibieron ZINTREPID® se compararon con aquellos que recibieron todas las dosis simvastatina, ZINTREPID® redujo significativamente el C-total, C-LDL, Apo B, TG, y C-C-no HDL, y proteína C reactiva. Los efectos de ZINTREPID® en el C-HDL fueron similares a los observados con la simvastatina. Los análisis adicionales mostraron que ZINTREPID® aumentó significativamente el C-HDL en comparación con el placebo. (Vea la Tabla 2.)
|
Tabla 2. Respuesta a ZINTREPID® en pacientes con hipercolesterolemia primaria (Mediaa del cambio % de los no tratados al iniciob) |
|||||||
|
Tratamiento (Dosis diaria) |
N |
C-total |
C-LDL |
Apo B |
C-HDL |
TGa |
C-no HDL |
|
Datos agrupados (Todas las dosis de ZINTREPID®)c |
353 |
-38 |
-53 |
-42 |
8 |
-28 |
-49 |
|
Datos agrupados (Todas las dosis de simvastatina)c |
349 |
-26 |
-38 |
-29 |
8 |
-15 |
-34 |
|
Ezetimiba 10 mg |
92 |
-14 |
-20 |
-15 |
7 |
-13 |
-19 |
|
Placebo |
93 |
2 |
3 |
3 |
2 |
-2 |
2 |
|
ZINTREPID® por dosis |
|||||||
|
10/10 |
87 |
-32 |
-46 |
-36 |
9 |
-21 |
-41 |
|
10/20 |
86 |
-37 |
-51 |
-41 |
8 |
-31 |
-47 |
|
10/40 |
89 |
-39 |
-55 |
-44 |
9 |
-32 |
-51 |
|
10/80 |
91 |
-43 |
-61 |
-47 |
6 |
-28 |
-55 |
|
Simvastatina por dosis |
|||||||
|
10 mg |
81 |
-21 |
-31 |
-23 |
5 |
-4 |
-27 |
|
20 mg |
90 |
-24 |
-35 |
-25 |
6 |
-14 |
-31 |
|
40 mg |
91 |
-29 |
-42 |
-33 |
8 |
-19 |
-37 |
|
80 mg |
87 |
-32 |
-46 |
-35 |
11 |
-26 |
-41 |
|
a Para triglicéridos, mediana del cambio % desde el inicio b Inicio - sin medicamento hipolipemiante c Las dosis agrupadas de ZINTREPID® (10/10-10/80) redujeron significativamente el C-total, C-LDL, Apo B, TG, y C-no HDL en comparación con la simvastatina, y aumentó significativamente el C-HDL en comparación con el placebo. |
|||||||
En un estudio de diseño similar, los resultados para todos los parámetros lipídicos fueron generalmente consistentes. En un análisis agrupado de estos dos estudios, la respuesta lipídica a ZINTREPID® fue similar en pacientes con niveles de TG mayores o menores a 200 mg/dL.
En un estudio multicéntrico, doble ciego, controlado, de 23 semanas de duración, 701 pacientes con EC conocida o equivalentes de riesgo de EC, según la definición de los lineamientos de NCEP ATP III, y un C-cuatro grupos de tratamiento: coadministración de ezetimiba y simvastatina equivalente a ZINTREPID® (10/10, 10/20, y 10/40), o simvastatina 20 mg. A los pacientes que no alcanzaron un C-LDL <100 mg/dL se les tituló la dosis de simvastatina en intervalos de 6 semanas a una dosis máxima de 80 mg. En la semana 5, las reducciones de C-LDL con ZINTREPID® 10/10, 10/20, o 10/40 fueron significativamente superiores que con la simvastatina 20 mg. Además, en la semana 5, significativamente más pacientes que recibieron ZINTREPID® 10/10, 10/20, o 10/40 alcanzaron la meta de C-LDL comparado con aquellos que recibieron simvastatina 20 mg (vea la Tabla 3). Los resultados de la semana 5 para la reducción de C-LDL y porcentaje que alcanzaron la meta de C-LDL fueron consistentes con los resultados del fin de estudio (semana 23).
|
Tabla 3. Respuesta a ZINTREPID® después de 5 semanas en pacientes con EC o equivalentes de riesgo de EC y un C-LDL ≥130 mg/dL |
||||
|
Simvastatina 20 mg |
ZINTREPID® 10/10 |
ZINTREPID® 10/20 |
ZINTREPID® 10/40 |
|
|
N |
253 |
251 |
109 |
97 |
|
Cambio porcentual del C-LDL |
-38 |
-47 |
-53 |
-59 |
|
Porcentaje que alcanzaron la meta de C-LDL |
46 |
75 |
83 |
88 |
En un estudio multicéntrico, doble ciego, de 6-semanas, 1902 pacientes con hipercolesterolemia primaria que no cumplieron su meta de C-LDL objetivo del Programa Nacional de Educación sobre el Colesterol (NCEP) ATPII se aleatorizaron a uno de los ocho grupos de tratamiento: ZINTREPID® (10/10, 10/20, 10/40, o 10/80) o atorvastatina (10 mg, 20 mg, 40 mg, o 80 mg). Cuando los pacientes que recibieron todas las dosis de ZINTREPID® se compararon con aquellos que recibieron todas las dosis de atorvastatina, ZINTREPID® redujo el C-total, C-LDL, Apo B, y C-no HDL, y aumentó el C-HDL significativamente más que la atorvastatina. Los efectos de ZINTREPID® en los TG fueron similares a los observados con la atorvastatina. (Vea la Tabla 4.)
|
Tabla 4. Respuesta a ZINTREPID® y atorvastatina en pacientes con hipercolesterolemia primaria (Mediaa del cambio % de los no tratados al iniciob) |
|||||||
|
Tratamiento (Dosis diaria) |
N |
C-total |
C-LDL |
Apo B |
C-HDL |
TGa |
C-no HDL |
|
Datos agrupados (Todas las dosis de ZINTREPID®) |
951 |
-38c |
-53c |
-43c |
+8c |
-27 |
-49c |
|
Datos agrupados (Todas las dosis de atorvastatina) |
951 |
-34 |
-45 |
-38 |
4 |
-26 |
-42 |
|
ZINTREPID® por dosis |
|||||||
|
10/10 |
238 |
-34d |
-47d |
-37d |
8 |
-26 |
-43d |
|
10/20 |
238 |
-37d |
-51d |
-40d |
7 |
-25 |
-46d |
|
10/40 |
238 |
-41d |
-57d |
-46d |
+9d |
-27 |
-52d |
|
10/80 |
237 |
-43d |
-59d |
-48d |
+8d |
-31 |
-54d |
|
Atorvastatina por dosis |
|||||||
|
10 mg |
238 |
-27 |
-36 |
-31 |
7 |
-21 |
-34 |
|
20 mg |
237 |
-32 |
-44 |
-37 |
5 |
-25 |
-41 |
|
40 mg |
237 |
-36 |
-48 |
-40 |
4 |
-24 |
-45 |
|
80 mg |
239 |
-40 |
-53 |
-44 |
1 |
-32 |
-50 |
|
a Para triglicéridos, mediana del cambio % desde el inicio b Inicio- sin medicamento hipolipemiante c p<0,05 para la diferencia con atorvastatina d p<0.05 para la diferencia con atorvastatina en dosis de mg equivalentes del componente simvastatina |
|||||||
En un estudio multicéntrico, doble ciego, de 24 semanas, y de titulación forzada, 788 pacientes con hipercolesterolemia primaria, que no cumplieron con su meta de C-LDL objetivo del NCEP ATP III, se aleatorizaron para recibir la coadministración de ezetimiba y simvastatina equivalente a ZINTREPID® (10/10 y 10/20) o atorvastatina 10 mg. Para todos los tres grupos de tratamiento, la dosis de la estatina se aumentó en intervalos de 6 semanas a 80 mg. En cada comparación de dosis preespecificada, ZINTREPID® redujo el C-LDL en un grado mayor que la atorvastatina (vea la Tabla 5).
|
Tabla 5. Respuesta a ZINTREPID® y atorvastatina en pacientes con hipercolesterolemia primaria (Mediaa del cambio % de los no tratados al iniciob) |
|||||||
|
Tratamiento |
N |
C-total |
C-LDL |
Apo B |
C-HDL |
TGa |
C-no HDL |
|
Semana 6 |
|||||||
|
Atorvastatina 10 mgc |
262 |
-28 |
-37 |
-32 |
5 |
-23 |
-35 |
|
ZINTREPID® 10/10d |
263 |
-34f |
-46f |
-38f |
+8f |
-26 |
-43f |
|
ZINTREPID® 10/20e |
263 |
-36f |
-50f |
-41f |
+10f |
-25 |
-46f |
|
Semana 12 |
|||||||
|
Atorvastatina 20 mg |
246 |
-33 |
-44 |
-38 |
7 |
-28 |
-42 |
|
ZINTREPID® 10/20 |
250 |
-37f |
-50f |
-41f |
9 |
-28 |
-46f |
|
ZINTREPID® 10/40 |
252 |
-39f |
-54f |
-45f |
+12f |
-31 |
-50f |
|
Semana 18 |
|||||||
|
Atorvastatina 40 mg |
237 |
-37 |
-49 |
-42 |
8 |
-31 |
-47 |
|
ZINTREPID® 10/40g |
482 |
-40f |
-56f |
-45f |
+11f |
-32 |
-52f |
|
Semana 24 |
|||||||
|
Atorvastatina 80 mg |
228 |
-40 |
-53 |
-45 |
6 |
-35 |
-50 |
|
ZINTREPID® 10/80g |
459 |
-43f |
-59f |
-49f |
+12f |
-35 |
-55f |
|
a Para triglicéridos, mediana del cambio % desde el inicio b Inicio - sin medicamento hipolipemiante c Atorvastatina: dosis de inicio de 10 mg titulada a 20 mg, 40 mg, y 80 mg en las semanas 6, 12, 18, y 24 d ZINTREPID®: dosis de inicio de 10/10 titulada a 10/20, 10/40 y 10/80 en las semanas 6, 12, 18, y 24 e ZINTREPID®: dosis de inicio de 10/20 titulada a 10/40, 10/40 y 10/80 en las semanas 6, 12, 18, y 24 f p0,05 para la diferencia con atorvastatina en la semana especificada g Datos agrupados para dosis comunes de ZINTREPID® en la semanas 18 y 24. |
|||||||
En un estudio multicéntrico, doble ciego, de 6 semanas, 2959 pacientes con hipercolesterolemia primaria que no cumplieron su meta de C-LDL objetivo del NCEP ATPII se aleatorizaron a uno de los seis grupos de tratamiento: ZINTREPID® (10/20, 10/40, o 10/80) o rosuvastatina (10 mg, 20 mg, o 40 mg). Cuando los pacientes que recibieron todas las dosis de ZINTREPID® se compararon con aquellos que recibieron todas las dosis de rosuvastatina, ZINTREPID® redujo el C-total, C-LDL, Apo B, TG, y C-no HDL significativamente más que la rosuvastatina. Los efectos de ZINTREPID® en el C-HDL fueron similares a los observados con la rosuvastatina. (Vea la Tabla 6).
|
Tabla 6. Respuesta a ZINTREPID® y rosuvastatina en pacientes con hipercolesterolemia primaria (Mediaa del cambio % de los no tratados al iniciob) |
|||||||
|
Tratamiento (Dosis diaria) |
N |
C-total |
C-LDL |
Apo B |
C-HDL |
TGa |
C-no HDL |
|
Datos agrupados (Todas las dosis de ZINTREPID®) |
1478 |
-40c |
-56c |
-45c |
8 |
-26c |
-51c |
|
Datos agrupados (Todas las dosis de rosuvastatina) |
1481 |
-37 |
-52 |
-42 |
8 |
-25 |
-47 |
|
ZINTREPID® por dosis |
|||||||
|
10/20 |
492 |
-37d |
-52d |
-42d |
7 |
-23d |
-47d |
|
10/40 |
493 |
-39e |
-55e |
-44e |
8 |
-27 |
-50e |
|
10/80 |
493 |
-44f |
-61f |
-50f |
8 |
-30f |
-56f |
|
Rosuvastatina por dosis |
|||||||
|
10 mg |
492 |
-32 |
-46 |
-37 |
7 |
-20 |
-42 |
|
20 mg |
495 |
-37 |
-52 |
-43 |
8 |
-26 |
-48 |
|
40 mg |
494 |
-41 |
-57 |
-47 |
8 |
-28 |
-52 |
|
a Para triglicéridos, mediana del cambio % desde el inicio b Inicio - sin medicamento hipolipemiante c p<0,05 para la diferencia con rosuvastatina d p<0,05 vs. rosuvastatina 10 mg e p<0,05 vs. rosuvastatina 20 mg f p<0,05 vs. rosuvastatina 40 mg |
|||||||
En un estudio doble ciego, controlado con placebo, de 8 semanas de duración, 240 pacientes con hipercolesterolemia que ya estaban recibiendo monoterapia de simvastatina y que no se encontraban en la meta de C-LDL objetivo (2,6 a 4,1 mmol/L [100 a 160 mg/dL] del Programa Nacional de Educación sobre el Colesterol (NCEP), dependiendo de las características iniciales) se aleatorizaron para recibir ezetimiba10 mg o placebo en adición a su terapia de simvastatina en curso. Entre los pacientes tratados con simvastatina que no se encontraban en la meta de C-LDL al inicio (~80%), significativamente más pacientes aleatorizados a la ezetimiba coadministrada con simvastatina alcanzaron su meta de C-LDL en el punto final del estudio comparado con los pacientes aleatorizados a placebo coadministrado con simvastatina, 76% y 21,5%, respectivamente. Las reducciones de C-LDL correspondientes para ezetimiba o placebo coadministrados con simvastatina también fueron significativamente diferentes (27% o 3%, respectivamente). Además la ezetimiba administrada con simvastatina disminuyó significativamente el C-total, Apo B, y TG en comparación con el placebo coadministrado con simvastatina.
En un estudio multicéntrico, doble ciego, de 24 semanas de duración, 214 pacientes con diabetes mellitus tipo 2 tratados con tiazolidinedionas (rosiglitazona o pioglitazona) durante un mínimo de 3 meses y simvastatina 20 mg durante un mínimo de 6 semanas con una media de C-LDL de 93 mg/dL, se aleatorizaron para recibir simvastatina 40 mg o los principios activos coadministrados equivalentes a ZINTREPID® 10/20.
ZINTREPID® 10/20 fue significativamente más efectiva que la duplicación de la dosis de simvastatina a 40 mg en la reducción de C-LDL (-21% y 0%, respectivamente), C-total (-14% y -1%, respectivamente), Apo B (-14% y -2%, respectivamente), y C-no HDL (-20% y -2%, respectivamente) más allá de las reducciones observadas con simvastatina 20 mg. Los resultados para C-HDL y TG entre los dos grupos de tratamiento no fueron significativamente diferentes. Los resultados no se afectaron por el tipo de tratamiento de la tiazolidinediona.
Coadministración con fenofibrato: En un estudio clínico multicéntrico, doble ciego, controlado con placebo en pacientes con hiperlipidemia mixta, 611 pacientes se trataron hasta por 12 semanas. Los pacientes se aleatorizaron para recibir placebo, ZINTREPID® 10/20 solo, 160 mg de fenofibrato solo, o ZINTREPID® 10/20 y 160 mg de fenofibrato.
ZINTREPID® coadministrado con fenofibrato redujo significativamente el C-total, C-LDL, Apo B, C-no HDL, y TG en comparación con fenofibrato solo y redujo significativamente la Apo B, C-no HDL, y TG y aumentó el C-HDL en comparación con ZINTREPID® administrado solo. (Vea la Tabla 7).
|
Tabla 7. Respuesta a ZINTREPID® y fenofibrato iniciados de forma concurrente en pacientes con hiperlipidemia mixta (medianaa del cambio % de los no tratados al iniciob a las 12 semanas) |
|||||||
|
Tratamiento (Dosis diaria) |
N |
C-total |
C-LDL |
Apo B |
C-HDLa |
TG |
C-no HDL |
|
Placebo |
60 |
-1 |
-4 |
0 |
1 |
-3 |
-2 |
|
ZINTREPID® 10/20 |
184 |
-35 |
-47 |
-39 |
9 |
-29 |
-45 |
|
Fenofibrato 160 mg |
184 |
-15 |
-16 |
-20 |
18 |
-41 |
-21 |
|
ZINTREPID® 10/20 + Fenofibrato 160 mg |
183 |
-39 |
-46 |
-45 |
19 |
-50 |
-51 |
|
a Para C-HDL, media del cambio % desde el inicio b Inicio - sin medicamento hipolipemiante |
|||||||
Estudios clínicos en pacientes pediátricos (10 a 17 años de edad): En un estudio multicéntrico, doble ciego, controlado con placebo, 142 niños y 106 niñas pos-menarquia, de 10 a 17 años de edad (edad media 14,2 años) con hipercolesterolemia familiar heterocigótica (HeFH) se aleatorizaron para recibir la coadministración de ezetimiba y simvastatina equivalente a ZINTREPID® o simvastatina sola. La inclusión en el estudio requirió 1) un nivel de C-LDL basal entre 160 y 400 mg/dl y 2) una historia médica y manifestación clínica consistente con HeFH. Los pacientes recibieron ZINTREPID® (10/10, 10/20, o 10/40) o simvastatina (10 mg, 20 mg, o 40 mg) durante 6 semanas, ZINTREPID® 10/40 o simvastatina 40 mg durante las siguientes 27 semanas, y ZINTREPID® 10/10, 10/20, o 10/40 de etiqueta abierta durante 20 semanas de ahí en adelante.
En la semana 6, ZINTREPID® (todas las dosis) redujo el C-total, C-LDL, Apo B, y C-no HDL significativamente más que la simvastatina (todas las dosis). Los resultados para TG y C-HDL fueron similares para los dos grupos de tratamiento. (Vea la Tabla 8.) En la semana 33, ZINTREPID® redujo el C-total, C-LDL, Apo B, TG, y C-no HDL significativamente más que la simvastatina. Los aumentos en C-HDL fueron similares para los dos grupos de tratamiento. Adicionalmente, en la semana 33, significativamente más pacientes que recibieron ZINTREPID® (63%) alcanzaron la meta ideal de la Academia Americana de Pediatría (AAP) para C-LDL (<110 mg/dL) comparado con aquellos que recibieron simvastatina 40 mg (27%). En la semana 53, la media de los cambios porcentuales desde el inicio para todas las dosis de ZINTREPID® fueron: -39% (C-total); -49% (C-LDL); -23% (Apo B); +3% (C-HDL); -17% (TG); y -46% (C-no HDL).
|
Tabla 8. Respuesta a ZINTREPID® en pacientes pediátricos con hipercolesterolemia familiar heterocigótica (Mediaa del cambio % de los no tratados al iniciob) |
|||||||
|
Tratamiento (Dosis diaria) |
N |
C-total |
C-LDL |
Apo B |
C-HDL |
TGa |
C-no HDL |
|
Semana 6 |
|||||||
|
Datos agrupados Todas las dosis de ZINTREPID® |
126 |
-38 |
-49 |
-39 |
7 |
-17 |
-47 |
|
Todas las dosis de simvastatina |
120 |
-26 |
-34 |
-27 |
6 |
-12 |
-33 |
|
ZINTREPID® por dosis |
|||||||
|
10/10 |
43 |
-37 |
-47 |
-37 |
4 |
-18 |
-44 |
|
10/20 |
40 |
-37 |
-50 |
-39 |
10 |
-17 |
-47 |
|
10/40 |
43 |
-40 |
-52 |
-41 |
6 |
-13 |
-49 |
|
Simvastatina por dosis |
|||||||
|
10 mg |
39 |
-23 |
-30 |
-23 |
3 |
-4 |
-28 |
|
20 mg |
39 |
-26 |
-34 |
-27 |
10 |
-12 |
-33 |
|
40 mg |
42 |
-30 |
-39 |
-29 |
7 |
-20 |
-37 |
|
Semana 33 |
|||||||
|
ZINTREPID® 10/40 |
126 |
-42 |
-54 |
-43 |
5 |
-20 |
-51 |
|
Simvastatina 40 mg |
120 |
-29 |
-38 |
-28 |
4 |
-13 |
-36 |
|
a Para triglicéridos, mediana del cambio % desde el inicio b Inicio - sin medicamento hipolipemiante |
|||||||
La seguridad y eficacia de las dosis superiores a 10/40 mg diarios no se han estudiado en niños. La eficacia a largo plazo de la terapia con ZINTREPID® en la niñez para reducir la morbilidad y mortalidad en la adultez no ha sido estudiada.
Ezetimiba: En dos estudios multicéntricos, doble ciego, controlados con placebo, de 12 semanas en 1719 pacientes con hipercolesterolemia primaria, ezetimiba redujo significativamente el C-total (13%), C-LDL (19%), Apo B (14%), TG (8%), y aumentó el C-HDL (3%) comparado con el placebo. La reducción en el C-LDL fue consistente a través de la edad, sexo, raza y C-LDL basal. Además, ezetimiba no tiene efecto en las concentraciones plasmáticas de las vitaminas liposolubles A, D, y E, no tiene efecto en el tiempo de protrombina, y no alteró la producción de hormonas esteroides adrenocorticales.
Simvastatina: ZINTREPID® contiene simvastatina. En dos estudios grandes, controlados con placebo, el Estudio escandinavo de supervivencia con simvastatina (N=4.444 pacientes) y el Estudio de protección cardiaca (N=20.536 pacientes), los efectos del tratamiento con simvastatina se evaluaron en pacientes en alto riesgo de eventos coronarios debido a enfermedad cardiaca coronaria existente, diabetes, enfermedad vascular periférica, historia de accidente cerebrovascular u otra enfermedad cerebrovascular. Se comprobó que la simvastatina reduce: el riesgo de mortalidad total al reducir las muertes por EC, el riesgo de infarto de miocardio no fatal y accidente cerebrovascular, y la necesidad de procedimientos de revascularización coronaria y no coronaria.
Hipercolesterolemia familiar homocigótica (HoFH): Un estudio doble ciego, aleatorizado, de 12 semanas de duración se realizó en pacientes con un diagnóstico clínico y/o genotípico de HoFH. Los datos se analizaron de un subgrupo de pacientes (n=14) que recibieron simvastatina 40 mg al inicio. El aumento de la dosis de simvastatina de 40 a 80 mg (n=5) produjo una reducción del C-LDL de 13% desde el inicio en simvastatina 40 mg. La ezetimiba coadministrada con simvastatina equivalente a ZINTREPID® (10/40 y 10/80 agrupados, n=9), produjo una reducción del C-LDL del 23% desde el inicio en simvastatina 40 mg. En esos pacientes que recibieron la coadministración de ezetimiba y simvastatina equivalentes a ZINTREPID® (10/80, n=5), se produjo una reducción del C-LDL del 29% desde el inicio en simvastatina 40 mg.
ADVERTENCIAS Y PRECAUCIONES: Cuando se administre ZINTREPID® con fenofibrato, por favor referirse a la información para prescripción de fenofibrato.
La dosis máxima de simvastatina sola o en combinación es 40 mg., en cualquier circunstancia.
Miopatía/rabdomiólisis: Simvastatina, al igual que otros inhibidores de la HMG-CoA reductasa, causa ocasionalmente miopatía que se manifiesta como dolor, sensibilidad o debilidad muscular con creatina cinasa (CK) por encima de 10X el límite superior normal (ULN). La miopatía algunas veces toma forma de rabdomiólisis con o sin insuficiencia renal aguda secundaria a la mioglobinuria, y han ocurrido fatalidades raras. El riesgo de miopatía se aumenta por los altos niveles de la actividad inhibitoria de la HMG-CoA reductasa en plasma. Los factores predisponentes de miopatía incluyen avanzada edad (≥65 años), sexo femenino, hipotiroidismo no controlado, y deterioro renal.
Al igual que con otros inhibidores de la HMG-CoA reductasa, el riesgo de miopatía/rabdomiólisis se relaciona con la dosis de simvastatina. En la base de datos de un estudio clínico en el cual 41.413 pacientes fueron tratados con simvastatina, de los cuales 24.747 (aproximadamente el 60%) fueron vinculados en estudios con una mediana de seguimiento de al menos 4 años, la incidencia de miopatía fue aproximadamente 0,03%, 0,08% y 0,61% en 20, 40 y 80 mg/día, respectivamente. En estos estudios, los pacientes se monitorearon cuidadosamente y se excluyeron algunos productos medicinales con interacción.
En un estudio clínico en los cuales pacientes con historia de infarto de miocardio se trataron con simvastatina 80 mg/día (media del seguimiento 6,7 años), la incidencia de miopatía fue aproximadamente 1,0% en comparación con 0,02% para pacientes en 20 mg/día. Aproximadamente la mitad de estos casos de miopatía ocurrieron durante el primer año de tratamiento. La incidencia de miopatía durante cada año de tratamiento subsecuente fue aproximadamente 0,1%.
El riesgo de miopatía es mayor en pacientes tratados con 80 mg de simvastatina si se compara con otras terapias basadas en estatinas con similar eficacia en la reducción del LDL-C.
Todos los pacientes que inician tratamiento con simvastatina, o aquellos cuya dosis de ZINTREPID® está siendo aumentada, deben ser advertidos del riesgo de miopatía e informados de que deben reportar inmediatamente cualquier dolor, sensibilidad o debilidad muscular inexplicable. El tratamiento con ZINTREPID® debe suspenderse inmediatamente si la miopatía es diagnosticada o sospechada. La presencia de estos síntomas, y un nivel de CK>10 veces el límite superior normal indican miopatía. En la mayoría de los casos, cuando el tratamiento fue suspendido oportunamente, los síntomas musculares y los aumentos de CK se resolvieron (Ver Efectos secundarios). Evaluaciones de CK periódicas pueden considerarse en pacientes que inician tratamiento con ZINTREPID® o en aquellos cuya dosis está siendo aumentada. No hay garantía de que ese monitoreo evitará la miopatía.
Muchos de los pacientes que han desarrollado rabdomiolisis durante el tratamiento con simvastatina habían tenido historias médicas complicadas, incluyendo insuficiencia renal por lo general como consecuencia de diabetes mellitus de larga data. Estos pacientes merecen una vigilancia más estricta. El tratamiento con simvastatina debe interrumpirse temporalmente unos cuantos días antes a una cirugía mayor programada y cuando se produce alguna condición médica o quirúrgica importante.
En el estudio Reducción Mejorada de los Desenlaces: Ensayo Internacional sobre la Eficacia de ZINTREPID® (IMPROVE-IT), 18.144 pacientes con EC se aleatorizaron para recibir ZINTREPID® 10/40 mg diarios (n=9067) o simvastatina 40 mg diarios (n=9077). Durante una mediana de seguimiento de 6,0 años, la incidencia de miopatía fue de 0,2% para ZINTREPID® y 0,1% para simvastatina, donde miopatía se definió como una debilidad o dolor muscular inexplicable con una CK sérica ≥10 veces el ULN o dos observaciones consecutivas de CK ≥5 y <10 veces el ULN. La incidencia de rabdomiólisis fue de 0,1% para ZINTREPID® y 0,2% para simvastatina, donde rabdomiólisis se definió como una debilidad o dolor muscular inexplicable con una CK sérica ≥10 veces el ULN con evidencia de lesión renal, ≥5 X ULN y < 10 X ULN sobre dos ocasiones consecutivas con evidencia de daño renal o CK ≥10.000 U/L sin evidencia de daño renal. (Vea Efectos secundarios)
En un estudio clínico de 9000 pacientes con enfermedad renal crónica, fueron elegidos al azar, para la administración de ZINTREPID® 10/20 mg/día (n=4650) o placebo (n=4620) (seguimiento promedio de 4.9 años), la incidencia de miopatía/rabdomiólisis fue de 0.2% para ZINTREPID® y del 0.1% para el placebo. (Ver Efectos secundarios).
En un estudio clínico en el cual pacientes en alto riesgo de enfermedad cardiovascular fueron tratados con simvastatina 40 mg/día (mediana de seguimiento de 3.9 años), la incidencia de miopatía fue aproximadamente 0.05% para pacientes no Chinos (n=7367) en comparación con 0.24% para pacientes Chinos (n=5468). Dado que la única población asiática evaluada en este estudio clínico era China, se debe tener precaución cuando se prescribe ZINTREPID® a pacientes asiáticos y debe emplearse la dosis necesaria más baja.
DOSIFICACIÓN Y ADMINISTRACIÓN: El paciente debe estar en una dieta hipolipemiante estándar antes de recibir ZINTREPID® y debe continuar con esta dieta durante el tratamiento con ZINTREPID®. La dosificación se debe individualizar de acuerdo con el nivel C-LDL basal, la meta recomendada de la terapia, y la respuesta del paciente. ZINTREPID® se debe tomar como una monodosis diaria en la noche, con o sin alimentos.
En pacientes con hiperlipidemia primaria o hiperlipidemia mixta, el rango de dosis es de 10/10 mg/día hasta 10/40 mg/día. La dosis de inicio usual recomendada es de 10/20 mg/día. Se puede considerar el inicio de la terapia con 10/10 mg/día para pacientes que requieren reducciones del C-LDL menos agresivas. Los pacientes que requieren una mayor reducción en C-LDL (más del 55%) se pueden iniciar en 10/40 mg/día. Después de la iniciación o titulación de ZINTREPID®, los niveles lipídicos se deben analizar después de 2 semanas o más y ajustar la dosis, si es necesario.
Pacientes con enfermedad cardiaca coronaria: En el estudio de reducción del riesgo de eventos cardiovasculares (IMPROVE-IT), la dosis de inicio fue de 10/40 mg una vez al día en la noche. (Ver Advertencias y precauciones).
Pacientes con deterioro renal/enfermedad renal crónica: En pacientes con insuficiencia renal leve (TFG estimada ≥60 mL/min/1,73 m2), no es necesario el ajuste de la dosis. En pacientes con enfermedad renal crónica y tasa estimada de filtración glomerular <60 ml/min/1,73 m2, la dosis de ZINTREPID® es de 10/20 mg una vez al día en la noche. En esos pacientes, el uso de dosis más altas se debe monitorear de cerca. (Ver Advertencias y precauciones)
Coadministración con fenofibrato: La dosis de ZINTREPID® cuando utilizada concomitantemente con fenofibrato es de 10/10 mg/día o 10/20 mg/día (ver Advertencias y precauciones, miopatía/rabdomiólisis).
Pacientes con hipercolesterolemia familiar homocigótica: La dosificación recomendada de ZINTREPID® en los pacientes con hipercolesterolemia familiar homocigótica es de 10/40mg/día en la noche. En esos pacientes ZINTREPID® se debe usar adjunto a otros tratamientos reductores de los lípidos (por ejemplo, LDL-aféresis) o si no se dispone de esos otros tratamientos.
En pacientes que toman lomitapida de forma concomitante con ZINTREPID®, la dosis de ZINTREPID® no debe exceder 10/40 mg/día (Ver Advertencias y precauciones, miopatía/rabdomiólisis y Interacciones con otros medicamentos).
Uso en Adultos Mayores: No es necesario hacer ningún ajuste de la dosificación en los pacientes de edad avanzada.
Uso en pacientes pediátricos (de 10 a 17 años de edad): La dosis inicial recomendada es de 10/10 mg una vez al día en la noche. El rango de dosis recomendado es de 10/10 mg/día hasta una dosis máxima de 10/40 mg/día. La dosis debe ser individualizada de acuerdo con la meta de la terapia recomendada. No se recomienda el tratamiento con ZINTREPID® en niños menores de 10 años de edad.
Uso en pacientes con deterioro hepático: No es necesario hacer ningún ajuste de la dosificación en los pacientes con insuficiencia hepática leve (puntuación de Child-Pugh de 5 ó 6). No se recomienda el tratamiento con ZINTREPID® en los pacientes con insuficiencia hepática moderada (puntuación de Child-Pugh de 7 a 9) o severa (puntuación de Child-Pugh mayor de 9). (Ver Advertencias y precauciones).
Coadministración con otros medicamentos: ZINTREPID® se debe administrar dos o más horas antes o cuatro o más horas después de administrar un secuestrante de ácidos biliares.
En los pacientes que estén tomando amiodarona, verapamilo, diltiazem, o productos que contienen elbasvir o grazoprevir concomitantemente con ZiNTREPID®, la dosis de ZiNTREPID® no debe exceder 10/20 mg/día. (Ver Advertencias y precauciones, miopatía/rabdomiólisis y Interacciones con otros medicamentos).
En los pacientes que estén tomando amlodipino concomitantemente con ZINTREPID®, las dosis de ZINTREPID® no debe exceder 10/40 mg/día (ver Advertencias y precauciones miopatía/rabdomiólisis e Interacciones con otros medicamentos).
La seguridad y efectividad de la administración de ZINTREPID® con fibratos, excepto con fenofibrato, no han sido estudiadas. Por lo tanto la combinación de ZINTREPID® con fibratos, excepto por el fenofibrato, debe evitarse (ver Contraindicaciones, advertencias y precauciones miopatía/rabdomiólisis e Interacciones con otros medicamentos).
SOBREDOSIFICACIÓN:
ZINTREPID®: No se puede recomendar ningún tratamiento específico de la sobredosificación de ZINTREPID®. En caso de una sobredosis, se deben aplicar medidas sintomáticas y de sostén. La coadministración de 1000 mg/kg de ezetimiba y 1000 mg/kg de simvastatina fue bien tolerada en los estudios de toxicidad aguda por vía oral en ratones y ratas. No se observó ningún signo clínico de toxicidad en esos animales. Las DL50 estimadas para ambas especies fueron 1000 mg/kg o más de ezetimiba y 1000 mg/kg o más de simvastatina.
Ezetimiba: En los estudios clínicos, la administración de 50 mg diarios de ezetimiba a 15 personas sanas durante hasta 14 días o de 40 mg diarios a 18 pacientes con hipercolesterolemia primaria durante hasta 56 días y 40 mg/día de 27 pacientes con sitosterolemia homocigótica por 26 semanas fue generalmente bien tolerada. Se han reportado pocos casos de sobredosificación, la mayoría de los cuales no se han asociado con experiencias adversas. Las experiencias adversas reportadas no fueron graves.
Simvastatina: Se han reportado pocos casos de sobredosificación; la máxima dosis ingerida fue de 3.6 g. Todos esos pacientes se recuperaron sin secuelas.
PRESENTACIÓN: ZINTREPID® 10/10mg: (Reg. San. INVIMA 2016M-0004174-R1). Caja por 14 y 28 tabletas en blíster.
ZINTREPID® 10/20mg: (Reg. San. INVIMA 2016M-0004172-R1). Caja por 14 y 28 tabletas en blíster.
ZINTREPID® 10/40mg: (Reg. San. INVIMA 2016M-0004175-R1). Caja por 14 y28 tabletas en blíster.
Este documento fue revisado por última vez en Junio de 2016
LPI-MK0653A-T-062016
MERCK SHARP & DOHME
Bogotá, D.C. - Colombia
ALMACENAMIENTO: Almacenar a temperatura no mayor a 30°C.