
ZOELY
ESTRADIOL, NOMEGESTROL
Tabletas recubiertas
,28 Tabletas recubiertas,
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA:
Tabletas recubiertas activas blancas: Cada TABLETA RECUBIERTA contiene 2.5 mg de acetato de nomegestrol y 1.5 mg de estradiol (como hemidrato).
Tabletas recubiertas placebo amarillas: La TABLETA no contiene sustancias activas.
Excipiente: Cada TABLETA RECUBIERTA activa blanca contiene 57.71 mg de lactosa monohidrato.
Cada TABLETA RECUBIERTA placebo amarilla contiene 61.76 mg de lactosa monohidrato.
Para una lista completa de excipientes, vea Lista de excipientes.
INDICACIONES TERAPÉUTICAS: Anticoncepción oral.
CARACTERÍSTICAS FARMACÉUTICAS:
Lista de excipientes:
Núcleo de tableta (tabletas recubiertas activas blancas y placebo amarillas)
– Lactosa monohidrato.
– Celulosa, microcristalina (E460).
– Crospovidona (E1201).
– Talco (E553b).
– Estearato de magnesio (E572).
– Sílice, coloidal anhidro.
Recubrimiento de tableta (tabletas recubiertas activas blancas)
– Polivinil alcohol (E1203).
– Dióxido de titanio (E171).
– Macrogol 3350.
– Talco (E553b).
Recubrimiento de tabletas (tabletas recubiertas placebo amarillas)
– Polivinil alcohol (E1203).
– Dióxido de titano (E171).
– Macrogol 3350.
– Talco (E553b).
– Óxido férrico amarillo (E172).
– Óxido férrico negro (E172).
Incompatibilidades: No aplica.
Vida útil: 36 meses.
Precauciones especiales de almacenamiento: Almacenar a una temperatura inferior a 30°C en su envase y empaque original.
Naturaleza y contenido del recipiente: Blíster que contiene 28 tabletas recubiertas (24 tabletas recubiertas blancas con principio activo y 4 tabletas recubiertas amarillas con placebo).
Precauciones especiales de desecho: Las tabletas de COC (incluyendo las tabletas ZOELY®) que ya no se requieran no deben desecharse a través de aguas residuales o el sistema de alcantarillado municipal. Los compuestos activos hormonales en la tableta pueden tener efectos nocivos si llegan al ambiente acuático. Las tabletas deben ser regresadas a la farmacia o desechadas en otra manera segura de acuerdo con los requerimientos locales. Estas medidas ayudarán a proteger el ambiente.
FORMA FARMACÉUTICA: Tableta recubierta (tableta).
PROPIEDADES FARMACOCINÉTICAS:
Acetato de nomegestrol (NOMAC):
Absorción: El acetato de nomegestrol oralmente administrado es absorbido rápidamente.
Concentraciones plasmáticas máximas de acetato de nomegestrol de aproximadamente 7 ng/ml son alcanzadas en 2 h después de una administración única. La disponibilidad absoluta del acetato de nomegestrol después de una dosis única es del 63%. Ningún efecto clínicamente relevante de los alimentos fue observado en la biodisponibilidad del acetato de nomegestrol.
Distribución: El acetato de nomegestrol se une extensamente a la albumina (97-98 %), pero no se une a la globulina de unión de hormona sexual (SHBG) o globulina de unión a corticoide (CBG). El volumen de distribución aparente del acetato de nomegestrol en estado estable es 1645 ± 576 L.
Biotransformación: El acetato de nomegestrol es metabolizado en varios metabolitos hidroxilados inactivos por las enzimas del citocromo P450, principalmente CYP3A4 y CYP3A5 con posible contribución de CYP2C19 and CYP2C8. El acetato de nomegestrol y sus metabolitos hidroxilados experimenta un extenso metabolismo fase 2 para formar conjugados glucurónido y sulfato. La depuración aparente en estado estable es de 26 L/h.
Eliminación: La vida media de eliminación (t1/2) es de 46 h (que varía de 28-83 h) en estado estable. La vida media de eliminación de los metabolitos no fue determinada.
El acetato de nomegestrol es excretado por orina y heces. Aproximadamente el 80% de la dosis es excretada en orina y heces dentro de 4 días. La excreción del acetato de nomegestrol fue casi completa después de 10 días y las cantidades excretadas fueron más altas en heces que en orina.
Linealidad: La linealidad de la dosis fue observada en el rango de 0.625-5 mg (evaluado en mujeres fértiles y posmenopáusicas).
Condiciones de estado estable: La farmacocinética del acetato de nomegestrol no es influenciada por SHBG.
El estado estable es alcanzado después de 5 días. Las concentraciones plasmáticas máximas del acetato de nomegestrol de aproximadamente 12 ng/ml son alcanzadas 1.5 h después de la dosificación.
Las concentraciones plasmáticas de estado estable promedio son de 4 ng/ml
PROPIEDADES FARMACODINÁMICAS:
Grupo farmacoterapéutico: Hormonas sexuales y moduladores del sistema genital, progestógenos y estrógenos, combinaciones fijas, código ATC: G03AA14.
Acetato de nomegestrol es un progestágeno altamente selectivo derivado de la hormona esteroidea que ocurre naturalmente, progesterona. El acetato de nomegestrol tiene una fuerte afinidad por el receptor progesterona humano y tiene una actividad anti-gonadotrópica, una actividad anti-estrogénica mediada por el receptor progesterona, una actividad anti-androgénica moderada, y es desprovista de cualquier actividad estrogénica, androgénica, glucocorticoide o mineralocorticoide.
El estrógeno contenido en ZOELY® es 17ß-estradiol, un estrógeno natural idéntico al 17ß-estradiol (E2) endógeno humano. Este estrógeno difiere del estrógeno etinilestradiol utilizado en otros COCs por la falta del grupo etinil en la posición 17 alfa. Durante el uso de ZOELY®, los niveles E2 promedio son comparables a los niveles E2 durante la fase folicular temprana y lútea tardía del ciclo menstrual (ver Propiedades farmacocinéticas).
El efecto anticonceptivo de ZOELY® se basa en la interacción de varios factores, los más importantes de los cuales son considerados la inhibición de la ovulación y los cambios en la secreción cervical.
En dos estudios aleatorizados, de etiqueta abierta, comparativos de la eficacia- seguridad, más de 3200 mujeres, con edades entre los 18-50 años, fueron tratadas hasta por 13 ciclos consecutivos con ZOELY® y más de 1000 mujeres con drospirenona 3 mg –etinilestradiol 30 µg (régimen 21/7).
En el grupo ZOELY®, el aumento de peso fue reportado por el 8.6% de las mujeres (versus 5.7 % en el grupo comparador), sangrado por retiro anormal (predominantemente la ausencia de sangrado por retiro) fue reportado por el 10.5% de las mujeres (versus 0.5 % en el grupo comparador), y el acné fue reportado por el 15.4% de las mujeres (versus 7.9 % en el grupo comparador) (ver Efectos indeseables). Las evaluaciones de acné durante el tratamiento de ZOELY® mostraron que la mayoría de las mujeres (73.1 %) no presentaron cambio en el estado del acné si se compara con el pretratamiento mientras que el 16.8 % tuvo mejoría en el acné y 10.1% tuvo empeoramiento del acné o acné nuevo.
En el estudio clínico realizado con ZOELY® en la Unión Europea, Asia, y Australia, los siguientes índices Pearl para el grupo de edad de 18-35 años fueron calculados:
Falla de método: 0.40 (intervalo de confianza del 95% límite superior de 1.03).
Falla de método y de usuario: 0.38 (intervalo de confianza del 95% límite superior de 0.97).
En el estudio clínico realizado con ZOELY® en los Estados Unidos, Canadá, y América Latina, los siguientes índices Pearl para el grupo de edad de 18-35 años fueron calculados:
Falla de método: 1.22 (intervalo de confianza del 95% límite superior de 2.18).
Falla de método y usuario: 1.16 (intervalo de confianza del 95% límite superior de 2.08).
En un estudio aleatorizado, de etiqueta abierta, 32 mujeres fueron tratadas durante 6 ciclos con ZOELY®.
Después de la interrupción de ZOELY®, el regreso de la ovulación ocurrió en promedio a los 20.8 días después de la última tableta tomada, con las primeras ovulaciones detectadas a los 16 días.
El ácido fólico es una vitamina importante en la fase temprana del embarazo. Los niveles séricos del ácido fólico permanecieron sin cambio durante y después del tratamiento con ZOELY® durante 6 ciclos consecutivos si se compara con los niveles.
En un estudio aleatorizado, comparativo, de etiqueta abierta de 2 años, las mujeres de 21-35 años de edad fueron tratadas con ZOELY® sin un efecto clínicamente relevante en la densidad mineral ósea.
Un estudio aleatorizado, de etiqueta abierta, comparativo, multicéntrico fue realizado para evaluar los efectos de ZOELY® en la hemostasia, lípidos, metabolismo de los carbohidratos, función de la suprarrenal y tiroides y en los andrógenos. Sesenta mujeres, de 18-50 años de edad fueron tratadas con ZOELY® durante 6 ciclos consecutivos. La tolerancia a la glucosa y sensibilidad a la insulina permanecieron inalterados y no se observaron efectos clínicamente relevantes en el metabolismo de los lípidos con ZOELY®. ZOELY® aumentó las proteínas transportadoras TBG y CBG e indujo un pequeño aumento en SHBG. Los parámetros androgénicos androstenediona, DHEA-S, testosterona total y libre fueron reducidas significativamente durante el uso de ZOELY®.
La histología endometrial fue investigada en un subgrupo de mujeres (n=32) en un estudio clínico después de 13 ciclos de tratamiento. No se observaron resultados anormales.
Población pediátrica: No se encuentran datos de eficacia y seguridad disponibles en adolescentes menores a 18 años. Los datos de farmacocinética disponibles se describen en Propiedades farmacocinéticas.
CONTRAINDICACIONES: Los anticonceptivos hormonales combinados (CHCs, por sus siglas en Ingles) no deben ser utilizados en presencia de las condiciones enumeradas a continuación. Debido que aún no hay datos epidemiológicos disponibles con COCs que contienen 17ß-estradiol, las contraindicaciones para los CHCs que contienen etinilestradiol se consideran aplicables al uso de ZOELY®. En caso que cualquiera de las condiciones aparezca por primera vez durante el uso de ZOELY®, el producto medicinal debe ser suspendido de inmediato.
• Hipersensibilidad a las sustancias activas o a cualquier otro excipiente de ZOELY®.
• Presencia o historia de trombosis venosa (trombosis de vena profunda, embolismo pulmonar).
• Presencia o historia de trombosis arterial (por ejemplo, infarto de miocardio) o condiciones prodrómicas (por ejemplo, ataque isquémico transitorio, angina de pecho);
• Presencia o historia de accidente cerebrovascular; Historia de migraña con síntomas neurológicos focales.
• La presencia de un factor de riesgo severo o múltiples factores de riesgo para trombosis venosa o arterial (ver Advertencias especiales y precauciones de uso) tal como:
– Diabetes mellitus con síntomas vasculares;
– Hipertensión severa;
– Dislipoproteinemia severa.
• Cirugía mayor con inmovilización prolongada (ver Advertencias especiales y precauciones de uso).
• Predisposición hereditaria o adquirida de trombosis venosa o arterial, tal como resistencia a proteína C activada (APC), deficiencia de antitrombina-III, deficiencia de proteína C, deficiencia de proteína S, hiperhomocisteinemia y anticuerpos antifosfolípidos (anticuerpos anticardiolipina, anticoagulante lúpico).
• Pancreatitis o historia de esto si está asociada con hipertrigliceridemia severa.
• Presencia o historia de enfermedad hepática severa siempre y cuando los valores de la función hepática no hayan regresado al valor normal.
• Presencia o historia de tumores hepáticos (benignos o malignos).
• Malignidades influenciadas por esteroides sexuales conocidas o sospechadas (por ejemplo, de los órganos genitales o senos).
• Embarazo conocido o sospechado
FERTILIDAD, EMBARAZO Y LACTANCIA:
Embarazo: ZOELY® no está indicado durante el embarazo.
Si ocurre un embarazo mientras que toma ZOELY®, la ingesta adicional debe suspenderse. La mayoría de los estudios epidemiológicos han revelado que ni hay un riesgo aumentado de defectos de nacimiento en infantes nacidos de mujeres que usaron COCs que contienen etinilestradiol previo al embarazo, ni un efecto teratogénico cuando los COCs que contienen etinilestradiol fueron tomados de forma inadvertida durante el embarazo temprano.
Los datos clínicos en un número limitado de embarazos expuestos no indican efectos adversos de ZOELY® en el feto o neonato.
En estudios en animales, la toxicidad reproductiva ha sido observada con la combinación de acetato de nomegestrol / estradiol (ver Datos de seguridad preclínicos).
Lactancia: La lactancia puede ser influenciada por los COCs ya que pueden reducir la cantidad y cambiar la composición de la leche materna. Por lo tanto, el uso de COCs no debe recomendarse hasta que la madre en lactancia haya destetado completamente su hijo y un método anticonceptivo alternativo debe ser propuesto a las mujeres que desean amamantar. Pequeñas cantidades de esteroides anticonceptivos y/o sus metabolitos pueden ser excretados con la leche, pero no existe evidencia que esto afecte adversamente la salud del infante.
Fertilidad: ZOELY® está indicado para la prevención del embarazo. Para información sobre regreso a la fertilidad, ver Propiedades farmacodinámicas
EFECTOS EN LA CAPACIDAD DE CONDUCIR Y USAR MAQUINARIA: No se han realizado estudios sobre los efectos en la capacidad de conducir y utilizar maquinarias con ZOELY®. Sin embargo, no se han observado efectos en la capacidad de conducir o utilizar maquinarias en usuarios de COCs.
EFECTOS INDESEABLES:
Resumen del perfil de seguridad: Siete estudios clínicos multicéntricos hasta de dos años de duración fueron utilizados para evaluar la seguridad de ZOELY®. En total 3490 mujeres, con edades entre los 18- 50, fueron vinculadas y completaron 35.028 ciclos.
Resumen tabulado de reacciones adversas: Reacciones adversas relacionadas posiblemente que han sido reportadas en usuarios de ZOELY® son enumeradas en la tabla a continuación.
Todas las reacciones adversas se enumeran por clasificación por sistema y órgano y frecuencia; muy común (≥ 1/10), común (≥ 1/100 a < 1/10), poco común (≥ 1/1,000 a < 1/100) y raro (≥ 1/10,000 a < 1/1,000).
|
Clasificación por sistema y órgano |
Reacción adversa en Término MedDRA1 |
|||
|
Muy Común |
Común |
Poco Común |
Raro |
|
|
Trastornos de metabolismo y nutrición |
apetito aumentado, retención de líquidos |
apetito disminuido |
||
|
Trastornos psiquiátricos |
libido disminuido, depresión/estado de ánimo deprimido, estado de ánimo alterado |
libido aumentado |
||
|
Trastornos del sistema nervioso |
dolor de cabeza, migraña |
Alteración en la atención |
||
|
Trastornos oculares |
intolerancia a lentes de contacto/ojo reseco |
|||
|
Trastornos vasculares |
sofoco |
|||
|
Trastornos gastrointestinales |
nauseas |
distensión abdominal |
boca reseca |
|
|
Trastornos de piel y tejido subcutáneo |
acne2 |
hiperhidrosis, alopecia, prurito, piel seca, seborrea |
cloasma, hipertricosis |
|
|
Trastornos musculoesqueléticos y del tejido conectivo |
Sensación de pesadez |
|||
|
Trastornos del sistema reproductivo y del seno |
sangrado por retiro anormal |
metrorragia, menorragia, dolor de seno, dolor pélvico |
hipomenorrea, inflamación de seno, galactorrea, espasmo uterino, síndrome premenstrual, masa en seno, dispareunia, resequedad vulvo-vaginal |
olor vaginal, molestia vulvovaginal |
|
Trastornos generales y condiciones del sitio de administración |
irritabilidad, edema |
hambre |
||
|
Investigaciones |
peso aumentado |
enzima hepática aumentada |
||
|
1El término MedDRA más apropiado (versión 13.1) para describir una cierta reacción adversa es enumerado. Sinónimos o condiciones relacionadas no son enumerados, pero también deben tenerse en cuenta. 2El acné fue una solicitud más que un evento reportado de forma espontánea, siendo evaluado en cada visita del estudio. |
||||
En adición a las reacciones adversas mencionadas anteriormente, se han reportado tromboembolismo venoso, tromboembolismo arterial, y reacciones de hipersensibilidad en usuarios de ZOELY® (frecuencia desconocida).
Descripción de reacciones adversas seleccionadas: Una serie de reacciones adversas han sido reportadas en mujeres que utilizan anticonceptivos orales combinados que contienen etinilestradiol, que son discutidos en más detalle en Advertencias especiales y precauciones de uso.
Las múltiples dosis de hasta cinco veces la dosis diaria de ZOELY® y las dosis únicas hasta de 40 veces la dosis diaria de acetato de nomegestrol sólo han sido utilizadas en mujeres sin preocupación de seguridad.
En base a la experiencia general con anticonceptivos orales combinados, los síntomas que pueden ocurrir son: nauseas, vómito y, en niñas jóvenes, ligero sangrado vaginal. No existen antídotos y el tratamiento adicional debe ser sintomático.
INTERACCIONES CON OTROS PRODUCTOS MEDICINALES Y OTRAS FORMAS DE INTERACCIÓN:
Interacciones:
Nota: La información para prescribir de los medicamentos concomitantes debe ser consultada para identificar interacciones potenciales.
Influencia de otros productos medicinales en ZOELY®: Las interacciones entre los anticonceptivos orales y productos medicinales inductores de enzimas pueden conllevar a la aparición de sangrado e incluso la falla del anticonceptivo.
Metabolismo hepático: Pueden ocurrir interacciones con medicamentos o productos herbales que inducen las enzimas microsomales, específicamente Enzimas del Citocromo P450 (CYP) las cuales pueden resultar en depuración aumentada, rediciendo las concentraciones plasmáticas de las hormonas sexuales y pueden disminuir la efectividad de los anticonceptivos orales combinados, incluyendo ZOELY®. Estos productos incluyen: fenitoina, fenobarbital, primidona, bosentan, carbamazepina, rifampicina, y productos medicinales o preparaciones herbales que contienen hierba de San Juan y, hasta una menor extensión, oxcarbazepina, topiramato, felbamato, y griseofulvina, y algunos inhibidores de proteasa del VIH (por ejemplo, ritonavir y nelfinavir) e inhibidores de la transcriptasa inversa no nucleósidos (por ejemplo, nevirapina y efavirenz).
La inducción enzimética puede ocurrir después de pocos días de tratamiento. La inducción enzimática máxima se observa generalmente dentro de unas pocas semanas. Después de que la terapia es descontinuada, la inducción enzimática puede durar cerca de 28 días.
Cuando se coadministran con anticonceptivos hormonales, muchas combinaciones de los inhibidores de la proteasa de VIH (por ejemplo Nelfinavir) e inhibidores de la trascriptasa reversa no nucleósidos (por ejemplo, Nevirapina), y/o combinaciones con medicamentos para el virus de la Hepatitis C (VHC) (por ejemplo Boceprevir, Telaprevir), pueden incrementar o disminuir las concentraciones plasmáticas de las progestinas, incluyendo Acetato de nomegestrol, o estrógeno. El efecto neto de estos cambios puede ser clínicamente relevante en algunos casos.
Las mujeres que reciben cualquiera de los medicamentos inductores de enzimas hepáticas o productos herbales mencionados arriba, deben ser advertidas de que la eficacia de ZOELY® se puede reducir. Un método anticonceptivo de barrera también debe ser utilizado durante la administración del medicamento inductor de enzimas hepáticas y por 28 días después de la descontinuación del mismo.
Si la administración concomitante del otro medicamento continúa más allá del final de las tabletas activas del blíster actual, se debe dar inicio al siguiente blíster inmediatamente sin el intervalo usual de tabletas placebo.
Para mujeres en terapia a largo plazo con medicamentos inductores de enzimas hepáticas, un método alternativo de anticoncepción que no se vea afectado por medicamentos inductores de enzimas, debe ser considerado.
La administración concomitante de inhibidores de CYP3A fuertes (por ejemplo Ketoconazol, Itraconazol, Claritromicina) o moderados (por ejemplo Fluconazol, Diltiazem, Eritromicina) puede incrementar las concentraciones séricas de estrógenos.
Los estudios de interacción de productos medicinales no fueron realizados con ZOELY®, pero dos estudios con rifampicina y ketoconazol, respectivamente, fueron realizados con una combinación de acetato de nomegestrol-estradiol en alta dosificación (acetato de nomegestrol 3.75 mg + estradiol 1.5 mg) en mujeres posmenopáusicas. El uso concomitante de rifampicina disminuye el AUC0-8 del acetato de nomegestrol al 95% y aumenta el AUC0-tlast del estradiol en un 25%. El uso concomitante de ketoconazol (dosis única de 200 mg) no modifica el metabolismo del estradiol mientras que se observaron aumentos en la concentración máxima (85 %) y AUC0-8 (115 %) del acetato de nomegestrol, que no fueron de relevancia clínica. Conclusiones similares se esperan en mujeres en edad fértil.
Influencia de ZOELY® en otros productos medicinales: Los anticonceptivos orales pueden afectar el metabolismo de otros productos medicinales. En consecuencia, las concentraciones plasmáticas y tisulares pueden incrementar o disminuir (por ejemplo lamotrigina).
Otras interacciones: Durante los ensayos clínicos con régimen combinado de medicamentos para el tratamiento contra el virus de la hepatitis C (VHC): ombitasvir / paritaprevir / ritonavir con y sin dasabuvir, elevaciones de ALT mayores a 5 veces el límite superior de los valores normales (ULN por sus siglas en inglés) fueron significativamente más frecuentes en mujeres que utilizan medicamentos que contienen etinilestradiol tales como CHCs. Las mujeres que usan medicamentos que contienen estrógenos distintos de etinilestradiol, tales como el estradiol tuvieron una tasa de elevación de la ALT similar a las que no reciben ningún estrógeno; Sin embargo, debido al número limitado de mujeres que toman estos otros estrógenos, debe tenerse cuidado con la co-administración del régimen de combinación de ombitasvir / paritaprevir / ritonavir con o sin dasabuvir.
Pruebas de laboratorio: El uso de COCs puede influenciar los resultados de ciertas pruebas de laboratorio, incluyendo los parámetros bioquímicos del hígado, tiroides, función adrenal y renal, niveles plasmáticos de proteínas (transportadora), por ejemplo, la globulina de unión a corticosteroides y fracciones de lípidos/lipoproteínas, parámetros de metabolismo a carbohidratos y parámetros de coagulación y fibrinólisis. Los cambios generalmente permanecen dentro del rango normal de laboratorio.
INTERACCIONES FARMACOLÓGICAS: El acetato de nomegestrol no causa in vitro inducción o inhibición notable de cualquiera de las enzimas del citocromo P450 y no tiene interacción clínicamente relevante con el transportador P-gp.
Estradiol (E2):
Absorción: El estradiol está sujeto a un efecto de primer paso sustancial después de la administración oral. La biodisponibilidad absoluta es aproximadamente 1%. No se observó un efecto clínicamente relevante de la comida en la biodisponibilidad del estradiol.
Distribución: La distribución del estradiol exógeno y endógeno es similar. Los estrógenos son distribuidos ampliamente en el cuerpo y son encontrados generalmente en concentraciones más altas en los órganos objetivo de las hormonas sexuales. El estradiol circula en el sangre unido al SHBG (37 %) y a la albumina (61 %), mientras que sólo aproximadamente el 1-2 % no se une.
Biotransformación: El estradiol exógeno oral es metabolizado extensamente. El metabolismo del estradiol exógeno y endógeno es similar. El estradiol es transformado rápidamente en el intestino y el hígado en varios metabolitos, principalmente estrona, que son conjugados subsecuentemente y sometidos a circulación entero-hepática. Existe un equilibrio dinámico entre el estradiol, estrona y sulfato de estrona debido a varias actividades enzimáticas incluyendo las estradioldehidrogenasas, sulfotransferasas y aril sulfatasas. La oxidación de la estrona y estradiol involucra enzimas del citocromo P450, principalmente CYP1A2, CYP1A2 (extra hepático), CYP3A4, CYP3A5, y CYP1B1 y CYP2C9.
Eliminación: El estradiol es eliminado rápidamente de la circulación. Debido al metabolismo y circulación enterohepática, un gran grupo circulante de sulfatos de estrógeno y glucurónidos está presente. Esto resulta en una vida media de eliminación corregida desde el inicio altamente variable del estradiol, que se calcula es de 3.6 ± 1.5 h, después de administración intravenosa.
Condiciones de estado estable: Las concentraciones séricas máximas del estradiol son de aproximadamente 90 pg/ml y son alcanzadas 6 h después de la dosificación. Las concentraciones séricas promedio son de 50 pg/ml y estos niveles de estradiol corresponden con la fase temprana y tardía del ciclo menstrual de la mujer.
Poblaciones Especiales:
Población pediátrica: La farmacocinética del acetato de nomegestrol (objetivo primario) después de una dosificación oral única de ZOELY® en adolescentes mujeres posmenárquicas sanas y sujetos adultos fue similar. La exposición al estradiol (objetivo secundario) fue similar en adolescentes versus sujetos adultos durante las primeras 24 horas, y más baja después de 24 horas. La relevancia clínica de este resultado es desconocida.
Efecto del deterioro renal: No se realizaron estudios para evaluar el efecto de la enfermedad renal en la farmacocinética del ZOELY®.
Efecto del deterioro hepático: No se realizaron estudios para evaluar el efecto de la enfermedad hepática en la farmacocinética de ZOELY®. Sin embargo, las hormonas esteroides pueden ser metabolizadas pobremente en mujeres con función hepática deteriorada.
Grupos étnicos: No se realizaron estudios formales para evaluar la farmacocinética en los grupos étnicos.
DATOS DE SEGURIDAD PRECLÍNICOS: Los estudios de toxicidad de dosis repetidas con estradiol, acetato de nomegestrol o de combinación han indicado efectos estrogénicos y gestagénicos. Los estudios de toxicidad reproductiva realizados con la combinación han demostrado fetotoxicidad que es consistente con la exposición al estradiol.
Los estudios de genotoxicidad y carcinogenicidad no fueron realizados con la combinación. El acetato de nomegestrol no es genotóxico.
Sin embargo, se debe tener en cuenta que los esteroides sexuales pueden promover el crecimiento de ciertos tejidos y tumores dependientes de hormonas.
ADVERTENCIAS ESPECIALES Y PRECAUCIONES DE USO ADVERTENCIAS: Si cualquiera de las condiciones/factores de riesgo mencionadas a continuación se presenta, los beneficios del uso de ZOELY® deben ser sopesados frente a los posibles riesgos para cada mujer individual y discutidos con la mujer antes que ella decida comenzar el uso de ZOELY®. En caso de empeoramiento, exacerbación o primera aparición de cualquiera de estas condiciones o factores de riesgo, la mujer debe ponerse en contacto con su médico. El médico debe decidir si el uso de ZOELY® debe ser descontinuado. Todos los datos presentados a continuación se basan en los datos epidemiológicos obtenidos con los CHCs que contienen etinilestradiol. ZOELY® contiene 17ß-estradiol. Debido a que aún no hay datos epidemiológicos disponibles con COCs que contienen 17ß-estradiol, las advertencias son consideradas aplicables al uso de ZOELY®.
Trastornos Circulatorios: Los siguientes datos se basan en los datos epidemiológicos obtenidos con los CHCs que contienen etinilestradiol. ZOELY® contiene 17ß-estradiol. Debido a que aún no hay datos epidemiológicos disponibles con COCs que contienen 17ß-estradiol, las advertencias son consideradas aplicables al uso de ZOELY®.
• El uso de CHCs tiene un riesgo aumentado de tromboembolismo venoso (TEV) comparado con el no uso. El riesgo excesivo de TEV es más alto durante el primer año que una mujer utiliza un CHC. El riesgo se incrementa también después de inicialmente empezar un CHC o reiniciar el mismo o diferente CHC después de un receso en el uso de 4 semanas o más.
• Estudios epidemiológicos han demostrado que la incidencia de TEV en mujeres sin factores de riesgo conocidos para TEV que utilizan un CHC de dosis baja de estrógeno (<50 µg de etinilestradiol) varía de aproximadamente 3 a 12 casos por cada 10.000 mujeres al año. Esto se compara con 1 a 5 casos por cada 10.000 mujeres por año para no usuarias y 5 a 20 casos por cada 10.000 mujeres al año en mujeres embarazadas. El TEV es fatal en 1-2 % de los casos.
• La figura a continuación muestra el riesgo de desarrollar un TEV para mujeres que no están embarazadas y no usan CHCs, para mujeres que usan CHCs, para mujeres embarazadas y para mujeres en período postparto. Para establecer el riesgo de desarrollar un TEV en perspectiva: Si 10.000 mujeres que no están embarazadas y no usan CHCs son seguidas durante un año, entre 1 y 5 de estas mujeres desarrollarán TEV.
Probabilidad de desarrollar un TEV
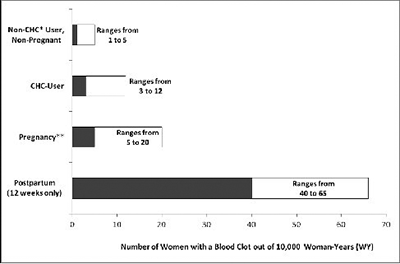
* CHC=Anticonceptivos hormonales combinados.
** Los datos de embarazo según la duración actual del embarazo en los estudios de referencia. Con base en un modelo de suposición que la duración del embarazo es nueve meses, la tasa es 7 a 27 por 10.000 WY.
• Se desconoce la forma como ZOELY® influencia el riesgo comparado con otros CHCs.
• Los estudios epidemiológicos también han asociado el uso de CHCs con un riesgo aumentado de tromboembolismo arterial (infarto de miocardio, ataque transitorio isquémico).
• Se ha reportado una trombosis extremadamente rara que ocurre en otros vasos sanguíneos, por ejemplo, venas hepáticas, mesentéricas, renales, cerebrales o retínales, en usuarias de CHC.
• Síntomas de trombosis venosa o arterial o de un accidente cerebrovascular puede incluir: dolor y/o inflamación de pierna unilateral inusual; dolor severo y repentino en el pecho, ya sea que se irradie o no al brazo izquierdo; dificultad respiratoria repentina; inicio de tos repentina; cualquier dolor de cabeza inusual prolongado y severo; pérdida de la visión parcial o total repentina; diplopía; problemas de dicción o afasia; vértigo; colapso con o sin convulsión focal; debilidad o entumecimiento marcado repentino que afecta un lado o una parte del cuerpo; alteraciones motoras; abdomen ‘agudo’.
• El riesgo de eventos tromboembólicos venosos aumenta con:
– La edad;
– Una historia familiar positiva (es decir, un evento de tromboembolismo venoso alguna vez en un hermano o padre en una edad relativamente temprana). Si se sospecha una predisposición hereditaria, la mujer debe ser remitida a un especialista para consulta antes de decidir sobre el uso de cualquier anticonceptivo hormonal;
– Inmovilización prolongada, cirugía mayor, cualquier cirugía en las piernas, o trauma mayor. En estas situaciones, es recomendable descontinuar el uso (en el caso de una cirugía electiva al menos cuatro semanas de anterioridad) y no reanudarlo hasta dos semanas después de completar la removilización. El tratamiento antitrombótico debe ser considerado si el COC no ha sido descontinuado con antelación. Ver Contraindicaciones.
– Obesidad (índice de masa corporal por encima de 30 Kg/m2).
• No existe consenso sobre el posible papel de las venas varicosas y la tromboflebitis superficial en el inicio de la trombosis venosa.
• El riesgo de complicaciones tromboembólicas arteriales o de un accidente cerebrovascular aumenta con:
– La edad:
– Fumar (fumar mucho y a una mayor edad incrementa aún más el riesgo, especialmente en mujeres mayores de 35 años de edad. A las mujeres mayores de 35 años se les debe recomendar fuertemente que no fumen si desean utilizar un COC);
– Dislipoproteinemia;
– Obesidad (índice de masa corporal por encima de 30 Kg/m2);
– Hipertensión;
– Migraña;
– Enfermedad cardiaca valvular;
– Fibrilación auricular;
– Una historia familiar positiva (trombosis arterial alguna vez en un hermano o pariente en una edad relativamente temprana). Si se sospecha una predisposición hereditaria, la mujer debe ser remitida a un especialista para consulta antes de decidir sobre el uso de cualquier anticonceptivo hormonal.
• Otras condiciones médicas, que han sido asociadas con eventos circulatorios, incluyendo diabetes mellitus, lupus eritematoso sistémico, síndrome urémico hemolítico, enfermedad intestinal inflamatoria crónica (por ejemplo, enfermedad de Chron o colitis ulcerativa) y anemia depranocítica.
• El riesgo aumentado de tromboembolismo en el puerperio debe ser considerado (para información sobre ‘Embarazo y lactancia’ vea Fertilidad, embarazo y lactancia).
• Un aumento en la frecuencia o severidad de la migraña durante el uso del COC (que puede ser prodrómico de un evento cerebrovascular) puede ser una razón para la descontinuación inmediata del uso de ZOELY®.
A las mujeres que utilizan COCs se les debe señalar específicamente que contacten a su médico en caso de posibles síntomas de trombosis. En caso de trombosis sospechada o confirmada, el uso del COC debe ser descontinuado. Un anticonceptivo adecuado debe ser iniciado debido a la teratogenicidad de la terapia anticoagulante (cumarinas).
Tumores: Todos los datos presentados a continuación se basan en los datos epidemiológicos obtenidos con los COCs que contienen etinilestradiol. ZOELY® contiene 17ß-estradiol. Debido a que aún no hay datos epidemiológicos disponibles con COCs que contienen 17ß-estradiol, las advertencias son consideradas aplicables al uso de ZOELY®.
• El factor de riesgo más importante para el cáncer cervical es la infección por el virus del papiloma humano (VPH). Los estudios epidemiológicos han indicado que el uso a largo plazo de los COCs que contienen etinilestradiol contribuyen a este riesgo aumentado, pero continúa siendo una incertidumbre sobre la extensión a la cual este hallazgo es atribuible a los efectos de confusión, como tamizaje cervical aumentado y diferencia en el comportamiento sexual que incluye el uso de anticonceptivos de barrera, o una asociación causal.
• Con el uso de un COC de dosis más alta (50 µg de etinilestradiol), el riesgo de cáncer de endometrio y ovario es reducido. Si esto aplica a los COCs que contienen 17ß-estradiol está aún por confirmarse.
• Un meta-análisis de 54 estudios epidemiológicos reportó que existe un riesgo relativo ligeramente aumentado (RR = 1.24) de que se diagnostique cáncer de seno en mujeres que utilizan actualmente COCs que contengan etinilestradiol. El riesgo excesivo desaparece gradualmente durante el transcurso de los 10 años después de la cesación del uso de COC. Debido a que el cáncer de seno es raro en mujeres menores a 40 años de edad, el número excesivo de diagnósticos de cáncer de seno en las usuarias COC actuales o recientes es pequeño en relación con el riesgo general de cáncer de seno. Los cánceres de seno diagnosticados en usuarias tienden a ser menos avanzados clínicamente que los cánceres en usuarias que nunca los han usado. El patrón observado de riesgo aumentado puede deberse a un diagnóstico previo de cáncer de seno en usuarias de COC, los efectos biológicos de los COCs o una combinación de ambos.
• En casos raros, tumores hepáticos benignos, e incluso aún más raro, tumores hepáticos malignos han sido reportados en usuarias de COCs. En casos aislados, estos tumores han conducido a hemorragias intraabdominales que amenazan la vida.
Por lo tanto, un tumor hepático debe ser considerado en el diagnóstico diferencial cuando dolor abdominal superior severo, agrandamiento del hígado o signos de hemorragia intraabdominal ocurren en mujeres que toman COCs.
Hepatitis C: Durante los ensayos clínicos con régimen combinado de medicamentos para el tratamiento contra el virus de la hepatitis C (VHC): ombitasvir / paritaprevir / ritonavir con y sin dasabuvir, elevaciones de ALT mayores a 5 veces el límite superior de los valores normales (ULN por sus siglas en inglés) fueron significativamente más frecuentes en mujeres que utilizan medicamentos que contienen etinilestradiol tales como CHCs. Las mujeres que usan medicamentos que contienen estrógenos distintos de etinilestradiol, tales como el estradiol tuvieron una tasa de elevación de la ALT similar a las que no reciben ningún estrógeno; Sin embargo, debido al número limitado de mujeres que toman estos otros estrógenos, debe tenerse cuidado con la co-administración del régimen de combinación de ombitasvir / paritaprevir / ritonavir con o sin dasabuvir. Ver Interacciones con otros productos medicinales y otras formas de interacción.
Otras condiciones: Todos los datos presentados a continuación se basan en los datos epidemiológicos obtenidos con los COCs que contienen etinilestradiol. ZOELY® contiene 17ß-estradiol. Debido a que aún no hay datos epidemiológicos disponibles con COCs que contienen 17ß-estradiol, las advertencias son consideradas aplicables al uso de ZOELY®.
• Mujeres con hipertrigliceridemia, o un historial de esta enfermedad, puede estar en riesgo aumentado de pancreatitis cuando se utilizan COCs.
• Aunque pequeños aumentos en la presión sanguínea han sido reportados en muchas mujeres que toman COCs, aumentos clínicamente relevantes son raros. Una relación entre el uso de un COC y la hipertensión clínica no ha sido establecida. Sin embargo, si una hipertensión clínicamente significativa sostenida se desarrolla durante el uso de un COC entonces es prudente que el médico suspenda la ingesta de las tabletas y trate la hipertensión. Donde es considerado apropiado, el uso de COC puede ser reanudado si los valores de normotensión pueden ser alcanzados con terapia antihipertensiva.
En siete estudios clínicos multicéntricos de hasta dos años de duración, ningún cambio clínicamente relevante en la presión sanguínea fue observado con ZOELY®.
• Las siguientes condiciones han sido reportadas que ocurren o se deterioran con el embarazo y uso de COC, pero la evidencia de una asociación con el uso del COC no es concluyente: ictericia y/o prurito relacionado con colestasis; formación de cálculos biliares; porfiria; lupus eritematoso sistémico; síndrome urémico hemolítico; corea de Sydenham; herpes gestacional; pérdida de audición relacionada con otoesclerosis;
• En mujeres con angioedema hereditario, los estrógenos exógenos pueden inducir o exacerbar los síntomas de angioedema.
• Alteraciones agudas o crónicas de la función hepática pueden necesitar la descontinuación del uso del COC hasta que los marcadores de la función hepática regresen a lo normal. La recurrencia de ictericia colestática que ocurrió primero durante el embarazo o uso previo de esteroides sexuales requiere la descontinuación de los COCs.
• Aunque los COCs pueden tener un efecto en la resistencia a la insulina periférica e intolerancia a la glucosa, no existe evidencia de la necesidad de alterar el régimen terapéutico en diabéticos que utilice un COC en dosis bajas (que contienen < 0.05 mg de etinilestradiol). Sin embargo, las mujeres diabéticas deben ser observadas cuidadosamente mientras que toman un COC especialmente en los primeros meses de uso. Se demostró que ZOELY® no tiene efecto en la resistencia a la insulina periférica e tolerancia a la glucosa en mujeres sanas (ver Propiedades farmacodinámicas).
• Enfermedad de Crohn, colitis ulcerativa y empeoramiento de la depresión han sido asociados con el uso de COC.
• El cloasma puede ocurrir ocasionalmente, especialmente en mujeres con historia de cloasma de la gravidez. Mujeres con una tendencia al cloasma deben evitar la exposición al sol o radiación ultravioleta mientras que toman COCs.
• Pacientes con problemas hereditarios raros de intolerancia a la galactosa, deficiencia de lactosa Lapp o malabsorción glucosa-galactosa no deben tomar este producto medicinal.
Examen/Consulta Médica: Previo a la iniciación o reinstauración del uso de ZOELY®, se debe realizar una historia médica completa (incluyendo historia familiar) y descartar un embarazo. La presión sanguínea debe ser medida y si es indicado clínicamente, se debe realizar un examen físico, guiado por las contraindicaciones (ver Contraindicaciones) y advertencias (ver Advertencias especiales y precauciones de uso). También se debe instruir a las mujeres de leer cuidadosamente el folleto de usuario y adherirse a las recomendaciones proporcionadas. La frecuencia y naturaleza de los controles periódicos posteriores se deben basar en los criterios de práctica establecidos y adaptarlos a cada mujer.
Se les debe informar a las mujeres que los anticonceptivos orales no protegen frente a la infección por VIH (SIDA) y otras enfermedades de transmisión sexual.
Eficacia reducida: La eficacia de los COCs puede reducirse en el caso de, por ejemplo, tabletas omitidas (ver Posología y método de administración), alteraciones gastrointestinales durante el consumo de productos medicinales concomitantes que disminuyen las concentraciones plasmáticas de Acetato de nomegestrol (ver Interacciones con otros productos medicinales y otras formas de interacción).
Control del ciclo: Con todos los COCs, la aparición de sangrado o manchado puede ocurrir, especialmente durante los primeros meses de uso. Por lo tanto, la evaluación de cualquier aparición de sangrado o manchado es significativo únicamente después de un intervalo de adaptación de aproximadamente 3 ciclos. El porcentaje de mujeres que utilizan ZOELY® que experimentan sangrado intracíclico después de este periodo de adaptación varió de 15-20 %.
Si las irregularidades de sangrado persisten u ocurren después de ciclos previamente regulares, entonces causas no hormonales deben ser consideradas y medidas de diagnóstico adecuadas están indicadas para excluir una malignidad o embarazo. Estos pueden incluir curetaje.
La duración del sangrado por retiro en mujeres que utilizan ZOELY® es en promedio 3- 4 días. Las usuarias de ZOELY® también pueden no tener su sangrado por retiro aunque no estén embarazadas. Durante estudios clínicos, la ausencia de sangrado por retiro varió de 18 % a 32 % (durante ciclos 1-12). En dichos casos, la ausencia de sangrado por retiro no estuvo asociada con una ocurrencia más alta de aparición de sangrado/manchado en ciclos posteriores. El 4.6 % de las mujeres experimentaron ausencia de sangrado por retiro en cada uno de los tres primeros ciclos de uso. Dentro de este subgrupo, el porcentaje de mujeres que experimentaron ausencia de sangrado por retiro en ciclos posteriores fue alto, que variaron de 76% a 87%. Del 28% de las mujeres que experimentaron ausencia de sangrado por retiro en al menos un ciclo (durante ciclos 2, 3 o 4), el 51% a 62% de estas mujeres también experimentaron ausencia de sangrado por retiro en ciclos posteriores.
Si la ausencia de sangrado por retiro ocurre y ZOELY® ha sido tomado de acuerdo con las instrucciones como se describe en la sección 4.2, es poco probable que la mujer esté embarazada. Si ZOELY® no ha sido tomado como se indica o si no se tienen dos sangrados de retiro consecutivos, el embarazo debe ser descartado antes que se continúe el ZOELY®.
Población pediátrica: Se desconoce si la cantidad de estradiol en ZOELY® es suficiente para mantener los niveles adecuados de estradiol en adolescentes, especialmente para la acumulación de masa ósea (verPropiedades farmacocinéticas).
POSOLOGÍA Y MÉTODO DE ADMINISTRACIÓN:
Posología: Una tableta debe ser tomada diariamente durante 28 días consecutivos. Cada empaque comienza con 24 tabletas activas blancas, seguido por 4 tabletas placebo amarillas. Un empaque subsiguiente es comenzado inmediatamente después de terminar el anterior, sin un intervalo en la ingesta diaria de la tableta y sin tener en cuenta la presencia o ausencia del sangrado por retiro. El sangrado por retiro comienza usualmente 2-3 días después de tomar la última tableta blanca y puede que no haya terminado antes que se comience el siguiente empaque. Ver Control del ciclo en Advertencias especiales y precauciones de uso.
Poblaciones especiales:
Deterioro renal: Aunque datos en pacientes con deterioro renal no se encuentran disponibles aún, es poco probable que el deterioro renal afecte la eliminación del acetato de nomegestrol y estradiol.
Deterioro hepático: No se han realizado estudios clínicos en pacientes con insuficiencia hepática. Debido a que el metabolismo de las hormonas esteroides podría estar alterado en pacientes con enfermedad hepática severa, el uso de ZOELY® en estas mujeres no está indicado siempre y cuando los valores de la función hepática no hayan regresado a los valores normales (ver Contraindicaciones).
Método de administración: Uso oral.
Cómo tomar ZOELY®: Las tabletas deben tomarse todos los días aproximadamente a la misma hora sin tener en cuenta las comidas. Las tabletas deben ser tomadas con algo de líquido según necesidad, y en el orden indicado en el blíster. Adhesivos marcados con los 7 días de la semana son proporcionados. Las mujeres deben elegir el adhesivo que corresponda al día en que ella comienza a tomar las tabletas y colocarlo en el blíster.
Cómo comenzar ZOELY®:
Sin uso de anticonceptivo hormonal anterior (en el último mes): La toma de tabletas tiene que comenzar en el día 1 del ciclo menstrual de la mujer (es decir, el primer día del sangrado menstrual). Cuando lo hace, ninguna medida anticonceptiva adicional es necesaria. El inicio en los días 2-5 es permitido, pero durante el primer paquete de píldoras, un método de barrera debe ser utilizado hasta que la mujer haya completado 7 días ininterrumpidos de haber tomado la tableta blanca (ver Figura 1).
Cambio de un anticonceptivo oral combinado (anticonceptivo oral combinado (COC por sus siglas en inglés), anillo vaginal o parche transdérmico): La mujer debe comenzar con ZOELY® preferiblemente al día siguiente a la última tableta activa (la última tableta que contiene las sustancias activas) de su COC previo, pero por tarde al día siguiente del intervalo libre de tableta usual o tableta placebo de su COC previo. En caso que un anillo vaginal o parche transdérmico haya sido utilizado, la mujer debe comenzar a utilizar ZOELY® preferiblemente en el día de remoción, pero por tarde cuando la siguiente aplicación debía ser realizada.
Cambio de un método de progestágeno único (minipíldora, implante, inyectable) o de un Sistema Intra Uterino (SIU) medicado: La mujer puede cambiar en cualquier día la minipíldora y ZOELY® puede ser iniciado al día siguiente. Un implante o SIU puede ser retirado en cualquier día, y ZOELY® debe comenzarse el día de su remoción. Cuando se cambia de un inyectable, ZOELY® debe ser iniciado en el día en el que la siguiente inyección se hubiera tenido que aplicar.
En todos estos casos, se le debe recomendar a la mujer que utilice adicionalmente un método de barrera hasta que ella haya completado los 7 días de estar tomando ininterrumpidamente la tableta blanca.
Después de un aborto en el primer trimestre: La mujer puede comenzar de inmediato. Cuando lo haga, medidas anticonceptivas adicionales no son necesarias.
Después del parto o aborto en el segundo trimestre: A las mujeres se les debe recomendar que inicien entre el día 21 y 28 después del parto o aborto en el segundo trimestre. Cuando inicia posteriormente, se le debe recomendar a la mujer que use adicionalmente un método de barrera hasta que haya completado los 7 días de estar tomando ininterrumpidamente la tableta activa blanca.
Sin embargo, si ya se han tenido relaciones sexuales, el embarazo debe ser descartado antes del inicio real del uso del COC o la mujer tiene que esperar su primer periodo menstrual.
Para mujeres en lactancia, vea Fertilidad, embarazo y lactancia.
El riesgo aumentado de TEV durante el período postparto debe ser considerado cuando se reinicie ZOELY®. (Ver Advertencias especiales y precauciones de uso).
Manejo de tabletas omitidas:
Las siguientes recomendaciones se refieren solamente a las tabletas blancas activas omitidas: Si la usuaria está menos de 24 horas tarde en tomar cualquier tableta activa, la protección anticonceptiva no se reduce. La mujer debe tomar la tableta tan pronto se acuerde y tomar las siguientes tabletas en la hora usual.
Si ella está 24 o más horas tarde en tomar cualquier tableta, la protección anticonceptiva puede reducirse. El manejo de las tabletas omitidas puede guiarse por las siguientes dos reglas básicas:
• Se requiere ‘tomar la tableta activa blanca’ 7 días ininterrumpidos para obtener la supresión adecuada del eje hipotálamo-hipófisis-ovario.
• Entre más ‘tabletas activas blancas’ se omitan y más cerca estén las tabletas omitidas a las 4 tabletas placebo amarillas, más alto el riesgo de embarazo.
Figura 1
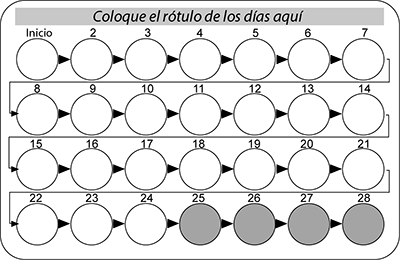
Día 1 - 7: La usuaria debe tomar la última tableta tan pronto como se acuerde incluso si significa tomar dos tabletas al mismo tiempo. Entonces ella continúa tomando las tabletas a su hora usual. Adicionalmente, un método de barrera como un preservativo debe ser utilizado hasta que haya completado 7 días de estar tomando la tableta blanca de forma ininterrumpida. Si se tuvieron relaciones sexuales en los 7 días anteriores, la posibilidad de un embarazo debe ser considerado.
Día 8 - 17: La usuaria debe tomar la última tableta tan pronto como se acuerde incluso si significa tomar dos tabletas al mismo tiempo. Entonces ella continúa tomando las tabletas a su hora usual. Siempre que la usuaria haya tomado sus tabletas correctamente en los 7 días anteriores a la primera tableta omitida, no hay necesidad de usar precauciones anticonceptivas adicionales. Sin embargo, si la usuaria ha omitido más de 1 tableta, ella debe tomar precauciones adicionales hasta que haya completado 7 días de estar tomando la tableta blanca de forma ininterrumpida.
Día 18 - 24: El riesgo de una confiabilidad reducida es inminente debido a que la fase de tableta placebo amarilla está próximo. Sin embargo, al ajustar el programa de ingesta de tableta, la protección anticonceptiva reducida aún puede prevenirse. Al adherirse a cualquiera de las siguientes dos opciones no hay por tanto necesidad de usar precaución anticonceptiva adicional, siempre que en los 7 días anteriores de la primera tableta omitida la mujer haya tomado todas las tabletas correctamente. Si este no es el caso, ella debe seguir la primera de estas dos opciones y usar precauciones adicionales por los siguientes 7 días también.
1. La usuaria debe tomar la última tableta omitida tan pronto como ella lo recuerde, incluso si esto significa tomar dos tabletas al mismo tiempo. Ella entonces continuará tomando sus tabletas a su hora usual, hasta que las tabletas activas se hayan agotado. Las 4 tabletas placebo de la última fila deben ser desechadas. El siguiente blíster debe ser iniciado de inmediato. Es poco probable que la usuaria tenga un sangrado por retiro hasta que tome las tabletas activas del segundo empaque, pero puede experimentar la aparición de sangrado o manchado en los días que toma las tabletas blancas. Es poco probable que la usuaria tenga un sangrado por retiro hasta el final de las tabletas activas del segundo blíster, pero ella puede experimentar manchado o sangrado en los días de toma del medicamento.
2. La mujer debe también considerar descontinuar la toma de tabletas activas del actual blíster. Ella debe entonces tomar tabletas placebo a partir de la última fila por un máximo 3 días para que sí el número total de tabletas placebo mas tabletas activas blancas omitidas no sea más de 4, y subsecuentemente continúe con el siguiente blíster.
Si la usuaria omitió tabletas y subsecuentemente no tuvo sangrado por retiro en la fase de tabletas placebo, la posibilidad de un embarazo debe ser considerada.
Por favor tenga en cuenta: Si la usuaria no está segura sobre el número o color de tabletas omitidas y qué recomendación seguir, un método de barrera debe ser utilizado hasta que ella haya completado 7 días de estar tomando la tableta activa blanca de forma ininterrumpida.
Tabletas placebo amarillas omitidas: La protección anticonceptiva no se reduce. Las tabletas amarillas en la última fila (4a) del blíster pueden ser ignoradas. Sin embargo, las tabletas omitidas deben ser desechadas para evitar que se prolongue de forma no intencional la fase de tabletas placebo.
Recomendación en caso de alteraciones gastrointestinales: En caso de una alteración gastrointestinal severa (por ejemplo, vómito o diarrea), la absorción de las sustancias activas puede no ser completa y medidas anticonceptivas adicionales deben tomarse.
Si el vómito ocurre dentro de 3-4 horas después de tomar la tableta blanca, la tableta debe ser considerada como omitida y una nueva tableta debe ser tomada tan pronto como sea posible. La nueva tableta debe ser tomada dentro de las 24 horas del tiempo usual de la toma de la tableta si es posible. La siguiente tableta entonces debe ser tomada a la hora usual. Si han pasado 24 o más horas desde la última tableta omitida, la advertencia relacionada a tabletas omitidas es aplicable como se indicó en la sección (Posología y método de administración “Manejo de tabletas omitidas).
Si la mujer no quiere cambiar su programa de ingesta de tabletas normal, ella tiene que tomar una tableta blanca adicional de otro empaque.
Cómo cambiar periodos o cómo demorar un periodo: Para demorar un periodo, la mujer debe continuar con otro empaque blíster de ZOELY® sin tomar las tabletas de placebo amarillas de su empaque actual. La extensión puede realizarse por el tiempo que se desee hasta el final de las tabletas activas blancas en el segundo empaque. La ingesta regular de ZOELY® es entonces reanudada después que las tabletas placebo amarillas hayan sido tomadas del segundo empaque. Durante la extensión, la mujer puede experimentar la aparición de sangrado o manchado.
Para cambiar sus periodos a otro día de la semana al que está acostumbrada la mujer con su esquema actual, se le puede recomendar que acorte su próxima fase de tabletas placebo amarillas con un máximo de 4 días. Entre más corto el intervalo, más alto el riesgo que ella no tenga el sangrado por retiro y pueda experimentar la aparición de sangrado o manchado durante el siguiente empaque (al igual que cuando se retarda un periodo).
PRESENTACIÓN: ZOELY® Tabletas recubiertas. Caja por 1 blíster por 28 tabletas recubiertas. (Reg. San. INVIMA 2012M-0013193.)
Fecha de revisión del texto: Agosto de 2016 (Versión 08-2016).
LPI -MK8175A-T-082016
MERCK SHARP & DOHME
Bogotá, D.C. - Colombia