
ZOLADEX LA 10.8 MG
GOSERELINA
Implante subcutáneo
, Jeringas,10,8 mg
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA:
Acetato de goserelina (cantidad equivalente a 10.8 mg de goserelina).
INDICACIONES TERAPÉUTICAS
1. Cáncer de próstata: ZOLADEX® LA está indicado para el manejo del cáncer de próstata susceptible de manipulación hormonal.
2. Endometriosis: ZOLADEX® LA está indicado para el tratamiento de la endometriosis, lo cual incluye el alivio de los síntomas tales como el dolor, y la reducción del tamaño y del número de las lesiones del endometrio.
3. Fibromas uterinos: ZOLADEX® LA está indicado para el tratamiento de los fibromas, lo cual incluye la disminución de las lesiones, la mejoría del estado hematológico de la paciente y el alivio de síntomas tales como el dolor. Puede utilizarse como complemento de la cirugía para facilitar la técnica quirúrgica y disminuir la pérdida de sangre durante la operación.
FORMA FARMACÉUTICA: Implante en jeringa prellenada.
PARTICULARIDADES CLÍNICAS
PROPIEDADES FARMACOCINÉTICAS:
La administración de ZOLADEX® LA de acuerdo con las recomendaciones de dosificación, garantiza que se mantenga la exposición a goserelina sin acumulación clínicamente significativa. ZOLADEX® se une muy poco a las proteínas y tiene una semivida de eliminación del suero de dos a cuatro horas en sujetos cuya función renal es normal. La semivida aumenta en pacientes con insuficiencia renal. Cuando el compuesto se administra cada 12 semanas en su presentación en implante de 10,8 mg, este cambio no produce acumulación. Por lo tanto, no es necesario modificar la dosis en estos pacientes. No se observan modificaciones importantes de la farmacocinética en pacientes con insuficiencia hepática.
PROPIEDADES FARMACODINÁMICAS: ZOLADEX® (D-Ser(But)6 Azgly10 LHRH) es un análogo sintético de la hormona natural LHRH (hormona liberadora de hormona luteinizante). La administración crónica de ZOLADEX® LA provoca la inhibición de la secreción hipofisiaria de hormona luteinizante, que conduce a una disminución de las concentraciones séricas de testosterona en los varones y de las concentraciones séricas de estradiol en las mujeres. En la etapa inicial del tratamiento, como otros agonistas de la LHRH, ZOLADEX® LA podría elevar en forma pasajera las concentraciones séricas de testosterona en los varones y las concentraciones séricas de estradiol en las mujeres.
En los varones, aproximadamente 21 días después de la primera inyección del implante, las concentraciones de testosterona alcanzan valores equivalentes a los observados en la castración, y esta supresión permanece si se sigue administrando el tratamiento cada 3 meses. Si en circunstancias excepcionales no ocurre repetición de la dosis a los 3 meses, los datos indican que los niveles de castración de la testosterona se mantienen hasta por 16 semanas en la mayoría de los pacientes.
En las mujeres se observa una supresión de las concentraciones de estradiol aproximadamente 4 semanas después de la primera inyección del implante, que perdura hasta el final del periodo de tratamiento a niveles comparables con aquellos observados en las mujeres postmenopáusicas. Esta supresión del estradiol se acompaña de una respuesta en la endometriosis y los fibromas uterinos, y producirá amenorrea en la mayoría de las pacientes.
Al principio del tratamiento con ZOLADEX®, algunas mujeres pueden presentar hemorragia vaginal de duración e intensidad variables. Es probable que tal hemorragia se deba a la supresión de estrógenos, y debería cesar espontáneamente.
Durante el tratamiento con análogos de LHRH, las pacientes pueden entrar en la menopausia natural. Rara vez, algunas mujeres no reanudan sus ciclos menstruales al suspender el tratamiento.
CONTRAINDICACIONES:
Hipersensibilidad conocida al principio activo, a otros análogos de la LHRH, o a uno de los excipientes de este producto. Embarazo y lactancia (véase la sección Embarazo y lactancia).
EMBARAZO Y LACTANCIA
Embarazo: ZOLADEX® LA no debe usarse durante el embarazo ya que existe un riesgo teórico de aborto o de anormalidad fetal al usar agonistas de la LHRH durante la gestación. Las mujeres fértiles deben examinarse cuidadosamente antes del tratamiento para descartar un posible embarazo. Deben emplearse métodos anticonceptivos no hormonales durante el tratamiento hasta que se reanude la menstruación (véase también la advertencia relativa al tiempo de reaparición de la menstruación en la sección “Advertencias y precauciones”).
Lactancia: No se recomienda utilizar ZOLADEX® LA durante la lactancia.
EFECTO SOBRE LA CAPACIDAD DE CONDUCIR O UTILIZAR MÁQUINAS:
No hay indicios de que ZOLADEX® LA 10.8 mg afecte la capacidad para conducir o utilizar máquinas.
REACCIONES ADVERSAS: Las siguientes categorías de frecuencia se calcularon basándose en las reacciones adversas notificadas durante los estudios clínicos de ZOLADEX® y durante la farmacovigilancia.
|
Tabla 1. Reacciones adversas a ZOLADEX® LA, por categoría de frecuencia y por sistema/órgano |
|||
|
Categoría de frecuencia |
Sistema/órgano |
Varones |
Mujeres |
|
Muy frecuentes (=10%) |
Trastornos psiquiátricos |
Disminución de la libido a |
Disminución de la libidoa |
|
Trastornos vasculares |
Sofocos a |
Sofocos a |
|
|
Trastornos de la piel y del tejido subcutáneo |
Hiperhidrosis a |
Hiperhidrosis a, acné i |
|
|
Trastornos del aparato reproductor y de la mama |
Disfunción eréctil |
N/A |
|
|
N/A |
Sequedad vulvovaginal |
||
|
N/A |
Aumento de las mamas |
||
|
Trastornos generales y alteraciones en el lugar de administración |
(Véase frecuentes) |
Reacción en el sitio de inyección |
|
|
Frecuentes (= 1% y < 10%) |
Trastornos del metabolismo y de la nutrición |
Alteraciones de la tolerancia a la glucosa b |
N/A |
|
Trastornos psiquiátricos |
Cambio de humor |
Alteración del humor, depresión |
|
|
Trastornos del sistema nervioso |
Parestesia |
Parestesia |
|
|
Compresión de la médula espinal |
N/A |
||
|
N/A |
Dolor de cabeza |
||
|
Trastornos cardiacos |
Insuficiencia cardiaca f, infarto de miocardio f |
N/A |
|
|
Trastornos vasculares |
Presión arterial anormal c |
Presión arterial anormal c |
|
|
Trastornos de la piel y del tejido subcutáneo |
Exantema d |
Exantema d, Alopecia g |
|
|
Trastornos osteomusculares y del tejido conjuntivo |
Dolor óseo e |
N/A |
|
|
(Véase infrecuentes) |
Artralgia |
||
|
Trastornos del aparato reproductor y de la mama |
Ginecomastia |
N/A |
|
|
Trastornos generales y alteraciones en el lugar de administración |
N/A |
Flare tumoral, dolor tumoral |
|
|
Reacción en el sitio de inyección |
(Véase frecuentes) |
||
|
Exploraciones complementarias |
Disminución de la densidad ósea, aumento de peso |
Disminución de la densidad ósea, aumento de peso |
|
|
Infrecuentes (= 0.1% y < 1%) |
Trastornos del sistema inmunitario |
Hipersensibilidad al medicamento |
Hipersensibilidad al medicamento |
|
Trastornos osteomusculares y del tejido conjuntivo |
Artralgia |
(Véase frecuentes) |
|
|
Trastornos renales y urinarios |
Obstrucción ureteral |
N/A |
|
|
Trastornos del aparato reproductor y de la mama |
Sensibilidad mamaria |
N/A |
|
|
Raras (= 0.01% y < 0.1%) |
Trastornos del sistema inmunitario |
Reacción anafiláctica |
Reacción anafiláctica |
|
Trastornos del aparato reproductor y de la mama |
N/A |
Quiste ovárico |
|
|
Muy raras (< 0.01%) |
Neoplasias benignas, malignas y no especificadas (incl. quistes y pólipos) |
Tumor hipofisario |
Tumor hipofisario |
|
Trastornos endocrinos |
Hemorragia hipofisaria |
Hemorragia hipofisaria |
|
|
Trastornos psiquiátricos |
Trastorno psicótico |
Trastorno psicótico |
|
|
Desconocidas |
Neoplasias benignas, malignas y no especificadas (incl. quistes y pólipos) |
N/A |
Degeneración de fibroma uterino |
|
Trastornos de la piel y del tejido subcutáneo |
Alopecia h |
(Véase frecuentes) |
|
|
a Se trata de efectos farmacológicos que raramente requieren la suspensión del tratamiento. b Se ha observado una disminución de la tolerancia a la glucosa en varones tratados con agonistas de la LHRH, que puede manifestarse en forma de diabetes o pérdida del control glucémico en aquellos con diabetes pre-existente. c Puede manifestarse en forma de hipotensión o hipertensión, y se han observado ocasionalmente en los pacientes tratados con ZOLADEX®. Generalmente, estas alteraciones son transitorias y se resuelven durante el tratamiento con ZOLADEX® o después de la suspensión del mismo. Dichas alteraciones raramente han sido suficientes como para justificar una intervención médica, por ejemplo, la suspensión del tratamiento con ZOLADEX®. d Esta reacción suele ser leve y a menudo desaparece sin suspender el tratamiento. e Al principio del tratamiento, los pacientes con cáncer de próstata pueden mostrar un aumento temporal del dolor óseo, el cual puede tratarse en forma sintomática. f Se observó en un estudio farmaco-epidemiológico sobre agonistas de la LHRH para el tratamiento del cáncer de próstata. El riesgo parece aumentar si se asocian con antiandrógenos. g Se ha reportado pérdida del cabello en mujeres, incluyendo pacientes más jóvenes tratadas para condiciones benignas. Esto es usualmente leve pero ocasionalmente puede ser severo. h Particularmente pérdida del vello corporal, un efecto esperado de los niveles disminuidos de andrógenos. i En la mayoría de los casos, se notificó la aparición de acné durante el primer mes de tratamiento con ZOLADEX®. |
|||
INTERACCIONES CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN: No se conoce ninguna.
Dado que el tratamiento de deprivación androgénica puede prolongar el intervalo QT, el uso concomitante de ZOLADEX® con otros medicamentos que prolongan el intervalo QT o que sean capaces de inducir Torsades de Pointes debe ser cuidadosamente evaluada (ver sección Advertencias y precauciones).
DATOS PRECLÍNICOS SOBRE SEGURIDAD:
Después de la administración repetida de ZOLADEX® a largo plazo, se ha observado un aumento de la incidencia de tumores hipofisiarios benignos en ratas machos. Aunque este hallazgo es similar al que se había registrado previamente en esta especie después de la castración quirúrgica, no se ha establecido si es importante para el ser humano.
En ratones, la administración repetida de múltiplos de la dosis recomendada para el ser humano produjo alteraciones histológicas en ciertas regiones del aparato digestivo, las cuales se tradujeron en hiperplasia de los islotes pancreáticos y en una enfermedad proliferativa benigna en la región pilórica del estómago, que se registró también como una lesión espontánea en esta especie. Se desconoce la importancia clínica de estos hallazgos.
PARTICULARIDADES FARMACÉUTICAS
Lista de excipientes: Una mezcla de copolímero láctido/glicólido de alto y bajo peso molecular.
Incompatibilidades: No se conoce ninguna.
Vida útil: 3 años.
Almacenamiento: No se conserve a temperatura superior a 25°C.
Naturaleza y contenidos del envase: Jeringa aplicadora monodosis con una funda protectora, envasada con un desecante en una bolsa cerrada.
Instrucciones de uso, manipulación y desecho: Para administrar ZOLADEX® correctamente, véase el modo de empleo en la tarjeta de instrucciones.
Seguir las instrucciones del médico. Tener especial cuidado al administrar ZOLADEX® a pacientes con IMC bajo y/o quienes estén recibiendo medicación anticoagulante a dosis máxima [véase sección Advertencias y precauciones]. No se use si la bolsa está dañada. Usar el producto inmediatamente después de abrir la bolsa.
La siguiente información está dirigida únicamente a profesionales médicos o del cuidado de la salud:
ZOLADEX® se administra a través de inyección subcutánea-lea y comprenda todas las instrucciones completamente antes de administrarlo.
1. Colocar al paciente en una posición cómoda, con la parte superior del cuerpo ligeramente elevada. Preparar el sitio de inyección conforme a la política y al procedimiento local vigente.
Nota: Se debe tener precaución mientras se inyecta ZOLADEX® en la pared abdominal anterior debido a la proximidad de la arteria epigástrica inferior subyacente y sus ramas; los pacientes muy delgados pueden estar en un riesgo más elevado de lesión vascular.
2. Abrir el sobre de aluminio, sacar la jeringa y examinarla contra la luz inclinándola ligeramente. Verificar que el implante ZOLADEX® esté visible, por lo menos parcialmente (Figura 1).
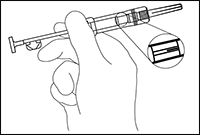
3. Desprender de la jeringa la pestaña de seguridad de plástico y desecharla (Figura 2). Retirar la cubierta protectora de la aguja. Al contrario de lo que sucede con las preparaciones inyectables líquidas, no es necesario eliminar las burbujas de aire ya que esta operación podría desplazar el implante de ZOLADEX®.
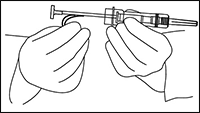
4. Sosteniendo la jeringa por su funda protectora, utilizando una técnica aseptica, pellizcar la piel del paciente e introducir la aguja en la piel con un ligero ángulo (de 30 a 45 grados). Orientando la aguja con la abertura hacia arriba, introducirla en el tejido subcutáneo de la pared abdominal anterior, debajo del nivel del ombligo, hasta que la funda protectora toque la piel del paciente (Figura 3).
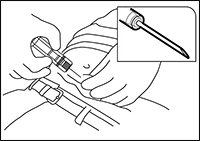
Nota: La jeringa de ZOLADEX® no se puede usar para aspiración. Si la aguja hipodérmica penetra un vaso grande, se verá sangre instantáneamente en la cámara de la jeringa. Si se penetra un vaso, retirar la aguja y controlar inmediatamente cualquier sangrado resultante, monitorear el paciente para detectar signos o síntomas de hemorragia abdominal. Después de asegurarse que el paciente esté hemodinámicamente estable, se puede inyectar otro implante de ZOLADEX® con una jeringa nueva en otro sitio. Tener especial cuidado al administrar ZOLADEX® a pacientes con un IMC bajo y/o a pacientes que estén recibiendo anticoagulación a dosis máxima.
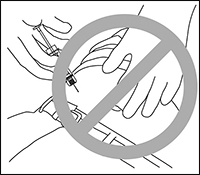
5. La aguja no debe penetrar el músculo o peritoneo. La Figura 4 muestra una forma de sostener la aguja y un ángulo de presentación incorrectos.
6. Presionar el émbolo hasta el tope para descargar el implante ZOLADEX® y activar la funda protectora. Escuchará un “clic” y sentirá que la funda protectora empieza a deslizarse automáticamente para recubrir la aguja. Si no presiona el émbolo hasta el tope, NO se activará la funda protectora.
Nota: La aguja no se retrae.
7. Sosteniendo la jeringa como muestra la Figura 5, retirar la aguja y dejar que la funda protectora siga deslizándose hasta recubrirla completamente.
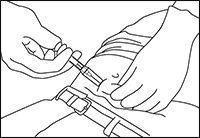
Desechar la aguja en un recipiente aprobado para instrumentos cortantes.
Nota: En el caso improbable que se requiera la remoción del implante de ZOLADEX®, este puede ser localizado por medio de ultrasonido.
ADVERTENCIAS Y PRECAUCIONES
Insuficiencia renal, uropatía obstructiva, metástasis vertebral: Úsese con precaución en pacientes con riesgo especial de desarrollar obstrucción uretral o compresión de la médula espinal.
Los pacientes deben vigilarse estrechamente durante el primer mes de tratamiento.
ZOLADEX® LA no está indicado en niños, ya que no se han establecido su seguridad y eficacia en este grupo de pacientes.
Se ha reportado lesión en el sitio de inyección con ZOLADEX®, incluyendo eventos de dolor, hematoma, hemorragia y lesión vascular. Monitoree los pacientes afectados para detectar signos o síntomas de hemorragia abdominal. En muy raros casos, el error de administración produjo lesión vascular y shock hemorrágico que requirió transfusiones sanguíneas e intervención quirúrgica. Se debe tener especial cuidado al administrar ZOLADEX® a pacientes con IMC bajo y/o quienes estén recibiendo medicación anticoagulante a dosis máxima [véase sección Dosis y vía de administración].
El tratamiento con ZOLADEX® LA debe considerarse cuidadosamente en varones que presentan un riesgo especial de desarrollar obstrucción uretral o compresión de la médula espinal, y los pacientes deben vigilarse estrechamente durante el primer mes de tratamiento. En caso de compresión de la médula espinal o insuficiencia renal debida a obstrucción uretral, o si se desarrollan estas complicaciones, debe administrarse el tratamiento convencional correspondiente.
En las mujeres, ZOLADEX® LA solo está indicado para el tratamiento de la endometriosis y los fibromas. Si las pacientes necesitan recibir la goserelina para tratar otros padecimientos, consulte la información para prescribir de ZOLADEX® 3,6 mg.
El uso de agonistas de la LHRH en mujeres puede causar una disminución de la densidad mineral ósea. En mujeres, los datos actualmente disponibles sugieren que, en la mayoría, ocurre recuperación de la pérdida ósea al suspender el tratamiento. En las pacientes que reciben ZOLADEX® 3,6 mg para el tratamiento de la endometriosis, se ha demostrado que la adición de una hormonoterapia sustitutiva (administración diaria de un agente estrogénico y un agente progestogénico) limita la disminución de la densidad mineral ósea y reduce los síntomas vasomotores. No se tiene experiencia sobre el uso de la hormonoterapia sustitutiva en las mujeres tratadas con ZOLADEX® LA. En los hombres, los datos preliminares sugieren que el uso de un bisfosfonato en combinación con un agonista LHRH puede reducir la pérdida mineral.
Se ha observado una reducción en la tolerancia a la glucosa en hombres que están recibiendo agonistas LHRH. Esto puede manifestarse como diabetes o pérdida del control glicémico en aquellos con diabetes mellitus preexistente. Por consiguiente, se debe tener en cuenta el monitoreo de la glicemia.
Después de la suspensión del tratamiento con ZOLADEX® LA, en algunas pacientes puede prolongarse el tiempo hasta la reaparición de la menstruación.
La utilización de ZOLADEX® puede aumentar la resistencia del cuello uterino, por lo que debe tenerse cuidado al dilatarlo.
Actualmente no hay información clínica disponible sobre los efectos del tratamiento de enfermedades ginecológicas benignas con ZOLADEX® durante periodos mayores de seis meses.
La terapia de deprivación androgénica puede prolongar el intervalo QT, aunque no hay una relación causal establecida con ZOLADEX®. En pacientes con antecedentes o con factores de riesgo de prolongación del intervalo QT y en pacientes que reciban concomitantemente medicamentos que puedan prolongar el intervalo QT (ver sección Interacciones con otros medicamentos y otras formas de interacción), el médico debe evaluar la relación riesgo beneficio incluyendo el potencial de desarrollo de Torsades de Pointes previo a iniciar ZOLADEX®.
Se ha reportado riesgo de infarto de miocardio en hombres, asociado con el uso de hormona liberadora de gonadotropina GnRH junto con terapia antiandrogénica. El riesgo debe ser cuidadosamente monitoreado en conjunto con los factores de riesgo cardiovascular cuando se determine un régimen de tratamiento para pacientes con cáncer de próstata.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Se debe tener precaución al insertar ZOLADEX® LA dentro de la pared abdominal anterior debido a la proximidad de la arteria epigástrica inferior subyacente y sus ramas.
Se debe tener especial cuidado al administrar ZOLADEX® LA a pacientes con IMC bajo y/o quienes estén recibiendo medicación anticoagulante a dosis máxima [véase sección Advertencias y precauciones].
Para administrar ZOLADEX® correctamente, véase el modo de empleo en la tarjeta de instrucciones (ver sección Instrucciones de uso, manipulación y desecho).
Hombres adultos: Un implante de 10,8 mg de ZOLADEX® LA por inyección subcutánea en la pared abdominal anterior, cada 3 meses (véase la sección “Propiedades farmacodinámicas”).
Mujeres adultas: Un implante de ZOLADEX® LA por inyección subcutánea en la pared abdominal anterior, cada 12 semanas.
Pacientes de edad avanzada: No es necesario ajustar la dosis en los pacientes de edad avanzada.
Insuficiencia renal: No es necesario ajustar la dosis en los pacientes con insuficiencia renal.
Insuficiencia hepática: No es necesario ajustar la dosis en los pacientes con insuficiencia hepática.
Niños: ZOLADEX® LA no está indicado en niños.
SOBREDOSIS:
La experiencia es limitada con respecto a sobredosis en el ser humano. En los casos en que, por accidente, se volvió a administrar ZOLADEX® prematuramente o con una dosis mayor, no se observaron efectos adversos clínicos importantes. Los ensayos en animales sugieren que, con dosis altas de ZOLADEX®, no se manifestarían otras reacciones aparte de los efectos terapéuticos buscados sobre las concentraciones de hormonas sexuales y sobre el aparato reproductor. En caso de sobredosis, ésta debe manejarse en forma sintomática.
PRESENTACIÓN: ZOLADEX® LA 10.8 mg. Jeringa prellenada. (Reg. San. INVIMA 2006M-005459-R1).
IPP Clave 2-2016. Fecha de preparación de la versión: Marzo de 2016.
Fuente: Doc ID-002756402 Versión 6.0
Texto basado en: CDS 13 Mayo de 2015
Mayor información Departamento Médico de
AstraZeneca Colombia S.A.S
Bogotá, D.C., Colombia