
3-A OFTENO 0.1%
DICLOFENACO SÓDICO
Solución oftálmica
Caja, Frasco gotero, solución oftálmica, 5 Mililitros
Caja, Frasco gotero, solución oftálmica, 2 Mililitros
COMPOSICIÓN:
Cada ml contiene:
Diclofenaco sódico 1.0 mg (0.1%)
Vehículo csp 1.0 mL
INDICACIONES Y USO:
3-A OFTENO 0.1% Solución oftálmica está indicado para el tratamiento de la inflamación postoperatoria en pacientes que han sido sometidos a extracción de catarata y para el alivio temporal del dolor y fotofobia en pacientes sometidos a cirugía refractiva de la córnea.
CONTRAINDICACIONES:
3-A OFTENO 0.1% Solución oftálmica está contraindicado en pacientes que son hipersensibles a cualquier componente de la medicación.
REACCIONES ADVERSAS:
Ocular: Ardor y escozor transitorio se reportaron en aproximadamente el 15% de los pacientes entre los estudios con el uso de diclofenaco sódico solución oftálmica 0.1%. En estudios de cirugía de cataratas, la queratitis se reportó en 28% de los pacientes que recibieron diclofenaco sódico solución oftálmica 0.1%, aunque en muchos de estos casos fue la queratitis se observó inicialmente antes de la iniciación del tratamiento. Se reportó elevada presión intraocular después de la cirugía de cataratas en aproximadamente el 15% de los pacientes sometidos a cirugía de cataratas.
Reportaron lagrimeo aproximadamente el 30% de los estudios de casos sometidos a cirugía refractiva incisional. Las siguientes reacciones adversas se reportaron en aproximadamente 10% o menos de los pacientes: visión anormal, la PIO elevada agudo, visión borrosa, conjuntivitis, depósitos corneales, edema corneal, opacidad de la córnea, lesiones en la córnea, secreción, hinchazón de los párpados, dolor de ojo, inyección (enrojecimiento), iritis, irritación, picazón, trastorno de lagrimeo, y alergia ocular.
Sistémico: Las siguientes reacciones adversas se reportaron en 3% o menos de los pacientes: dolor abdominal, astenia, escalofríos, mareos, edema facial, fiebre, dolor de cabeza, insomnio, náuseas, dolor, rinitis, infección viral y vómitos.
Práctica clínica: Las siguientes reacciones han sido identificadas durante el uso posterior a la comercialización de la solución tópica oftálmica de diclofenaco sódico 0,1% en la práctica clínica. Debido a que son reportados voluntariamente por una población de tamaño desconocido, las estimaciones de la frecuencia no se puede realizar. Las reacciones, que han sido elegidas las cuales han sido elegidas para su inclusión ya sea debido a su gravedad, frecuencia de los reportes, es posible la conexión causal con la solución tópica oftálmica de diclofenaco sódico 0,1%, o una combinación de estos factores, incluyen la erosión corneal, infiltrados corneales, perforación corneal, adelgazamiento de la córnea, ulceración de la córnea, y la ruptura del epitelio (ver Precauciones, general).
ADVERTENCIAS:
La estabilidad de refracción de los pacientes sometidos a procedimientos refractivos corneales y tratados con diclofenaco sódico solución oftálmica 0.1% no ha sido establecido.
Los pacientes deben ser monitoreados durante un año después de su uso en este ajuste. Con algunos medicamentos antiinflamatorios no esteroideos, existe la posibilidad de aumentar el tiempo de sangrado debido a la interferencia con la agregación plaquetaria. Ha habido informes de que los fármacos antiinflamatorios no esteroides aplicados ocularmente pueden causar aumento del sangrado de los tejidos oculares (incluyendo hipemas) en combinación con la cirugía ocular.
Existe sensibilidad cruzada potencial con el ácido acetilsalicílico, derivados del ácido fenilacético, y otros agentes antiinflamatorios no esteroides. Por lo tanto, se debe tener precaución al tratar a las personas que han mostrado previamente la sensibilidad a estos fármacos.
PRECAUCIONES:
General: Todos los fármacos no esteroideos tópicos antiinflamatorios (AINES) pueden disminuir o retrasar la curación. Los corticosteroides tópicos son conocidos también para disminuir o retrasar la curación. El uso concomitante de AINE tópicos y esteroides tópicos pueden aumentar el potencial de problemas de curación.
El uso de los AINE tópicos puede causar queratitis. En algunos pacientes susceptibles el uso continuado de AINE tópicos puede provocar ruptura epitelial, adelgazamiento corneal, infiltrados corneales, erosión corneal, ulceración de la córnea, y perforación de la córnea.
Estos eventos pueden ser una amenaza para la vista.
Los pacientes con evidencia de ruptura del epitelio corneal deben suspender inmediatamente el uso de AINE tópicos y deben ser estrechamente monitorizados por la salud de la córnea.
La experiencia post-comercialización con los AINE tópicos sugiere que los pacientes que experimentan cirugías oculares complicadas, denervación corneal, defectos epiteliales de la córnea, diabetes mellitus, enfermedad de la superficie ocular (por ejemplo, el síndrome de ojo seco), artritis reumatoide, o cirugías oculares repetidas dentro de un corto período de tiempo, pueden estar en mayor riesgo de eventos adversos de la córnea, lo cual puede convertirse en amenaza para la vista. Los AINEs tópicos deben usarse con precaución en estos pacientes.
La experiencia post-comercialización con los AINE tópicos también sugiere que el uso de más de 24 horas antes a la cirugía o el uso más allá de 14 días después de la cirugía puede aumentar el riesgo del paciente para la ocurrencia y gravedad de los eventos adversos de la córnea.
Se recomienda que diclofenaco sódico solución oftálmica 0.1%, como otro AINE, puede utilizarse con precaución en pacientes con diátesis hemorrágica conocida o que están recibiendo otros medicamentos que pueden prolongar el tiempo de sangrado. El uso del mismo frasco para ambos ojos no se recomienda con gotas oculares tópicas que se utilizan en asociación con la cirugía.
Los resultados de los estudios clínicos indican que Diclofenaco sódico solución oftálmica 0.1% no tiene ningún efecto significativo sobre la presión ocular. Sin embargo, la elevación de la presión intraocular puede ocurrir después de una cirugía de cataratas.
Información para los pacientes: Excepto por el uso de vendaje con lentes de contacto blandas de hidrogel durante los primeros 3 días siguientes de la cirugía refractiva, diclofenaco sódico solución oftálmica 0.1% no debe ser usado por pacientes que en la actualidad el usan lentes de contacto blandos debido a eventos adversos que han ocurrido en otras circunstancias de contacto.
Carcinogénesis, mutagénesis, deterioro de la fertilidad: Los estudios de carcinogenicidad a largo plazo en ratas que recibieron diclofenaco sódico solución oftálmica 0.1% en dosis orales de hasta 2 mg/kg/día (aproximadamente 500 veces la dosis oftálmica tópica humana) no reveló un aumento significativo en la incidencia de tumores.
Un estudio de carcinogenicidad de 2 años realizado en ratones empleando diclofenaco sódico solución oftálmica 0.1% oral hasta 2 mg/kg/día no revelaron ningún potencial oncogénico.
Diclofenaco sódico solución oftálmica 0.1% no mostró potencial mutagénico en diversos estudios de mutagénesis, incluyendo la prueba de Ames. Diclofenaco sódico solución oftálmica 0.1% administrado a ratas macho y hembras a 4 mg/kg/día (aproximadamente 1.000 veces la dosis tópica oftálmica humana) no afectó a la fertilidad.
Uso geriátrico: No se observaron diferencias generales en la seguridad o la eficacia entre los pacientes adultos mayores y jóvenes.
Embarazo:
• Efectos teratogénicos: Embarazo Categoría C. Los estudios de reproducción realizados en ratones con dosis orales de hasta 5.000 veces (20 mg/kg/día) y en ratas y conejos a dosis orales de hasta 2500 veces (10 mg/kg/día), la dosis tópica humana ha revelado evidencia de teratogenicidad debido a diclofenaco sódico solución oftálmica 0.1% a pesar de la inducción de toxicidad materna y toxicidad fetal. En ratas, las dosis tóxicas para la madre se asociaron con distocia, gestación prolongada, reduce el peso y el crecimiento del feto, y reduce la supervivencia del feto.
Diclofenaco sódico solución oftálmica 0.1% ha demostrado que atraviesa la barrera placentaria en ratones y ratas. Sin embargo, no son estudios adecuados y bien controlados en mujeres embarazadas.
Dado que los estudios de reproducción animal no siempre son predictivos de la respuesta humana, este medicamento debe usarse durante el embarazo sólo si claramente necesario.
• Efectos no teratogénicos: Debido a los efectos conocidos de la biosíntesis de prostaglandinas inhibiendo las drogas en el sistema cardiovascular fetal (cierre del conducto arterioso persistente), el uso de diclofenaco sódico solución oftálmica 0.1% durante el final del embarazo debería ser evitado.
Mujeres lactantes: No se sabe si la administración tópica oftálmica de diclofenaco sódico solución oftálmica 0.1% podría dar lugar a una absorción a una absorción sistémica suficiente para producir cantidades detectables en la leche materna. Debido a que muchos fármacos se excretan en la leche humana, se debe decidir si se suspende la lactancia o descontinuar el fármaco, teniendo en cuenta la importancia de la droga para la madre.
Uso pediátrico: No se ha establecido la seguridad y eficacia en pacientes pediátricos.
DOSIS Y ADMINISTRACIÓN:
Cirugía de catarata: Una gota de 3-A OFTENO 0.1% Solución oftálmica se debe aplicar en el ojo afectado, 4 veces al día empezando 24 horas después de la cirugía de cataratas y continuando durante las 2 primeras semanas del período postoperatorio .
Cirugía refractiva corneal: Una o dos gotas de 3-A OFTENO 0.1% Solución oftálmica deben aplicarse al ojo operatorio una hora antes de la cirugía refractiva corneal. Dentro de los 15 minutos después de la cirugía, una o dos gotas deben ser aplicados al ojo operado y continúo 4 veces al día durante un máximo de 3 días.
Vía de administración: Tópica oftálmica.
SOBREDOSIS: La sobredosis no causa comúnmente problemas agudos. Si 3-A OFTENO 0.1% Solución oftálmica es ingerido accidentalmente, se deben tomar líquidos para diluir el medicamento.
DESCRIPCIÓN: 3-A OFTENO (solución oftálmica de diclofenaco sódico) solución al 0.1% es una solución tópica estéril, producto no esteroideo, antiinflamatorio para uso oftálmico. El diclofenaco sódico se denomina químicamente como 2 - [(2,6-diclorofenil) amino] bencenoacético, sal monosódica, con un fórmula empírica de C14H10Cl2NO2Na. La fórmula estructural de diclofenaco sódico es:
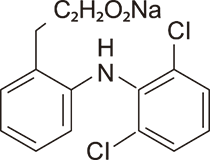
[Fórmula estructural]
3-A OFTENO está disponible como una solución estéril que contiene diclofenaco sódico 0.1% (1mg/ml).
Ingredientes inactivos: Edetato disódico dihidratado, ácido bórico, bisulfito de sodio, cloruro de sodio, estearato de polioxil 40, ácido sórbico como conservador 2.20mg/mL, y agua purificada. Cada gota contiene aproximadamente 0.04mg de diclofenaco sódico.
El diclofenaco sódico es un polvo cristalino de color ligeramente amarillo-blanco a beige claro, ligeramente higroscópico. Es fácilmente soluble en metanol, poco soluble en agua, muy poco soluble en acetonitrilo, e insoluble en cloroformo y en ácido clorhídrico 0,1 N. Su peso molecular es 318.14.
FARMACOLOGÍA CLÍNICA:
Farmacodinamia: El diclofenaco sódico es el único de una serie de ácidos fenilacético que ha demostrado propiedades antiinflamatorias y analgésicas en estudios farmacológicos. Se cree que inhibe la enzima ciclooxigenasa, que es esencial en la biosíntesis de prostaglandinas.
Estudios en animales: Las prostaglandinas han demostrado en muchos modelos animales que son mediadores de ciertos tipos de inflamación intraocular. En estudios realizados en los ojos de los animales, las prostaglandinas han demostrado que producen disrupción de la barrera sangre-humor acuoso, vasodilatación, aumento vascular permeabilidad, leucocitosis, y el aumento de la presión intraocular.
Farmacocinética: Los resultados de un estudio de biodisponibilidad establecieron que los niveles plasmáticos de diclofenaco después de la instilación ocular de dos gotas de diclofenaco sódico solución oftálmica 0.1% para cada ojo estaban por debajo del límite de cuantificación (10 ng/ml) durante un período de 4 horas. Este estudio sugiere que limite, en su caso, si se produce la absorción sistémica con diclofenaco sódico solución oftálmica 0.1%.
Ensayos clínicos: Efectos antiinflamatorios postoperatorias: En dos estudios controlados, doble ciego, de la eficacia de la inflamación postoperatoria, con un total de 206 pacientes con cataratas fueron tratados con diclofenaco sódico solución oftálmica 0.1% y 103 pacientes fueron tratados con vehículo placebo. Diclofenaco sódico solución oftálmica 0.1% se ve favorecida por el vehículo placebo durante un período de 2 semanas para las evaluaciones clínicas de la inflamación, medidos por las células de la cámara anterior y los brillos.
En estudios doble ciego, controlados, de cirugía refractiva corneal (queratotomía radial (RK) y queratectomía fotorrefractiva con láser (PRK)) los pacientes fueron tratados con diclofenaco sódico solución oftálmica 0.1% y/o vehículo placebo. La eficacia de diclofenaco sódico solución oftálmica 0.1% Dado antes y poco después de la cirugía fue favorecido sobre el vehículo placebo durante el período de 6 horas después de la cirugía para las evaluaciones clínicas de dolor y fotofobia. Se permitió a los pacientes usar lentes de contacto blandas de hidrogel con diclofenaco sódico solución oftálmica 0.1% por hasta tres días después de PRK.
PRESENTACIÓN:
Caja con frasco gotero con 5 mL de solución oftálmica (1 mg/mL).
ALMACENAMIENTO:
Consérvese el frasco bien tapado a temperatura ambiente a no más de 30 °C. Desechar el contenido del frasco luego de 30 días de abierto.
Laboratorios Sophia, S.A. De C.V.
Importado y Distribuido por:
LABORATORIOS OFTÁLMICOS S.A.C.
Calle Horacio Cachay N° 195
Urb. Santa Catalina La Victoria - Lima, Perú.
Teléfono: 225-1912