
APIDRA
INSULINA GLULISINA
Solución inyectable
1 Vial(es), 10 mL, 100 U/mL
2 Vial(es), 10 mL, 100 U/mL
4 Vial(es), 10 mL, 100 U/mL
5 Vial(es), 10 mL, 100 U/mL
1 Envase(s), 1 Cartucho(s), 3 mL, 100 U/mL
1 Envase(s), 3 Cartucho(s), 3 mL, 100 U/mL
1 Envase(s), 4 Cartucho(s), 3 mL, 100 U/mL
1 Envase(s), 5 Cartucho(s), 3 mL, 100 U/mL
1 Envase(s), 6 Cartucho(s), 3 mL, 100 U/mL
1 Envase(s), 8 Cartucho(s), 3 mL, 100 U/mL
1 Envase(s), 9 Cartucho(s), 3 mL, 100 U/mL
1 Envase(s), 10 Cartucho(s), 3 mL, 100 U/mL
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA:
Cada ml contiene 100 Unidades de insulina glulisina (equivalente a 3,49 mg)
APIDRA 100 Unidades/ml solución inyectable en un vial:
Cada vial contiene 10 ml de solución inyectable, equivalente a 1000 Unidades
APIDRA 100 Unidades/ml solución inyectable en un cartucho:
Cada cartucho contiene 3 ml de solución inyectable, equivalente a 300 Unidades
APIDRA SoloStar 100 Unidades/ml solución inyectable en una pluma precargada:
Cada pluma contiene 3 ml de solución inyectable, equivalente a 300 Unidades
Insulina glulisina se obtiene por tecnología de ADN recombinante en Escherichia coli
Para consultar la lista completa de excipientes, ver sección Lista de excipientes
FORMA FARMACÉUTICA:
APIDRA 100 Unidades/ml solución inyectable en un vial:
Solución inyectable en un vial.
APIDRA 100 Unidades/ml solución inyectable en un cartucho:
Solución inyectable en un cartucho.
APIDRA SoloStar 100 Unidades/ml solución inyectable en una pluma precargada:
Solución inyectable en una pluma precargada. Solución acuosa, incolora y transparente.
LISTA DE EXCIPIENTES:
Metacresol
Cloruro de sodio
Trometamol
Polisorbato 20
Ácido clorhídrico, concentrado
Hidróxido de sodio
Agua para preparaciones inyectables
INDICACIONES TERAPÉUTICAS:
Tratamiento de diabetes mellitus en adultos, adolescentes y niños a partir de los 6 años, cuando se precise tratamiento con insulina.
PROPIEDADES FARMACOCINÉTICAS:
En la insulina glulisina la sustitución de la asparragina, aminoácido de la insulina humana en la posición B3 por lisina, y de la lisina en la posición B29 por ácido glutámico favorece una absorción más rápida.
En un estudio con 18 sujetos varones, con diabetes mellitus tipo 1, de edades comprendidas entre 21 y 50 años, la insulina glulisina muestra proporcionalidad respecto a la dosis en la primera exposición, la exposición máxima y la exposición total, en el rango de dosis de 0,075 a 0,4 Unidades/kg.
Absorción y biodisponibilidad:
Los perfiles farmacocinéticos en voluntarios sanos y pacientes con diabetes (tipo 1 o 2) demostraron que la absorción de insulina glulisina fue alrededor de dos veces más rápida con un pico de concentración aproximadamente dos veces más alto que en la insulina humana regular.
En un estudio en pacientes con diabetes mellitus tipo 1 después de una administración subcutánea de 0,15 Unidades/kg de insulina glulisina, el Tmax fue de 55 minutos y la Cmax fue de 82 ± 1,3 microunidades/ml comparado con un Tmax de 82 minutos y una Cmax de 46 ± 1,3 microunidades/ml para la insulina humana regular. El tiempo medio de permanencia de la insulina glulisina fue más corto (98 min) que el de la insulina humana regular (161 minutos) (ver figura 3).
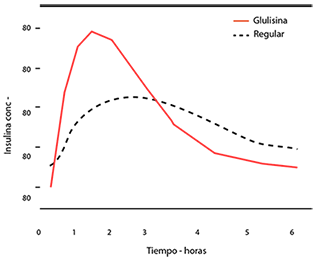
Figura 3: Perfil farmacocinético de insulina glulisina e insulina humana regular en pacientes con diabetes mellitus tipo 1 después de la administración de una dosis de 0,15 Unidades/kg.
En un estudio en pacientes con diabetes mellitus tipo 2 después de la administración subcutánea de 0,2 Unidades/kg de insulina glulisina, la Cmax fue de 91 microunidades/ml con un rango intercuartil de 78 a 104 microunidades/ml.
Cuando la insulina glulisina se administra subcutáneamente en el abdomen, deltoide y muslo, los perfiles concentración-tiempo fueron similares, con una absorción ligeramente más rápida cuando se administra en el abdomen en comparación con el muslo. La absorción en los lugares del deltoide está en medio (ver sección Posología y forma de administración). La biodisponibilidad absoluta (70%) de la insulina glulisina fue similar en los lugares de inyección, y de baja variabilidad intra-individual (11% CV). La administración de bolo intravenoso de insulina glulisina causó una exposición sistémica más alta cuando se comparó con la inyección subcutánea, con una Cmax aproximadamente 40 veces mayor.
Obesidad:
Otro estudio fase I con insulina glulisina e insulina lispro en una población no diabética de 80 sujetos, con un amplio rango de índices de masa corporal (18-46 kg/m2), ha demostrado que la absorción rápida y la exposición total se mantiene generalmente a lo largo de un amplio rango de índices de masa corporal.
El tiempo hasta el 10% de exposición total a la insulina se alcanzó antes, en 5-6 minutos aproximadamente con la insulina glulisina.
Distribución y eliminación:
La distribución y eliminación de la insulina glulisina y la insulina regular después de una administración intravenosa es similar con volúmenes de distribución de 13 l y 22 l y semividas de 13 y 18 minutos, respectivamente.
Después de la administración subcutánea, la insulina glulisina se elimina más rápidamente que la insulina humana regular con una semivida aparente de 42 minutos en comparación con los 86 minutos. En un análisis de un estudio cruzado de insulina glulisina con sujetos sanos o pacientes con diabetes mellitus tipo 1 o tipo 2 el rango de vida media aparente va de 37 a 75 minutos (rango intercuartil).
Insulina glulisina muestra una unión baja a las proteínas plasmáticas, similar a la insulina humana.
Poblaciones especiales:
Insuficiencia renal:
En un estudio clínico realizado en sujetos no diabéticos con un amplio rango de función renal (ClCr > 80 ml/min, 30-50 ml/min, < 30 ml/min), por lo general se mantuvieron las propiedades de acción rápida de la insulina glulisina. Sin embargo, las necesidades de insulina podrían verse reducidas en caso de insuficiencia renal.
Insuficiencia hepática:
No se han investigado las propiedades farmacocinéticas en pacientes con insuficiencia en la función hepática.
Pacientes de edad avanzada:
Existen datos farmacocinéticos muy limitados para pacientes de edad avanzada con diabetes mellitus.
Niños y adolescentes:
Las propiedades farmacocinéticas y farmacodinámicas de la insulina glulisina se investigaron en niños (7- 11 años) y adolescentes (12-16 años) con diabetes mellitus tipo 1. La insulina glulisina se absorbió rápidamente en los dos grupos de edad, con una Tmax y una Cmax similares a las de adultos (ver sección 4.2). Administrada inmediatamente antes de una prueba de comida, insulina glulisina proporciona un mejor control postprandial que la insulina humana regular, como en adultos (ver sección 5.1). El recorrido de glucosa (AUC0-6h) fue de 641 mg.h.dl-1 para la insulina glulisina y 801 mg.h.dl-1 para la insulina humana regular.
PROPIEDADES FARMACODINÁMICAS:
Grupo farmacoterapéutico: Fármacos usados en diabetes, insulinas y análogos para inyección, de acción rápida. Código ATC: A10AB06.
Mecanismo de acción:
Insulina glulisina es un análogo de insulina humana recombinante que es equipotente a la insulina humana regular. Insulina glulisina tiene un comienzo de acción más rápido y una duración de acción más corta que la insulina humana regular.
La actividad principal de las insulinas y análogos de insulina, donde se incluye la insulina glulisina, es la regulación del metabolismo de la glucosa. Las insulinas reducen los niveles de glucosa en sangre mediante la estimulación de la captación de la glucosa periférica, especialmente del músculo esquelético y la grasa, y por inhibición de la producción de la glucosa hepática. La insulina inhibe la lipólisis en el adipocito, inhibe la proteólisis y aumenta la síntesis de proteínas.
Estudios en voluntarios sanos y en pacientes con diabetes demostraron que la insulina glulisina tiene un comienzo de acción más rápido y una duración de acción más corta que la insulina humana regular cuando se administra subcutáneamente. Cuando la insulina glulisina se inyecta subcutáneamente, la actividad reductora de glucosa empezaría a los 10-20 minutos. Después de la administración intravenosa, se observaron un inicio más rápido y una duración de acción más corta, así como un mayor pico de respuesta en comparación con la administración subcutánea. Las actividades reductoras de glucosa de la insulina glulisina y de la insulina humana regular son equipotentes cuando se administran por vía intravenosa.
Una unidad de insulina glulisina tiene la misma actividad reductora de glucosa que una unidad de insulina humana regular.
Proporcionalidad de la dosis:
En un estudio con 18 sujetos varones, con diabetes mellitus tipo 1, de edades comprendidas entre 21 y 50 años, la insulina glulisina demostró un efecto reductor de glucosa proporcional a la dosis, en el rango de dosis terapeútica relevante de 0,075 a 0,15 Unidades/kg y un efecto reductor de glucosa menor que el incremento proporcional con 0,3 Unidades/kg o más, como la insulina humana.
Insulina glulisina tiene un efecto aproximadamente dos veces más rápido que la insulina humana regular y completa el efecto reductor de glucosa aproximadamente 2 horas antes que la insulina humana regular.
Un estudio fase I en pacientes con diabetes mellitus tipo 1 evaluó los perfiles reductores de glucosa de la insulina glulisina y de la insulina humana regular, administradas subcutáneamente a dosis de 0,15 Unidades/kg, a diferentes tiempos en relación con una comida estándar de 15 minutos. Los datos indicaron que la insulina glulisina administrada 2 minutos antes de la comida, aporta un control glucémico postprandial similar al aportado por la insulina humana regular administrada 30 minutos antes de la comida. La insulina glulisina administrada 2 minutos antes de la comida proporciona un mejor control postprandial que la insulina humana regular administrada 2 minutos antes de la comida. La insulina glulisina administrada 15 minutos después de comenzar la comida proporciona un control glucémico similar al de la insulina humana regular administrada 2 minutos antes de la comida (ver figura 1).
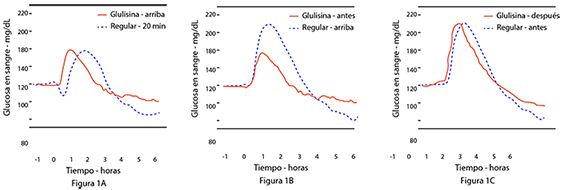
Figura 1: Media del efecto reductor de glucosa a las 6 horas en 20 pacientes con diabetes mellitus tipo 1. Insulina glulisina administrada 2 minutos (preGLULISINA) antes del comienzo de una comida, comparada con la insulina humana regular administrada 30 minutos (REGULAR 30 min) antes del comienzo de la comida (figura 1A), y comparada con la insulina humana regular administrada 2 minutos (preREGULAR) antes de una comida (figura 1B). Insulina glulisina administrada 15 minutos (postGLULISINA) después del comienzo de la comida, comparada con la insulina humana regular administrada 2 minutos (preREGULAR) antes del comienzo de la comida (figura 1C). En el eje de las x, cero (la fecha) es el comienzo de una comida de 15 minutos.
Obesidad:
Un estudio fase I realizado con insulina glulisina, lispro e insulina humana regular en una población de pacientes obesos, ha demostrado que la insulina glulisina mantiene sus propiedades de acción rápida. En este estudio, el tiempo hasta el 20% del total del AUC y el AUC (0-2h) que representa la actividad reductora de glucosa inicial, fueron respectivamente de 114 minutos y 427 mg/kg para la insulina glulisina, 121 minutos y 354 mg/kg para lispro, y 150 minutos y 197 mg/kg para la insulina humana regular (ver figura 2).
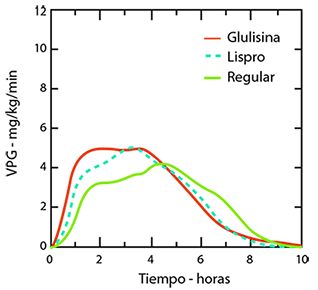
Figura 2: Velocidad de perfusión de glucosa (VPG) después de una inyección subcutánea de 0,3 Unidades/kg de insulina glulisina (GLULISINA) o insulina lispro (LISPRO) o insulina humana regular (REGULAR) en una población de pacientes obesos.
Otro estudio fase I con insulina glulisina e insulina lispro en una población no diabética de 80 sujetos, con un amplio rango de índices de masa corporal (18-46 kg/m2), ha demostrado que la acción rápida se mantiene generalmente en un amplio rango de índices de masa corporal (IMC), mientras que el efecto reductor de glucosa total, disminuye cuando aumenta la obesidad.
La media total del AUC de la VPG entre 0-1 hora fue 102±75 mg/kg y 158±100 mg/kg con 0,2 y 0,4 Unidades/kg de insulina glulisina respectivamente, y 83,1±72,8 mg/kg y 112,3±70,8 mg/kg con 0,2 y 0,4 Unidades/kg de insulina lispro, respectivamente.
Un estudio fase I en 18 pacientes obesos con diabetes mellitus tipo 2 (IMC entre 35 y 40 kg/m2) con insulina glulisina e insulina lispro [90% IC: 0,81, 0,95 (p=<0,01)], ha demostrado que la insulina glulisina controla eficazmente las excursiones diurnas post-prandiales de glucemia.
Eficacia y seguridad clínica:
Diabetes mellitus tipo I-Adultos:
En un estudio clínico fase III de 26 semanas que compara insulina glulisina con insulina lispro administradas subcutáneamente poco tiempo (0-15 minutos) antes de una comida en pacientes con diabetes mellitus tipo I que usaban insulina glargina como insulina basal, la insulina glulisina fue comparable a la insulina lispro durante el control glucémico tal y como lo reflejan los cambios en la hemoglobina glicosilada (expresada como HbA1c equivalente) desde el punto basal hasta el punto final. Se observaron valores auto-controlados de glucosa en sangre, comparables. Con insulina glulisina no se necesitaron incrementos en la dosis de insulina basal, en contraste con insulina lispro.
Un estudio clínico fase III de 12 semanas realizado en pacientes con diabetes mellitus tipo 1 que recibían insulina glargina como terapia basal, indica que la administración de insulina glulisina inmediatamente después de la comida proporciona una eficacia comparable a la de la insulina glulisina administrada inmediatamente antes de la comida (0-15 minutos) o la insulina regular (30-45 minutos). En la población por protocolo hubo una reducción de GHb muy significativa en el grupo de glulisina administrada antes de las comidas en comparación con el grupo de insulina regular.
Diabetes mellitus tipo 1-Población pediátrica:
En un ensayo clínico fase III de 26 semanas de duración realizado en niños (4-5 años: n=9; 6-7 años n=32 y 8-11 años: n=149) y adolescentes (12-17 años: n=382) con diabetes mellitus tipo 1, se comparó la insulina glulisina con insulina lispro ambas administradas por vía subcutanea (0-15 minutos) antes de una comida. Se utilizó insulina glargina o NPH como insulina basal. Insulina glulisina fue comparable a insulina lispro en el control glucémico tal y como reflejan los cambios en la hemoglobina glicosilada (GHb expresada como HbA1c) desde el punto basal hasta el final y según los valores obtenidos por autodeterminaciones de glucemia.
No existe información clínica suficiente sobre el uso de APIDRA en niños menores de 6 años.
Diabetes mellitus tipo 2-Adultos:
Se realizó un estudio clínico fase III de 26 semanas seguido de un estudio de seguridad de 26 semanas, para comparar insulina glulisina (0-15 minutos antes de una comida) con insulina humana regular (30- 45 minutos antes de una comida) administradas subcutáneamente en pacientes con diabetes mellitus tipo 2, también se utilizó insulina NPH como insulina basal. La media del índice de masa corporal (IMC) de los pacientes fue 34,55 kg/m2. Insulina glulisina demostró ser comparable a la insulina humana regular teniendo en cuenta los cambios en hemoglobina glicosilada (expresada como HbA1c equivalente) desde el punto basal hasta el punto final a los 6 meses (-0,46% para insulina glulisina y - 0,30% para insulina humana regular, p=0,0029) y desde el punto basal hasta el punto final a los 12 meses (-0,23% para insulina glulisina y -0,13% para insulina humana regular, sin diferencia significativa). En este estudio, la mayoría de los pacientes (79%) mezclaron su insulina de corta duración de acción con insulina NPH inmediatamente antes de la inyección y el 58 % de los pacientes utilizó agentes hipoglucémicos orales de forma randomizada, y se instruyó a los pacientes que continuaran utilizándolos a la misma dosis.
Raza y sexo:
En estudios clínicos controlados en adultos, insulina glulisina no mostró diferencias en cuanto a seguridad y eficacia en los subgrupos analizados en función de la raza y el sexo.
CONTRAINDICACIONES:
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección Lista de excipientes. Hipoglucemia.
EMBARAZO Y LACTANCIA:
Embarazo:
No hay datos o éstos son limitados (datos en menos de 300 embarazos) relativos al uso de insulina glulisina en mujeres embarazadas.
Los estudios sobre reproducción animal no han revelado ninguna diferencia entre insulina glulisina e insulina humana con respecto al embarazo, desarrollo embrio/fetal, parto o desarrollo postnatal (ver sección Datos preclínicos sobre seguridad).
Debería prestarse atención en la prescripción a mujeres embarazadas. Es fundamental una monitorización cuidadosa del control de glucemia.
En pacientes con diabetes pre-existente o gestacional es fundamental mantener un buen control metabólico durante todo el embarazo. Las necesidades de insulina podrían disminuir durante el primer trimestre, y generalmente incrementarse durante el segundo y tercer trimestre. Inmediatamente después del parto, las necesidades de insulina disminuyen rápidamente.
Lactancia:
No se sabe si insulina glulisina se excreta en leche humana, pero por lo general la insulina no pasa a la leche materna y no se absorbe después de la administración oral.
Las madres lactantes podrían necesitar ajustes en la dosis de insulina y la dieta.
Fertilidad:
Los estudios de reproducción en animales con insulina glulisina no han revelado ningún efecto adverso sobre la fertilidad.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MAQUINAS:
La capacidad del paciente para concentrarse y reaccionar podría verse afectada como resultado de una hipoglucemia o hiperglucemia o, por ejemplo, como resultado de un deficiencia visual. Esto podría suponer un riesgo en aquellas situaciones donde estas capacidades son de especial importancia (por ejemplo: conducir un coche o manejar máquinas).
Debe advertirse a los pacientes de que tomen precauciones para evitar una hipoglucemia mientras conducen. Esto es especialmente importante en aquellas personas que tienen un conocimiento reducido o no tienen conocimiento de los síntomas de aviso de una hipoglucemia, o tienen episodios frecuentes de hipoglucemia. En estas circunstancias debe considerarse la conveniencia de conducir.
REACCIONES ADVERSAS:
Resumen del perfil de seguridad:
La hipoglucemia, la reacción adversa más frecuente de la terapia con insulina, podría ocurrir si la dosis de insulina es demasiado alta en relación con las necesidades de insulina.
Lista tabulada de reacciones adversas:
A continuación se adjuntan las siguientes reacciones adversas procedentes de estudios clínicos según la clasificación por órganos y sistemas y en orden decreciente de incidencia (muy frecuentes: ≥ 1/10; frecuentes: ≥ 1/100 a < 1/10; poco frecuentes: ≥ 1/1.000 a < 1/100; raras: ≥ 1/10.000 a < 1/1.000; muy raras: < 1/10.000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Las reacciones adversas se presentan en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Clasificación de órganos del sistema MedDRA |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
No conocida |
|
Trastorno del metabolismo y de la nutrición |
Hipoglucemia |
Hiperglucemia (potencialmente conduce a una cetoacidosis diabética1) |
|||
|
Trastornos de la piel y del tejido subcutáneo |
Reacciones en el lugar de la inyección Reacciones de hipersensibilidad local |
Lipodistrofia |
Amiloidosis cutánea |
||
|
Trastornos generales y alteraciones en el lugar de administración |
Reacciones sistémicas de hipersensibilidad |
1 APIDRA 100 Unidades/ml solución inyectable en un vial: La mayoría de los casos estaban relacionados con errores en el manejo o fallo del sistema de bomba cuando se usó APIDRA en PCSI.
Descripción de las reacciones adversas seleccionadas:
• Trastornos del metabolismo y de la nutrición:
Los síntomas de una hipoglucemia normalmente aparecen de repente. Estos podrían incluir sudores fríos, piel pálida y fría, fatiga, nerviosismo o temblor, ansiedad, cansancio inusual o debilidad, confusión, dificultad de concentración, somnolencia, hambre excesiva, cambios en la visión, dolor de cabeza, náuseas y palpitaciones. La hipoglucemia puede llegar a ser severa y podría llevar a pérdida de conocimiento y/o convulsiones que podrían dar como resultado, deterioro temporal o permanente de la función del cerebro o incluso muerte.
APIDRA 100 Unidades/ml solución inyectable en un vial:
Se han notificado casos de hiperglucemia con APIDRA cuando se usó en PCSI (ver sección Advertencias y precauciones especiales de empleo) que ha conducido a una Cetoacidosis Diabética (CAD); la mayoría de los casos estaban relacionados con errores en el manejo o con un fallo del sistema de bomba. El paciente debe seguir siempre las instrucciones específicas de APIDRA y tener siempre acceso a un sistema de administración de insulina alternativo en caso de fallo del sistema de bomba.
• Trastornos de la piel y del tejido subcutáneo:
Las reacciones de hipersensibilidad local (enrojecimiento, hinchazón y picor en el lugar de inyección) podrían ocurrir durante el tratamiento con insulina. Estas reacciones generalmente son transitorias y normalmente desaparecen durante el tratamiento continuado.
Pueden producirse lipodistrofia y amiloidosis cutánea en el lugar de inyección y retrasar la absorción local de insulina. La rotación continua del punto de inyección dentro de la zona de administración de la inyección puede ayudar a reducir o prevenir estas reacciones (ver sección Advertencias y precauciones especiales de empleo).
• Trastornos generales y alteraciones en el lugar de administración:
Las reacciones sistémicas de hipersensibilidad podrían incluir urticaria, opresión torácica, disnea, dermatitis alérgica y prurito. Los casos graves de alergia generalizada que incluyen una reacción anafiláctica pueden causar la muerte.
Notificación de sospechas de reacciones adversas:
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas directamente a través del Sistema Nacional de Farmacovigilancia o a Sanofi por cualquiera de las siguientes vías: farmacovigilancia.peru@sanofi.com ó http://www.sanofi.com.pe/es/contacto.
INCOMPATIBILIDADES:
APIDRA 100 Unidades/ml solución inyectable en un vial:
Vía subcutánea:
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros medicamentos excepto con insulina humana NPH.
Cuando se utiliza con una bomba de perfusión de insulina, APIDRA no debe mezclarse con otros medicamentos.
Vía intravenosa:
Se ha visto que APIDRA es incompatible con la solución de glucosa al 5 % y con la solución de Ringer y, por lo tanto, no debe utilizarse con estas soluciones. El uso de otras soluciones no ha sido estudiado.
INTERACCIÓN CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN:
No se han realizado estudios sobre interacciones farmacocinéticas. En base al conocimiento empírico sobre medicamentos similares, no es probable que aparezcan interacciones farmacocinéticas clínicamente relevantes.
Existe un número de sustancias que afectan al metabolismo de la glucosa por lo que podría requerir el ajuste de la dosis de insulina glulisina y particularmente una estrecha monitorización.
Las sustancias que podrían aumentar la actividad reductora del nivel de glucosa en sangre e incrementar la susceptibilidad a una hipoglucemia son los medicamentos antidiabéticos orales, los inhibidores de la enzima convertidora de angiotensina (ECA), disopiramida, fibratos, fluoxetina, inhibidores de la monoamino oxidasa (IMAOs), pentoxifilina, propoxifeno, salicilatos y antibióticos sulfonamidas.
Las sustancias que podrían disminuir la actividad reductora del nivel de glucosa en sangre incluyen corticoides, danazol, diazóxido, diuréticos, glucagón, isoniazida, derivados de la fenotiazina, somatropina, medicamentos simpaticomiméticos (por ejemplo: epinefrina [adrenalina, salbutamol, terbutalina), hormonas tiroideas, estrógenos, progestágenos (por ejemplo: anticonceptivos orales), inhibidores de la proteasa y medicamentos antipsicóticos atípicos (por ejemplo: olanzapina y clozapina).
Los betabloqueantes, clonidina, sales de litio o alcohol podrían potenciar o debilitar la actividad reductora del nivel de glucosa en sangre de la insulina. La pentamidina podría causar hipoglucemia que algunas veces podría ir seguida de una hiperglucemia.
Además, bajo la influencia de medicamentos simpaticolíticos como los betabloqueantes, clonidina, guanetidina y reserpina, los signos de una contra-regulación adrenérgica podrían atenuarse o no aparecer.
DATOS PRECLÍNICOS SOBRE SEGURIDAD:
Los datos de los estudios preclínicos no evidenciaron otros hallazgos sobre toxicidad relacionados con la actividad farmacodinámica (hipoglucemia) reductora de glucosa en sangre, diferentes de los de la insulina humana regular o de relevancia clínica para humanos.
PRECAUCIONES ESPECIALES DE ELIMINACIÓN Y OTRAS MANIPULACIONES:
APIDRA 100 Unidades/ml solución inyectable en un vial:
Vía subcutánea:
Los viales de APIDRA son para utilizar con jeringas de insulina con la correspondiente escala graduada y para utilizar con un sistema de bomba de insulina (ver sección Posología y forma de administración).
Inspeccionar el vial antes de usar. Sólo debe utilizarse si la solución es transparente, incolora y sin partículas sólidas visibles. Debido a que APIDRA es una solución, no necesita una resuspensión antes de uso.
Se debe comprobar siempre la etiqueta de insulina antes de cada inyección para evitar errores de medicación entre insulina glulisina y otras insulinas (ver sección Advertencias y precauciones especiales de empleo).
Mezcla con insulinas:
Cuando se mezcla con insulina humana NPH, APIDRA se debe introducir primero en la jeringa. La inyección debe ser administrada inmediatamente después de la mezcla debido a que no existen datos disponibles sobre las mezclas preparadas un tiempo significativo antes de la inyección.
Bomba de perfusión continua subcutánea:
Ver secciones Posología y forma de administración y Advertencias y precauciones especiales de empleo para asesorarse.
Vía intravenosa:
APIDRA debe utilizarse a una concentración de 1 Unidad/ml de insulina glulisina en sistemas de perfusión con una solución para perfusión de cloruro de sodio 9 mg/ml (0,9 %) con o sin 40 mmol/l de cloruro de potasio utilizando bolsas para perfusión de plástico coextrusionado de poliolefina/poliamida con una línea de perfusión exclusiva. La insulina glulisina para uso intravenoso en una concentración de 1 Unidad/ml es estable a temperatura ambiente durante 48 horas.
Después de la dilución para la vía intravenosa, la solución debe ser inspeccionada visualmente para detectar partículas antes de la administración. Sólo debe ser usada si la solución es transparente e incolora, no deberá utilizarse cuando esté turbia o con partículas visibles.
Se ha visto que APIDRA es incompatible con la solución de glucosa al 5 % y con la solución de Ringer y, por lo tanto, no debe utilizarse con estas soluciones. El uso de otras soluciones no ha sido estudiado.
APIDRA 100 Unidades/ml solución inyectable en un cartucho:
APIDRA 100 unidades/ml en un cartucho sólo es adecuado para inyecciones subcutáneas con una pluma reutilizable. Si fuera necesaria la administración con jeringa, inyección intravenosa o bomba de perfusión, se debe utilizar un vial. Los cartuchos de APIDRA deben utilizarse únicamente con las plumas: OptiPen, ClikSTAR, Autopen 24, Tactipen, AllStar, AllStar PRO o JuniorSTAR (ver secciones Posología y forma de administración y Advertencias y precauciones especiales de empleo). En su país, puede que solamente estén comercializadas algunas de estas plumas. La pluma debe utilizarse tal y como se recomienda en la información suministrada por el fabricante de la pluma.
Las instrucciones del fabricante para utilizar la pluma deben seguirse cuidadosamente para cargar el cartucho, colocar la aguja y administrar la inyección de insulina. Inspeccionar el cartucho antes de usar. Sólo debe utilizarse si la solución es transparente, incolora y sin partículas sólidas visibles. Antes de insertar el cartucho en la pluma reutilizable, el cartucho debe almacenarse a temperatura ambiente durante 1 o 2 horas. Las burbujas de aire deben eliminarse del cartucho antes de la inyección (ver instrucciones de uso de la pluma). Los cartuchos vacíos no deben recargarse.
Si la pluma de insulina está dañada o no funciona correctamente (debido a fallos mecánicos) debe desecharse, y utilizarse una pluma de insulina nueva.
Para prevenir cualquier tipo de contaminación, la pluma reutilizable debe ser utilizada por un único paciente.
Se debe comprobar siempre la etiqueta de insulina antes de cada inyección para evitar errores de medicación entre insulina glulisina y otras insulinas (ver sección Advertencias y precauciones especiales de empleo).
APIDRA SoloStar 100 Unidades/ml solución inyectable en una pluma precargada:
APIDRA SoloStar 100 unidades/ml en pluma precargada sólo es adecuado para inyecciones subcutáneas. Si fuera necesaria la administración con jeringa, inyección intravenosa o bomba de perfusión, se debe utilizar un vial.
Antes del primer uso, la pluma debe conservarse a temperatura ambiente durante 1 o 2 horas.
Inspeccionar el cartucho antes de usarlo. Sólo se debe utilizar si la solución es transparente, incolora, carece de partículas sólidas visibles, y si presenta una consistencia acuosa. Dado que APIDRA es una solución, no necesita resuspensión antes de su uso.
Las plumas vacías nunca deben reutilizarse y deben desecharse de forma segura.
Para prevenir cualquier tipo de contaminación, la pluma precargada debe utilizarse exclusivamente por un solo paciente.
Se debe comprobar siempre la etiqueta de insulina antes de cada inyección para evitar errores de medicación entre insulina glulisina y otras insulinas (ver sección Advertencias y precauciones especiales de empleo).
Manejo de la pluma:
El paciente debe ser advertido para leer detenidamente las instrucciones de uso incluidas en el prospecto antes de utilizar SoloStar.
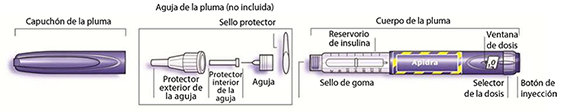
Esquema de la pluma:
Información importante para la utilización de SoloStar:
• Una aguja nueva debe ser insertada siempre antes de cada uso y se debe realizar la prueba de seguridad. No se debe seleccionar una dosis ni presionar el botón si no hay una aguja insertada. Utilizar sólo las agujas que son compatibles con SoloStar.
• Se debe tener especial cuidado para evitar accidentes con la aguja y la transmisión de infecciones.
• SoloStar nunca debe utilizarse si está dañado o si el paciente no está seguro de que funciona correctamente.
• El paciente debe disponer siempre de un SoloStar de reserva disponible por si el SoloStar se pierde o estropea.
Instrucciones de conservación:
Revise en la sección Precauciones especiales de conservación de esta ficha técnica las instrucciones de cómo conservar SoloStar.
Si SoloStar se encuentra almacenado en frío, debe sacarse de 1 a 2 horas antes de la inyección para atemperarlo. La inyección de insulina fría es más dolorosa.
El SoloStar utilizado debe desecharse tal y como indiquen sus autoridades locales.
Mantenimiento:
SoloStar debe protegerse del polvo y la suciedad.
La parte exterior de SoloStar puede limpiarse frotándola con un paño húmedo.
La pluma no debe ponerse en remojo, lavarse o lubricarse, ya que esto puede dañarla.
SoloStar está diseñado para funcionar con precisión y seguridad. Debe manipularse con cuidado. El paciente debe evitar situaciones en las que SoloStar pueda estropearse. Si el paciente es consciente que su SoloStar puede estar estropeado, debe utilizar uno nuevo.
Paso 1 Comprobación de la insulina:
Se debe comprobar la etiqueta de la pluma para asegurarse de que contiene la insulina correcta. APIDRA SoloStar es azul. Dispone de un botón de inyección azul oscuro con un anillo que sobresale en un extremo. Después de retirar el capuchón de la pluma, el aspecto de la insulina también debería ser comprobado: la solución de insulina debe ser transparente, incolora, sin partículas sólidas visibles y debe tener una consistencia acuosa.
Paso 2 Colocación de la aguja:
Solamente deben utilizarse las agujas que son compatibles con SoloStar.
Se debe utilizar siempre una aguja estéril para cada inyección. Después de quitar el capuchón, la aguja debe insertarse con cuidado directamente en la pluma.
Paso 3 Prueba de seguridad:
Antes de cada inyección se debe realizar una prueba de seguridad para asegurar que la pluma y la aguja funcionan correctamente y eliminar las burbujas de aire.
Una dosis de 2 unidades debe seleccionarse.
Quitar los protectores exterior e interior de la aguja.
Mientras sujeta la pluma con la aguja apuntando hacia arriba, el reservorio de insulina debe golpearse ligeramente con el dedo hasta que cualquier burbuja de aire suba hacia la aguja.
Entonces presione el botón de inyección completamente.
Si la insulina sale a través del extremo de la aguja, la pluma y la aguja funcionan correctamente. Si no aparece insulina en el extremo de la aguja, el paso 3 debe repetirse hasta que aparezca insulina en el extremo de la aguja.
Paso 4 Selección de la dosis:
Puede fijarse la dosis en pasos de 1 unidad, desde un mínimo de 1 unidad hasta un máximo de 80 unidades. Si se necesita una dosis mayor de 80 unidades deben administrarse dos inyecciones o más.
Después de la prueba de seguridad la ventana de la dosis debe marcar “0”. Si es así la dosis puede ser seleccionada.
Paso 5 Inyección de la dosis:
El paciente debe ser instruido en la técnica de inyección por su profesional sanitario. La aguja debe insertarse en la piel.
El botón de inyección debe presionarse completamente. Antes de retirar la aguja, el botón de inyección debe mantenerse presionado durante 10 segundos. Esto garantiza que la dosis completa de insulina ha sido inyectada.
Paso 6 Retirada y eliminación de la aguja:
La aguja siempre debe eliminarse y desecharse después de cada inyección. Se deben seguir las recomendaciones para prevenir contaminaciones y/o infecciones, la entrada de aire en el reservorio de insulina y la pérdida de insulina. Las agujas no deben reutilizarse. Se debe tener especial precaución cuando se retira y desecha la aguja. Siga las recomendaciones de seguridad para retirar y desechar las agujas (p. ej. técnica de colocar el protector con una mano) para reducir el riesgo de accidentes y transmisión de enfermedades infecciosas.
El capuchón de la pluma se debe recolocar en la pluma.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE EMPLEO:
Trazabilidad:
Con objeto de mejorar la trazabilidad de los medicamentos biológicos, el nombre y el número de lote del medicamento administrado deben estar claramente registrados.
En un paciente el cambio a otro tipo o marca de insulina debe realizarse bajo estricta supervisión médica. Cambios en la concentración, marca (fabricante), tipo (regular, neutral protamine Hagedorn [NPH], lenta, acción prolongada, etc.), origen (animal, humano, análogo de insulina humana) y/o método de fabricación podría dar lugar a la necesidad de un cambio en la dosis. El tratamiento antidiabético oral concomitante puede presentar la necesidad de un ajuste.
Se debe enseñar a los pacientes a realizar una rotación continua del punto de inyección para reducir el riesgo de sufrir lipodistrofia y amiloidosis cutánea. Hay un posible riesgo de retraso de la absorción de insulina y empeoramiento del control de la glucemia tras las inyecciones de insulina en puntos con estas reacciones. Se ha notificado que un cambio repentino en el punto de inyección en una zona no afectada produce hipoglucemia. Se recomienda vigilar la glucosa en sangre después de cambiar el punto de inyección y podrá considerarse el ajuste de las medicaciones antidiabéticas.
Hiperglucemia:
La utilización de dosis inadecuadas o la interrupción del tratamiento especialmente en diabéticos insulino-dependientes, podría dar lugar a una hiperglucemia o cetoacidosis diabética; condiciones que son potencialmente letales.
Hipoglucemia:
El tiempo de aparición de una hipoglucemia depende del perfil de acción de las insulinas utilizadas y por lo tanto, podría cambiar cuando se cambie el régimen de tratamiento.
Las condiciones que podrían hacer que los primeros síntomas de aviso de una hipoglucemia sean diferentes o menos pronunciados, incluyen diabetes de larga duración, terapia insulínica intensiva, neuropatía diabética, medicamentos como betabloqueantes o después de pasar de una insulina de origen animal a una insulina humana.
También podría ser necesario un ajuste de la dosis si los pacientes incrementan la actividad física o si hacen un cambio en su plan de comidas habitual. El ejercicio realizado inmediatamente después de una comida podría incrementar el riesgo de hipoglucemia.
En comparación con la insulina humana soluble, si la hipoglucemia aparece después de una inyección con análogos de acción rápida, esta podría aparecer antes.
Reacciones hipoglucémicas o hiperglucémicas no tratadas pueden causar pérdida de conocimiento, coma o muerte.
Las necesidades de insulina podrían alterarse durante una enfermedad o trastornos emocionales.
APIDRA 100 Unidades/ml solución inyectable en un cartucho:
Plumas a utilizar con APIDRA 100 Unidades/ml solución inyectable en un cartucho:
APIDRA 100 unidades/ml en cartuchos sólo es adecuado para inyecciones subcutáneas con una pluma reutilizable. Si fuera necesaria la administración con jeringa, inyección intravenosa o bomba de perfusión, se debe utilizar un vial.
Los cartuchos de APIDRA sólo deben utilizarse con las siguientes plumas:
- JuniorSTAR que libera APIDRA en incrementos de 0,5 unidades de dosis.
- OptiPen, ClikSTAR, Tactipen, Autopen 24, AllStar y AllStar PRO que liberan APIDRA en incrementos de 1 unidad de dosis.
Estos cartuchos no se deben utilizar con ninguna otra pluma reutilizable, ya que la exactitud de la dosis está únicamente establecida con las plumas citadas (ver secciones Posología y forma de administración y Precauciones especiales de eliminación y otras manipulaciones).
En su país, puede que solamente estén comercializadas algunas de estas plumas.
Errores de medicación:
Se han notificado errores de medicación, en los cuales se han administrado de forma accidental otras insulinas, en particular insulinas de acción prolongada, en lugar de insulina glulisina. Se debe comprobar siempre la etiqueta de insulina antes de cada inyección para evitar errores de medicación entre insulina glulisina y otras insulinas.
APIDRA 100 Unidades/ml solución inyectable en un vial:
Perfusión continua subcutánea de insulina.
El mal funcionamiento de la bomba de insulina o del dispositivo de perfusión o errores en el manejo pueden conducir rápidamente a hiperglucemia, cetosis y cetoacidosis diabética. Es necesaria la rápida identificación y corrección de la causa de la hiperglucemia o cetosis o cetoacidosis diabética.
Se han notificado casos de cetoacidosis diabética cuando se ha administrado APIDRA en perfusión continua subcutánea de insulina con un sistema de bomba. La mayoría de los casos estaban relacionados con errores en el manejo o con un fallo del sistema de bomba.
Temporalmente, se pueden requerir inyecciones subcutáneas con APIDRA. Los pacientes que utilizan un tratamiento con bombas de perfusión continua subcutánea de insulina deben de ser instruidos para administrar inyecciones de insulina y tener un sistema alternativo de administración de insulina disponible en caso de fallo del sistema de bomba (ver sección Posología y forma de administración y Reacciones adversas).
Excipientes:
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por dosis, por lo que se considera esencialmente “exento de sodio”.
APIDRA contiene metacresol, que puede causar reacciones alérgicas.
Combinación de APIDRA con pioglitazona:
Se han notificado casos de insuficiencia cardíaca cuando se utiliza pioglitazona en combinación con insulina, sobre todo en pacientes con factores de riesgo para el desarrollo de insuficiencia cardíaca. Esto deberá tenerse en cuenta si se considera el tratamiento con la combinación de pioglitazona y APIDRA. Si se usa esta combinación, se deben observar a los pacientes por si aparecen signos y síntomas de insuficiencia cardíaca, aumento de peso y edema. Se debe interrumpir el tratamiento con pioglitazona si se produce cualquier deterioro de los síntomas cardíacos.
APIDRA SoloStar 100 Unidades/ml solución inyectable en una pluma precargada:
Manejo de la pluma precargada SoloStar:
APIDRA SoloStar 100 Unidades/ml en pluma precargada sólo es adecuado para inyecciones subcutáneas. Si fuera necesaria la administración con jeringa, inyección intravenosa o bomba de perfusión, se debe utilizar un vial.
Antes de utilizar SoloStar, se deben leer las Instrucciones de uso incluidas en el prospecto detenidamente. SoloStar debe ser utilizado como se recomienda en estas Instrucciones de uso (ver sección Precauciones especiales de eliminación y otras manipulaciones).
POSOLOGÍA Y FORMA DE ADMINISTRACIÓN:
Posología:
La potencia de este medicamento se establece en unidades. Estas unidades son exclusivas de APIDRA y no son las mismas que las UI o las unidades utilizadas para expresar la potencia de otros análogos de insulina (ver sección Propiedades farmacodinámicas).
APIDRA debe utilizarse en regímenes que incluyen una insulina de acción prolongada o intermedia o un análogo de insulina basal y puede utilizarse con agentes hipoglucémicos orales. La dosis de APIDRA debe ser ajustada de forma individual.
Poblaciones especiales:
Insuficiencia renal:
Las propiedades farmacocinéticas de la insulina glulisina generalmente se mantienen en pacientes con insuficiencia renal. Sin embargo en caso de insuficiencia renal, las necesidades de insulina podrían reducirse (ver sección Propiedades farmacocinéticas).
Insuficiencia hepática:
En pacientes con disminución de la función hepática, las propiedades farmacocinéticas de la insulina glulisina no han sido investigadas. En pacientes con insuficiencia hepática, las necesidades de insulina podrían disminuir debido a la reducida capacidad para la gluconeogénesis y el reducido metabolismo de insulina.
Pacientes de edad avanzada:
Existen datos farmacocinéticos limitados en pacientes de edad avanzada con diabetes mellitus. El deterioro de la función renal podría llevar a una disminución de las necesidades de insulina.
Población pediátrica:
No existe información clínica suficiente sobre el uso de APIDRA en niños menores de 6 años.
Forma de administración:
APIDRA 100 Unidades/ml solución inyectable en un vial:
Vía intravenosa:
APIDRA puede administrarse por vía intravenosa. Debe ser administrado por profesionales sanitarios. APIDRA no debe mezclarse con glucosa o solución de Ringer ni con ninguna otra insulina.
Perfusión continua subcutánea de insulina:
APIDRA se puede utilizar en Perfusión Continua Subcutánea de Insulina (PCSI), en sistemas de bomba adecuados para la perfusión de insulina con catéteres y reservorios adecuados. Los pacientes que utilizan PCSI deben ser instruidos de manera clara en el uso del sistema de bomba.
El dispositivo de perfusión y el reservorio utilizados con APIDRA deben cambiarse al menos cada 48 horas utilizando una técnica aséptica. Estas instrucciones pueden diferir de las instrucciones generales del manual de la bomba. Cuando se use APIDRA, es importante que los pacientes sigan las instrucciones específicas para APIDRA. El no seguir las instrucciones específicas para APIDRA podría conducir a reacciones adversas graves.
Cuando se utilice con una bomba de perfusión de insulina, APIDRA no debe mezclarse con diluyentes o ninguna otra insulina.
Los pacientes que se administran APIDRA en PCSI deben tener disponible un sistema alternativo de administración de insulina en caso de fallo del sistema de bomba (ver sección Advertencias y precauciones especiales de empleo y Reacciones adversas).
APIDRA 100 Unidades/ml solución inyectable en un vial:
Para más información acerca de la manipulación, ver sección Precauciones especiales de eliminación y otras manipulaciones.
APIDRA 100 Unidades/ml solución inyectable en un cartucho:
APIDRA 100 Unidades/ml en cartuchos sólo es adecuado para inyecciones subcutáneas con una pluma reutilizable. Si fuera necesaria la administración con jeringa, inyección intravenosa o bomba de perfusión, se debe utilizar un vial (ver sección Advertencias y precauciones especiales de empleo). Para más información acerca de la manipulación, ver sección Precauciones especiales de eliminación y otras manipulaciones.
APIDRA SoloStar 100 Unidades/ml solución inyectable en una pluma precargada:
APIDRA SoloStar 100 unidades/ml en pluma precargada sólo es adecuado para inyecciones subcutáneas. Si fuera necesaria la administración con jeringa, inyección intravenosa o bomba de perfusión, se debe utilizar un vial (ver sección Advertencias y precauciones especiales de empleo).
Vía subcutánea:
APIDRA debe administrarse mediante inyección subcutánea poco tiempo (0-15 minutos) antes o después de las comidas o mediante bomba de perfusión continua subcutánea.
APIDRA debe administrarse subcutáneamente en la pared abdominal, muslo o deltoide o por perfusión continua en la pared abdominal. Los lugares de inyección y perfusión dentro de un área de inyección (abdomen, muslo o deltoide) deben alternarse de una inyección a otra para reducir el riesgo de lipodistrofia y amiloidosis cutánea (ver secciones Advertencias y precauciones especiales de empleo y Reacciones adversas).
La velocidad de absorción y consecuentemente el comienzo y la duración de acción, pueden verse afectados por el lugar de inyección, el ejercicio y otras variables. La inyección subcutánea en la pared abdominal asegura una absorción un poco más rápida que en los otros lugares de inyección (ver sección Propiedades farmacocinéticas).
Debe tenerse precaución para no atravesar un vaso sanguíneo. Después de la inyección, no debe masajearse el lugar de inyección. Los pacientes deben ser educados en técnicas de inyección adecuadas.
Mezcla con insulinas:
Cuando de administre como inyección subcutánea, APIDRA no debe mezclarse con otros medicamentos salvo insulina humana NPH.
Para más detalles sobre la manipulación, ver sección Precauciones especiales de eliminación y otras manipulaciones.
Antes de utilizar SoloStar, las Instrucciones de uso incluidas en el prospecto se deben leer detenidamente (ver sección Precauciones especiales de eliminación y otras manipulaciones).
SOBREDOSIS:
Síntomas:
Podría aparecer hipoglucemia como resultado de un exceso de la actividad de la insulina relacionada con la ingesta de comida y el gasto de energía.
No existen datos disponibles específicos de sobredosis con insulina glulisina. Sin embargo, la hipoglucemia podría desarrollarse en etapas consecutivas.
Tratamiento:
Los episodios de hipoglucemia leves pueden tratarse mediante la administración oral de glucosa o productos con azúcar. Por ello se recomienda que el paciente diabético siempre lleve terrones de azúcar, caramelos, galletas o zumo de fruta azucarado.
Los episodios de hipoglucemia graves, cuando los pacientes pierden la conciencia, pueden tratarse con glucacón (0,5 mg a 1 mg) administrado por vía intramuscular o subcutánea por una persona que haya recibido las instrucciones adecuadas, o con glucosa administrada por vía intravenosa por un profesional sanitario. También se debe administrar glucosa por vía intravenosa, si el paciente no responde al glucagón después de 10 a 15 minutos.
Después de recobrar el conocimiento, se recomienda la administración oral de carbohidratos al paciente para evitar una recaída.
Después de la inyección de glucagón, el paciente debería monitorizarse en un hospital para encontrar la causa de esta hipoglucemia grave y prevenir otros episodios similares.
REVISIÓN LOCAL:
23/02/2022
Versión 1.0
FABRICANTE:
Sanofi-Aventis Deutschland GmbH D-65926 Frankfurt am Main Alemania.
NATURALEZA Y CONTENIDO DEL ENVASE:
APIDRA 100 Unidades/ml solución inyectable en un vial:
Solución de 10 ml en un vial (vidrio incoloro de tipo I) con un tapón (goma de elastómero de clorobutilo y cápsula de aluminio con pestaña) y una cubierta de polipropileno extraíble. Está disponible en envases de 1, 2, 4 y 5 viales.
Puede que solamente estén comercializados algunos tamaños de envases.
APIDRA 100 Unidades/ml solución inyectable en un cartucho:
Solución de 3 ml en un cartucho (vidrio incoloro de tipo I) con un émbolo (goma de elastómero de bromobutilo) y una cubierta con pestaña (aluminio) con un tapón (goma de elastómero de bromobutilo). Está disponible en envases de 1, 3, 4, 5, 6, 8, 9 y 10 cartuchos.
Puede que solamente estén comercializados algunos tamaños de envases.
APIDRA SoloStar 100 Unidades/ml solución inyectable en una pluma precargada:
Solución de 3 ml en un cartucho (vidrio incoloro) con un émbolo (goma de elastómero de bromobutilo) y una cápsula con pestaña (aluminio) con un tapón (goma de elastómero de bromobutilo). El cartucho se encuentra sellado en una pluma precargada desechable. Está disponible en envases de 1, 3, 4, 5, 6, 8, 9 y 10 plumas.
Puede que solamente estén comercializados algunos tamaños de envases.
PERIODO DE VALIDEZ:
2 años
APIDRA 100 Unidades/ml solución inyectable en un vial:
Periodo de validez después del primer uso del vial:
El medicamento se puede conservar durante un máximo de 4 semanas por debajo de 25ºC protegido de la luz y el calor directo. Mantener el vial en el embalaje exterior para protegerlo de la luz.
Se recomienda anotar en la etiqueta la fecha de la primera utilización del vial. Periodo de validez para la vía intravenosa
La insulina glusilina por vía intravenosa a una concentración de 1 Unidad/ml es estable entre 15ºC y 25ºC durante 48 horas (ver sección Precauciones especiales de eliminación y otras manipulaciones).
APIDRA 100 Unidades/ml solución inyectable en un cartucho:
Periodo de validez después del primer uso del cartucho:
El medicamento puede conservarse durante un máximo de 4 semanas por debajo de 25ºC protegido de la luz y el calor directo.
La pluma que contenga un cartucho no debe guardarse en la nevera.
La tapa de la pluma debe colocarse de nuevo en la pluma tras cada inyección para protegerlo de la luz.
APIDRA SoloStar 100 Unidades/ml solución inyectable en una pluma precargada:
Periodo de validez después del primer uso de la pluma:
El medicamento puede conservarse durante un máximo de 4 semanas por debajo de 25ºC protegido de la luz y del calor directo. La pluma en uso no debe guardarse en la nevera. La tapa de la pluma debe colocarse de nuevo en la pluma tras cada inyección para protegerla de la luz.
PRECAUCIONES ESPECIALES DE CONSERVACIÓN:
APIDRA 100 Unidades/ml solución inyectable en un vial:
Viales sin abrir:
Conservar en nevera (entre 2ºC y 8ºC). No congelar.
No colocar APIDRA cerca del compartimento del congelador o junto a un acumulador de frío. Conservar el vial en el embalaje exterior para protegerlo de la luz.
Viales abiertos:
Para las condiciones de conservación tras la primera apertura del medicamento, ver sección Periodo de validez.
APIDRA 100 Unidades/ml solución inyectable en un cartucho:
Cartuchos sin abrir:
Conservar en nevera (entre 2ºC y 8ºC). No congelar.
No colocar APIDRA cerca del compartimento del congelador o junto a un acumulador de frío. Conservar el cartucho en el embalaje exterior para protegerlo de la luz.
Cartuchos en uso:
Para las condiciones de conservación tras la primera apertura del medicamento, ver sección Periodo de validez.
APIDRA SoloStar 100 Unidades/ml solución inyectable en una pluma precargada:
Plumas sin utilizar:
Conservar en nevera (entre 2 ºC y 8 ºC). No congelar.
No colocar APIDRA cerca del compartimento del congelador o junto a un acumulador de frío. Conservar la pluma precargada en el embalaje exterior para protegerla de la luz.
Plumas en uso:
Para las condiciones de conservación tras la primera apertura del medicamento, ver sección Periodo de validez.
REFERENCIA:
Agencia Europea de Medicamentos – EMA
APIDRA
Diciembre 2021
https://www.ema.europa.eu/en/documents/product-information/apidra-epar-product-information_es.pdf