
HALOVATE
HALOBETASOL
Crema
Tubo , 15 g Crema , 0.05 Gramos
Tubo , 30 g Crema , 0.05 Gramos
COMPOSICIÓN:
Cada 100 g contiene:
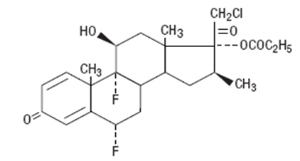
Propionato de halobetasol 0.05 g
Excipientes: Vaselina blanca, cetomacrogol , alcohol cetílico, glicerol monosestearato, polioxil 20 cetil éter, polioxil estearil éter, palmitato de isopropilo, butil hidroxitolueno, metilparabeno, propilparabeno, propilenglicol, fosfato monobásico de sodio dihidrato, fosfato dibásico de sodio anhidro, dietilenglicol monoetil éter y agua purificada.
Solo para uso dermatológico, no para su uso oftalmológico
INFORMACIÓN ADICIONAL:
• Almacénese a temperatura no mayor de 30 °C.
• No usar después de la fecha de vencimiento indicada en el envase.
• Mantener fuera del alcance de los niños.
• Venta con receta médica.
Fabricado por: Glenmark Pharmaceuticals Ltd.
Plot No. S-7, Colvale Industrial Estate, Colvale, Bardez, Goa, India
™ Trade Mark
Importado por:
GLENMARK PHARMACEUTICALS PERÚ S.A
INDICACIONES:
Propionato de halobetasol crema es un corticosteroide de potencia muy alta indicado para el alivio de manifestaciones inflamatorias y pruríticas de dermatosis que se tratan con corticosteroide.
Usos: No se recomienda su uso en tratamientos que excedan las dos semanas, y la dosis total no debe ascender a 50 g por semana debido a la potencia que presenta el medicamento para suprimir el eje hipotalámico-hipofisario-adrenal (HPA).
No se recomienda su uso en niños menores de 12 años. Como otros corticosteroides altamente activos, su aplicación debe descontinuarse una vez el problema se haya controlado. Si no presenta mejora en un periodo de 2 semanas, puede que se requiera una reevaluación del diagnóstico.
ACCIÓN FARMACOLÓGICA:
Propionato de halobetasol, un corticosteroide sintético para uso dermatológico tópico. Los corticosteroides constituyen una clase de esteroides sintéticos primarios que se emplean de manera tópica como un agente antiinflamatorio y antiprurítico.
Corticosteroide tópico, propionato de halobetasol tiene acciones antiinflamatorias, antipruríticas y vasoconstrictora. Por lo general, el mecanismo de la actividad antiinflamatoria del corticosteroide tópico no es claro. Por lo tanto, se cree que los corticosteroides actúan mediante la inducción de proteínas inhibidoras de fosfolipasa A, denominadas colectivamente como lipocortinas. Se postula que estas proteínas controlan la biosíntesis de los potentes mediadores de inflamación, tales como las prostaglandinas y leucotrienes inhibiendo la liberación de su ácido araquidónico precursor común. El ácido araquidónico es liberado de los fosfolípidos en las membranas mediante fosfolipasa A2.
Farmacocinética: La extensión de la absorción percutánea del corticosteroide tópico se determina a través de diversos factores, que incluyen el transporte e integridad de la barrera epidérmica. No se ha demostrado que los vendajes oclusivos con hidrocortisona durante más de 24 horas incrementen su penetración; sin embargo, la oclusión de hidrocortisona durante 96 horas aumenta su penetración notablemente. Los corticosteroides tópicos pueden absorberse de piel intacta normal. Alguna inflamación y/o cualquier otro proceso de trastorno en la piel pueden incrementar la absorción percutánea.
Se indica que menos del 6% de la dosis aplicada de propionato de halobetasol entra en circulación dentro de las 96 horas tras su administración.
Propionato de halobetasol se encuentra en el rango de potencia muy alta, en comparación con otros corticosteroides tópicos.
CONTRAINDICACIONES:
El uso de propionato de halobetasol está contraindicado para pacientes con antecedentes de hipersensibilidad a cualquiera de los componentes de la preparación.
REACCIONES ADVERSAS:
Las reacciones adversas que se han reportado son:
• Más frecuentes: Escozor, ardor o comezón.
• Menos frecuentes: Pustulación, eritema, atrofia cutánea, leucoderma, acné, comezón, infección secundaria, telangiectasia, urticaria, piel seca, miliaria, parestesia y erupción. Las siguientes reacciones adversas locales no se reportan de manera frecuente con el uso de corticosteroides tópicos; sin embargo, su ocurrencia puede producirse con corticosteroides de potencia alta, como en el caso de propionato de halobetasol. Estas reacciones se listan en un orden descendiente estimado de incidencia: Foliculitis, hipertricosis,erupciones acneiformes (erupción cutánea en forma de acné), hipopigmentación de la piel, dermatitis perioral, dermatitis alérgica de contacto, infección secundaria, estrías y miliaria.
Se debe comunicar a su médico o a su farmacéutico cualquier reacción adversa que no estuviese descrita en el inserto.
INTERACCIONES CON OTROS MEDICAMENTOS:
No se encuentra disponible información acerca de interacciones reportadas con el uso de propionato de halobetasol.
ADVERTENCIAS ESPECIALES:
Embarazo: Efectos teratógenos: Categoría en embarazo C
No hay estudios adecuados ni bien controlados del potencial teratógeno de propionato de halobetasol en mujeres embarazadas. Por lo tanto, debe utilizarse en mujeres embarazadas sólo si el beneficio potencial justifica el riesgo potencial para el feto.
Las formulaciones que contengan esteroides potentes, como halobetasol, no deben emplearse de sobre manera, en grandes cantidades o en periodos extendidos de tiempo en pacientes gestantes o en pacientes que planeen quedar embarazadas.
Madres en lactancia: El corticosteroide administrado de manera sistémica se presenta en la leche materna humana y podría afectar el crecimiento, interferir con la producción endógena de corticosteroide o causar otros efectos adversos. Se desconoce si la administración tópica del corticosteroide podría resultar en una absorción sistémica suficiente como producirse en cantidades detectables en la leche materna humana. Debido a que muchos medicamentos son excretados a través de la leche materna humana, se debe tener cuidado cuando se administre propionato de halobetasol a una madre en lactancia.
Uso pediátrico: No se ha establecido la seguridad y efectividad de propionato de halobetasol; por lo tanto no se recomienda su uso en pacientes pediátricos menores de 12 años de edad. Debido a la alta relación entre el área de la superficie de la piel y la masa corporal, los pacientes pediátricos presentan un mayor riesgo de supresión del eje hipotalámico-hipofisario-adrenal (HPA) y del síndrome de Cushing en comparación con los adultos, cuando se les administra corticosteroides. Como consecuencia, los pacientes pediátricos presentan un mayor riesgo de sufrir de insuficiencia adrenal durante o después de la interrupción del tratamiento. Los efectos adversos, que incluyen estrías, se han reportado con el uso adecuado del corticosteroide tópico en infantes y niños.
Se ha reportado casos de supresión del eje HPA, síndrome de Cushing, retraso en el crecimiento longitudinal, retraso en el aumento de peso e hipertensión intracraneal en niños que reciben corticosteroides tópicos. Las manifestaciones de supresión adrenal en niños incluyen niveles bajos de cortisol en el plasma y ausencia de respuestas a la estimulación con ACTH. Las manifestaciones de hipertensión intracraneal incluyen fontanelas abultadas, dolores de cabeza y edema de papila bilateral.
Uso geriátrico: No se reportan diferencias en general entre la seguridad o efectividad entre pacientes geriátricos y los pacientes jóvenes; además, otra experiencia clínica reportada no ha identificado diferencias en las respuestas entre pacientes adultos y jóvenes, sin embargo, no se puede descartar una mayor sensibilidad en algunos individuos mayores.
ADVERTENCIAS Y PRECAUCIONES:
Advertencias: No se recomienda el uso oftalmológico, oral o intravaginal de propionato de halobetasol.
Precauciones:
Generales: La absorción sistémica de corticosteroides tópicos puede producir supresión del eje hipotalámico-pituitaria-adrenal reversible (HPA) con la posibilidad de insuficiencia glucocorticosteroide después de detener el tratamiento. Las manifestaciones de síndrome de Cushing, hiperglucemia y glucosuria también se pueden producir en algunos pacientes por absorción sistémica de corticosteroides tópicos durante el tratamiento.
Los pacientes que apliquen un esteroide tópico a una superficie grande o áreas bajo oclusión deben ser evaluados periódicamente para detectar supresión del eje HPA. Esto se puede llevar a cabo mediante una prueba de estimulación con ACTH, una prueba de cortisol en el plasma A.M. y una prueba para determinar la ausencia de cortisol en la orina. El tratamiento para los pacientes que reciban corticosteroides altamente potentes no debe exceder el periodo de 2 semanas; asimismo, solo pequeñas áreas deben ser tratadas a la vez debido al riesgo incrementado de producirse la supresión del HPA.
En pacientes con psoriasis, propionato de halobetasol puede producir la supresión del eje HPA cuando se emplea en dosis divididas de 7 gramos por día durante una semana. Sin embargo, dichos efectos fueron reversibles con la interrupción del tratamiento.
Si se observa la supresión del eje HPA, se debe hacer un intento de retirar el medicamento, de reducir la frecuencia de aplicación o de sustituir un esteroide menos potente. Por lo general, la recuperación del funcionamiento del eje HPA se genera con la interrupción del corticosteroide tópico. Raramente, puede ocurrir que las señales o síntomas de insuficiencia glucocorticosteroide requieran de la aplicación adicional de corticosteroide sistémico.
Los pacientes pediátricos pueden ser más susceptibles a la toxicidad sistémica con dosis equivalentes debido a las relaciones más grandes de superficie de la piel a masa corporal (ver Precauciones: Uso pediátrico).
En caso se desarrolle irritación, la aplicación de propionato de halobetasol debe descontinuarse y se debe realizar la terapia adecuada. Por lo general, la dermatitis alérgica de contacto con corticosteroides se diagnostica al observarse la incapacidad para sanar en vez de notarse una exacerbación clínica como sucede con la mayoría de los productos tópicos que no contienen corticosteroides. Tal observación se debe corroborar con el debido examen de parches para su diagnóstico.
En caso se presente o desarrolle infecciones a la piel, se debe instituir el uso de un agente antimicótico o antibacteriano apropiado. Si no se produce una respuesta favorable inmediata, se debe suspender el uso del corticosteroide hasta que la infección se controle adecuadamente.
Propionato de halobetasol está contraindicado para el tratamiento de rosácea o dermatitis perioral y no se debe aplicar en el rostro, ingle o axilas.
Pruebas de laboratorio: Las siguientes pruebas pueden ayudar a evaluar pacientes para confirmar supresión del eje HPA: Examen de estimulación con ACTH, una prueba de cortisol en el plasma A.M. y una prueba para determinar la ausencia de cortisol en la orina.
DOSIS Y ADMINISTRACIÓN:
Aplicar una capa delgada de propionato de halobetasol crema sobre las áreas afectadas de la piel una o dos veces al día, por recomendación del médico y frotar suavemente y en su totalidad.
Propionato de halobetasol es un corticosteroide de potencia muy alta; por lo tanto, su aplicación debe limitarse a las dos semanas y no se debe emplear en cantidades que excedan los 50 g por semana. Como otros corticosteroides, su aplicación debe descontinuarse una vez el problema se haya controlado. Si no presenta mejora en un periodo de 2 semanas, puede que se requiera una reevaluación del diagnóstico.
No se recomienda el uso de propionato de halobetasol con vendajes oclusivos.
Instrucciones para los pacientes: Los pacientes que hagan uso de corticosteroides tópicos deben recibir la siguiente información e instrucciones:
1. El medicamento debe usarse tal como el médico lo indica. Es de uso estrictamente externo. Evitar el contacto con los ojos.
2. El medicamento no debe emplearse en otros tratamientos que no sea para el que se ha prescrito.
3. El área de la piel que está siendo tratada no debe vendarse, cubrirse o envolverse, o en estar en estado oclusivo a menos que el médico así lo haya prescrito.
4. Los pacientes deben reportar a sus médicos cualquier señal de reacciones adversas locales.
SOBREDOSIS:
Propionato de halobetasol aplicado de manera tópica puede absorberse en cantidades suficientes para producir efectos sistémicos.