
INVEGA SUSTENNA
PALIPERIDONA
Suspensión inyectable
Caja, 1 Jeringa(s) precargada(s), Suspensión inyectable de liberación prolongada, 50/0.5 mg/ml
Caja, 1 Jeringa(s) precargada(s), Suspensión inyectable de liberación prolongada, 75/0.75 mg/ml
Caja, 1 Jeringa(s) precargada(s), Suspensión inyectable de liberación prolongada, 100/1.0 mg/ml
Caja, 1 Jeringa(s) precargada(s), Suspensión inyectable de liberación prolongada, 150/1.5 mg/ml
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA:
INVEGA® SUSTENNA® 25 mg/0.25 ml:
Cada JERINGA PRECARGADA contiene: 39 mg de palmitato de paliperidona equivalentes a 25 mg de paliperidona, Excipientes (ver Lista de excipientes).
INVEGA® SUSTENNA® 50 mg/0.50 ml:
Cada JERINGA PRECARGADA contiene: 78 mg de palmitato de paliperidona equivalentes a 50 mg de paliperidona, Excipientes (ver Lista de excipientes).
INVEGA® SUSTENNA® 75 mg/0.75 ml:
Cada JERINGA PRECARGADA contiene 117 mg de palmitato de paliperidona equivalentes a 75 mg de paliperidona, Excipientes (ver Lista de excipientes).
INVEGA® SUSTENNA® 100 mg/1.0 ml:
Cada JERINGA PRECARGADA contiene: 156 mg de palmitato de paliperidona equivalentes a 100 mg de paliperidona, Excipientes (ver Lista de excipientes).
INVEGA® SUSTENNA® 150 mg/1.5 ml:
Cada JERINGA PRECARGADA contiene: 234 mg de palmitato de paliperidona equivalentes a 150 mg de paliperidona, Excipientes (ver Lista de excipientes).
INDICACIONES Y USO:
INVEGA® SUSTENNA® (palmitato de paliperidona) está indicado para el tratamiento de:
• La esquizofrenia [véase Estudios clínicos].
• El trastorno esquizoafectivo como monoterapia y como complemento de los estabilizadores del humor o antidepresivos [véase sección Estudios clínicos].
DATOS FARMACÉUTICOS:
Lista de excipientes: Polisorbato 20; polietilenglicol 4000, ácido cítrico monohidrato, fosfato disódico de hidrógeno anhidro, fosfato sódico dihidrógeno monohidrato, hidróxido de sodio, agua para inyección.
Incompatibilidades: Este medicamento no debe mezclarse con otros medicamentos.
Período de validez: 2 años
No utilice INVEGA® SUSTENNA® después de la fecha de caducidad o expira que aparece en el envase. La fecha de caducidad o expira es el último día del mes que se indica.
Precauciones especiales de conservación: Consérvese a no más de 30 °C.
Manténgase fuera del alcance de los niños.
Precauciones especiales de eliminación: La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma ayudará a proteger el medio ambiente.
CONTRAINDICACIONES:
INVEGA® SUSTENNA® está contraindicado en pacientes con hipersensibilidad conocida a la paliperidona o risperidona o a cualquier de los excipientes de la formulación INVEGA® SUSTENNA®. Las reacciones de hipersensibilidad, incluyendo reacciones anafilácticas y angioedema, se han reportado en los pacientes tratados con risperidona y en pacientes tratados con paliperidona. Palmitato de paliperidona se convierte a la paliperidona, que es un metabolito de la risperidona.
REACCIONES ADVERSAS:
En personas que toman medicamentos que contienen risperidona, paliperidona o palmitato de paliperidona existe el riesgo de desarrollar síndrome de iris flácido intraoperatorio (IFIS) durante y después de la cirugía de cataratas.
Los siguientes son discutidos con más detalle en otras secciones del etiquetado:
• Aumento de la mortalidad en pacientes ancianos con psicosis relacionada con demencia [véase Advertencias y precauciones].
• Reacciones adversas cerebrovasculares, incluyendo accidente cerebrovascular, en pacientes ancianos con psicosis relacionada con demencia [véase Advertencias y precauciones].
• Síndrome neuroléptico maligno [véase Advertencias y precauciones].
• Intervalo QT [véase Advertencias y precauciones].
• Discinesia tardía [véase Advertencias y precauciones].
• Cambios metabólicos [véase Advertencias y precauciones]
• Hipotensión ortostática y síncope [véase Advertencias y precauciones].
• Leucopenia, neutropenia y agranulocitosis [véase Advertencias y precauciones].
• Hiperprolactinemia [véase Advertencias y precauciones].
• Potencial para el deterioro cognitivo y motor [véase Advertencias y precauciones].
• Convulsiones [véase Advertencias y precauciones].
• Disfagia [véase Advertencias y precauciones].
• Priapismo [véase Advertencias y precauciones].
• Interrupción de Regulación de Temperatura Corporal [véase Advertencias y precauciones].
La más común (al menos el 5% en cualquier grupo INVEGA® SUSTENNA®) y probablemente relacionado con el fármaco (eventos adversos para los que la tasa del fármaco es al menos el doble de la tasa de placebo) reacciones adversas doble ciego, controlados con placebo en sujetos con esquizofrenia fueron reacciones en el lugar de la inyección, somnolencia/sedación, mareos, acatisia y trastorno extrapiramidal. Ningunas ocurrencias de eventos adversos alcanzaron este umbral en el estudio a largo plazo doble ciego, controlado con placebo en sujetos con trastorno esquizoafectivo.
Los datos descritos en esta sección se derivan de una base de datos de ensayos clínicos que consta de un total de 3.817 sujetos (aproximadamente 1.705 pacientes- año de exposición) con esquizofrenia que recibieron al menos una dosis de INVEGA® SUSTENNA® en el rango de dosis recomendada de 39 mg a 234 mg y un total de 510 sujetos con esquizofrenia que recibieron placebo. Entre los 3.817 sujetos tratados con INVEGA® SUSTENNA®, 1.293 recibieron INVEGA® SUSTENNA® en cuatro dosis fija, doble ciego, controlados con placebo (estudios uno de 9 semanas y tres de 13 semanas), 849 recibieron INVEGA® SUSTENNA® en el ensayo de mantenimiento (la media de exposición 229 días durante el estudio inicial de la fase de etiqueta abierta de 33 semanas, de los cuales 205 siguieron recibiendo INVEGA® SUSTENNA® durante el estudio de la fase doble ciego controlada con placebo, [exposición media de 171 días]), y 1675 recibió INVEGA® SUSTENNA® en cinco ensayos no controlados con placebo (tres ensayos de comparación activo de no inferioridad, un estudio farmacocinético y de seguridad de etiqueta abierta a largo plazo en el lugar de la inyección [deltoides glúteo-] ensayo cruzado ). Uno de los estudios de 13 semanas incluyó una dosis de iniciación INVEGA® SUSTENNA® de 234 mg seguido del tratamiento con 39 mg, 156 mg, o 234 mg cada 4 semanas.
La seguridad de INVEGA® SUSTENNA® también se evaluó en un estudio a largo plazo en adultos con trastorno esquizoafectivo. Un total de 667 sujetos recibieron INVEGA® SUSTENNA® durante el estudio inicial del período de etiqueta abierta de 25 semanas (media exposición de 147 días); 164 sujetos continuaron recibiendo INVEGA® SUSTENNA® durante el estudio del período doble ciego controlado con placebo de 15 meses (media exposición de 446 días). Las reacciones adversas que se produjeron con más frecuencia en INVEGA® SUSTENNA® que en el grupo placebo (una diferencia del 2% o más entre los grupos) aumentaron de peso, nasofaringitis, dolor de cabeza, la hiperprolactinemia, y pirexia.
Experiencia de ensayos clínicos: Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica clínica.
Reacciones adversas notificados con frecuencia en ensayos doble ciego, controlado con placebo: La Tabla 10 enumera las reacciones adversas notificadas en un 2% o más de los sujetos tratados con INVEGA® SUSTENNA® y en una proporción mayor que en el grupo placebo con esquizofrenia en los ensayos de cuatro dosis fija, doble ciego, controlados con placebo.
Tabla 10. Reacciones adversas en ≥ 2% de los pacientes con esquizofrenia tratados con INVEGA® SUSTENNA® (y mayor que el placebo) en los ensayos controlados con placebo, de cuatro dosis fija y doble ciego.
|
Clase de órgano o sistema Reacción adversa |
INVEGA® SUSTENNA® |
||||||
|
Placeboa (N=510) |
39 mg (N=130) |
78 mg (N=302) |
156 mg (N=312) |
234/39 mgb (N=160) |
234/156 mgb (N=165) |
234/156 mgb (N=165) |
|
|
Porcentaje total de personas con reacciones adversas |
70 |
75 |
68 |
69 |
63 |
60 |
63 |
|
Trastornos gastrointestinales |
|||||||
|
Malestar abdominal/Dolor abdominal alto |
2 |
2 |
4 |
4 |
1 |
2 |
4 |
|
Diarrea |
2 |
0 |
3 |
2 |
1 |
2 |
2 |
|
Sequedad en la boca |
1 |
3 |
1 |
0 |
1 |
1 |
1 |
|
Náuseas |
3 |
4 |
4 |
3 |
2 |
2 |
2 |
|
Dolor de diente |
1 |
1 |
1 |
3 |
1 |
2 |
3 |
|
Vómitos |
4 |
5 |
4 |
2 |
3 |
2 |
2 |
|
Trastornos generales y alteraciones en el lugar de administración |
|||||||
|
Astenia |
0 |
2 |
1 |
<1 |
0 |
1 |
1 |
|
Fatiga |
1 |
1 |
2 |
2 |
1 |
2 |
1 |
|
Dolor en el lugar de la inyección |
2 |
0 |
4 |
6 |
9 |
7 |
10 |
|
Infecciones e infestaciones |
|||||||
|
Nasofaringitis |
2 |
0 |
2 |
2 |
4 |
2 |
2 |
|
Infección de vías respiratorias superiores |
2 |
2 |
2 |
2 |
1 |
2 |
4 |
|
Infección del tracto urinario |
1 |
0 |
1 |
<1 |
1 |
1 |
2 |
|
Investigaciones |
|||||||
|
Aumento de peso |
1 |
4 |
4 |
1 |
1 |
1 |
2 |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
|||||||
|
Dolor de espalda |
2 |
2 |
1 |
3 |
1 |
1 |
1 |
|
Rigidez musculoesquelética |
1 |
1 |
<1 |
<1 |
1 |
1 |
2 |
|
Mialgia |
1 |
2 |
1 |
<1 |
1 |
0 |
2 |
|
Dolor en las extremidades |
1 |
0 |
2 |
2 |
2 |
3 |
0 |
|
Trastornos del sistema nervioso |
|||||||
|
Acatisia |
3 |
2 |
2 |
3 |
1 |
5 |
6 |
|
Mareos |
1 |
6 |
2 |
4 |
1 |
4 |
2 |
|
Síndrome extrapiramidal |
1 |
5 |
2 |
3 |
1 |
0 |
0 |
|
Dolor de cabeza |
12 |
11 |
11 |
15 |
11 |
7 |
6 |
|
Somnolencia/sedación |
3 |
5 |
7 |
4 |
1 |
5 |
5 |
|
Trastornos psiquiátricos |
|||||||
|
Agitación |
7 |
10 |
5 |
9 |
8 |
5 |
4 |
|
Ansiedad |
7 |
8 |
5 |
3 |
5 |
6 |
6 |
|
Pesadillas |
<1 |
2 |
0 |
0 |
0 |
0 |
0 |
|
Trastornos respiratorios, torácicos y mediastínicos |
|||||||
|
Tos |
1 |
2 |
3 |
1 |
0 |
1 |
1 |
|
Trastornos vasculares |
|||||||
|
Hipertensión |
1 |
2 |
1 |
1 |
1 |
1 |
0 |
|
Los porcentajes se redondearán a números enteros. El cuadro incluye los eventos adversos que se informaron en un 2% o más de los sujetos en cualquiera de los grupos de dosis de INVEGA® SUSTENNA® y que se produjeron en mayor incidencia que en el grupo placebo. a El grupo placebo ha sido agrupado de todos los ensayos e incluye inyecciones en el deltoides o el glúteo, dependiendo del diseño del estudio. b Inyección inicial de 234 mg en el deltoides, seguida de una inyección de 39 mg, 156 mg o 234 mg en el deltoides o en el glúteo, cada 4 semanas. Los demás grupos de dosificación (39 mg, 78 mg y 156 mg) corresponden a estudios realizados sólo con inyecciones en los glúteos. [Véase Estudios clínicos] Los eventos adversos para los que la incidencia de INVEGA® SUSTENNA® era igual o menor que el placebo no se enumeran en la tabla, pero fueron los siguientes: dispepsia, trastorno psicótico, la esquizofrenia, y temblor. Los siguientes términos se combinaron: somnolencia/sedación, sensibilidad en los senos/dolor de pecho, malestar abdominal/malestar abdominal dolor superior/estómago, y taquicardia/taquicardia sinusal/ritmo cardíaco aumentado. Todos los eventos adversos de reacción relacionados con el lugar de inyección se cayeron y se agrupan en "reacciones en el lugar de inyección". |
|||||||
Otras reacciones adversas observadas durante la evaluación de ensayo clínico de INVEGA® SUSTENNA®: La siguiente lista no incluye reacciones: 1) ya puesto en una lista en la tabla anterior o en el etiquetado en otros lugares, 2) para los que una causa del fármaco era remota, 3), que eran tan generales como para ser poco informativo, o 4) que no se considera que tiene implicaciones clínicas importantes.
Trastornos cardíacos: Bloqueo auriculoventricular de primer grado, bradicardia, bloqueo de rama, palpitaciones, síndrome de taquicardia postural ortostática, taquicardia.
Trastornos auditivos y laberínticos: Vértigo.
Trastornos oculares: Trastornos del movimiento ocular, ojos rodantes, crisis oculógiras, visión borrosa.
Trastornos gastrointestinales: Estreñimiento, dispepsia, flatulencia, hipersecreción salival.
Trastornos del sistema inmunológico: Hipersensibilidad.
Exploraciones complementarias: Aumento de alanina aminotransferasa, aspartato aminotransferasa, electrocardiograma anormal.
Trastornos del metabolismo y de la nutrición: Disminución del apetito, hiperinsulinemia, aumento del apetito.
Trastornos musculoesqueléticos y del tejido conjuntivo: Artralgia trastornos, rigidez articular, rigidez muscular, espasmos musculares, rigidez muscular, espasmos musculares, rigidez de nuca.
Trastornos del sistema nervioso: Bradicinesia, accidente cerebrovascular, convulsiones, mareos posturales, babeo, disartria, discinesia, distonía, hipertonía, letargo, distonía oromandibular, parkinsonismo, hiperactividad psicomotora, síncope.
Trastornos psiquiátricos: Insomnio, inquietud.
Trastornos del sistema reproductor y mamario: Amenorrea, secreción de las mamas, la disfunción eréctil, galactorrea, ginecomastia, trastorno menstrual, menstruación retrasada, menstruación irregular, la disfunción sexual.
Trastornos respiratorios, torácicos y mediastínicos: Congestión nasal.
Trastornos de piel y del tejido subcutáneo: Erupción medicamentosa, prurito, prurito generalizado, erupción cutánea, urticaria.
Interrupciones debidas a eventos adversos: El porcentaje de sujetos que discontinuaron debido a eventos adversos en estudios de esquizofrenia controlado con placebo, a cuatro dosis fijas, doble ciego fueron similares para INVEGA® SUSTENNA® y sujetos tratados con placebo.
El porcentaje de sujetos que abandonaron debido a eventos adversos en el período de etiqueta abierta de estudio a largo plazo en pacientes con trastorno esquizoafectivo fue del 7,5%. Durante el período doble ciego, controlado con placebo, de ese estudio, el porcentaje de sujetos que discontinuaron debido a eventos adversos fueron del 5,5% y del 1,8% en INVEGA® SUSTENNA® y sujetos tratados con placebo, respectivamente.
Reacciones adversas relacionadas con la dosis: Basado en los datos agrupados de los ensayos de cuatro dosis fija, doble ciego, controlados con placebo en pacientes con esquizofrenia, entre las reacciones adversas que ocurrieron en ≥ 2% de incidencia en los sujetos tratados con INVEGA® SUSTENNA®, sólo aumentó la acatisia con la dosis. La hiperprolactinemia también mostró una relación con la dosis, pero no se produjo en ≥ 2% de incidencia en los sujetos tratados con INVEGA® SUSTENNA® de los estudios de cuatro dosis fija.
Diferencias demográficas: Un examen de los subgrupos de población en los ensayos doble ciego controlados con placebo, no reveló ninguna evidencia de diferencias en la seguridad sobre la base de la edad, sexo o raza solamente; Sin embargo, había pocos sujetos ≥ 65 años de edad.
Síntomas extrapiramidales (EPS): Los datos combinados de los dos ensayos de dosis fija doble ciego controlados con placebo de 13 semanas, en pacientes adultos con esquizofrenia proporcionaron información respecto a los EPS. Varios métodos se utilizaron para medir EPS: (1) la puntuación global Simpson-Angus (cambio medio desde la admisión o la puntuación al final del ensayo) que evalúa ampliamente parkinsonismo, (2) Escala de Calificación de Barnes Acatisia Puntuación de Clasificación Global Clínica (cambio medio desde la línea basal o la puntuación final del ensayo) que evalúa la acatisia, (3) el uso de fármacos anticolinérgicos para tratar EPS, (4) las Puntuaciones de Escala de Movimientos Involuntarios Anormales (cambio desde la línea basal o las puntuaciones final del ensayo) (Tabla 11), y (5) la incidencia de notificaciones espontáneas de EPS (Tabla 12).
Tabla 11. Síntomas extrapiramidales (EPS) evaluado por incidencia de escalas de calificación y uso de medicación anticolinérgica-estudios de esquizofrenia en adultos
|
Porcentaje de sujetos |
||||
|
INVEGA® SUSTENNA® |
||||
|
Escala |
Placebo (N=262) |
39 mg (N=130) |
78 mg (N=223) |
156 mg (N=228) |
|
Parkinsonismoa |
9 |
12 |
10 |
6 |
|
Acatisiab |
5 |
5 |
6 |
5 |
|
Discinesiac |
3 |
4 |
6 |
4 |
|
Uso de fármacos |
||||
|
Anticolinérgicosd |
12 |
10 |
12 |
11 |
|
a Para parkinsonismo, el porcentaje de sujetos con Simpson-Angus puntuación total > 0,3 en el punto final (puntuación total definida como la suma total de ítems dividido por el número de artículos). b Para Acatisia, porcentaje de sujetos con Puntuación Global de Escala de Calificación de Barnes de Acatisia ≥ 2 en el punto final. c Para disquinesia, porcentaje de sujetos con una puntuación ≥ 3 en cualquiera de los 7 primeros artículos o una puntuación ≥ 2 en dos o más de cualquiera de los 7 primeros artículos de Escala de Movimiento Involuntario Anormal en el punto final. d Porcentaje de sujetos que recibieron medicamentos anticolinérgicos para el tratamiento de EPS. |
||||
Tabla 12. Síntomas Extrapiramidales (EPS) Eventos Relacionados por Término Preferido MedDRA - Estudios de Esquizofrenia en Adultos
|
|
Porcentaje de sujetos |
|||
|
INVEGA® SUSTENNA® |
||||
|
Grupo EPS |
Placebo (N=262) |
39 mg (N=130) |
78 mg |
156 mg (N=228) |
|
Porcentaje global de sujetos con EPS-eventos adversos relacionados |
10 |
12 |
11 |
11 |
|
Parkinsonismo |
5 |
6 |
6 |
4 |
|
Hiperquinesia |
2 |
2 |
2 |
4 |
|
Temblor |
3 |
2 |
2 |
3 |
|
Discinesia |
1 |
2 |
3 |
1 |
|
Distonía |
0 |
1 |
1 |
2 |
|
Grupo Parkinsonismo incluye: trastorno extrapiramidal, hipertonía, rigidez musculoesquelética, parkinsonismo, babeo, facies enmascarados, tensión muscular, la hipocinesia. Grupo hiperquinesia incluye: acatisia, síndrome de piernas inquietas, inquietud. Grupo discinesia incluye: discinesia, coreoatetosis, espasmos musculares, mioclonías, discinesia tardía. Grupo Distonía incluye: distonía, espasmos musculares. |
||||
Los resultados a través de todas las fases del estudio de mantenimiento en pacientes con esquizofrenia mostraron resultados comparables. En el ensayo de 9 semanas, a dosis fijas, doble ciego, controlado con placebo, las proporciones de parkinsonismo y acatisia evaluadas por la incidencia de las escalas de calificación fueron mayores en el grupo de 156 mg INVEGA® SUSTENNA® (18% y 11%, respectivamente) que en el grupo INVEGA® SUSTENNA® 78 mg (9% y 5%, respectivamente) y el grupo placebo (7% y 4%, respectivamente).
En el estudio de 13 semanas en sujetos con esquizofrenia que implican dosificación de iniciación de 234 mg, la incidencia de cualquier EPS fue similar a la del grupo de placebo (8%), pero exhibió un patrón relacionado con la dosis con 6%, 10%, y 11% en INVEGA® SUSTENNA® en grupos 234/39 mg, 234/156 mg, y 234/234 mg, respectivamente. La hiperquinesia fue la categoría más frecuente de eventos adversos relacionados con EPS en este estudio, y se informó a una tasa similar entre el grupo placebo (4,9%) y los grupos de INVEGA® SUSTENNA® 234/156 mg (4,8%) y 234/234 mg (5,5%), pero a una tasa menor en el grupo 234/39 mg (1,3%).
En el estudio a largo plazo en pacientes con trastorno esquizoafectivo, tratamiento etiqueta abierta de EPS durante 25 semanas INVEGA® SUSTENNA® eran hiperquinesia (12,3%), parkinsonismo (8,7%), temblor (3,4%), discinesia (2,5%), y distonía (2,1%). Durante el tratamiento doble ciego de 15 meses, la incidencia de cualquier EPS fue similar a la del grupo placebo (8,5% y 7,1% respectivamente). Los eventos adversos más comúnmente reportados en relación con EPS y tratamientos emergentes (> 2%) en cualquier grupo de tratamiento en la fase de doble ciego del estudio (INVEGA® SUSTENNA® frente al placebo) fueron hiperquinesia (3,7% vs. 2,9%), parkinsonismo (3,0% vs. 1,8%), y el temblor (1,2% vs. 2,4%).
Distonía: Los síntomas de distonía, las contracciones prolongadas anormales de grupos de músculos, pueden ocurrir en individuos susceptibles durante los primeros días de tratamiento. Los síntomas de distonía incluyen: espasmo de los músculos del cuello, a veces progresando a opresión en la garganta, dificultad para tragar, dificultad para respirar y/o protrusión de la lengua. Si bien estos síntomas pueden producirse a bajas dosis, ocurren más frecuentemente y con mayor gravedad con alta potencia y en dosis más altas de los fármacos antipsicóticos de primera generación. Un elevado riesgo de distonía aguda se observa en los varones y los grupos de edad más jóvenes.
Prueba de anormalidades de laboratorio: En los datos agrupados de los ensayos a dosis fija, doble ciego, controlado con placebo, 13 semanas, en sujetos con esquizofrenia, una comparación entre los grupos no revelaron diferencias médicamente importantes entre INVEGA® SUSTENNA® y placebo en las proporciones de sujetos experimentan cambios potencial y clínicamente significativos en los parámetros rutinarios de química sérica, hematología, análisis de orina o. Del mismo modo, no hubo diferencias entre INVEGA® SUSTENNA® y el placebo en la incidencia de interrupciones debidas a cambios en la hematología, análisis de orina, o química sérica, incluyendo cambios medios de la línea basal en la glucosa en ayunas, insulina, péptido C, triglicéridos, HDL, LDL y mediciones de colesterol total. Sin embargo, INVEGA® SUSTENNA® se asoció con un aumento de la prolactina sérica [véase Advertencias y precauciones (5.9)]. Los resultados del estudio de 13 semanas con 234 mg de dosis de iniciación, la de 9 semanas, de dosis fija, doble ciego, controlado con placebo, y la fase de doble ciego en el ensayo de mantenimiento en pacientes con esquizofrenia mostraron resultados comparables.
Evaluación del dolor y reacciones locales en el sitio de inyección: En los datos agrupados de los dos ensayos controlados con placebo, de dosis fijas, doble ciego, de 13 semanas, en pacientes con esquizofrenia, la intensidad del dolor de la inyección reportado por los sujetos utilizando una escala analógica visual (0 = no significa dolor a 100 = insoportablemente dolorosa) disminuyó en todos los grupos de tratamiento de la primera a la última inyección (placebo: 10.09 a 09.08; 39 mg: 10.03 a 07.07; 78 mg: 10,0 a 9,2; 156 mg: 11.01 a 08.08). Los resultados de ambos ensayos controlado con placebo, de 9 semanas, a dosis fijas, doble ciego y la fase doble ciego del ensayo mantenimiento exhiben hallazgos comparables.
En el estudio de 13 semanas con 234 mg de dosis de iniciación en pacientes con esquizofrenia, las apariciones de la induración, enrojecimiento o hinchazón, según lo evaluado por el personal de estudio ciego, eran poco frecuentes, generalmente leves, disminuido con el tiempo, y similar en la incidencia entre INVEGA® SUSTENNA® y el grupo placebo. Las puntuaciones del investigador del dolor de la inyección fueron similares en los grupos placebo e INVEGA SUSTENNA. Las evaluaciones del investigador del lugar de la inyección después de la primera inyección en busca de enrojecimiento, hinchazón, induración y dolor fueron calificados como ausente por 69-100% de los sujetos, tanto en INVEGA® SUSTENNA® y el grupo placebo. En el día 92, los investigadores calificaron ausencia de enrojecimiento, hinchazón, induración y dolor en el 95-100% de los sujetos, tanto en INVEGA® SUSTENNA® y el grupo placebo.
Reacciones adversas notificadas en los ensayos clínicos con paliperidona oral: La siguiente es una lista de reacciones adversas adicionales que se han reportado en los ensayos clínicos con paliperidona oral:
Trastornos cardíacos: Bloqueo de rama izquierda, la arritmia sinusal.
Trastornos gastrointestinales: Dolor abdominal, obstrucción del intestino delgado.
Trastornos generales y alteraciones en el lugar de administración: Edema, edema periférico.
Trastornos del sistema inmunológico: Reacción anafiláctica.
Infecciones e infestaciones: Rinitis.
Trastornos musculoesqueléticos y del tejido conjuntivo: Dolor musculoesquelético, tortícolis, trismus.
Trastornos del sistema nervioso: Rigidez en rueda dentada, convulsión de gran mal, marcha parkinsoniana, ataque isquémico transitorio.
Trastornos psiquiátricos: Trastorno del sueño.
Sistema reproductor y trastornos mamarios: Congestión mamaria, sensibilidad en los senos/dolor en las mamas, eyaculación retrógrada.
Trastornos respiratorios, torácicos y mediastínicos: Dolor faringolaríngeo, neumonía por aspiración.
Trastornos de piel y del tejido subcutáneo: Rash papular.
Trastornos vasculares: Hipotensión, isquemia.
Experiencia posterior a la comercialización: Las siguientes reacciones adversas han sido identificadas durante el uso posterior a la aprobación de la paliperidona; ya que estas reacciones fueron reportadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera fiable su frecuencia o establecer una relación causal con la exposición al fármaco. Reacciones ya figuran en la sección de Reacciones adversas, o los considerados en la sección Advertencias y precauciones no figuran en esta lista.
Trastornos de la sangre: Púrpura trombocitopénica trombótica.
Trastornos gastrointestinales: Íleo.
Trastorno genitourinario: Incontinencia urinaria, retención urinaria.
Trastornos del sistema inmunológico: Angioedema, inflamación de la lengua.
Los casos de reacción anafiláctica después de la inyección con INVEGA® SUSTENNA® se han reportado durante la experiencia post-comercialización en pacientes que han tolerado anteriormente risperidona oral o paliperidona oral.
Reacciones adversas notificadas con risperidona: La paliperidona es el principal metabolito activo de la risperidona. Las reacciones adversas notificadas con la risperidona oral y risperidona inyectable de acción prolongada se pueden encontrar en las Reacciones adversas secciones de los prospectos de estos productos.
Notificación de sospechas de reacciones adversas: Si experimenta cualquier tipo de reacción adversa, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este inserto. También puede comunicarlos directamente a través del sistema nacional de notificación. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de Farmacovigilancia: farmacovigilancia@digemid.minsa.gob.pe.
INTERACCIONES DEL FÁRMACO:
Debido a que el palmitato de paliperidona es hidrolizado a paliperidona [véase Farmacología clínica], los resultados de los estudios con paliperidona oral se deben tomar en cuenta al evaluar el potencial de interacción farmacológica.
Capacidad de INVEGA® SUSTENNA® para afectar a otros fármacos: La paliperidona puede antagonizar el efecto de levodopa y otros agonistas de la dopamina.
Debido a su capacidad para inducir hipotensión ortostática, un efecto aditivo puede ocurrir cuando INVEGA® SUSTENNA® es administrado con otros agentes terapéuticos que tienen esta capacidad [véase Advertencias y precauciones].
Ningún ajuste de la dosis es necesario para el litio cuando se coadministra con INVEGA® SUSTENNA®. Interacción farmacocinética entre INVEGA® SUSTENNA® y litio es poco probable.
Ningún ajuste de la dosis es necesario para el valproato cuando se añade INVEGA® SUSTENNA® a la terapia. La farmacocinética en estado estacionario de valproato no se vio afectada cuando los pacientes se administraron conjuntamente con paliperidona oral tabletas de liberación prolongada [véase Farmacología clínica].
No se espera que la paliperidona produzca interacciones farmacocinéticas clínicamente importantes con fármacos que son metabolizados por las isoenzimas del citocromo P450 [véase Farmacología clínica].
Capacidad de otros fármacos para afectar a INVEGA® SUSTENNA®: El inicio de inductores potentes de CYP3A4 y P-gp (por ejemplo, carbamazepina, rifampicina o la hierba de San Juan), puede ser necesario aumentar la dosis de INVEGA® SUSTENNA®. Por el contrario, en la interrupción del potente inductor, puede ser necesario disminuir la dosis de INVEGA® SUSTENNA® [ver Farmacología clínica].
Ningún ajuste de la dosis es necesario para INVEGA® SUSTENNA® cuando se añade valproato al tratamiento [ver Farmacología clínica].
Ningún ajuste de la dosis es necesario para INVEGA® SUSTENNA® cuando se administra conjuntamente con litio. Interacción farmacocinética entre INVEGA® SUSTENNA® y el litio es poco probable.
Los estudios in vitro indican que CYP2D6 y CYP3A4 pueden estar involucrados en el metabolismo de paliperidona; Sin embargo, no hay evidencia in vivo que los inhibidores de estas enzimas afectan significativamente el metabolismo de paliperidona. La paliperidona no es un sustrato de CYP1A2, CYP2A6, CYP2C9 y CYP2C19; una interacción con inhibidores o inductores de estas isoenzimas es poco probable.
ESTUDIOS CLÍNICOS:
La eficacia de INVEGA® SUSTENNA® se estableció en los siguientes estudios adecuados y bien controlados:
• Cuatro de corto plazo, realizados con dosis fijas y un ensayo de mantenimiento en adultos con esquizofrenia como monoterapia [véase Estudios clínicos]
• Uno a largo plazo, el estudio de mantenimiento de dosis flexible en adultos con trastorno esquizoafectivo como monoterapia o como tratamiento complementario a un estabilizador del humor o antidepresivos [véase Estudios clínicos].
Esquizofrenia:
Monoterapia a corto plazo (Estudios 1, 2, 3, 4): La eficacia de INVEGA® SUSTENNA® en el tratamiento agudo de la esquizofrenia se evaluó en cuatro estudios a dosis fija, a corto plazo (uno de 9 semanas y tres de 13 semanas), doble ciego, controlado con placebo, aleatorizados, con adultos hospitalizados en recaída que cumplían los criterios del DSM-IV para la esquizofrenia. Las dosis fijas de INVEGA® SUSTENNA® en estos estudios fueron dadas en los días 1, 8 y 36 en el estudio de 9 semanas, y, además, en el día 64 de los estudios de 13 semanas, es decir, en un intervalo de una semana para las dos dosis iniciales y luego cada 4 semanas para el mantenimiento.
La eficacia se evaluó mediante la puntuación total en la Escala del Síndrome Positivo y Negativo (PANSS). La PANSS es una escala de 30 elementos que mide los síntomas positivos de la esquizofrenia (7 ítems), los síntomas negativos de la esquizofrenia (7 ítems) y la psicopatología general (16 artículos), cada uno clasificado en una escala de 1 (ausente) a 7 (extremo); las puntuaciones totales de PANSS oscilan de 30 a 210.
En el Estudio 1 (PSY-3007), un estudio de 13 semanas (n=636) comparó tres dosis fijas de INVEGA® SUSTENNA® (inyección inicial en el deltoides de 234 mg seguida de 3 dosis en los glúteos o deltoides ya sea de 39 mg/4 semanas 156 mg/4 semanas o 234 mg/4 semanas) con placebo, las tres dosis de INVEGA® SUSTENNA® fueron superiores al placebo en la mejora de la puntuación total de la PANSS.
En el Estudio 2 (PSY-3003), otro estudio de 13 semanas (n=349) comparó tres dosis fijas de INVEGA® SUSTENNA® (78 mg/4 semanas, 156 mg/4 semanas y 234 mg/4 semanas) con placebo, sólo 156 mg/4 semanas de INVEGA® SUSTENNA® fue superior al placebo en la mejora de la puntuación total de la PANSS.
En el Estudio 3 (PSY-3004), un tercer estudio de 13 semanas (n= 513) comparó tres dosis fijas de INVEGA® SUSTENNA® (39 mg/4 semanas, 78 mg/4 semanas y 156 mg/4 semanas) a placebo, las tres dosis de INVEGA® SUSTENNA® fueron superiores al placebo en la mejora de la puntuación total de la PANSS.
En el Estudio 4 (SCH-201), el estudio de 9 semanas (n = 197) la comparación de dos dosis fijas de INVEGA® SUSTENNA® (78 mg/4 semanas y 156 mg/4 semanas) con el placebo, ambas dosis de INVEGA® SUSTENNA® fueron superiores al placebo en la mejora de la puntuación total de la PANSS.
Un resumen de las puntuaciones medias de la escala PANSS, junto con los cambios medios desde la línea basal en los cuatro estudios corto plazo de la esquizofrenia aguda se proporcionan en la Tabla 13.
Tabla 13. Estudios a corto plazo de la Esquizofrenia
|
Número del estudio |
Grupo de tratamiento |
Medida de Eficacia Primario: Puntuación Total PANSS |
||
|
Resultado Medio de Línea Basal (SD) |
Cambio Medio LS de Línea Basal (SE) |
Diferencia de sustracción de placeboa (95% CI) |
||
|
Estudio 1 |
INVEGA® SUSTENNA® (39 mg/4 semanas)* |
86.9 (11.99) |
-11.2 (1.69) |
-5.1 (-9.01, -1.10) |
|
INVEGA® SUSTENNA® (156 mg/4 semanas)* |
86.2 (10.77) |
-14.8 (1.68) |
-8.7 (-12.62, -4.78) |
|
|
INVEGA® SUSTENNA® (234 mg/4 semanas)* |
88.4 (11.70) |
-15.9 (1.70) |
-9.8 (-13.71, -5.85) |
|
|
Placebo |
86.8 (10.31) |
-6.1 (1.69) |
-- |
|
|
Estudio 2b |
INVEGA® SUSTENNA® (78 mg/4 semanas)* |
89.9 (10.78) |
-6.9 (2.50) |
-3.5 (-8.73, 1.77) |
|
INVEGA® SUSTENNA® (156 mg/4 semanas)* |
90.1 (11.66) |
-10.4 (2.47) |
-6.9 (-12.12, -1.68) |
|
|
Placebo |
92.4 (12.55) |
-3.5 (2.15) |
--- |
|
|
Estudio 3 |
INVEGA® SUSTENNA® (39 mg/4 semanas)* |
90.7 (12.25) |
-19.8 (2.19) |
-6.6 (-11.40, -1.73) |
|
INVEGA® SUSTENNA® (78 mg/4 semanas)* |
91.2 (12.02) |
-19.2 (2.19) |
-5.9 (-10.76, -1.07) |
|
|
INVEGA® SUSTENNA® (156 mg/4 semanas)* |
90.8 (11.70) |
-22.5 (2.18) |
-9.2 (-14.07, -4.43) |
|
|
Placebo |
90.7 (12.22) |
-13.3 (2.21) |
--- |
|
|
Estudio 4 |
INVEGA® SUSTENNA® (78 mg/4 semanas)* |
88.0 (12.39) |
-4.6 (2.43) |
-11.2 (-9.01, -1.10) |
|
INVEGA® SUSTENNA® (156 mg/4 semanas)* |
85.2 (11.09) |
-7.4 (2.45) |
-8.7 (-12.62, -4.78) |
|
|
Placebo |
87.8 (13.90) |
-6.6 (2.45) |
-9.8 (-13.71, -5.85) |
|
|
SD: desviación estándar; SE: error estándar; LS Medio: mínimos cuadrados medios; IC: intervalo de confianza sin ajustar. a Diferencia (menos fármaco placebo) en mínimos cuadrados cambio medio desde la línea basal. b Debido a un número insuficiente de sujetos recibieron la dosis de 234 mg/4 semanas, los resultados de este grupo no se incluyen. *p<0.05 (Dosis estadísticamente significativamente superior al placebo). |
||||
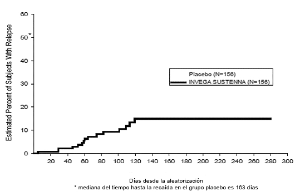
Mantenimiento del tratamiento de monoterapia (estudio 5: psy-3001): La eficacia de INVEGA® SUSTENNA® en el mantenimiento del control sintomático de la esquizofrenia fue establecida en un estudio a dosis flexible, a largo plazo, doble ciego, controlado con placebo, enrolando a sujetos que cumplían los criterios del DSM-IV para la esquizofrenia. Este estudio incluyó a 12 semanas mínimo, la fase de estabilización de dosis fija, y una fase de estudio aleatorizado, controlado con placebo para observar la recaída. Durante la fase de doble ciego, los pacientes fueron asignados al azar a la misma dosis de INVEGA® SUSTENNA® que recibieron durante la fase de estabilización, es decir, 39 mg, 78 mg o 156 mg administrados cada 4 semanas, o con el placebo. Un total de 410 pacientes estabilizados fueron aleatorizados a INVEGA® SUSTENNA® o placebo hasta que experimentaran una recaída de los síntomas de la esquizofrenia. La recaída se pre-define como tiempo hasta la primera aparición de uno o más de los siguientes: hospitalización psiquiátrica, ≥ 25% de aumento (si la puntuación inicial fue> 40) o un aumento de 10 puntos (si la puntuación basal fue ≤ 40) la puntuación total de la PANSS en dos consecutivos evaluaciones, autoagresión deliberada, comportamiento violento, ideación suicida/homicida, o una puntuación de ≥ 5 (si la puntuación inicial máxima era ≤ 3) o ≥ 6 (si la puntuación inicial máxima fue de 4) en dos evaluaciones consecutivas de los items específicos de PANSS. La variable principal de eficacia fue el tiempo hasta la recaída. Un análisis intermedio previamente planificado mostró un tiempo significativamente más largo hasta la recaída en pacientes tratados con INVEGA® SUSTENNA® en comparación con el placebo, y el estudio se detuvo antes debido a mantenimiento de la eficacia fue demostrada. Treinta y cuatro por ciento (34%) de los sujetos en el grupo placebo y el 10% de los sujetos en el grupo de INVEGA® SUSTENNA® experimentaron un evento de recaída. Hubo una diferencia estadísticamente significativa entre los grupos de tratamiento a favor de INVEGA® SUSTENNA®. Un gráfico de Kaplan-Meier del tiempo hasta la recaída por grupo de tratamiento se muestra en la Figura 1. El tiempo de recaída en los pacientes del grupo placebo fue estadísticamente significativamente más corto que para el grupo de INVEGA® SUSTENNA®. Un examen de los subgrupos de población no reveló diferencias clínicamente significativas en la capacidad de respuesta en función de sexo, edad o raza.
Figura 1: Gráficos Kaplan-Meier de proporción acumulada de pacientes con recaída con el tiempo (Estudio 5 de esquizofrenia)
Trastorno esquizoafectivo:
Tratamiento de mantenimiento - Monoterapia y como adjunto a estabilizador de humor o antidepresivos (SAFF Estudio 1: CEA-3004): La eficacia de INVEGA® SUSTENNA® en mantenimiento del control de los síntomas en el trastorno esquizoafectivo se estableció en un diseño largo plazo, doble ciego, controlado con placebo, de dosis flexible, aleatorizado, para retrasar las recaídas en sujetos adultos que cumplieron con los criterios DSM-IV para el trastorno esquizoafectivo, según lo confirmado por la Entrevista Clínica Estructurada para los Trastornos DSM IV. La población incluyó a sujetos con trastorno esquizoafectivo bipolar de tipos depresivo. Los sujetos recibieron INVEGA® SUSTENNA® ya sea como monoterapia o como adyuvante a dosis estables de estabilizadores del estado de ánimo o antidepresivos.
Este estudio incluyó a 13 semanas, de dosis flexible de etiqueta abierta, (INVEGA® SUSTENNA® 78 mg, 117 mg, 156 mg o 234 mg) de plomo en el período en el que participaron un total de 667 sujetos que tenían 1) exacerbación aguda síntomas de psicóticos; 2) Puntuación ≥4 en ≥3 items PANSS de delirios, desorganización conceptual, comportamiento alucinatorio, emoción, suspicacia/persecución, hostilidad, falta de cooperación, tensión, y pobre control de impulsos; y 3) los síntomas afectivos acusados ≥ 16 en la Young Mania Rating Scale (YMRS) y/o la Escala de Hamilton para la depresión, la versión de 21 ítems (HAM-D-21). Los sujetos fueron 19 y 66 años de edad (media 39,5 años) y el 53,5% eran varones. Las puntuaciones medias de etiqueta abierta de enrolados en el PANSS total fue de 85,8 (rango 42-128), HAM-D-21 fue de 20,4 (rango 3-43), YMRS fue de 18,6 (rango de 0 a 50), y CGI-S SCA fue 4,4 (intervalo de 2 a 6).
Después de un tratamiento de 13-semanas, con etiqueta abierta, a dosis flexible con INVEGA® SUSTENNA®, 432 participantes cumplieron con los criterios de estabilización (puntuación total PANSS ≤70, YMRS ≤12 y HAM-D21 ≤12) y continuó en dosis fija de etiqueta abierta de 12 semanas período de estabilización.
Un total de 334 sujetos que cumplieron con los criterios de estabilización durante 12 semanas consecutivas fueron aleatorizados (1: 1) para continuar con la misma dosis de INVEGA® SUSTENNA® o el placebo en los 15 meses de duración, doble ciego, período de mantenimiento. Para los 164 sujetos que fueron asignados al azar a INVEGA® SUSTENNA®, distribución de dosis fue de 78 mg (4,9%), 117 mg (9,8%), 156 mg (47,0%) y 234 mg (38,4%). La variable principal de eficacia fue el tiempo hasta la recaída. La recaída se define como la primera aparición de uno o más de los siguientes: 1) hospitalización psiquiátrica; 2) intervención empleada para evitar la hospitalización; 3) auto-lesión clínicamente significativa, ideación suicida u homicida o comportamiento violento; 4) una puntuación de ≥6 (si la puntuación era ≤4 en la aleatorización) de cualquiera de los elementos de la PANSS individuales: delirios, desorganización conceptual, comportamiento alucinatorio, emoción, suspicacia/persecución, hostilidad, falta de cooperación, o pobre control de impulsos; 5) en dos evaluaciones consecutivas dentro de 7 días: ≥25% de aumento (si la puntuación en la aleatorización fue> 45) o aumento ≥ 10 puntos (si la puntuación en la aleatorización fue ≤45) en la puntuación total de la PANSS; una puntuación de ≥ 5 (si la puntuación fue ≤3 en la aleatorización) de cualquiera de los elementos de la PANSS individuales: delirios, desorganización conceptual, comportamiento alucinatorio, emoción, suspicacia/persecución, hostilidad, falta de cooperación, o control pobre de impulsos; un aumento de ≥2 puntos (si la puntuación fue de 1 [no enfermo] a 3 [levemente enfermo] en la aleatorización) o aumento de ≥1 punto (si la puntuación era ≥4 [moderadamente enfermos o peor] en la aleatorización) en CGI- S-SCA puntuación global.
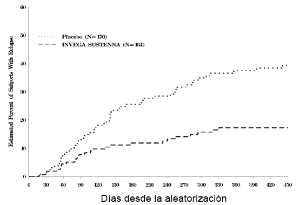
Hubo una diferencia estadísticamente significativa en el tiempo hasta la recaída entre los grupos de tratamiento a favor de INVEGA® SUSTENNA®. Un gráfico de Kaplan-Meier del tiempo hasta la recaída por grupo de tratamiento se muestra en la Figura 2.
Figura 2: Grafico Kaplan-Meier Proporción Acumulada de Pacientes con Recaída con el Tiempo (SAFF Estudio 1)
La Tabla 14 resume el número de sujetos con recaída en la población general, por subgrupo (en monoterapia frente a la terapia adyuvante), y por tipo de síntomas en la primera aparición de recaídas.
Tabla 14. Resumen de la proporción de recaídas
|
Número (por ciento) de los sujetos que recayeron |
||
|
Placebo N=170 |
INVEGA® SUSTENNA® N=164 |
|
|
Todos los sujetos |
57 (33.5%) |
25 (15.2%) |
|
Subconjunto monoterapia |
N=73 24 (32.9%) |
N=78 9 (11.5%) |
|
Adjunto a antidepresivos o del estabilizador de humor |
N=97 33 (34.0%) |
N=86 16 (18.6%) |
|
Síntomas psicóticosa |
53 (31.2%) |
21 (12.8%) |
|
Síntomas del estado de ánimob |
||
|
Cualquier síntomas del estado de ánimo |
48 (28.2%) |
18 (11.0%) |
|
Maníaco |
16 (9.4%) |
5 (3.0%) |
|
Depresivo |
23 (13.5%) |
8 (4.9%) |
|
Mixto |
9 (5.3%) |
5 (3.0%) |
|
a 8 sujetos experimentaron una recaída sin síntomas psicóticos. b 16 sujetos experimentan una recaída sin ningún elemento del síntoma estado de ánimo. |
||
TOXICOLOGÍA NO CLÍNICA:
Carcinogénesis, mutagénesis, deterioro de la fertilidad:
Carcinogénesis: El potencial carcinogénico de palmitato de paliperidona inyectado por vía intramuscular se evaluó en ratas. Hubo un aumento en los adenocarcinomas de las glándulas mamarias en las ratas hembras a los 16, 47 y 94 mg/kg/mes, que es de 0,6, 2 y 4 veces, respectivamente, la dosis humana máxima recomendada de 234 mg en INVEGA® SUSTENNA® mg/m2 según la superficie corporal. No se estableció una dosis sin efecto. Las ratas macho mostraron un aumento en los adenomas de glándulas mamarias, por fibroadenomas y carcinomas en 47 mg y 94 mg/kg/mes. Un estudio de carcinogenicidad en ratones no se ha llevado a cabo con palmitato de paliperidona.
Se llevaron a cabo estudios de carcinogenicidad de risperidona, que se convierte ampliamente en paliperidona en ratas, ratones y los seres humanos, en ratones albinos suizos y ratas Wistar. La risperidona se administró en la dieta a dosis diarias de 0,63, 2,5, y 10 mg/kg durante 18 meses a ratones y durante 25 meses a ratas. Una dosis máxima tolerada no se logró en ratones machos. Hubo aumentos estadísticamente significativos en los adenomas de la glándula pituitaria, adenomas del páncreas endocrino, y adenocarcinomas de la glándula mamaria. La dosis sin efecto para estos tumores fue menor o igual a la dosis máxima recomendada en humanos de la risperidona sobre una base de mg/m2 de superficie corporal (ver paquete inserto de RISPERDAL). Un aumento en mamaria, pituitaria, y las neoplasias de páncreas endocrino se ha encontrado en roedores después de la administración crónica de otros fármacos antipsicóticos y se considera estar mediada por la dopamina prolongada antagonismo del receptor D2 e hiperprolactinemia. La relevancia de estos hallazgos tumorales en roedores para el riesgo en seres humanos es desconocida [véase Advertencias y precauciones].
Mutagénesis: Palmitato de paliperidona no mostró potencial genotóxico en el ensayo de mutación inversa de Ames o en el ensayo de linfoma de ratón. No hay evidencia de potencial genotóxico para paliperidona se encontró en la prueba de Ames de mutación inversa, el ensayo de linfoma de ratón, o la prueba in vivo de micronúcleo de rata.
Deterioro de la fertilidad: Los estudios de fertilidad de palmitato de paliperidona non han sido realizados.
En un estudio de fertilidad realizado con paliperidona administrada por vía oral, el porcentaje de ratas hembras tratadas que quedaron preñadas no se vio afectada a dosis de paliperidona de hasta 2,5 mg/kg/día. Sin embargo, la pérdida de pre y post-implantación se incrementa, y el número de embriones vivos se redujo ligeramente, a 2,5 mg/kg, una dosis que también causó una ligera toxicidad materna. Estos parámetros no se vieron afectados a una dosis de 0,63 mg/kg, que es la mitad de la dosis máxima humana recomendada (12 mg/día) de la paliperidona administrada por vía oral (INVEGA®) en una base de superficie corporal mg/m2.
La fertilidad de las ratas macho no se vio afectada a dosis orales de paliperidona de hasta 2,5 mg/kg/día, aunque el conteo de espermatozoides y los estudios de viabilidad de los espermatozoides no se llevaron a cabo con paliperidona. En un estudio subcrónico en perros Beagle con risperidona, que se convierte ampliamente en paliperidona en perros y seres humanos, todas las dosis ensayadas (0,31 mg/kg - 5,0 mg/kg) dieron lugar a una disminución de la testosterona sérica y la motilidad espermática y la concentración. La testosterona sérica y los parámetros del esperma se recuperaron parcialmente, pero permanecieron disminuyendo después de la última observación (dos meses después de la interrupción del tratamiento).
ABUSO DE DROGAS Y DEPENDENCIA:
Sustancias controladas: INVEGA® SUSTENNA® (paliperidona) no es una sustancia controlada.
Abuso: La paliperidona no se ha estudiado sistemáticamente en animales o humanos por su potencial de abuso.
Dependencia: La paliperidona no se ha estudiado sistemáticamente en animales o humanos por su potencial para la tolerancia o dependencia física.
ADVERTENCIAS Y PRECAUCIONES:
• El Síndrome de Iris Flácido Intraoperatorio (SIFI), ha sido observado durante la cirugía de cataratas en pacientes tratados con medicamentos antagonistas alfa-1a adrenérgicos (ejemplo: risperidona, paliperidona o palmitato de paliperidona).
• El SIFI puede aumentar el riesgo de complicaciones oculares durante y después de la cirugía de cataratas. El uso actual o pasado de medicamentos con efectos antagonistas alfa-1a adrenérgicos, debe ser conocido por el cirujano oftalmológico antes de la cirugía.
El beneficio potencial de interrumpir el tratamiento con antagonistas alfa-1a adrenérgicos, antes de la cirugía de cataratas, no se ha establecido; y debe ser sopesado contra el riesgo de detener la terapia antipsicótica.
El aumento de mortalidad en pacientes ancianos con psicosis relacionada con demencia: Los pacientes ancianos con psicosis relacionada con demencia tratados con fármacos antipsicóticos tienen un mayor riesgo de muerte. Los análisis de 17 ensayos controlados con placebo (duración modal de 10 semanas), en gran medida en los pacientes que toman fármacos antipsicóticos atípicos, revelaron un riesgo de muerte en pacientes tratados con el fármaco de entre 1,6 a 1,7 veces el riesgo de muerte en pacientes tratados con placebo. En el transcurso de un ensayo típico controlado de 10 semanas, la tasa de muerte en pacientes tratados con el fármaco fue aproximadamente de 4,5%, frente a una tasa de alrededor de 2,6% en el grupo placebo. Si bien las causas de muerte fueron variadas, la mayoría de muertes parecieron ser de naturaleza cardiovascular (por ejemplo, insuficiencia cardíaca, muerte súbita) o infecciosa (por ejemplo, neumonía). Los estudios observacionales sugieren que, de forma similar a los fármacos antipsicóticos atípicos, el tratamiento con fármacos antipsicóticos convencionales pueden aumentar la mortalidad. La medida en que los resultados de aumento de la mortalidad en los estudios observacionales pueden atribuirse al fármaco antipsicótico en oposición a alguna característica (s) de los pacientes no está clara. INVEGA® SUSTENNA® (palmitato de paliperidona) no está aprobado para el tratamiento de pacientes con psicosis relacionada con demencia.
Eventos adversos cerebrovasculares, incluyendo accidente cerebrovascular, en pacientes ancianos con psicosis relacionada con demencia: En ensayos controlados con placebo, en pacientes ancianos con demencia y tratados con antipsicóticos como risperidona, aripiprazol, y olanzapina, se registró una incidencia mayor de eventos adversos cerebrovasculares (accidentes cerebrovasculares y ataques isquémicos transitorios), incluida la muerte, en comparación con el grupo tratado con placebo. La paliperidona oral y el INVEGA® SUSTENNA® no fueron comercializaban en el momento de realizarse estos estudios y no están aprobados para el tratamiento de los pacientes con psicosis relacionada con la demencia [ver Advertencias y precauciones].
Síndrome neuroléptico maligno: Un complejo de síntomas potencialmente fatal a veces denominada como síndrome neuroléptico maligno (SNM) ha sido reportado en asociación con fármacos antipsicóticos, incluyendo INVEGA® SUSTENNA®.
Las manifestaciones clínicas del SNM comprenden hipertermia, rigidez muscular, alteración de la conciencia, evidencia de inestabilidad autónoma (pulso irregular o la presión arterial, taquicardia, diaforesis y trastornos del ritmo cardíaco). Otros signos pueden ser elevados creatina fosfoquinasa, mioglobinuria (rabdomiólisis) e insuficiencia renal aguda.
El diagnóstico de la evaluación de los pacientes con este síndrome es complicado. Para llegar a un diagnóstico, es importante identificar los casos en los que la presentación clínica incluye tanto una enfermedad médica grave (por ejemplo, neumonía, infección sistémica, etc.) y sin tratamiento o tratamiento inadecuado de signos y síntomas extra piramidales (EPS) con tratamiento inadecuado. Otras consideraciones importantes en el diagnóstico diferencial incluyen toxicidad anticolinérgica central, golpe de calor, fiebre medicamentosa y patología del sistema nervioso central primario.
El tratamiento del SNM debe incluir: (1) suspensión inmediata de los fármacos antipsicóticos y otros medicamentos no esenciales a la terapia concurrente; (2) tratamiento sintomático intensivo y monitoreo médico; y (3) tratamiento de cualquier problema médico serio concomitante para el cual los tratamientos específicos están disponibles. No existe un acuerdo general sobre los regímenes de tratamiento farmacológico específicos para SNM complicada.
Si un paciente parece requerir tratamiento antipsicótico después de la recuperación del SNM, la reintroducción de la terapia con medicamentos debe ser controlada estrechamente, ya que se han reportado recurrencias de SNM.
Prolongación del intervalo QT: La paliperidona causa un aumento modesto en el intervalo QT corregido (QTc). El uso de la paliperidona debe evitarse en combinación con otros medicamentos que se sabe que prolongan QTc incluyendon la Clase 1A (por ejemplo, quinidina, procainamida) o clase III (por ejemplo, amiodarona, sotalol) medicamentos antiarrítmicos, los medicamentos antipsicóticos (por ejemplo, clorpromazina, tioridazina), antibióticos (por ejemplo, la gatifloxacina, moxifloxacina), o cualquier otra clase de medicamentos conocidos que prolongan el intervalo QTc. La paliperidona también debe evitarse en pacientes con síndrome de QT largo congénito y en pacientes con antecedentes de arritmias cardíacas.
Ciertas circunstancias pueden aumentar el riesgo de la aparición de Torsades de pointes y/o muerte súbita en asociación con el uso de fármacos que prolongan el intervalo QTc, incluyendo (1) bradicardia; (2) la hipopotasemia o hipomagnesemia; (3) el uso concomitante de otros fármacos que prolongan el intervalo QTc; y (4) la presencia de prolongación congénita del intervalo QT.
Los efectos de la paliperidona oral en el intervalo QT se evaluaron en un estudio doble ciego, con control activo (moxifloxacino 400 mg dosis única), un estudio multicéntrico QT en adultos con esquizofrenia y trastorno esquizoafectivo, y en tres ensayos de eficacia con dosis fija con placebo y control activo de 6 semanas, en adultos con esquizofrenia.
En el estudio QT (n = 141), la dosis de 8 mg de paliperidona oral de liberación inmediata (n = 50) demostraron un aumento de medio sustraído del placebo desde la admisión en QTcLD de 12,3 mseg (IC del 90%: 8,9; 15,6) en el día 8 a las 1,5 horas después de la dosis. La concentración plasmática máxima media en estado estable para esta dosis de 8 mg de paliperidona liberada inmediata (Cmáx ss = 113 ng/mL) fue de más del doble de la exposición observada con la dosis máxima recomendada de 234 mg de INVEGA® SUSTENNA® administrada en el músculo deltoides (predicho la mediana Cmáx ss= 50 ng/mL). En este mismo estudio, una dosis de 4 mg de la formulación oral de liberación inmediata de paliperidona, para lo cual Cmáx ss = 35 ng/ml, demostró un aumento de QTcLD sustraído del placebo de 6,8 mseg (IC del 90%: 3,6; 10,1) en el día 2 a 1,5 horas después de la dosis.
En los tres estudios de eficacia con dosis fijas de paliperidona oral de liberación prolongada en sujetos con esquizofrenia, electrocardiograma (ECG) tomadas en varios puntos de tiempo demostraron que solo un sujeto en el grupo de 12 mg de paliperidona oral, tuvo un cambio superior a 60 ms en un punto de tiempo el Día 6 (aumento de 62 ms).
En los cuatro estudios de eficacia de dosis fijas de INVEGASUSTENNA en sujetos con esquizofrenia y en el estudio a largo plazo en pacientes con trastorno esquizoafectivo, ningún sujeto experimentó un cambio en QTcLD que excede 60 mseg y ninguno presentó un valor de QTcLD > 500 mseg en ningún punto de tiempo. En el estudio de mantenimiento en pacientes con esquizofrenia, ninguno presentó un cambio de QTcLD > 60 ms, y un sujeto tenía un valor QTcLD de 507 mseg (QT corregido de Bazett valor del intervalo [QTcB] de 483 ms); este último sujeto también tenía una frecuencia cardíaca de 45 latidos por minuto.
Discinesia tardía: Un síndrome potencialmente irreversible, involuntarios, movimientos discinéticos se puede desarrollar en pacientes tratados con fármacos antipsicóticos. Si bien la prevalencia del síndrome parece ser más elevada entre los ancianos, especialmente las mujeres de edad avanzada, es imposible predecir qué pacientes desarrollarán este síndrome. Ya sea que los medicamentos antipsicóticos difieren en su potencial para causar discinesia tardía es desconocida.
El riesgo de desarrollar discinesia tardía y la probabilidad de que se torne irreversible parece aumentar con la duración del tratamiento y la dosis acumulativa total de los fármacos antipsicóticos administrados en el paciente aumentan, pero el síndrome puede desarrollarse después de períodos de tratamiento relativamente cortos con dosis bajas, si bien esto no es común.
No existe un tratamiento conocido para la discinesia tardía establecida, si bien el síndrome puede remitir, parcial o completamente, si el tratamiento antipsicótico se suspende. El tratamiento antipsicótico en sí mismo puede suprimir (o suprimir parcialmente) los signos y síntomas del síndrome y puede así enmascarar el proceso subyacente. Se desconoce el efecto de la supresión sintomática del curso a largo plazo del síndrome.
Dadas estas consideraciones, INVEGA® SUSTENNA® debe ser prescrito de una manera que sea más probable para minimizar la incidencia de discinesia tardía. El tratamiento antipsicótico crónico debe reservarse, por lo general, para los pacientes que sufren de una enfermedad crónica que se sepa que responde a los fármacos antipsicóticos. En los pacientes que requieran tratamiento crónico, se debe buscar la dosis más baja y la duración más corta del tratamiento que produzca una respuesta clínica satisfactoria. La necesidad de un tratamiento continuado debe reevaluar periódicamente.
Si los signos y síntomas de discinesia tardía aparecen en un paciente tratado con INVEGA® SUSTENNA®, debe considerarse la discontinuación del fármaco. Sin embargo, algunos pacientes pueden requerir tratamiento con INVEGA® SUSTENNA® a pesar de la presencia del síndrome.
Cambios metabólicos: Los fármacos antipsicóticos atípicos se han asociado con cambios metabólicos que pueden aumentar el riesgo cardiovascular/cerebrovascular. Estos cambios metabólicos incluyen hiperglucemia, la dislipidemia y la ganancia de peso corporal. Mientras que todos los fármacos de la clase han demostrado producir algunos cambios metabólicos, cada fármaco tiene su propio perfil de riesgo específico.
Hiperglucemia y diabetes mellitus: La hiperglucemia y la diabetes mellitus, en algunos casos extrema y asociada con cetoacidosis o coma hiperosmolar o muerte, han sido reportados en pacientes tratados con todos los antipsicóticos atípicos. Estos casos, en su mayor parte, se vieron en la post-comercialización de uso clínico y estudios epidemiológicos, no en los ensayos clínicos, y ha habido pocos informes de hiperglucemia o diabetes en sujetos del ensayo tratados con INVEGA® SUSTENNA®. La evaluación de la relación entre antipsicóticos atípicos y alteraciones en la glucosa se complica por el hecho de que los pacientes con esquizofrenia corren mayor riesgo de sufrir diabetes mellitus y por la creciente incidencia de la diabetes mellitus en la población general. Debido a estos factores de confusión, la relación entre el uso de antipsicóticos atípicos y los eventos adversos relacionados con la hiperglucemia aún no se comprenden totalmente. Sin embargo, los estudios epidemiológicos sugieren un aumento del riesgo de eventos adversos relacionados con la hiperglucemia en pacientes tratados con antipsicóticos atípicos. Debido a que INVEGA® SUSTENNA® no se comercializó en el momento que se realizaron estos estudios, no se sabe si INVEGA® SUSTENNA® se asocia con este riesgo.
Los pacientes con un diagnóstico establecido de diabetes mellitus que comenzaron con antipsicóticos atípicos deben ser monitorizados regularmente por el empeoramiento del control de glucosa. Los pacientes con factores de riesgo de diabetes mellitus (por ejemplo, la obesidad, antecedentes familiares de diabetes) que están iniciando el tratamiento con antipsicóticos atípicos deben someterse a la prueba de glucosa en sangre en ayunas al inicio del tratamiento y periódicamente durante el tratamiento. Cualquier paciente tratado con antipsicóticos atípicos deben ser monitorizados para detectar síntomas de hiperglucemia incluyendo polidipsia, poliuria, polifagia y debilidad. Los pacientes que desarrollan síntomas de hiperglucemia durante el tratamiento con antipsicóticos atípicos deben someterse a las pruebas de glucosa en sangre en ayunas. En algunos casos, la hiperglucemia se resuelve cuando se discontinúa el antipsicótico atípico; Sin embargo, algunos pacientes requieren la continuación del tratamiento antidiabético a pesar de la suspensión del fármaco sospechoso.
Los datos combinados de los cuatro estudios con dosis fija y controlado con placebo (uno de 9 semanas y tres de 13 semanas), en sujetos con esquizofrenia se presentan en la Tabla 5.
Tabla 5. Cambio de glucosa en ayunas de cuatro controlados con placebo, de 9 a 13 semanas de duración, estudios a dosis fija en sujetos con esquizofrenia
|
Placebo |
INVEGA® SUSTENNA® |
||||||
|
39 mg |
78 mg |
156 mg |
234/39 mga |
234/156 mga |
234/234 mga |
||
|
|
Cambio medio de línea basal (mg/dL) |
||||||
|
|
n=367 |
n=86 |
n=244 |
n=238 |
n=110 |
n=126 |
n=115 |
|
Cambio de glucosa del suero de línea basal |
-1.3 |
1.3 |
0.1 |
3.4 |
1.8 |
-0.2 |
|
|
Proporción de pacientes con cambios |
|||||||
|
Glucosa del Suero |
4.6% |
6.3% |
6.4% |
3.90% |
2.5% |
7.0% |
6.6% |
|
Normal a alto (<100 mg/dL a ≥126 mg/dL) |
(11/241) |
(4/64) |
(11/173) |
(6/154) |
(2/79) |
(6/86) |
(5/76) |
|
a Inyección inicial de 234 mg en el deltoides seguida de una inyección de 39 mg, 156 mg o 234 mg en el deltoides o en el glúteo, cada 4 semanas. Los demás grupos de dosificación (39 mg, 78 mg y 156 mg) corresponden a estudios realizados sólo con inyecciones en los glúteos. [Véase Estudios clínicos]. |
|||||||
En un estudio de farmacocinética y seguridad de etiqueta abierta a largo plazo en sujetos con esquizofrenia en los que se evaluó la dosis más alta disponible (234 mg), INVEGA® SUSTENNA® se asoció con un cambio medio en la glucosa de -0,4 mg/dl en la semana 29 (n = 109) y 6,8 mg/dL en la Semana 53 (n = 100).
Durante el período inicial de etiqueta abierta de 25 semanas de un estudio a largo plazo en pacientes con trastorno esquizoafectivo, INVEGA® SUSTENNA® fue asociada con un cambio promedio en la glucosa de 5,3 mg/dl (n = 518). En el punto final del período doble ciego posterior del estudio de 15 meses, INVEGA® SUSTENNA® se asoció con un cambio medio en la glucosa de 0,3 mg/dl (n = 131) en comparación con un cambio promedio de 4,0 mg/dl en el grupo placebo (n = 120).
Dislipidemia: Se observó alteraciones indeseables en lípidos en pacientes tratados con antipsicóticos atípicos.
Los datos combinados de los cuatro estudios con control de placebo, a dosis fija, (uno de 9 semanas y tres de 13 semanas), en sujetos con esquizofrenia son presentados en la Tabla 6.
Tabla 6. Cambio de Lípidos en ayunas de cuatro estudios con control de placebo, a dosis fija, de 9 a 13 semanas de duración, en sujetos con esquizofrenia
|
Placebo |
INVEGA® SUSTENNA® |
||||||
|
39 mg |
78 mg |
156 mg |
234/39 mga |
234/156 mga |
234/234 mga |
||
|
Cambio medio de línea basal (mg/dL) |
|||||||
|
Colesterol |
n=366 |
n=89 |
n=244 |
n=232 |
n=105 |
n=119 |
n=120 |
|
Cambio de línea basal |
-6.6 |
-6.4 |
-5.8 |
-7.1 |
-0.9 |
-4.2 |
9.4 |
|
LDL |
n=275 |
n=80 |
n=164 |
n=141 |
n=104 |
n=117 |
n=108 |
|
Cambio de línea basal |
-6 |
-4.8 |
-5.6 |
-4.8 |
0.9 |
-2.4 |
5.2 |
|
DHL |
n=286 |
n=89 |
n=165 |
n=150 |
n=105 |
n=118 |
n=115 |
|
Cambio de línea basal |
0.7 |
2.1 |
0.6 |
0.3 |
1.5 |
1.1 |
0 |
|
Triglicéridos |
n=366 |
n=89 |
n=244 |
n=232 |
n=105 |
n=119 |
n=120 |
|
Cambio de línea basal |
-16.7 |
7.6 |
-9 |
-11.5 |
-14.1 |
-20.0 |
11.9 |
|
Proporción de pacientes con cambios |
|||||||
|
Colesterol |
3.2% |
2.0% |
2.0% |
2.1% |
0% |
3.1% |
7.1% |
|
Normal a alto (<200 mg/dL a ≥240 mg/dL) |
(7/222) |
(1/51) |
(3/147) |
(3/141) |
(0/69) |
(2/65) |
(6/84) |
|
LDL |
1.1% |
0% |
0% |
0% |
0% |
0% |
0% |
|
Normal a Alto (<100 mg/dL a ≥160 mg/dL) |
(1/95) |
(0/29) |
(0/67) |
(0/46) |
(0/41) |
(0/37) |
(0/44) |
|
HDL |
13.8% |
14.8% |
9.6% |
14.2% |
12.7% |
10.5% |
16.0% |
|
Normal a Bajo( ≥40 mg/dL a <40 mg/dL) |
(28/203) |
(9/61) |
(11/115) |
(15/106) |
(9/71) |
(8/76) |
(13/81) |
|
Triglicéridos |
3.6% |
6.1% |
9.2% |
7.2% |
1.3% |
3.7% |
10.7 |
|
Normal a Alto (<150 mg/Dl a ≥200 mg/dL) |
(8/221) |
(3/49) |
(14/153) |
(10/139) |
(1/79) |
(3/82) |
(9/84) |
|
a Inyección inicial de 234 mg en el deltoides seguida de una inyección de 39 mg, 156 mg o 234 mg en el deltoides o en el glúteo, cada 4 semanas. Los demás grupos de dosificación (39 mg, 78 mg y 156 mg) corresponden a estudios realizados sólo con inyecciones en los glúteos. [Véase sección Estudios Clínicos]. |
|||||||
En un estudio farmacocinético y de seguridad de etiqueta abierta a largo plazo en pacientes con esquizofrenia en el que se evaluó la dosis más alta disponible (234 mg), el cambio medio desde la línea basal en los valores lípidos se presentan en la Tabla 7.
Tabla 7. Cambio en lípidos en ayunas en un estudio de farmacocinética y seguridad de etiqueta abierta a largo plazo en sujetos con esquizofrenia
|
|
INVEGA® SUSTENNA® 234 mg |
|
|
Semana 29 |
Semana 53 |
|
|
Cambio medio de línea basal (mg/dL) |
||
|
Colesterol |
n=112 |
n=100 |
|
Cambio de línea basal |
-1.2 |
0.1 |
|
LDL |
n=107 |
n=89 |
|
Cambio de línea basal |
-2.7 |
-2.3 |
|
HDL |
n=112 |
n=98 |
|
Cambio de línea basal |
-0.8 |
-2.6 |
|
Triglicéridos |
n=112 |
n=100 |
|
Cambio de línea basal |
16.2 |
37.4 |
El cambio promedio de los valores de la línea basal en lípidos durante el período inicial de 25 semanas de etiqueta abierta y el punto final del siguiente período de doble ciego de 15 meses en un estudio a largo plazo en sujetos con trastorno esquizoafectivo se presentan en la Tabla 8.
Tabla 8. Cambio en lípidos en ayunas en un estudio de etiqueta abierta y períodos doble ciegos a largo plazo en sujetos con trastorno esquizoafectivo
|
Período de etiqueta abierta |
Períodos doble ciegos |
||
|
INVEGA® SUSTENNA® |
Placebo |
INVEGA® SUSTENNA® |
|
|
Cambio medio de línea basal (mg/dL) |
|||
|
Colesterol |
n=198 |
n=119 |
n=132 |
|
Cambio de línea basal |
-3.9 |
-4.2 |
2.3 |
|
LDL |
n=198 |
n=117 |
n=130 |
|
Cambio de línea basal |
-2.7 |
-2.8 |
5.9 |
|
LHD |
n=198 |
n=119 |
n=131 |
|
Cambio de línea basal |
-2.7 |
-0.9 |
-0.7 |
|
Triglicéridos |
n=198 |
n=119 |
n=132 |
|
Cambio de línea basal |
7 |
2.5 |
-12.3 |
Aumento de peso: El aumento de peso se ha observado con el uso de antipsicóticos atípicos. Se recomienda la monitorización clínica del peso.
Los datos sobre los cambio promedio en el peso corporal y la proporción de sujetos que cumplieron un criterio de aumento de peso ≥ 7% del peso corporal de los cuatro estudios controlados con placebo, a dosis fija, (uno de 9 semanas y tres de 13 semanas), en pacientes con esquizofrenia se presentan en la Tabla 9.
Tabla 9. Cambio en el peso corporal (kg) y la proporción de sujetos con ≥ 7% de ganancia en el peso corporal de los cuatro controlados con placebo, de 9 a 13 semanas, con estudios de dosis fija en sujetos con esquizofrenia.
|
INVEGA® SUSTENNA® |
|||||||
|
Placebo |
39 mg |
78 mg |
156 mg |
234/39 mga |
234/156 mga |
234/234 mga |
|
|
n=451 |
n=116 |
n=280 |
n=267 |
n=137 |
n=144 |
n=145 |
|
|
Cambio de peso(kg) de línea basal |
-0.4 |
0.4 |
0.8 |
1.4 |
0.4 |
0.7 |
1.4 |
|
Ganancia en el peso ≥ 7% aumento de línea basal |
3.3% |
6.0% |
8.9% |
9.0% |
5.8% |
8.3% |
13.1 % |
|
a Inyección inicial de 234 mg en el deltoides seguida de una inyección de 39 mg, 156 mg o 234 mg en el deltoides o en el glúteo, cada 4 semanas. Los demás grupos de dosificación (39 mg, 78 mg y 156 mg) corresponden a estudios realizados sólo con inyecciones en los glúteos. [Véase Estudios clínicos]. |
|||||||
En un estudio farmacocinético y seguridad de etiqueta abierta a largo plazo en el que se evaluó la dosis más alta disponible (234 mg), INVEGA® SUSTENNA® se asoció con un cambio medio en peso de 2,4 kg en la semana 29 (n=134) y 4,3 kg en la semana 53 (n=113).
Durante el período de etiqueta abierta de las 25 semanas iniciales de un estudio a largo plazo en pacientes con trastorno esquizoafectivo, INVEGA® SUSTENNA® fue asociado con un cambio medio del peso de +2,2 kg y 18,4% de los sujetos que tenían un aumento en el peso corporal de ≥ 7% (n=653). En el punto final del siguiente período de doble ciego de 15 meses del estudio, INVEGA® SUSTENNA® fue asociado con un cambio medio en el peso de -0,2 kg y 13,0% de los sujetos que tenían un aumento del peso corporal de ≥ 7% (n=161); el grupo placebo tuvieron un cambio medio en el peso de -0,8 kg y 6,0% de los sujetos tenían un aumento en el peso corporal de ≥ 7% (n=168).
Hipotensión ortostática y síncope: La paliperidona puede inducir a la hipotensión ortostática y síncope en algunos pacientes, debido a su actividad alfa-bloqueante. El síncope se informó en <1% (4/1293) de los sujetos tratados con INVEGA® SUSTENNA® en el rango de dosis recomendada de 39 mg a 234 mg en cuatro estudios controlados con placebo, a dosis fija y doble ciego en comparación con el 0% (0/510) de los sujetos tratados con placebo. En los cuatro estudios de eficacia con dosis fija en sujetos con esquizofrenia, la hipotensión ortostática se reportó como un evento adverso por <1% (2/1293) de los sujetos tratados con INVEGA® SUSTENNA® en comparación con el 0% (0/510) con placebo. La incidencia de hipotensión ortostática y síncope en los estudios a largo plazo en sujetos con esquizofrenia y trastorno esquizoafectivo fueron similares a los observados en los estudios a corto plazo.
INVEGA® SUSTENNA® se debe administrar con precaución a los pacientes con enfermedad cardiovascular conocida (p. ej., insuficiencia cardíaca, infarto o isquemia miocárdicos, anomalías en la conducción), enfermedad cerebrovascular u otros trastornos que predispongan al paciente a la hipotensión (p. ej., deshidratación, hipovolemia y tratamiento con medicamentos antihipertensivos). El monitoreo de los signos vitales ortostáticos debe ser considerado en pacientes que son vulnerables a la hipotensión.
Leucopenia, neutropenia y agranulocitosis: En ensayos clínicos y/o experiencia post-comercialización, se han notificado eventos de leucopenia/neutropenia relacionados temporalmente a los agentes antipsicóticos, incluido INVEGA®, una forma oral de paliperidona. La agranulocitosis también ha sido reportada.
Los posibles factores de riesgo para la leucopenia/neutropenia incluyen preexistente de bajo recuento de glóbulos blancos (GB) y la historia de leucopenia/neutropenia inducidos por fármacos. Los pacientes con antecedentes de GB bajos clínicamente significativos o una leucopenia/neutropenia inducida por fármacos deben tener su conteo sanguíneo completo (CSC) monitorizándose frecuentemente durante los primeros meses de tratamiento y la interrupción de INVEGA® SUSTENNA® se debe considerar a la primera señal de una disminución clínicamente significativa de GB, en ausencia de otros factores causales.
Los pacientes con neutropenia clínicamente significativa, deben ser cuidadosamente monitorizados por fiebre u otros síntomas o signos de infección, y tratarlos rápidamente si estos aparecen. Los pacientes con neutropenia severa (recuento absoluto de neutrófilos <1.000/mm3) deben suspender INVEGA® SUSTENNA® y se debe controlar su recuento leucocitario hasta su recuperación.
Hiperprolactinemia: Al igual que otros fármacos que antagonizan los receptores de dopamina D2, la paliperidona eleva los niveles de prolactina y la elevación persiste durante la administración crónica. La paliperidona tiene un efecto de elevación de prolactina similar a la observada con la risperidona, un fármaco que se asocia con mayores niveles de prolactina que otros fármacos antipsicótico.
La hiperprolactinemia, independientemente de la etiología, puede suprimir la GnRH hipotalámica, lo que resulta en la secreción de gonadotropina hipofisaria reducida. Esto, a su vez, puede inhibir la función reproductiva perjudicando la esteroidogénesis gonadal tanto en pacientes femeninos y masculinos. La galactorrea, amenorrea, ginecomastia e impotencia han sido reportadas en pacientes que reciben compuestos que eleven la prolactina. La hiperprolactinemia de larga duración cuando se asocia con hipogonadismo puede conducir a una menor densidad ósea tanto en pacientes femeninos y masculinos.
Experimentos de cultivo de tejidos indican que aproximadamente un tercio de los cánceres de mamas son dependientes de la prolactina in vitro, un factor de potencial importancia si la prescripción de estos fármacos se considera en un paciente con cáncer de mama detectado previamente. Se observó un aumento en la incidencia de la glándula pituitaria, glándula mamaria, y la neoplasia de células de islote pancreático (adenocarcinomas mamarios, adenomas pituitarios y pancreáticos) en los estudios de carcinogenicidad de risperidona realizados en ratones y ratas [ver sección Toxicología no clínica]. Ni los estudios clínicos ni los estudios epidemiológicos realizados hasta la fecha han demostrado una asociación entre la administración crónica de esta clase de fármacos y la tumorigénesis en humanos, pero la evidencia disponible es demasiado limitada para ser concluyente.
Potencial de deterioro cognitivo y motor: Somnolencia, sedación y mareos fueron reportados como los eventos adversos en los pacientes tratados con INVEGA® SUSTENNA® [ver sección Eventos adversos]. Los antipsicóticos, incluido INVEGA® SUSTENNA®, tienen el potencial de afectar las habilidades del juicio, pensamiento o motoras. Los pacientes deben ser advertidos sobre la realización de actividades que requieran alerta mental, tales como el manejo de maquinaria peligrosa o si conduce un vehículo de motor, hasta que tengan la certeza de que la terapia con paliperidona no afecta adversamente.
Convulsiones: En estudios de cuatro dosis fijas, controlados con placebo, doble ciego en sujetos con esquizofrenia, <1% (1/1293) de los sujetos tratados con INVEGA® SUSTENNA® en el rango de dosis recomendada de 39 mg a 234 mg experimentó un evento adverso de convulsión en comparación con <1% (1/510) de los sujetos tratados con placebo que experimentaron un evento adverso de la convulsión de gran mal.
Como otros fármacos antipsicóticos, INVEGA® SUSTENNA® debe utilizarse con precaución en pacientes con antecedentes de convulsiones o de otros trastornos que potencialmente puedan reducir el umbral convulsivo. Las condiciones que disminuyen el umbral de convulsión pueden ser más frecuentes en los pacientes de 65 años o más.
Disfagia: Dismotilidad esofágica y aspiración han sido asociadas con el uso de fármacos antipsicóticos. La neumonía por aspiración es una causa frecuente de morbilidad y mortalidad en pacientes con demencia de Alzheimer avanzada. INVEGA® SUSTENNA® y otros fármacos antipsicóticos deben ser utilizados con precaución en pacientes con riesgo de neumonía por aspiración.
Priapismo: Los fármacos con efectos bloqueadores alfa-adrenérgicos se han reportado para inducir priapismo. Aunque ningún caso de priapismo se haya reportado en los ensayos clínicos con INVEGA SUSTENNA, el priapismo se ha reportado con paliperidona oral durante la vigilancia posterior. El priapismo severo puede requerir intervención quirúrgica.
Interrupción de regulación de temperatura corporal: La interrupción de la capacidad del cuerpo para reducir la temperatura corporal central se ha atribuido a los antipsicóticos. Se aconseja tener precaución cuando se prescriba INVEGA® SUSTENNA® a pacientes que vayan a experimentar circunstancias que puedan contribuir a una elevación de la temperatura corporal, por ejemplo, hacer ejercicio intenso, exposición a calor extremo, tratamiento concomitante con medicamentos de actividad anticolinérgica o sujeto a la deshidratación.
DOSIS Y ADMINISTRACIÓN:
Instrucciones para la administración: Cada inyección debe ser administrada solamente por un profesional de la salud.
Los medicamentos parenterales deben ser inspeccionados visualmente para detectar la presencia de partículas extrañas y decoloración antes de su administración, siempre que el producto y el envase lo permitan.
INVEGA® SUSTENNA® está diseñado sólo para uso intramuscular. No administre por ninguna otra vía. Evitar la inyección involuntaria en un vaso sanguíneo. Administrar la dosis en una sola inyección; no administrar la dosis en inyecciones divididas. Inyectar lentamente, profundamente en el músculo.
El tamaño de la aguja recomendado para la administración de INVEGA® SUSTENNA® en el músculo deltoides es determinado por el peso del paciente:
• Para los pacientes que pesen menos de 90 kg, se recomienda emplear una aguja de calibre 23 de 1 pulgada.
• Para pacientes con un peso de 90 kg o más, se recomienda una aguja de calibre 22 de 1½ pulgadas.
Inyecciones deltoides se deben alternar entre los dos músculos deltoides.
El tamaño de la aguja recomendado para la administración de INVEGA® SUSTENNA® en el músculo glúteo es calibre 22 de 1 ½ pulgadas, independientemente del peso del paciente.
Administrar en el cuadrante superior externo del músculo glúteo. Las inyecciones en el músculo glúteo se deben alternar entre ambos glúteos.
Esquizofrenia y trastorno esquizoafectivo: Para pacientes que nunca han tomado la paliperidona oral o risperidona oral o inyectable, se recomienda establecer la tolerabilidad con paliperidona oral o risperidona oral antes de iniciar el tratamiento con INVEGA® SUSTENNA®.
La dosificación recomendada de INVEGA® SUSTENNA® para cada indicación aprobada se muestra en la Tabla 1. La iniciación recomendada de INVEGA® SUSTENNA® es con una dosis de 234 mg en el primer día de tratamiento y 156 mg una semana después, ambos administrados en el músculo deltoides. Después de la segunda dosis de iniciación, la dosis de mantenimiento mensual se puede administrar ya sea en el deltoides o en el músculo glúteo.
Tabla 1. Dosificación Recomendada de INVEGA® SUSTENNA® para Adultos con Esquizofrenia o Trastorno Esquizoafectivo
|
Indicación |
Dosificación de Iniciación (deltoides) |
Dosis De Mantenimiento Mensuala (deltoides o glúteo) |
Dosis Máxima Mensual |
|
|
Día 1 |
Día 8 |
|||
|
Esquizofrenia |
234 mg |
156 mg |
39-234 mgb |
234 mg |
|
Trastorno esquizoafectivo |
234 mg |
156 mg |
78-234 mgc |
234 mg |
|
a Administrado 5 semanas después de la primera inyección. b La dosis de mantenimiento recomendada para el tratamiento de la esquizofrenia es de 117 mg. Algunos pacientes pueden beneficiarse de dosis de mantenimiento más bajos o más altos dentro de las concentraciones adicionales disponibles (39 mg, 78 mg, 156 mg y 234 mg). c Ajustar la dosis en función de la tolerabilidad y/o eficacia usando concentraciones disponibles. La concentración de 39 mg no se estudió a largo plazo en el estudio de trastorno esquizoafectivo. |
||||
El ajuste de la dosis de mantenimiento puede hacerse mensualmente. Al realizar ajustes de dosis, las características de liberación prolongada de INVEGA® SUSTENNA® deben considerarse [ver sección Farmacología clínica], ya que el efecto total del ajuste de la dosis puede no ser evidente durante varios meses.
Dosis omitida:
Evitar la omisión de dosis: Se recomienda administrar la segunda dosis de iniciación con INVEGA® SUSTENNA® una semana después de la primera dosis. Para evitar saltarse una dosis, los pacientes pueden recibir la segunda dosis 4 días antes o después del plazo establecido de una semana. Del mismo modo, se recomiendan la tercera y las subsiguientes inyecciones después del régimen de iniciación para ser dado mensual. Para evitar saltarse una dosis mensual, los pacientes pueden recibir la inyección hasta 7 días antes o después del plazo mensual establecido.
Manejo de una segunda dosis de iniciación omitida: Si el plazo establecido para la segunda inyección INVEGA® SUSTENNA® (una semana ± 4 días) se omite, el reinicio recomendado depende de la cantidad de tiempo que ha transcurrido desde la primera inyección del paciente. En caso de una segunda dosis de iniciación omitida siga las instrucciones de dosificación proporcionadas en la Tabla 2.
Tabla 2. Manejo de una segunda dosis de iniciación omitida
|
Ocurrencia de la segunda dosis de iniciación omitida |
Dosificación |
|
Menos de 4 semanas desde la primera inyección |
Administre la segunda dosis de iniciación de 156 mg en el músculo deltoides tan pronto como sea posible. 1. Se recomienda administrar una tercera inyección de 117 mg, ya sea en el deltoides o en el músculo glúteo 5 semanas después de la primera inyección (independientemente de la ocurrencia de la segunda inyección). 2. A partir de entonces, reanude la dosificación mensual regular, ya sea en el músculo deltoides o en el glúteo. |
|
4 a 7 semanas desde la primera inyección |
Reinicie la dosificación con dos inyecciones de 156 mg de la siguiente manera: 1. Administre una inyección en el deltoides tan pronto como sea posible. 2. Administre una segunda inyección en el deltoides 1 semana después. 3. A partir de entonces, reanude la dosificación mensual regular, ya sea en el músculo deltoides o en el glúteo. |
|
Más de 7 semanas desde la primera inyección |
Reinicie la dosificación con la iniciación recomendada (ver Sección 2.2, Tabla 1): 1. Administre una inyección de 234 mg en el deltoides el día 1. 2. Administre una inyección de 156 mg en deltoides 1 semana después. 3. A partir de entonces, reanude la dosificación mensual regular, ya sea en el músculo deltoides o en el glúteo. |
Manejo de dosis de mantenimiento omitida: En caso de una dosis de mantenimiento omitida siga las instrucciones de dosificación proporcionadas en la Tabla 3.
Tabla 3. Manejo de dosis de mantenimiento omitida.
|
Ocurrencia de la segunda dosis de mantenimiento omitida |
Dosificación |
|
4 a 6 semanas desde la última inyección |
Reanudar la dosificación mensual regular tan pronto como sea posible a la dosis previamente estabilizada del paciente, seguida de inyecciones a intervalos mensuales. |
|
Más de 6 semanas a 6 meses desde la última inyección |
Reanudar la misma dosis que el paciente se estabilizó anteriormente en (a menos que el paciente se estabilizó en una dosis de 234 mg, luego las 2 primeras inyecciones deberían ser cada uno de 156 mg.) de la siguiente manera: 1. Administrar una inyección en el deltoides tan pronto como sea posible. 2. Administrar una segunda inyección en el deltoides 1 semana después de la misma dosis. 3. A partir de entonces, retomar la administración de la dosis previamente estabilizada en el músculo deltoides o en el glúteo 1 mes después de la segunda inyección. |
|
Más de 6 meses desde la última inyección |
Reinicie la dosificación con la iniciación recomendada (ver Sección 2.2, Tabla 1): 1. Administre una inyección de 234 mg en el deltoides el día 1. 2. Administre una inyección de 156 mg en el deltoides 1 semana después. 3. A partir de entonces, reanude la administración de la dosis previamente establecida, ya sea en el músculo deltoides o en e glúteo. |
Use con paliperidona oral o con risperidona: Ya que la paliperidona es el principal metabolito activo de la risperidona, se debe tener precaución cuando INVEGA® SUSTENNA® se coadministra con risperidona o con paliperidona oral durante períodos prolongados de tiempo. Los datos de seguridad relacionados con el uso concomitante de INVEGA® SUSTENNA® con otros antipsicóticos es limitada.
Ajustes de la dosis:
Insuficiencia renal: INVEGA® SUSTENNA® no se ha estudiado sistemáticamente en pacientes con insuficiencia renal [véase Farmacología clínica]. En el caso de los pacientes con insuficiencia renal leve (aclaramiento de creatinina de ≥ 50 a < 80 ml/min [Fórmula Cockcroft-Gault]), se recomienda iniciar el tratamiento con INVEGA® SUSTENNA® con una dosis de 156 mg el primer día de tratamiento y de 117 mg una semana después, ambas dosis administradas en el músculo deltoides. Luego de ese momento, se debe continuar con inyecciones mensuales de 78 mg en el músculo deltoides o en los glúteos [véase Uso en poblaciones específicas y Farmacología clínica].
No se recomienda administrar INVEGA® SUSTENNA® a pacientes con insuficiencia renal moderada o grave (aclaramiento de creatinina < 50 ml/min). [Véase Uso en poblaciones específicas y Farmacología clínica].
La administración concomitante con inductores potentes de CYP3A4/P y glicoproteína (P-gp): Puede ser necesario aumentar la dosis de INVEGA® SUSTENNA® cuando es co-administrado un inductor potente de CYP3A4 y P-gp (por ejemplo, carbamazepina, rifampicina, hierba de San Juan). Por el contrario, tras la interrupción del inductor potente, puede ser necesario disminuir la dosis de INVEGA® SUSTENNA® [ver Interacciones de los medicamentos y Farmacología clínica].
Sustitución de otros antipsicóticos: No hay datos recogidos de forma sistemática que traten específicamente la sustitución, por parte de pacientes con esquizofrenia o trastorno esquizoafectivo, de un tratamiento con otros antipsicóticos por un tratamiento con INVEGA® SUSTENNA®, ni sobre la administración concomitante de otros antipsicóticos.
Sustitución de antipsicóticos orales: En aquellos pacientes que no hayan tomado nunca paliperidona oral o risperidona oral o inyectable, se debe establecer la tolerabilidad con paliperidona oral o risperidona oral antes de iniciar un tratamiento con INVEGA® SUSTENNA®.
Los antipsicóticos orales previos pueden ser gradualmente discontinuados al momento del tratamiento de iniciación con INVEGA® SUSTENNA®. El tratamiento con INVEGA® SUSTENNA® se iniciará con una dosis de 234 mg en el primer día del tratamiento y 156 mg una semana después, ambos administrados en el músculo deltoides [ver Dosis y administración]. Los pacientes previamente estabilizados con diferentes dosis de INVEGA® tabletas de liberación prolongada pueden alcanzar una exposición en el estado estacionario similar a paliperidona durante el tratamiento de mantenimiento con dosis mensuales de INVEGA® SUSTENNA® como se muestra en la Tabla 4.
Tabla 4. Las dosis de INVEGA e INVEGA® SUSTENNA® necesarias para alcanzar una exposición similar al paliperidona en estado estacionario durante el tratamiento de mantenimiento
|
Formulación |
INVEGA Tabletas de Liberación Prolongada |
Inyección de INVEGA® SUSTENNA® |
|
Frecuencia de dosificación |
Una vez al día |
Una vez cada 4 semanas |
|
Dosis (mg) |
12 6 3 |
234 117 39-78 |
Sustitución de antipsicóticos inyectables de acción prolongada: En aquellos pacientes que no hayan tomado nunca paliperidona oral o risperidona oral o inyectable, se debe establecer la tolerabilidad con paliperidona oral o risperidona oral antes de iniciar un tratamiento con INVEGA® SUSTENNA®.
Cuando sustituyes a los pacientes actualmente en estado estacionario a un antipsicótico inyectable de acción prolongada, iniciando un tratamiento con INVEGA® SUSTENNA® en lugar de la siguiente inyección programada. INVEGA® SUSTENNA® debe entonces continuarse a intervalos mensuales. No se requiere el régimen de iniciación de dosificación de una semana como se describe en la sección Dosis y Administración. Ver anterior Tabla 1 para la dosis recomendada de mantenimiento mensual. En base a la historia clínica previa de la tolerabilidad y/o eficacia, algunos pacientes pueden beneficiarse de dosis de mantenimiento inferiores o superiores dentro de las concentraciones adicionales disponibles (39 mg, 78 mg, 117 mg, 156 mg y 234 mg). La concentración de 39 mg no se estudió a largo plazo en el estudio de trastorno esquizoafectivo. Las dosis de mantenimiento mensual se pueden administrar tanto en el músculo deltoides o en el glúteo [véase Dosis y administración].
Si se suspende el tratamiento con INVEGA® SUSTENNA®, sus características de liberación prolongada deben ser consideradas. Tal como se recomienda con otros medicamentos antipsicóticos, se re-evaluará periódicamente la necesidad de continuar con la medicación para síntomas extrapiramidales (SEP).
USO EN POBLACIONES ESPECÍFICAS:
Embarazo: Embarazo Categoría C .
Detalles de riesgo: Estudios adecuados y bien controlados con INVEGA® SUSTENNA® no se han realizado en estudios de mujeres embarazadas. Los recién nacidos expuestos a antipsicóticos durante el tercer trimestre de embarazo están en riesgo de síntomas extrapiramidales y/o de abstinencia después del parto. INVEGA® SUSTENNA® debe utilizarse durante el embarazo sólo si el beneficio potencial justifica el riesgo potencial para el feto.
Consideraciones clínicas:
Reacciones adversas fetales/neonatales: Monitorear a los neonatos que presentan síntomas extrapiramidales o de abstinencia. Algunos neonatos se recuperan en cuestión de horas o días, sin tratamiento específico; otros pueden requerir hospitalización prolongada.
Datos:
Datos humanos: Se han notificado casos de agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria, y el trastorno de la alimentación en recién nacidos que presentaron la exposición intrauterina a los antipsicóticos en el tercer trimestre. Estas complicaciones han variado en intensidad; mientras que en algunos casos los síntomas han sido autolimitada, en otros casos los recién nacidos han requerido soporte de la unidad de cuidados intensivos y hospitalización prolongada.
Datos animales: No hubo efectos relacionados con el tratamiento de la descendencia cuando las ratas preñadas fueron inyectadas por vía intramuscular con palmitato de paliperidona durante el período de organogénesis a dosis de hasta 250 mg/kg, que es 10 veces la dosis de 234 mg el máximo recomendado para humanos de INVEGA® SUSTENNA® en una base de la superficie corporal mg/m2.
En estudios realizados en ratas y conejas preñadas en los que se administró paliperidona oral durante el período de organogénesis, no hubo aumentos en las anormalidades fetales hasta las dosis más altas ensayadas (10 mg/kg/día en ratas y 5 mg/kg/día en conejos, que son cada 8 veces la dosis máxima recomendada en humanos de 12 mg/día de paliperidona administrada por vía oral [INVEGA] de acuerdo al área de superficie corporal mg/m2).
En los estudios de reproducción en ratas con risperidona, que se convierte ampliamente en paliperidona en ratas y humanos, el aumento de las muertes de crías se observaron con dosis orales que son menores que la dosis máxima recomendada en humanos de la risperidona sobre una base de mg/m2 de superficie corporal (ver prospecto RISPERDAL).
Trabajo de parto y parto: El efecto de INVEGA® SUSTENNA® en el trabajo de parto y el parto en los seres humanos es desconocido.
Madres lactantes: En estudios con animales con paliperidona y en estudios en humanos con risperidona, la paliperidona se excreta en la leche. Debido al potencial de reacciones adversas severas en los lactantes, debe tomarse una decisión sobre si interrumpir la lactancia o suspender el fármaco, teniendo en cuenta la importancia del fármaco para la madre.
Uso pediátrico: La seguridad y eficacia de INVEGA® SUSTENNA® en pacientes <18 años de edad no se han establecido.
En un estudio en el cual las ratas jóvenes fueron tratadas con paliperidona oral a partir de los días 24 a 73 de edad, fue visto un daño reversible de rendimiento en una prueba de aprendizaje y la memoria, en las mujeres únicamente con una dosis no efectiva de 0,63 mg/kg/día, que produjo niveles plasmáticos (AUC) de la paliperidona similares a las de los adolescentes. No hay otros efectos consistentes sobre neuroconductual o desarrollo reproductivo se observaron hasta la dosis más alta (2,5 mg/kg/día), que produjo niveles plasmáticos de paliperidona 2-3 veces mayores que en los adolescentes.
Los perros más jóvenes fueron tratados durante 40 semanas con risperidona oral, que se metaboliza ampliamente en paliperidona en animales y humanos, en dosis de 0,31, 1,25, o 5 mg/kg/día. La disminución de la longitud y la densidad ósea se observaron con una dosis sin efecto fue de 0,31 mg/kg/día, que produjo niveles plasmáticos (AUC) de risperidona más paliperidona que eran similares a los de los niños y adolescentes que recibieron la dosis máxima recomendada en humanos de la risperidona. Además, un retraso en la maduración sexual se observó en todas las dosis en varones y mujeres. Los efectos anteriores mostraron poca o ninguna reversibilidad en las mujeres después de un período de recuperación libre de fármacos de 12 semanas.
Los efectos a largo plazo de la paliperidona sobre el crecimiento y la maduración sexual no han sido evaluados en niños y adolescentes.
Uso geriátrico: Los estudios clínicos de INVEGA® SUSTENNA® no incluyeron un número suficiente de personas de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes. Otra experiencia clínica informada no identificó diferencias en las respuestas entre los pacientes ancianos y jóvenes.
Este fármaco se sabe que se excreta principalmente por el riñón y el aclaramiento se reduce en pacientes con insuficiencia renal [véase Farmacología clínica], que se le debe dar dosis reducidas. Dado que los pacientes de edad avanzada son más propensos a tener una función renal disminuida, ajustar la dosis según la función renal [véase Dosis y administración].
Insuficiencia renal: El uso de INVEGA® SUSTENNA® no está recomendado en pacientes con insuficiencia renal moderada o severa (aclaramiento de creatinina <50 ml/min). Se recomienda reducir la dosis en pacientes con insuficiencia renal leve (aclaramiento de creatinina ≥ 50 ml/min a <80 ml min) [véase Dosis y administración y Farmacología clínica].
Insuficiencia hepática: INVEGA® SUSTENNA® no se ha estudiado en pacientes con insuficiencia hepática. Basado en un estudio con paliperidona oral, no se requiere ajuste de dosis en pacientes con insuficiencia hepática leve o moderada. La paliperidona no se ha estudiado en pacientes con insuficiencia hepática severa.
Pacientes con enfermedad de Parkinson o demencia de cuerpo de Lewy: Los pacientes con enfermedad de Parkinson o demencia con cuerpo de Lewy pueden experimentar una mayor sensibilidad a INVEGA® SUSTENNA®. Las manifestaciones pueden incluir confusión, embotamiento, inestabilidad postural con caídas frecuentes, síntomas extrapiramidales y características clínicas compatibles con el síndrome neuroléptico maligno.
SOBREDOSIS:
Experiencia humana: No se han reportado casos de sobredosis en estudios previos a la comercialización con INVEGA® SUSTENNA®. Debido a que INVEGA® SUSTENNA® es administrado por profesionales de la salud, el potencial de sobredosis por los pacientes es bajo.
Si bien la experiencia con sobredosis de paliperidona es limitada, entre los pocos casos de sobredosis reportados en los ensayos previos a la comercialización de paliperidona oral, la ingestión más alta estimada fue de 405 mg. Los signos y síntomas observados incluyeron síntomas extrapiramidales e inestabilidad de la marcha. Otros signos y síntomas potenciales incluyen las resultantes de una exageración de los efectos farmacológicos conocidos de la paliperidona, es decir, somnolencia y sedación, taquicardia e hipotensión, y la prolongación del intervalo QT. Torsades de pointes y fibrilación ventricular se han reportado en un paciente en el ámbito de la sobredosis de paliperidona oral.
La paliperidona es el principal metabolito activo de la risperidona. Experiencia con sobredosis informada con risperidona se puede encontrar en la sección Sobredosis del prospecto de risperidona.
Gestión de sobredosis: Póngase en contacto con un centro de control de envenenamientos certificado. Proporcionar cuidados de apoyo, incluyendo una estrecha supervisión médica y seguimiento. El tratamiento debe consistir en medidas generales empleadas en el tratamiento de la sobredosis con cualquier medicamento. Considere la posibilidad de una sobredosis de drogas múltiples. Asegure una adecuada vía respiratoria, oxigenación, y ventilación. Monitorear el ritmo cardíaco y los signos vitales. Usar medidas de apoyo y sintomáticas. No existe un antídoto específico para la paliperidona.
Tenga en cuenta las características de liberación prolongada de INVEGA® SUSTENNA® y el período de vida media aparente de paliperidona la hora de evaluar las necesidades de tratamiento y recuperación.
DESCRIPCIÓN:
INVEGA® SUSTENNA® es un antipsicótico atípico. INVEGA® SUSTENNA® contiene palmitato de paliperidona. El ingrediente activo, el palmitato de paliperidona, es un agente psicotrópico que pertenece a la clase química de derivados del benzisoxazol. INVEGA® SUSTENNA® contiene una mezcla racémica de (+) - y (-) - palmitato de paliperidona. El nombre químico es (9RS) 3- [2- [4 (6-fluoro-1,2-bencisoxazol-3-il) piperidin-1-il] etil] -2-metil-4oxo-6,7 , 8,9-tetrahidro-4H pirido [1,2-a] hexadecanoato pyrimadin-9-ilo. Su fórmula molecular es C39H57FN4O4 y su peso molecular es 664.89. La fórmula estructural es:
El palmitato de paliperidona es muy ligeramente soluble en etanol y metanol, prácticamente insoluble en polietilenglicol 400 y propilenglicol, y ligeramente soluble en acetato de etilo.
INVEGA® SUSTENNA® está disponible como una suspensión de liberación prolongada acuosa blanco a blanquecino estéril para inyección intramuscular en las siguientes dosis de concentración de palmitato de paliperidona (y volúmenes entregables de las jeringas prellenadas): 39 mg (0,25 ml), 78 mg (0,5 ml), 117 mg (0,75 ml), 156 mg (1,0 ml), y 234 mg (1,5 ml). El producto farmacéutico hidroliza a la fracción activa, la paliperidona, resultando en concentraciones de dosis de 25 mg, 50 mg, 75 mg, 100 mg y 150 mg de paliperidona, respectivamente. Los ingredientes inactivos son polisorbato 20 (12 mg/mL), polietilenglicol 4.000 (30 mg/ml), ácido cítrico monohidrato (5 mg/mL), fosfato disódico anhidro de hidrógeno, fosfato de dihidrógeno de sodio monohidrato, hidróxido de sodio, y agua para inyección.
INVEGA® SUSTENNA® se presenta en una jeringa precargada (olefina-copolímero cíclico) con un tapón de émbolo y tapón en el extremo (goma de bromobutilo). El kit también contiene 2 agujas de seguridad (una aguja de seguridad 22G de 1 ½ pulgadas y una aguja de seguridad 23G de 1 pulgada).
FARMACOLOGÍA CLÍNICA:
Mecanismo de acción: Palmitato de paliperidona es hidrolizado a paliperidona [ver Farmacología clínica]. La paliperidona es el principal metabolito activo de la risperidona. El mecanismo de acción de la paliperidona es desconocida. Sin embargo, se ha propuesto que la actividad terapéutica del fármaco en la esquizofrenia está mediada a través de una combinación de dopamina central Tipo 2 (D2) y serotonina de tipo 2 (5HT2A) antagonismo del receptor.
Farmacodinamia: La paliperidona es un dopamina activa a nivel central de tipo 2 (D2) antagonista del receptor de la serotonina y un tipo de antagonista del receptor 2 (5HT2A). La paliperidona también es activa como antagonista en los receptores adrenérgicos α1 y α2 y H1 histaminérgicos, lo que puede explicar algunos de los otros efectos de la droga. La paliperidona no tiene afinidad por los receptores muscarínicos colinérgicos o ß1- y ß2- receptores adrenérgico. La actividad farmacológica de los (+) - y (-) - enantiómeros paliperidona es cualitativa y cuantitativamente similar en vitro.
Farmacocinética:
Absorción y distribución: Debido a su extremadamente baja solubilidad en agua, el palmitato de paliperidona se disuelve lentamente después de la inyección intramuscular antes de ser hidrolizado a paliperidona y se absorbe en la circulación sistémica. Después de una dosis única por vía intramuscular, las concentraciones plasmáticas de paliperidona aumentan gradualmente hasta alcanzar las concentraciones plasmáticas máximas en un Tmáx promedio de 13 días. La liberación del fármaco comienza ya en el día 1 y dura por hasta 126 días.
Después de la inyección intramuscular de dosis únicas (39 mg - 234 mg) en el músculo deltoides, en promedio, un 28% Cmáx más alta se observó en comparación con la inyección en el músculo glúteo. Las dos inyecciones intramusculares deltoides iniciales de 234 mg el día 1 y 156 mg en el día 8 ayuda a alcanzar concentraciones terapéuticas rápidamente. El perfil de liberación y el régimen de dosificación de INVEGA® SUSTENNA® resulta en concentraciones terapéuticas sostenidas. El AUC de paliperidona tras la administración INVEGA® SUSTENNA® fue proporcional a la dosis en un rango de dosis 39 mg- 234 mg, y menos proporcional a la dosis para Cmáx para dosis superiores a 78 mg. El promedio máximo en estado estacionario: la relación a través una dosis de INVEGA® SUSTENNA® de 156 mg fue de 1,8 después de la administración en los glúteos y 2,2 después de la administración en el deltoides.
Tras la administración de palmitato de paliperidona los enantiomeros de paliperidona (+) y (-) se interconvierten, alcanzando un proporción AUC (+) a (-) de aproximadamente 1/6 a 1/8.
Basado en un análisis de la población, el volumen de distribución aparente de la paliperidona es de 391 L. La unión a proteínas plasmáticas de paliperidona racémica es del 74%.
Metabolismo y eliminación: En un estudio con 14C-paliperidona oral de liberación inmediata, una semana después de la administración de una dosis oral única de 1 mg de 14C-paliperidona de liberación inmediata, el 59% de la dosis se excreta sin cambios en la orina, lo que indica que la paliperidona no se metaboliza ampliamente en el hígado. Aproximadamente el 80% de la radioactividad administrada se recuperó en la orina y 11% en las heces. Cuatro vías metabólicas se han identificado in vivo, ninguna de las cuales representó más del 10% de la dosis: desalquilación, hidroxilación, deshidrogenación y escisión benzisoxazol. Aunque los estudios in vitro sugieren un papel para CYP2D6 y CYP3A4 en el metabolismo de la paliperidona, no hay evidencia in vivo de que estas isoenzimas desempeñen un papel significativo en el metabolismo de paliperidona. Los análisis de farmacocinética de la población no indicaron ninguna diferencia apreciable en el aclaramiento aparente de paliperidona tras la administración de paliperidona oral entre los metabolizadores rápidos y los metabolizadores lentos de los sustratos de la CYP2D6.
La vida media aparente de paliperidona tras la administración de dosis única de INVEGA® SUSTENNA® en el intervalo de dosis de 39 mg - 234 mg dio un rango de 25 días - 49 días.
Inyección de acción prolongada de paliperidona palmitato frente paliperidona oral de liberación prolongada: INVEGA® SUSTENNA® está diseñado para liberar paliperidona durante un período mensual, mientras paliperidona oral de liberación prolongada se administra sobre una base diaria. El régimen de iniciación para INVEGA® SUSTENNA® (234 mg/156 mg en el músculo deltoides en el día 1/día 8) fue diseñado para alcanzar rápidamente las concentraciones en estado estacionario de paliperidona al iniciar el tratamiento sin el uso de la suplementación oral.
En general, los niveles generales de plasma de iniciación con INVEGA® SUSTENNA® estuvieron dentro del rango de exposición observado con 6-12 mg de paliperidona oral de liberación prolongada. El uso del régimen de iniciación de INVEGA® SUSTENNA® permitió a los pacientes a permanecer en esta ventana de exposición de 6 a 12 mg de paliperidona oral de liberación prolongada incluso en mínimas días antes de la dosis (día 8 y el día 36). La variabilidad interindividual de la farmacocinética para paliperidona tras la entrega de INVEGA® SUSTENNA® fue relativamente menor en relación con la variabilidad determinada a partir de las tabletas de paliperidona oral de liberación prolongada de. Debido a la diferencia en los perfiles de mediana farmacocinéticas entre los dos productos, se debe ejercer precaución al realizar una comparación directa de sus propiedades farmacocinéticas.
Estudios de interacción farmacológica:
Capacidad de INVEGA® SUSTENNA® para afectar a otros fármacos: Los estudios in vitro en microsomas hepáticos humanos demostró que la paliperidona no inhibe sustancialmente el metabolismo de los fármacos metabolizados por las isoenzimas del citocromo P450, incluyendo CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 y CYP3A5. Por lo tanto, no se espera que la paliperidona inhiba eliminación de los fármacos que son metabolizados por estas vías metabólicas de forma clínicamente relevante. Tampoco se espera que la paliperidona tenga propiedades inductoras de la enzima.
La paliperidona es un inhibidor débil de la P-glicoproteína (P-gp) en altas concentraciones. No se dispone de datos en vivo, y la relevancia clínica se desconoce.
En un estudio de interacción farmacológica, la administración concomitante de paliperidona oral de tabletas de liberación prolongada (12 mg una vez al día durante 5 días) con divalproex sódico tabletas de liberación prolongada de (500 mg a 2.000 mg una vez al día) no afectó la farmacocinética en estado estacionario (AUC24h y la Cmáx, ss) de valproato en 13 pacientes estabilizados con valproato. En un estudio clínico, los sujetos con dosis estables de valproato tenían concentraciones plasmáticas promedio de valproato comparable cuando se añadió la paliperidona oral de tabletas de liberación prolongada 3-15 mg/día para su tratamiento con valproato existencia [Véase Interacciones medicamentosas].
Capacidad de otros fármacos para afectar INVEGA® SUSTENNA®: Mientras que los estudios in vitro indican que CYP2D6 y CYP3A4 pueden intervenir mínimamente en el metabolismo de la paliperidona, los estudios in vivo no demostraron disminución de la eliminación de estas isoenzimas; contribuyen a sólo una pequeña fracción del aclaramiento corporal total. En estudios in vitro han demostrado que la paliperidona es un sustrato de la P-gp [véase Interacciones medicamentosas].
La administración concomitante de paliperidona oral de liberación prolongada de 6 mg una vez al día con carbamazepina, un potente inductor de CYP3A4 y P-gp, a 200 mg dos veces al día originó una disminución de aproximadamente el 37% de la media en estado estacionario Cmáx y el AUC de paliperidona. Esta disminución se debe, en un grado sustancial, por un aumento del 35% en el aclaramiento renal de paliperidona. Una disminución menor de la cantidad del fármaco se excreta sin cambios en la orina sugiere que hubo poco efecto sobre el metabolismo del CYP o en la biodisponibilidad de paliperidona durante la administración concomitante con carbamazepina [véase Interacciones medicamentosas].
La co-administración de una sola dosis de paliperidona de liberación prolongada 12 mg tableta oral con tabletas divalproex sódico de liberación prolongada de (dos tabletas de 500 mg una vez al día en el estado estacionario) dio lugar a un aumento de aproximadamente 50% en la Cmáx y el AUC de paliperidona. Aunque esta interacción no se ha estudiado con INVEGA® SUSTENNA®, no se espera una interacción clínicamente significativa entre divalproex sódico y INVEGA® SUSTENNA® inyección intramuscular [véase Interacciones medicamentosas].
La paliperidona se metaboliza en una medida limitada por la CYP2D6. En un estudio de interacción en voluntarios sanos en los que se administró una dosis única de 3 mg de paliperidona de liberación prolongada por vía oral en forma concomitante con 20 mg por día de paroxetina (un inhibidor potente del CYP2D6), las exposiciones de paliperidona fueron del 16% (IC del 90% promedio: 4, 30) mayor en metabolizadores rápidos de CYP2D6. Las dosis más altas de paroxetina no se han estudiado. La relevancia clínica se desconoce.
Poblaciones específicas:
Insuficiencia renal: INVEGA® SUSTENNA® no se ha estudiado sistemáticamente en pacientes con insuficiencia renal. Basado en un número limitado de observaciones con INVEGA® SUSTENNA® en sujetos con deterioro renal leve y simulaciones farmacocinéticas, la dosis de INVEGA® SUSTENNA® debe reducirse en pacientes con insuficiencia renal leve; INVEGA® SUSTENNA® no está recomendado en pacientes con insuficiencia renal moderada o grave. Aunque INVEGA® SUSTENNA® no se ha estudiado en pacientes con insuficiencia renal moderada o grave, la disposición de una sola dosis de paliperidona oral de 3 mg tabletas de liberación prolongada se estudió en sujetos con grados variables de la función renal. Eliminación de la paliperidona disminuye al disminuir el aclaramiento de creatinina estimado. El aclaramiento total de la paliperidona se redujo en sujetos con insuficiencia renal en un 32% de media a leve (CrC1 = 50 ml/min a <80 ml/min), el 64% en moderada (CrC1 = 30 ml/min a <50 ml/min), y el 71% en severa (CrC1 = 10 ml/min a <30 ml/min) insuficiencia renal, que corresponde a un incremento medio de la exposición (AUCinf) de 1,5 veces, 2,6 veces y 4,8 veces, respectivamente, en comparación con sujetos sanos [véase Dosis y administración y Uso en poblaciones específicas].
Insuficiencia hepática: INVEGA® SUSTENNA® no se ha estudiado en pacientes con insuficiencia hepática. Basado en un estudio con paliperidona oral en sujetos con insuficiencia hepática moderada (Child-Pugh clase B), no se requiere ajuste de dosis en pacientes con insuficiencia hepática leve o moderada. En el estudio con paliperidona oral en sujetos con insuficiencia hepática moderada (Child-Pugh clase B), las concentraciones plasmáticas de paliperidona libre fueron similares a las de los sujetos sanos, aunque la exposición total de la paliperidona disminuyó debido a una disminución de la unión a proteínas. La paliperidona no se ha estudiado en pacientes con insuficiencia hepática grave [véase Uso en poblaciones específicas].
Ancianos: No se recomienda ajustar la dosis en función de la edad por sí sola. Sin embargo, el ajuste de dosis puede requerirse debido a disminuciones relacionadas con la edad en el aclaramiento de creatinina [véase Insuficiencia renal arriba y Dosis y administración].
Raza: No se recomienda ajustar la dosis en función de la raza. No se observaron diferencias en la farmacocinética entre japoneses y caucásicos.
Género: No se recomienda ajustar la dosis en función del sexo, a pesar de absorción más lenta en las mujeres se observó en un análisis farmacocinético de la población.
Fumadores: No se recomienda ajustar la dosis en función de la condición de fumador. En base a los estudios in vitro realizados con enzimas hepáticas humanas, la paliperidona no es un sustrato de la CYP1A2; fumar debe, por lo tanto, no tener un efecto sobre la farmacocinética de paliperidona.
INFORMACIÓN DESTINADA ÚNICAMENTE A MÉDICOS O PROFESIONALES DE LA SALUD:
Instrucciones de uso:
Cada inyección debe ser administrada solamente por un profesional de la salud.
El kit contiene una jeringa precargada y 2 agujas de seguridad (una aguja de calibre 22 de 1 ½ pulgadas y una aguja de calibre 23 de 1 pulgada) para la inyección intramuscular.
INVEGA® SUSTENNA® es para un solo uso.
a. Agitar vigorosamente la jeringa durante al menos 10 segundos para asegurar una suspensión homogénea.
b. Seleccionar la aguja adecuada.
Para la inyección en el DELTOIDES:
• Si el paciente pesa menos de 90 kg, utilice la aguja de calibre 23 y 1 pulgada (la aguja con el cono azul).
• Si el paciente pesa 90 kg o más, utilice la aguja de calibre 22 y 1½ pulgadas 22 (la aguja con el cono gris).
Para la inyección en el GLÚTEO:
Utilice la aguja de calibre 22 y 1 ½ pulgadas (la aguja con el cono gris). Independientemente del peso del paciente.
c. Mientras sujeta la jeringa en posición vertical, quite el tapón de goma de la punta, girándolo suavemente en el sentido de las agujas del reloj.
d. Abra el envoltorio de la aguja de seguridad hasta la mitad. Sujete la funda de la aguja utilizando el envoltorio de plástico. Acople la aguja de seguridad a la conexión Luer de la jeringa girándola suavemente en el sentido de las agujas del reloj.
e. Retire la funda de la aguja tirando de forma recta. No retuerza la funda ya que la aguja podría aflojar de la jeringa.
f. Coloque la jeringa con la aguja adjuntada en posición vertical para eliminar el aire. Elimine el aire de la jeringa moviendo el vástago del émbolo lentamente hacia arriba.
g. Inyecte todo el contenido por vía intramuscular lentamente y en profundidad en el músculo seleccionado deltoides o en el músculo glúteo del paciente. No administre por otra vía.
h. Una vez puesta la inyección, utilice el pulgar u otro dedo de la mano (h1, h2), o bien una superficie plana (h3), para activar el sistema de protección de la aguja. El sistema de protección de la aguja estará totalmente activado cuando se oiga un clic. Deseche la jeringa con la aguja de manera adecuada.
Aprobado por DIGEMID: 28-Marzo-2016
Titular del registro sanitario:
JOHNSON & JOHNSON DEL PERÚ S.A.
Av. Canaval y Moreyra N° 480 – Int. 901 y 1301. San Isidro
Lima-Perú
FORMAS DE PRESENTACIÓN:
INVEGA® SUSTENNA® 50 mg/0.5 ml, 75 mg/0.75 ml, 100 mg/1.0 ml y 150 mg/1.5 ml Suspensión de liberación prolongada para inyección será comercializado en caja de cartón dúplex conteniendo 1 jeringa precargada + 1 aguja de 1.5” 22G y 1 aguja de 1” 23G o en caja de cartón dúplex conteniendo 1 jeringa precargada y backstop ensamblado + 1 aguja de 1.5” 22G y 1 aguja de 1” 23G.
INVEGA® SUSTENNA® 25 mg/0.25 ml Suspensión de liberación prolongada para inyección no estará disponible en el mercado local.
Si tiene alguna duda del correcto uso de este medicamento consulte a su médico o farmacéutico.