
RETEVEN CR
OXIBUTININA
Comprimidos de liberación prolongada
Comprimidos recubiertos de liberación prolongada , 5 Miligramos
Comprimidos recubiertos de liberación prolongada , 10 Miligramos
Comprimidos recubiertos de liberación prolongada , 10 Miligramos
FÓRMULA
Cada COMPRIMIDO RECUBIERTO DE LIBERACIÓN CONTROLADA de RETEVEN CR® 5 mg contiene:
Oxibutinina clorhidrato 5 mg
Excipientes c.s.p.
Cada COMPRIMIDO RECUBIERTO DE LIBERACIÓN CONTROLADA de RETEVEN CR® 10 mg contiene:
Oxibutinina clorhidrato 10 mg
Excipientes c.s.p.
Químicamente, el cloruro de oxibutinina es hidroclorhidrato de d,l (racémico) 4-dietilamino-2-butinil clorhidrato fenilciclohexilglicolato. La fórmula empírica de oxibutinina clorhidrato es C22H31NO3• HCl.
Su fórmula estructural es:
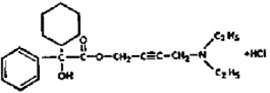
Oxibutinina clorhidrato es un sólido blanco cristalino con un peso molecular de 393,9. Es fácilmente soluble en agua y ácidos, pero relativamente insoluble en álcalis.
Componentes y rendimiento del sistema: RETEVEN CR® utiliza presión osmótica para liberar oxibutinina clorhidrato a una velocidad controlada durante 24 hs aproximadamente. El sistema, que se parece al de un comprimido convencional en aspecto, está compuesto por un núcleo bicapa osmóticamente activo rodeado por una membrana semipermeable. El núcleo bicapa está compuesto por una capa de droga que contiene la droga y los excipientes, y un motor osmótico que contiene componentes osmóticamente activos. En la membrana semipermeable hay un orificio perforado con láser de precisión en el lado de la capa de fármaco del comprimido. En un medio acuoso, como por ejemplo el tracto gastrointestinal, el agua penetra la membrana hacia el núcleo del comprimido, generando que la droga quede en suspensión y que se expanda la capa de empuje. Esta expansión empuja la droga suspendida para que salga por el orificio. La membrana semipermeable controla la velocidad en el que el agua penetra el núcleo del comprimido, que a su vez controla la velocidad de la liberación de la droga. La velocidad controlada de liberación de la droga dentro del lumen gastrointestinal es por lo tanto independiente del pH o de la motilidad gastrointestinal. La función de RETEVEN CR® depende de la existencia de un gradiente osmótico entre los contenidos de un núcleo bicapa y el fluido en el tracto gastrointestinal. Dado que el gradiente osmótico se mantiene constante, la liberación de la droga se mantiene esencialmente constante. Los componentes biológicamente inertes del comprimido se mantienen intactos durante el tránsito gastrointestinal y se eliminan en las heces como una cáscara insoluble.
INDICACIONES Y USO
• RETEVEN CR® (cloruro de oxibutinina) es un comprimido recubierto de liberación controlada que se administra una vez al día y está indicado para el tratamiento de la vejiga hiperactiva con síntomas de incontinencia urinaria, urgencia urinaria y frecuencia urinaria.
• RETEVEN CR® también está indicado para el tratamiento de pacientes pediátricos de 6 años de edad en adelante con síntomas de sobreactividad del detrusor asociada con un trastorno neurológico (por ejemplo, espina bífida).
CONTRAINDICACIONES
• RETEVEN CR® (cloruro de oxibutinina) está contraindicado en pacientes con retención urinaria, retención gástrica o glaucoma no controlado de ángulo estrecho y en pacientes con riesgo de tales condiciones.
• RETEVEN CR® también está contraindicado en pacientes que han demostrado hipersensibilidad a la sustancia farmacológica u otros componentes del producto.
REACCIONES ADVERSAS
Eventos adversos con RETEVEN CR®: La seguridad y eficacia de RETEVEN CR® (cloruro de oxibutinina) se evaluaron en un total de 580 participantes que recibieron RETEVEN CR® en 4 ensayos clínicos (429 pacientes) y cuatro estudios farmacocinéticos (151 voluntarios sanos). Los 429 pacientes fueron tratados con 5-30 mg/día por hasta 4,5 meses. Tres de los 4 ensayos clínicos permitieron ajustes de dosis basados en la eficacia y los eventos adversos, y uno tenía un diseño de escalamiento de dosis fijada. Se brinda información de seguridad a los 429 pacientes de estos tres estudios clínicos controlados y del estudio abierto en la primera columna de la Tabla 3 a continuación.
Los eventos adversos de otros dos estudios adicionales, posteriores a la comercialización, controlados, de dosis fijada y 12 semanas de duración del tratamiento, en los que 576 pacientes fueron tratados con RETEVEN CR® 10 mg/día, también figuran en la Tabla 3 (segunda columna). Los eventos adversos se informan independientemente de su causalidad.
Tabla 3: Incidencia (%) de eventos adversos informados por ≥5% de los pacientes que utilizan RETEVEN CR® (5-30 mg/día) y % de los correspondientes eventos adversos en dos estudios de dosis filadas (10 mg/día)
|
Sistema orgánico |
Evento adverso |
RETEVEN CR® |
RETEVEN CR® |
|
General |
Dolor de cabeza |
10 |
6 |
|
Astenia |
7 |
3 |
|
|
Dolor |
7 |
4 |
|
|
Digestivo |
Boca seca |
61 |
29 |
|
Constipación |
13 |
7 |
|
|
Diarrea |
9 |
7 |
|
|
Náuseas |
9 |
2 |
|
|
Dispepsia |
7 |
5 |
|
|
Nervioso |
Somnolencia |
12 |
2 |
|
Mareos |
6 |
4 |
|
|
Respiratorio |
Rinitis |
6 |
2 |
|
Sensaciones especiales |
Visión borrosa |
8 |
1 |
|
ojo seco |
6 |
3 |
|
|
Urogenital |
Infección del tracto urinario |
5 |
5 |
Los eventos adversos más comunes informados por 429 pacientes que recibieron entre 5-30 mg/día RETEVEN CR® fueron los efectos colaterales esperados de los agentes anticolinérgicos. La incidencia de la boca seca estuvo relacionada con la dosis.
El índice de discontinuación para todos los eventos adversos fue de 6,8% en los 429 pacientes de los 4 estudios de eficacia y seguridad que recibieron entre 5-30 mg/día. El evento adverso más frecuente que provocó la discontinuación temprana de la medicación en estudio fue las náuseas (1,9%), mientras que la discontinuación debido a la boca seca fue del 1,2%.
Además, los siguientes eventos adversos fueron informados por entre ≥1 y <5% de todos los pacientes que recibieron RETEVEN CR® en los 6 estudios de eficacia ajustable y de dosis fijada y de seguridad. Infecciones e infestaciones: nasofaringitis, infección del tracto respiratorio superior, sinusitis, bronquitis, cistitis; Trastornos psiquiátricos: insomnio, depresión, nerviosismo, estado de confusión; Trastornos del sistema nervioso central: disgeusia: Trastornos cardíacos: palpitaciones; Trastornos vasculares: hipertensión; Trastornos respiratorios, torácicos y mediastínicos: sequedad nasal, tos, dolor faringolaríngeo, garganta seca; Trastornos gastrointestinales: enfermedad por reflujo gastroesofágico, dolor abdominal, diarrea, flatulencia, vómitos; Trastornos de la piel y del tejido subcutáneo: piel seca, prurito; Trastornos músculo-esqueléticos y del tejido conectivo: dolor de espalda; artralgia; dolor en las extremidades; Trastornos renales y urinarios: retención urinaria, vacilación urinaria, disuria; Trastornos generales y condiciones en la zona de administración: fatiga, edema periférico, astenia, dolor de pecho; Investigaciones: aumento de presión arterial.
Farmacovigilancia posterior a la comercialización: Dado que las reacciones posteriores a la comercialización son informadas voluntariamente por una población de tamaño indeterminado, no siempre es posible calcular de forma confiable su frecuencia o establecer una relación causal con la exposición al fármaco. Las siguientes reacciones adversas adicionales se han informado a partir de la experiencia posterior a la comercialización de RETEVEN CR® en todo el mundo: Trastornos psiquiátricos: trastorno psicótico, agitación, alucinaciones, trastornos de la memoria; Trastornos del sistema nervioso central: convulsiones: Trastornos cardíacos: arritmia, taquicardia, prolongación del intervalo QT; Trastornos vasculares: enrojecimiento; Trastornos de la piel y del tejido subcutáneo: rash; Trastornos renales y urinarios: impotencia; Trastornos generales y alteraciones en el lugar de administración: reacciones de hipersensibilidad, incluido angioedema con obstrucción de las vías respiratorias, urticaria, y edema facial; reacciones anafilácticas raras que requirieron hospitalización para un tratamiento de emergencia; Complicaciones en procedimientos, lesiones e intoxicación: caída.
Los eventos adversos adicionales informados con otras formulaciones de cloruro de oxibutinina incluyen: cicloplejía, midriasis y prohibición de la lactancia.
ESTUDIOS CLÍNICOS: RETEVEN CR® (cloruro de oxibutinina) fue evaluado para el tratamiento de pacientes con vejiga hiperactiva con síntomas de incontinencia urinaria, urgencia urinaria y frecuencia urinaria en tres estudios controlados y un estudio abierto. La mayoría de los pacientes eran caucásicos (89,0%) y de sexo femenino (91,9%) con una edad promedio de 59 años (rango, 18 a 98 años). Los criterios de inicio requirieron que los pacientes tuvieran una incontinencia de urgencia o mezclada (con una predominancia de urgencia) tal como se evidenció en ≥6 episodios por semana de incontinencia de urgencia y ≥10 micciones por día. El estudio 1 tuvo un diseño de escalamiento de dosis fijada, mientras que los otros estudios utilizaron un diseño de ajuste de dosis en el que cada dosis final del paciente se ajustó a un equilibrio entre la mejora de los síntomas de incontinencia y la tolerabilidad de los efectos secundarios. Los estudios controlados incluyeron pacientes que habían respondido a la oxibutinina u otros medicamentos anticolinérgicos, y estos pacientes se mantuvieron con una dosis final durante 2 semanas.
ADVERTENCIAS: Se ha informado las siguientes reacciones adversas con oxibutinina: angioedema de cara, labios, lengua y/o laringe. En algunos casos, el angioedema ocurrió luego de la primera dosis. El angioedema asociado con las vías respiratorias superiores podría poner la vida en riesgo. Si involucra a la lengua, hipofaringe o laringe, la oxibutinina debe discontinuarse de inmediato y se debe proveer una terapia y/o medidas adecuadas necesarias para asegurar unas vías respiratorias despejadas.
PRECAUCIONES
Efectos sobre el sistema nervioso central: La oxibutinina está asociada a los efectos anticolinérgicos del sistema nervioso central (SNC) (ver Reacciones adversas). Se ha informado una variedad de efectos anticolinérgicos del SNC, que incluyen alucinaciones, agitación, confusión y somnolencia. Se deben monitorear los efectos anticolinérgicos del SNC en los pacientes, especialmente durante los primeros meses posteriores al tratamiento o al aumento de la dosis. Si el paciente experimenta efectos anticolinérgicos del SNC, se debe considerar una reducción de la dosis o la interrupción de la droga.
RETEVEN CR® se debe utilizar con precaución en pacientes con demencia preexistente tratados con inhibidores de la colinesterasa debido al riesgo de agravar los síntomas.
General: RETEVEN CR® (cloruro de oxibutinina) se debe utilizar con precaución en pacientes con insuficiencia hepática o renal y en pacientes con miastenia gravis debido al riesgo de que se agraven los síntomas.
Retención urinaria: RETEVEN CR® debe administrarse con precaución a pacientes con obstrucción de la vejiga del flujo de salida vesical clínicamente importante, por el riesgo de retención urinaria (ver Contraindicaciones).
Trastornos gastrointestinales: RETEVEN CR® debe administrarse con precaución a pacientes con trastornos de obstrucción gastrointestinal, porel riesgo de retención gástrica (ver Contraindicaciones).
RETEVEN CR®, al igual que otros fármacos anticolinérgicos, puede reducir la motilidad gastrointestinal y debe usarse con precaución en pacientes con colitis ulcerativa, atonía intestinal.
RETEVEN CR® debe usarse con precaución en pacientes con reflujo gastroesofágico y/o que estén tomando simultáneamente fármacos (como los bisfosfonatos) que puedan causar o exacerbar la esofagitis.
Al igual que con cualquier otro material no deformable, se debe tener precaución al administrar RETEVEN CR® a pacientes con estrechamiento gastrointestinal grave preexistente (patológico o iatrogénico). Hubo reportes raros de síntomas de obstrucción en pacientes con estenosis conocida y asociada con la ingestión de otros fármacos en formulaciones no deformables de liberación controlada.
Información para pacientes: A los pacientes se les debe informar que la oxibutinina puede generar angioedema que podría traer como consecuencia una obstrucción en las vías respiratorias con riesgo de muerte. A los pacientes se les debe discontinuar la terapia con oxibutinina y deben buscar atención médica inmediata si experimentan edema en la lengua, edema laringofaríngeo, o dificultad para respirar. A los pacientes se les debe informar que la congestión por el calor (fiebre e insolación debido a una sudoración disminuida) puede ocurrir cuando se administran anticolinérgicos, como cloruro de oxibutinina, en la presencia de alta temperatura ambiental.
Debido a que los agentes anticolinérgicos, como por ejemplo oxibulinina, podrían producir somnolencia o visión borrosa, se les debe advertirá los pacientes quetengan precaución.
A los pacientes se les debe informar que el alcohol puede acentuar la somnolencia provocada por los agentes anticolinérgicos como la oxibutinina.
Se debe informara los pacientes que RETEVEN CR® debe tragarse entero con la ayuda de líquidos. Los pacientes no deben masticar, dividir ni triturar los comprimidos. La medicación está contenida dentro de una cubierta no absorbible, diseñada para liberar el fármaco a una velocidad controlada. La cubierta del comprimido se elimina del organismo; los pacientes no deben preocuparse si ocasionalmente notan en sus heces algo que se asemeja a un comprimido. RETEVEN CR® se debe tomar a la misma hora aproximadamente cada día.
Interacciones medicamentosas: El uso concomitante de oxibutinina con otras drogas anticolinérgicas o con otros agentes que produzcan resequedad de boca, constipación, somnolencia y/u otros efectos similares a los de los anticolinérgicos, puede aumentar la frecuencia y/o la gravedad de tales efectos.
Los agentes anticolinérgicos pueden alterar potencial mente la absorción de algunos fármacos administrados concomitantemente, por los efectos anticolinérgicos en la motilidad gastrointestinal. Esto podría ser de importancia para las drogas con un índice terapéutico limitado.
Las concentraciones promedio de cloruro de oxibutinina en plasma fueron aproximadamente 2 veces más altas cuando RETEVEN CR® se administró con ketoconazol, un potente inhibidor del CYP3A4. Otros inhibidores del citocromo P-450, como los agentes antimicóticos (por ejemplo, itraconazol y miconazol) o los antibióticos macrólidos (por ejemplo, eritromicina y claritromicina) podrían alterar los parámetros farmacocinéticos promedio (Cmax y AUC). Se desconoce la relevancia clínica de las potenciales interacciones. Se debe tener precaución cuando se coadministran tales drogas.
Carcinogénesis, mutagénesis, trastornos en fertilidad: Un estudio de 24 meses en ratas con dosificaciones de cloruro de oxibutinina de 20, 80 y 160 mg/kg/día no mostró evidencia de carcinogenicidad. Estas dosis son aproximadamente 6, 25 y 50 veces mayores a la exposición máxima en humanos, con base en el área superficial.
El cloruro de oxibutinina no mostró un aumento de la actividad mutagénica cuando se la analizó en los siguientes sistemas de prueba: Schizosaccharomyces pompholiciformis, Saccharomyces cerevisiae y Salmonella typhimurium.
Los estudios de reproducción con cloruro de oxibutinina en ratones, ratas, hámsters y conejos no mostraron evidencia definitiva de trastornos en la fertilidad.
Embarazo:
• Efectos teratogénicos Embarazo Categoría B
Estudios de reproducción con cloruro de oxibutinina en ratones, ratas, hámsters y conejos no mostraron evidencia definitiva de alteración en la fertilidad ni daño a los fetos. No se ha establecido la seguridad de la administración de RETEVEN CR® a mujeres que están o pueden quedar embarazadas. Por tanto, RETEVEN CR® no debe administrarse a mujeres embarazadas, a menos que, según el criterio del médico, los beneficios clínicos probables superen los posibles riesgos.
Uso durante la lactancia: Se desconoce si la oxibutinina se excreta en la leche humana. Debido a que muchas drogas se excretan en la leche humana, se debe tener precaución cuando se administra RETEVEN CR® a las mujeres que amamantan.
Uso pediátrico: La eficacia y seguridad de RETEVEN CR® se estudiaron en 60 pacientes pediátricos en un estudio abierto de 24 semanas. Los pacientes tenían entre 6 y 15 años y síntomas de sobreactividad del detrusor en asociación con un trastomo neurológico (por ejemplo, espina bífida). Todos tuvieron un cateterismo limpio intermitente y se les administró cloruro de oxibutinina. Los resultados del estudio demostraron que la administración de RETEVEN CR® de 5 a 20 mg/día estuvo asociada con un aumento de línea de base en el volumen promedio de la orina por cateterismo de 108 mL a 136 mL, un aumento desde la línea de base en el volumen promedio de orina al despertarse por la mañana de entre 148 mL y 189 mL, y un aumento desde la línea de base en el porcentaje promedio de cateterizaciones sin un episodio de pérdidas entre un 34% y un 51%.
Los resultados urodinámicos fueron consistentes con los resultados clínicos. La administración de RETEVEN CR® dio como resultado un aumento desde la línea de base en la capacidad promedio máxima cistométrica entre 185 mL y 254 mL, una disminución desde la línea de base en la presión promedio del detrusor con una capacidad máxima dstométrica desde 44 cm de H2O a 33 cm de H2O, y una reducción en el porcentaje de pacientes que demostraron contracciones no inhibidas del detrusor (de al menos 15 cm de H2O) del 60% al 28%.
RETEVEN CR® no está recomendado en pacientes pediátricos que no pueden tragar el comprimido entero sin masticarlo, dividirlo o romperlo, ni tampoco en pacientes de menos de 6 años (ver Dosis y administración).
Uso geriátrico: El índice y la severidad de los efectos anticolinérgicos informados por pacientes de menos de 65 años de edad y de aquellos de más de 65 años de edad fueron similares (ver Farmacologia cíinica: Farmacocinética, Poblaciones especiales: Geriátrica).
POSOLOGÍA Y ADMINISTRACIÓN
RETEVEN CR® (cloruro de oxibutinina) se debe tragar entero con la ayuda de líquidos, y no debe masticarse, dividirse ni triturarse.
RETEVEN CR® puedeadministrarseconosin alimentos.
Adultos: La dosis inicial recomendada de RETEVEN CR® es de 5 o 10 mg una vez por día en el mismo momento cada día. La dosis se puede ajustar con aumentos de 5 mg para alcanzar un equilibrio de eficacia y tolerabilidad (hasta a un máximo de 30 mg/día). En general, el ajuste de dosis podría realizarse en intervalos semanales.
Pacientes pediátricos de 6 años de edad en adelante: La dosis inicial recomendada de RETEVEN CR® es de 5 mg una vez por día en el mismo momento cada día. La dosis se puede ajustar con aumentos de 5 mg para alcanzar un equilibrio de eficacia ytolerabilidad (hasta a un máximo de 20 mg/día).
SOBREDOSIS: Se debe considerar la liberación continua de oxibutinina de RETEVEN CR® (cloruro de oxibutinina) en el tratamiento de la sobredosis. Los pacientes deben ser monitoreados por al menos 24 horas. El tratamiento debe ser sintomático y dar soporte. Se debe administrar carbón activado como así también un catártico.
La sobredosis con cloruro de oxibutina se ha asociado con efectos anticolinérgicos que incluyen excitación del sistema nervioso central, enrojecimiento, fiebre, deshidratación, arritmia cardiaca, vómitos y retención urinaria.
Se ha informado la ingesta de 100 mg de cloruro de oxibutinina en asociación con alcohol en un paciente de 13 años de edad que experimentó pérdida de memoria, y en una mujer de 34 años que desarrolló estupor, seguido de desorientación y agitación al despertarse, pupilas dilatadas, piel seca, arritmia cardiaca y retención de la orina. Ambos pacientes se recuperaron por completo con tratamiento sintomático.
FARMACOLOGÍA CLÍNICA: El cloruro de oxibutinina ejerce un efecto antiespasmódico directo sobre el músculo liso e inhibe la acción muscarínica de la acetilcolina en tal músculo. El cloruro de oxibutinina exhibe sólo una quinta parte de la actividad antícolinérgica de la atropina en el músculo detrusor del conejo, pero entre cuatro y diez veces la actividad antiespasmódico. No ocurren efectos de bloqueo en las uniones neuromusculares ni en los ganglios autónomos (efectos antinicotínicos).
El cloruro de oxibutinina relaja el músculo liso de la vejiga. En pacientes con contracciones involuntarias de la vejiga, los estudios cistométricos han demostrado que la oxibutinina aumenta la capacidad de la vejiga (vesical), disminuye la frecuencia de las contracciones no inhibidas del músculo detrusor, y retrasa el deseo inicial de orinar. Por lo tanto, la oxibutinina disminuye la urgencia y la frecuencia tanto de episodios de incontinencia y de orinar voluntariamente.
La actividad antimuscarínica reside predominantemente en el R-isómero. El metabolito desetiloxibutinina tiene una actividad farmacológica similar a la de la oxibutinina en estudios in vitro.
Farmacocinética:
• Absorción: Luego de la primera dosis de RETEVEN CR® (cloruro de oxibutinina), las concentraciones en plasma de oxibutinina aumentan de 4 a 6 horas; por lo tanto las concentraciones estables se mantienen por hasta 24 horas, minimizando las fluctuaciones entre las concentraciones máximas y mínimas asociadas con la oxibutinina.
Las biodisponibilidades relativas de oxibutinina-R y oxibutinina-S de RETEVEN CR® son del 156% y 187%, respectivamente, en comparación con la oxibutinina. Los parámetros farmacocinéticos promedio para -R y -S se resumen en la Tabla 1. Los perfiles de concentración-tiempo en plasma para oxibutinina-R y -S son similares en forma; la Figura 1 muestra el perfil para oxibutinina -R.
Tabla 1: Los promedios farmacocinéticos promedio de oxibutinina-R y -S (SD) seguidos de una dosis individual de RETEVEN CR® 10 mg (n=43)
|
Parámetros (unidades) |
Oxibutinina-R |
Oxibutinina-S |
||
|
Cmax (ng/mL) |
1,0 |
(0,6) |
1,8 |
(1,0) |
|
Tmax (h) |
12,7 |
(5,4) |
11,8 |
(5,3) |
|
T1/2 (h) |
13,2 |
(6,2) |
12,4 |
(6,1) |
|
AUC(0-48) (ng• h/mL) |
18,4 |
(10,3) |
34,2 |
(16,9) |
|
AUCinf (ng• h/mL) |
21,3 |
(12,2) |
39,5 |
(21,2) |
Figura 1: Las concentraciones promedio en plasma de oxibutinina-R luego de una dosis individual de RETEVEN CR® 10 mg y oxibutinina 5 mg administrada cada 8 horas (n=23 para cada tratamiento).
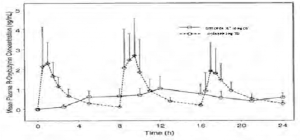
Las concentraciones plasmáticas de estado estable de la oxibutinina se alcanzan en el día 3 de dosificación repetida de RETEVEN CR® sin que se observe acumulación de fármaco ni cambio en los parámetros farmacocinéticos de la oxibutinina y la desetiloxibutinina.
Se estudió la farmacocinética de RETEVEN CR® en estado estable en 19 pacientes de entre 5 y 15 años con sobreactividad del detrusor asociada con una condición neurológica (por ejemplo, espina bífida). Los niños recibieron una dosis diaria total de RETEVEN CR® de entre 5 y 20 mg (0,10 a 0,77 mg/kg). La técnica de muestreo disperso se utilizó para obtener muestras séricas. Cuando todos los datos disponibles se normalizan a un equivalente de 5 mg por día de RETEVEN CR®, los parámetros farmacocinéticas promedio derivados para la oxibutinina-R y-S, y para desetiloxibutinina-R y -S se resumen en la Tabla 2. Los perfiles de concentración plasma-tiempo para oxibutinina-R y -S son similares en forma; la Figura 2 muestra el perfil de oxibutinina-R cuando todos los disponibles se normalizan a un equivalente de 5 mg por día.
Tabla 2: Parámetros farmacocinéticos promedio ± SD de oxibutinina-R y -S y desetiloxibutinina-R y -S en niños de entre 5 y 15 años luego de la administración de 5 a 20 mg RETEVEN CR® una vez por día (n= 19), todos los datos disponibles normalizados a un equivalente de RETEVEN CR® 5 mg una vez por día
|
Oxibutinina-R |
Oxibutinina-S |
Desetiloxibutinina-R |
Desetiloxibutinina-S |
|
|
Qmax (ng/mL) |
0,7±0,4 |
1,3±0,8 |
7,8±3,7 |
4,2±2,3 |
|
Tmax (h) |
5,0 |
5,0 |
5,0 |
5,0 |
|
AUC (ng• h/mL) |
12,8±7,0 |
23,7±14,4 |
125,1±66,7 |
73,6±47,7 |
Figura 2: Concentraciones en plasma en estado estable (± SD) de oxibutinina-R luego de la ad ministración de 5 a 20 mg RETEVEN CR® un vez por día en niños de entre 5 y 15 años. El gráfico representa todos los datos disponibles normalizados a un equivalente de RETEVEN CR® 5 mg una vez pordía.
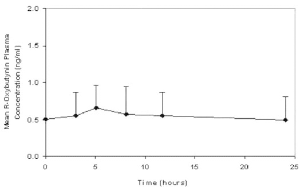
• Efectos de los alimentos: La velocidad y el grado de absorción y de metabolismo de la oxibutinina son similares cuando el organismo recibe alimentos o está en ayunas.
• Distribución: Las concentraciones plasmáticas de oxibutinina disminuyen bioexponencialmente luego de la administración intravenosa u oral. El volumen de distribución es de 193 L después de la administración intravenosa de 5 mg de cloruro de oxibutinina.
• Metabolismo: La oxibutinina es metabolizada principalmente por los sistemas de enzimas del citocromo P-450, particulamente el CYP3A4 que se encuentra primordialmente en el hígado y la pared intestinal. Sus productos metabólicos incluyen el ácido fenilciclohexilglicólico, que es farmacológicamente inactivo, y la desetiloxibutinina, que es farmacológicamente activa. Luego de la administración de RETEVEN CR®, las concentraciones plasmáticas de R-desetiloxibutinina y S-desetiloxibutinina son de 73 y 92%, respectivamente de las concentraciones observadas con la oxibutinina.
• Excreción: La oxibutinina se metaboliza ampliamente en el hígado, y menos del 0,1% de la dosis administrada se excreta inalterada en la orina. Asimismo, menos del 0,1% de la dosis administrada se excreta como el metabolito desetiloxibutinina.
• Proporcionalidad de la dosis: Los parámetros farmacocinéticos de la oxibutinina y la desetiloxibutinina (Cmáx y AUC) después de la administración de 5-20 mg de RETEVEN CR® son proporcionales a la dosis.
• Poblaciones especiales:
– Pacientes geriátricos: La farmacocinética de RETEVEN CR® fue similar en todos los pacientes estudiados (de hasta 78 años).
– Pacientes pediátricos: La farmacocinética de RETEVEN CR® se evaluó en 19 pacientes de entre 5 y 15 años con sobreactividad del detrusor asociada con una condición neurológica (por ejemplo, espina bífida). La farmacocinética de RETEVEN CR® en estos pacientes pediátricos fue consistente con la informada para pacientes adultos (ver Tablas 1 y 2, y Figuras 1 y 2 que están más arriba).
– Género: No hay diferencias significativas en la farmacocinética de oxibutinina en voluntarios sanos de sexo masculino y femenino luego de la administración de RETEVEN CR®.
– Raza: Los datos disponibles sugieren que no hay diferencias significativas en la farmacocinética de la oxibutinina según la raza, en voluntarios sanos, luego de la administración de RETEVEN CR®.
– Insuficiencia renal: No hay experiencia con el uso de RETEVEN CR® en pacientes con insuficiencia renal.
– Insuficiencia hepática: No hay experiencia con el uso de RETEVEN CR® en pacientes con insuficiencia hepática.
– Interacciones medicamentosas: Ver Precauciones: Interacciones medicamentosas.
CONSERVACIÓN: Almacenar a temperatura no mayor de 30 °C.
Para mayor información científica sobre el producto, comunicarse con Tecnofarma S.A.,
al telefax 700-3000 o
vía e-mail: info@tecnofarma.com.pe
TECNOFARMA S.A