
ROSINA 20
DROSPIRENONA, ETINILESTRADIOL
Comprimidos recubiertos
Caja, 1 Blíster de aluminio, 21 Comprimidos recubiertos, 3/0,02 mg/mg
Caja, 3 Blíster de aluminio, 21 Comprimidos recubiertos, 3/0,02 mg/mg
Caja, 6 Blíster de aluminio, 21 Comprimidos recubiertos, 3/0,02 mg/mg
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA:
Cada COMPRIMIDO RECUBIERTO contiene 3 mg de Drospirenona y 0,02 mg de Etinilestradiol. Excipientes con efecto conocido: Cada COMPRIMIDO RECUBIERTO contiene 48,53 mg de lactosa monohidrato y 0,070 mg de lecitina de soya.
Para consultar la lista completa de excipientes, ver la sección Excipientes.
FORMA FARMACÉUTICA:
Comprimido recubierto
Comprimidos recubiertos blancos o casi blancos, biconvexos, redondos, con un diámetro de aproximadamente 6 mm. Grabado por una cara: "G73", la otra cara no tiene grabado.
INDICACIONES TERAPÉUTICAS:
Anticoncepción oral.
En la decisión de prescribir Rosina 20 se deben tener en cuenta los factores de riesgo actuales de cada mujer, en particular los de tromboembolismo venoso (TEV), y el riesgo de TEV con ROSINA 20 en comparación con otros anticonceptivos hormonales combinados (AHC) (ver secciones Contraindicaciones y Advertencias).
DATOS FARMACÉUTICOS:
Lista de excipientes
Núcleo del comprimido:
Lactosa monohidrato
Almidón de maíz
Almidón de maíz, pregelatinizado
Copolímero injerto de alcohol polivinílico y macrogol
Estearato de magnesio
Recubrimiento con película:
Poli(vinil alcohol)
Dióxido de titanio
(E171) Talco
Macrogol 3350
Lecitina (soya)
Incompatibilidades
No aplica.
Vida útil
3 años
Precauciones especiales de almacenamiento
Almacenar por debajo de los 30°C. Almacenar en el empaque original con el fin de proteger el producto de la luz y de la humedad.
PROPIEDADES FARMACOLOGICAS:
Propiedades farmacodina´micas
Grupo farmacoterape´utico: hormonas sexuales y moduladoras del sistema genital; progestágenos y estrógenos, combinaciones fijas, código ATC: G03AA12
Índice de Pearl: por falla del método: 0,11 (límite superior de confianza bilateral del 95%: 0,60). índice de Pearl general (falla del método + error de la paciente): 0,31 (límite superior de confianza bilateral del 95%: 0,91)
Mecanismo de acción
El efecto anticonceptivo de Rosina 20 se basa en la interacción de varios factores, los más importantes de los cuales son la inhibición de la ovulación y los cambios en el endometrio.
Rosina 20 es un anticonceptivo oral combinado que contiene Etinilestradiol y el progestágeno Drospirenona. En una dosis terapéutica, la Drospirenona también posee propiedades anti androgénicas y mineral corticoides leves. No tiene actividad estroge´nica, glucocorticoide ni antiglucocorticoide. Esto le da a la Drospirenona un perfil farmacológico muy parecido a la hormona natural progesterona.
Hay indicaciones de los estudios clínicos que las propiedades antimineralocorticoides leves tienen como resultado un efecto antimineralocorticoides leve.
Propiedades farmacocinéticas
Drospirenona
Absorción
Drospirenona administrada oralmente se absorbe rápida y casi completamente. Las concentraciones máximas del principio activo en suero de cerca de 38 ng/ml se alcanzan cerca de 1 a 2 horas luego de una ingestión única. La biodisponibilidad de Drospirenona está entre 76 y 85%. La ingestión
concomitante de comida no tiene influencia alguna sobre la biodisponibilidad de Drospirenona.
Distribución
Despues de la administraci6n oral, los niveles séricos de Drospirenona disminuyen con una vida media terminal de 31 h. La drospirenona se une a la albumina sérica y no se une a la globulina fijadora de hormonas sexuales (SHBG) o la globulina fijadora de corticoides (CBG). Únicamente el 3-5% de las concentraciones séricas totales del principio activo están presentes como esteroides libres. El incremento de SHBG inducido por Etinilestradiol no influencia la unión a proteínas del suero de drospirenona. El promedio del volumen aparente de distribución de Drospirenona es 3,7 ± 1,2 l/kg.
Biotransformación
La drospirenona se metaboliza extensivamente luego de la administración oral. Los principales metabolitos en plasma son la forma ácida de Drospirenona, que se genera por la apertura del anillo de lactona y el 4,5-dihidro-Drospirenona-3-sulfato, formado por reducción y subsiguiente sulfatación. La drospirenona está también sujeta al metabolismo oxidativo catalizado por el CYP3A4. In vitro, la drospirenona es capaz de inhibir de forma débil a moderada las enzimas del citocromo P450 CYP1A1, CYP2C9, CYP2C19 y CYP3A4.
Eliminación
La tasa de depuración metabólica de Drospirenona en suero es 1,5 ± 0,2 ml/min/kg. Únicamente se excreta en cantidades traza en forma inalterada. Los metabolitos de Drospirenona se excretan con las heces y la orina a una tasa de excreción de cerca de 1,2 a 1,4. La semivida de la excreción de metabolitos con la orina y las heces es aproximadamente de 40 horas.
Condiciones en estado estacionario
Durante un ciclo de tratamiento, las concentraciones máximas en estado estacionario de Drospirenona en suero de cerca de 70 ng/ml se alcanzan luego de 8 días de tratamiento aproximadamente. Los niveles de Drospirenona en suero se acumulan por un factor de aproximadamente 3 como consecuencia de la relación de semivida terminal e intervalo de dosificación.
Poblaciones especiales
Efecto de la disfunción renal
Los niveles en estado estacionario de Drospirenona en suero en mujeres con disfunción renal leve o (depuración de la creatinina CLcr, 50-80 ml/min) fueron comparables a los de mujeres con función renal normal. Los niveles de Drospirenona en suero fueron en promedio 37% más altos en mujeres con disfunción renal moderada (CLcr 30-50 ml/min) en comparación con los de mujeres con función renal normal. El tratamiento con Drospirenona también fue bien tolerado por mujeres con disfunción renal de leve y moderada. El tratamiento con Drospirenona no mostró ningún efecto clínicamente significativo sobre la concentraci6n de potasio en suero.
Efecto de la insuficiencia hepática
En un estudio de dosis única, la depuraci6n oral (CL/F) decreció aproximadamente 50% en voluntarios con disfunción hepática moderada al compararse con aquellos con función hepática normal. El declive que se observa en la depuración de Drospirenona en voluntarias con disfunción hepática moderada no se tradujo en ninguna diferencia aparente en términos de concentraciones de potasio en suero. Incluso en la presencia de diabetes y tratamiento concomitante con espironolactona (dos factores que pueden predisponer a un paciente a hiperpotasemia), no se observó incremento en las concentraciones de potasio en suero por encima del límite superior del intervalo normal. Puede concluirse que Drospirenona es bien tolerada en pacientes con disfunci6n hepática leve a moderada (Child-Pugh B).
Grupos étnicos
No se han observado diferencias clínicamente relevantes en la farmacocinética de Drospirenona o Etinilestradiol entre mujeres japonesas o caucásicas.
Etinilestradiol
Absorción
Etinilestradiol en administración oral se absorbe rápida y completamente. Las concentraciones séricas máximas de aproximadamente 33 pg / ml se alcanzan en 1-2 horas despues de la administración oral única. La biodisponibilidad absoluta como resultado de la conjugación presiste´mica y el metabolismo de primer paso es aproximadamente del 60%. La ingesta concomitante de alimentos reduce la biodisponibilidad de Etinilestradiol en aproximadamente el 25% de los sujetos investigados, mientras que no se observó ningún cambio en los demás.
Distribución:
Los niveles séricos de etinilestradiol disminuyen en dos fases, la fase de eliminación terminal se caracteriza por una vida media de aproximadamente 24 horas. Etinilestradiol se une altamente pero no específicamente a la albumina sérica (aproximadamente 98,5%), e induce un aumento de las concentraciones séricas de SHBG y de la globulina fijadora de corticoides (CBG). Se determinó un volumen de distribución aparente de alrededor de 5 l/kg.
Biotransformación
Etinilestradiol está sujeto a la conjugación presiste´mica tanto en la mucosa del intestino delgado y el hígado. Etinilestradiol se metaboliza principalmente por hidroxilacio´n aromática, aunque se forman una gran variedad de metabolitos hidroxilados y metilados y se encuentran como metabolitos libres, y como conjugados de glucurónido y sulfato. La tasa de depuración metabólica de Etinilestradiol es de aproximadamente 5 ml/min/kg.
Eliminación
Etinilestradiol no se excreta en forma inalterada en ningún grado significativo. Los metabolitos de Etinilestradiol se excretan en una razón urinaria a biliar de 4:6. La vida media de excreción del metabolito es cerca de 1 día.
Condiciones en estado estacionario
Las condiciones en estado estacionario se alcanzan durante la segunda mitad de un ciclo de tratamiento y los niveles séricos de Etinilestradiol se acumulan en un factor de aproximadamente 2,0 a 2,3.
Datos preclínicos de seguridad
En animales de laboratorio, los efectos de Drospirenona y Etinilestradiol fueron específicos para los asociados con la acción farmacológica reconocida. En particular, los estudios de toxicidad sobre la reproducción revelaron efectos embriotóxicos y citotóxicos en animales considerados como especies específicas. A exposiciones superiores a las de las usuarias de Drospirenona y Etinilestradiol, se observaron efectos sobre la diferenciación sexual en fetos de rata, pero no en monos.
CONTRAINDICACIONES:
Los anticonceptivos hormonales combinados (AHCs) no se deben tomar si se presenta alguno de los problemas enumerados a continuación. En caso de que se presente alguno de estos problemas por primera vez durante el uso de AHC, el producto debe suspenderse de inmediato.
- Hipersensibilidad a los principios activos o a alguno de los excipientes incluidos en la sección 6.1.
- Hipersensibilidad al maní o a la soya.
- Presencia o riesgo de tromboembolismo venoso (TEV)
- Tromboembolismo venoso: TEV actual (con anticoagulantes) o a (por ejemplo, trombosis venosa profunda [TVP] o embolia pulmonar [EP]).
- Predisposición hereditaria conocida o adquirida de tromboembolismo venoso, como resistencia a la APC, (incluyendo el factor V Leiden), deficiencia de antitrombina III, deficiencia de proteína C y deficiencia de proteína S
- Cirugía mayor con inmovilización prolongada (ver sección Advertencias)
- Un alto riesgo de tromboembolismo venoso debido a la presencia de múltiples factores de riesgo (ver sección Advertencias)
- Presencia o riesgo de tromboembolismo arterial (TEA)
- Tromboembolismo arterial: tromboembolismo arterial actual, antecedentes de tromboembolismo arterial (por ejemplo, infarto de miocardio) o enfermedad prodrómica (por ejemplo, angina de pecho).
- Enfermedad cerebrovascular: accidente cerebrovascular actual, antecedentes de accidente cerebrovascular o enfermedad prodrómica (por ejemplo, ataque isquémico transitorio, AIT)
- Predisposición hereditaria conocida o adquirida a tromboembolismo arterial, como la hiperhomocisteinemia y anticuerpos antifosfolípidos (anticuerpos anticardiolipina, anticoagulante del lupus).
- Antecedentes de migraña con síntomas neurológicos focales.
- Un alto riesgo de tromboembolismo arterial debido a múltiples factores de riesgo (ver sección Advertencias) o a la presencia de un factor de riesgo grave como:
- diabetes mellitus con síntomas vasculares
- hipertensión severa
- dislipoproteinemia severa
- Presencia o antecedentes de enfermedad hepática grave, siempre y cuando los valores de función hepática no hayan regresado a la normalidad
- Insuficiencia renal grave o falla renal aguda.
- Presencia o antecedentes de tumores hepáticos (benignos o malignos).
- Tumores malignos conocidos o sospechados debido a esteroides sexuales (por ejemplo, de los órganos genitales o de las mamas);
- Sangrado vaginal no diagnosticado.
FERTILIDAD, EMBARAZO Y LACTANCIA:
Embarazo
Rosina 20 no está indicado durante el embarazo.
Si el embarazo se produce durante el uso de Rosina 20, se debe interrumpir la ingesta de la preparación inmediatamente. Estudios epidemiológicos extensos no han revelado un incremento del riesgo de defectos de nacimiento en niños que nacen de mujeres que utilizaron AOC antes del embarazo, ni efecto teratógeno cuando se tomaron AOC inadvertidamente durante el embarazo.
Los estudios en animales han mostrado efectos indeseados durante el embarazo y la lactancia (ver sección Datos preclínicos de seguridad). Con base en los datos en animales, no pueden excluirse los efectos indeseados debidos a la acción hormonal de los principios activos. Sin embargo, la experiencia general con AOC durante el embarazo no suministro evidencia de un efecto indeseado real en humanos.
Los datos disponibles con relación al uso de Drospirenona/Etinilestradiol durante el embarazo son muy limitados para permitir generar conclusiones con respecto a los efectos negativos de Drospirenona/Etinilestradiol sobre el embarazo, la salud del feto o el neonato. A la fecha, no se dispone de datos epidemiológicos relevantes.
El aumento del riesgo de TEV durante el puerperio debe ser considerado cuando se vuelva a iniciar la ingesta de ROSINA 20 (ver sección Posología y Advertencias).
Lactancia
Los AOC pueden influir en la lactancia ya que pueden reducir la cantidad de leche materna y cambiar la composición. Por lo tanto, el uso de AOC generalmente no se debe recomendar hasta que la madre lactante haya destetado completamente a su hijo. Pequeñas cantidades de los esteroides anticonceptivos y/o sus metabolitos pueden ser excretados en la leche materna durante el uso de los AOC. Estas cantidades pueden afectar al infante.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y USAR MAQUINARIA:
No se realizaron estudios de los efectos sobre la capacidad para conducir y usar maquinaria. No se observaron efectos sobre la capacidad para conducir y utilizar maquinas en las usuarias de AOC.
EFECTOS NO DESEADOS:
Para efectos no deseados graves en usuarias de AOC ver sección Advertencias.
Se han reportado las siguientes reacciones adversas durante la utilización de 3mg de Drospirenona y 0,02 mg de Etinilestradiol:
La siguiente tabla muestra reacciones adversas según la clasificación por clases de órganos y sistemas de MedDRA (SOC MedDRA). Las frecuencias se basan en datos de ensayos cli´nicos.
|
Clasificación por órganos y sistemas |
Frecuencia de las reacciones adversas |
||
|
MedDRA versión 17.1 |
Frecuente ≥l/l00 a <l/l0 |
Poco frecuente ≥l/l000 a <l/l00 |
Raro ≥l/l0.000 a <l/l000 |
|
Infecciones e infestaciones |
Candidiasis Herpes simple |
||
|
Trastornos del sistema inmunológico |
Reacción alérgica |
Asma |
|
|
Trastornos del metabolismo y la nutrición |
Aumento del apetito |
||
|
Trastornos psiquiátricos |
Labilidad emocional |
Depresión Nerviosismo Trastorno del sueño |
|
|
Trastornos del sistema nervioso |
Cefalea |
Parestesia Vértigo |
|
|
Trastornos del oído y del laberinto |
Hipoacusia |
||
|
Trastornos oculares |
Alteraciones visuales |
||
|
Trastornos cardiacos |
Extrasístoles Taquicardia |
||
|
Trastornos vasculares |
Embolia pulmonar Hipertensión Hipotensión Migraña Venas varico-sas |
tromboembolismo venoso (TEV) tromboembolismo arterial (TEA) |
|
|
Trastornos respiratorios, toráxicos y del mediastino |
Faringitis |
||
|
Trastornos gastrointestinales |
Dolor abdominal |
Náusea Vómito Gastroenteritis Diarrea Estreñimiento Trastorno gastrointestinal |
|
|
Trastornos de la piel y del tejido subcutáneo |
Acné |
Angioedema Alopecia Eccema Prurito Erupción Piel seca Seborrea Trastornos de la piel |
Eritema nodoso Eritema multiforme |
|
Trastornos musculo esqueléticos y del tejido conectivo |
Dolor en el cuello Dolor en extremidad Calambres musculares |
||
|
Trastornos renales y urinarios |
Cistitis |
||
|
Trastornos del aparato reproductor y de las mamas |
Dolor en las mamas Agrandamiento de las mamas Sensibilidad de la mama Dismenorrea Metrorragia |
Neoplasia de mama Mamas fibroquísticas Galactorrea Quiste ovárico Sofocos Trastorno menstrual Amenorrea Menorragia Candidiasis vaginal Vaginitis Flujo genital Trastorno vulvovaginal Resequedad vaginal Dolor pélvico Frotis de Papanicolaou sospechosa Disminución de la libido |
|
|
Trastornos generales y afecciones en el lugar de administración |
Edema Astenia Dolor Sed excesiva Aumento de la sudoración |
||
|
Exploraciones complementarias |
Aumento de peso |
Disminución en el peso |
|
Descripción de reacciones seleccionadas adversas
En las mujeres que usan AHC, se ha observado un aumento del riesgo de trombosis arterial y venosa y eventos tromboembólicos, incluyendo infarto de miocardio, ictus, ataques isquémicos transitorios, trombosis venosa y embolia pulmonar, lo cual se aborda con más detalle en la sección Advertencias.
Los siguientes eventos adversos graves se han reportado en mujeres que utilizan AOC, los cuales se discuten en la sección Advertencias especiales y precauciones de uso:
- Trastornos venosos tromboembólicos;
- Trastornos arteriales tromboembólicos;
- Hipertensión;
- Tumores hepáticos;
- Ocurrencia o deterioro de condiciones para las cuales la asociación con el uso de los AOC no es concluyente: Enfermedad de Crohn, colitis ulcerosa, epilepsia, mioma uterino, porfiria, lupus eritematosos sistémicos, herpes gestacional, corea de Sydenham, síndrome urémico hemolítico e ictericia colestática;
- Cloasma,
- Las alteraciones de la función hepática agudas o crónicas pueden necesitar la descontinuación de la utilización de AOC hasta que los marcadores de la función hepática regresen a lo normal.
- En mujeres con angioedema hereditario, los estrógenos exógenos pueden inducir o exacerbar los síntomas de angioedema.
La frecuencia de diagnóstico de cáncer de mama tiene un incremento muy leve entre usuarias de AO. Debido a que el cáncer de mama es poco común en mujeres menores de 40 años, el número excedente es pequeño en relación con el riesgo global de cáncer de mama. La causalidad con el uso de AOC es desconocida. Para más información, consulte las secciones Contraindicaciones y Advertencias.
INTERACCIÓN CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN:
Nota: Se debe consultar la información sobre prescripción de medicamentos concomitantes para identificar posibles interacciones.
Efectos de otros Medicamentos sobre Rosina 20
Se pueden presentar interacciones con medicamentos que inducen enzimas microsomales que pueden dar lugar a un aumento de la depuración de hormonas sexuales y que puede llevar a tener sangrado intercurrente y/o fracaso de la anticoncepción.
Manejo
La inducción de enzimas se puede observar después de unos pocos días de tratamiento. Generalmente, la inducción enzimática máxima se observa luego de unas pocas semanas. Despues de la suspensión del tratamiento con el medicamento, la inducción enzimática se mantendrá por aproximadamente 4 semanas.
Tratamiento a corto plazo
Las mujeres en tratamiento con medicamentos que inducen enzimas deben utilizar temporalmente un método de barrera u otro método anticonceptivo además del AOC. El método de barrera debe emplearse durante todo el tiempo de tratamiento con el medicamento concomitante y durante 28 días despues de su interrupción. Si el tratamiento con el medicamento se extiende más allá del final de los comprimidos en el blíster de AOC, el siguiente blíster de AOC se debe iniciar justo despues del blíster anterior sin llevar a cabo el intervalo habitual sin toma de comprimidos.
Tratamiento a largo plazo
Para las mujeres en tratamiento a largo plazo con principios activos inductores de enzimas hepáticas, se recomienda usar otro método de anticoncepción no hormonal confiable.
Las siguientes interacciones han sido reportadas en la literatura médica.
Sustancias que incrementan la depuración de los AOC (disminución de la eficacia de los AOC mediante inducción enzimática), por ejemplo.
Barbitúricos, bosentan, carbamazepina, fenitoína, primidona, rifampicina y medicamentos contra el VIH ritonavir, nevirapina y efavirenz, y posiblemente también felbamato, griseofulvina, oxcarbazepina, topiramato y productos que contienen la hierba de San Juan (Hypericum perforatum).
Sustancias con efectos variables sobre la depuración de los AOCs.
Al administrar de manera concomitante con AOC, muchas combinaciones de inhibidores de proteasas del VIH e inhibidores no nucleósidos de la transcriptasa inversa, incluidas combinaciones con inhibidores del VHC, se puede incrementar o disminuir la concentración plasmática de estrógenos o progestágenos. El efecto neto de estos cambios puede ser clínicamente relevante en algunos casos.
Por lo tanto se debe consultar la información para prescripción de los medicamentos concomitantes de VIH/VHC con el fin de identificar las posibles interacciones y cualquiera de las recomendaciones relacionadas. En caso de tener cualquier duda, la mujer en tratamiento con un inhibidor de proteasas o un inhibidor no nucleósido de la transcriptasa inversa debe utilizar un método anticonceptivo de barrera adicional.
Sustancias que disminuyen la depuración de los AOC (inhibidor enzimático)
La relevancia clínica de las interacciones potenciales con inhibidores enzimáticos es aún desconocida.
La administración concomitante de inhibidores potentes del CYP3A4 puede aumentar las concentraciones plasmáticas del estrógeno, del progestágeno o de ambos.
En un estudio a dosis múltiples con una combinación de drospirenona (3 mg/día)/etinilestradiol (0,02 mg/día), la administración conjunta con ketoconazol (inhibidor potente del CYPA4) durante 10 días, aumentó el AUC (0-24h) de la drospirenona y el etinilestradiol, 2,7 y 1,4 veces respectivamente.
Se ha demostrado que dosis de etoricoxib de 60 a 120 mg/día aumentan las concentraciones plasmáticas de etinilestradiol de 1,4 a 1,6 veces respectivamente, cuando se toman conjuntamente con un anticonceptivo hormonal combinado con 0,035 de etinilestradiol.
Efectos de Rosina 20 sobre otros medicamentos:
Los anticonceptivos orales pueden afectar el metabolismo de otros principios activos. En consecuencia, las concentraciones plasmáticas y tisulares pueden aumentar (por ejemplo, ciclosporina) o disminuir (por ejemplo lamotrigina).
Según estudios de inhibición in vitro y estudios de interacción in vivo realizados con mujeres voluntarias usando omeprazol, simvastatina y midazolam como sustrato marcador, se estableció que es poco probable que se produzca una interacción clínicamente relevante de Drospirenona (3 mg) con el metabolismo mediado por el citocromo P450 de otros principios activos.
Otras formas de interacción
En las pacientes sin insuficiencia renal, el uso concomitante de Drospirenona con inhibidores de la ECA o AINE no mostro un efecto significativo sobre el potasio sérico. Sin embargo, no se ha estudiado el uso concomitante de Rosina 20 o Etinilestradiol con antagonistas de la aldosterona o diuréticos ahorradores de potasio. En este caso, se debe examinar el potasio sérico durante el primer ciclo de tratamiento. Ver también la sección Advertencias.
Pruebas de laboratorio
El uso de esteroides anticonceptivos puede afectar los resultados de ciertas pruebas de laboratorio, como los parámetros bioquímicos del hígado, la tiroides, la función suprarrenal y renal, los niveles plasmáticos de proteínas (transportadoras), como por ejemplo, la globulina de unión a corticosteroides y fracciones de lípidos y lipoproteínas, parámetros del metabolismo de carbohidratos y los parámetros de coagulación y fibrinólisis. Los cambios generalmente se mantienen dentro de los límites normales.
La Drospirenona causa un incremento en la actividad de la renina plasmática y de la aldosterona plasmática inducida por su leve actividad antimineralocorticoides.
INTERACCIONES
El sangrado intercurrente y/o el fracaso de la anticoncepción pueden ser el resultados de las interacciones de otros medicamentos (inductores enzimáticos) con anticonceptivos orales (ver Sección Interacciones).
Notificación de sospechas de reacciones adversas
Es importante informar sospechas de reacciones adversas después de la aprobación del medicamento. Esto permite continuar la monitorización del balance beneficio/riesgo del medicamento.
ADVERTENCIAS ESPECIALES Y PRECAUCIONES DE USO:
Advertencias
Si se presenta alguno de los problemas o factores de riesgo que se mencionan a continuación, se debe discutir la idoneidad de Rosina 20 con la mujer.
En caso de agravamiento o de presentar por primera vez cualquiera de estas enfermedades o factores de riesgo, la mujer debe ponerse en contacto con su médico para determinar si debe suspender el uso de Rosina 20.
En caso de sospecha o presencia de TEV o TEA, se debe suspender el uso de AHC. Si se inicia una terapia anticoagulante, se deberá empezar un método de anticoncepción alternativo adecuado debido a la teratogenicidad del tratamiento con anticoagulantes (cumarinas).
Desordenes circulatorios
Riesgo de tromboembolismo venoso (TEV)
El uso de cualquier anticonceptivo hormonal combinado (AHC) aumenta el riesgo de padecer tromboembolismo venoso (TEV) en comparación con el no uso. Los productos que contienen levonorgestrel, norgestimato o noretisterona se asocian con un menor riesgo de TEV. Otros productos, como Rosina 20, pueden tener hasta el doble de este nivel de riesgo. La decisión de utilizar un producto diferente a los que tienen menor riesgo de TEV debe tomarse solo después de hablar con la mujer para asegurar que entienda el riesgo de TEV que hay con Rosina 20, como sus factores de riesgo actuales influyen en este riesgo y que el riesgo de TEV es mayor en el primer año de uso. También hay evidencia de que el riesgo se incrementa cuando se reinicia un AHC despues de una interrupción de 4 semanas o más.
Para las mujeres que no usan un AHC y que no están embarazadas, aproximadamente 2 de cada
10.000 desarrollaran un TEV en un periodo de un año. Sin embargo, en cualquier mujer en particular el riesgo puede ser mucho más alto, dependiendo de sus factores de riesgo subyacentes (ver más abajo).
Se estima1 que de cada 10.000 mujeres que utilizan un AHC que contiene Drospirenona, entre9 y 12 mujeres desarrollaran un TEV en un año; esto se compara con alrededor de 62 en mujeres que usan un AHC que contiene levonorgestrel.
En ambos casos, el número de TEV por año es menor que el número esperado durante el embarazo o en el puerperio.
El TEV puede ser fatal en el 1 - 2% de los casos.
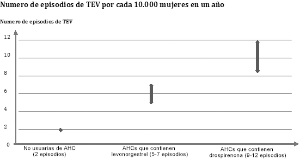
1 Estos incidentes se estimaron a partir de la totalidad de los datos del estudio epidemiológico, usando riesgos relativos de los diferentes productos en comparación con los AHC que contienen levonorgestrel.
2 Punto medio del rango de 5-7 por cada 10.000 MA, con base en un riesgo relativo para los AHC que contienen levonorgestrel en comparación con el no uso de aproximadamente 2,3 a 3,6.
La ocurrencia de trombosis en usuarias de AHC se ha reportado con una frecuencia extremadamente baja en otros vasos sanguíneos, a saber, venas y arterias hepáticas, mesentéricas, renales y retinianas.
Factores de riesgo para TEV
El riesgo de complicaciones trombo embolicas venosas en usuarias de AHC puede aumentar sustancialmente en mujeres con factores de riesgo adicionales, en especial si hay varios factores de riesgo (ver tabla).
Rosina 20 está contraindicado si una mujer tiene múltiples factores de riesgo que la ponen en alto riesgo de trombosis venosa (ver sección Contraindicaciones). Si una mujer tiene más de un factor de riesgo, es posible que el aumento de riesgo sea mayor que la suma de los factores individuales (en este caso se debe considerar su riesgo total de TEV). Si la relación beneficio/riesgo se considera negativa, no se debe prescribir un AHC (ver sección Contraindicaciones).
|
Tabla: Factores de riesgo de TEV |
|
|
Factor de riesgo |
Comentario |
|
Obesidad (indice de masa corporal por encima de los 30 kg/m2) |
El riesgo aumenta sustancialmente a medida que aumenta el IMC. Particularmente importante considerar si ademas hay otros factores de riesgo. |
|
Inmovilización prolongada, cirugías mayores, cualquier cirugía en las piernas en la pelvis, neurocirugías o traumas mayores. Nota: la inmovilización temporal, incluyendo los viajes en avión de > 4 horas, también puede ser un factor de riesgo para el TEV, sobre todo en mujeres con otros factores de riesgo |
En estas situaciones se aconseja interrumpir el uso del comprimido (en el caso de intervención quirúrgica programada al menos con cuatro semanas de anticipación) y no reanudar hasta dos semanas luego de que se recupere completamente la movilidad. Se debe usar otro método anticonceptivo para evitar un embarazo no deseado. Debe considerarse el tratamiento antitrombótico si no se ha suspendido el uso de Rosina 20 con antelación. |
|
Antecedente familiar positivo (tromboembolismo venoso en un hermano o padre, especialmente a una edad relativamente temprana, por ejemplo antes de los 50). |
Si se sospecha predisposición hereditaria, la mujer debe ser referida a un especialista para asesorarse antes de decidir acerca del uso de cualquier AHC. |
|
Otras condiciones médicas asociadas con TEV |
Cáncer, lupus eritematoso sistémico, síndrome urémico hemolítico, enfermedad inflamatoria intestinal crónica (enfermedad de Crohn o colitis ulcerosa) y la enfermedad de celulas falciformes |
|
Aumento con la edad |
Especialmente mayores de 35 años |
No existe consenso acerca del posible papel de las venas varicosas y de la tromboflebitis superficial en la aparición o progresión de la trombosis venosa.
Debe tenerse en cuenta el aumento del riesgo de tromboembolismo en el embarazo, y en particular en el periodo de 6 semanas del puerperio (para informaci6n sobre "Fertilidad, embarazo y lactancia"
Sintomas de TEV (trombosis venosa profunda y embolia pulmonar)
En caso de presentar síntomas, las mujeres deben buscar atención médica urgente e informar al profesional de la salud que está tomando un AHC.
Los síntomas de la trombosis venosa profunda (TVP) pueden incluir:
- Inflamación unilateral de la pierna o del pie o a lo largo de una vena de la pierna;
- Dolor o sensibilidad en la pierna, que se puede sentir solo al estar de pie o al caminar,
- Aumento de calor en la pierna afectada; enrojecimiento o decoloración de la piel de la pierna.
Los síntomas de embolia pulmonar (EP) pueden incluir:
- Aparición repentina de falta de aliento o respiración rápida injustificable;
- Tos repentina que puede estar asociada con hemoptisis;
- Dolor Torácico agudo;
- Aturdimiento o mareo grave
- Latidos cardiacos acelerados o irregulares.
Algunos de estos síntomas (por ejemplo, "falta de aire", "tos") no son específicos y podrían interpretarse erróneamente como eventos comunes o menos graves (por ejemplo, infecciones de las vías respiratorias).
Otros signos de oclusión vascular pueden incluir: dolor súbito, hinchazón y ligera decoloración azul de una extremidad.
Si la oclusión ocurre en un ojo, los síntomas pueden ir desde difuminación indolora de la visión que puede progresar a la perdida de la visión. A veces, la pérdida de la visión puede ocurrir casi inmediatamente.
Riesgo de tromboembolismo arterial (TEA)
Los estudios epidemiológicos han asociado el uso de los AHC con un incremento del riesgo de tromboembolismo arterial (infarto del miocardio) o de accidente cerebrovascular (por ejemplo, ataque isquémico transitorio o accidente cerebrovascular). Los eventos de tromboembolismo arterial pueden ser fatales.
Factores de riesgo de TEA
El riesgo de complicaciones tromboemb6licas arteriales o de un accidente cerebrovascular en las usuarias que toman AHC aumenta en mujeres con factores de riesgo (ver tabla). Rosina 20 está contraindicado si una mujer tiene múltiples factores de riesgo o alguno serio de TEA que la ponen en alto riesgo de trombosis arterial (ver sección Contraindicaciones). Si una mujer tiene más de un factor de riesgo, es posible que el aumento de riesgo sea mayor que la suma de los factores individuales (en este caso se debe considerar su riesgo total). Si la relación beneficios/riesgos se considera negativa, no se debe prescribir un AHC (ver sección Contraindicaciones).
|
Tabla: Factores de riesgo de TEA |
|
|
Factor de riesgo |
Comentario |
|
Aumento en la edad |
Especialemnte mayores de 35 años |
|
Tabaquismo |
Se debe advertir a las mujeres que no fumen si desean usar un AHC. A las mujeres mayores de 35 afios que sigan fumando se les debe recomendar enfáticamente utilizar un método anticonceptivo diferente. |
|
Hipertensión |
|
|
Obesidad (indice de masa corporal por encima de los 30 kg/m2) |
El riesgo aumenta sustancialmente a medida que aumenta el IMC. Particularmente importante en las mujeres con factores de riesgo adicionales. |
|
Antecedentes familiares positivos tromboembolismo arterial en un hermano o padre, especialmente a una edad relativamente temprana, por ejemplo antes de los 50 años). |
Si se sospecha predisposici6n hereditaria, la mujer debe ser referida a un especialista para asesorarse antes de decidir acerca del uso de cualquier AHC. |
|
Migraña |
Un incremento de la frecuencia o severidad de la migraña durante el uso de AHC (que pueden ser prodrómico de un evento cerebrovascular) debe llevar a la interrupción inmediata. |
|
Otras condiciones médicas asociadas con eventos vasculares adversos |
Diabetes mellitus, hiperhomocisteinemia, enfermedad cardiaca valvular y fibrilación atrial, dislipoproteinemia y lupus eritematoso sistemico. |
Síntomas de TEA
En el caso de que se produzcan síntomas, se debe buscar atención médica urgente e informar al profesional de la salud que está tomando un AHC.
Los síntomas de accidente cerebrovascular pueden incluir:
- Debilidad o entumecimiento repentino del rostro, brazo o pierna, especialmente en un lado del cuerpo;
- Dificultad repentina para caminar, mareo o pérdida del equilibrio o de la coordinación.
- Confusión repentina, problemas para hablar o entender.
- Problemas repentinos de visión en uno o los dos ojos.
- Cefalea repentina intensa o prolongada sin causa conocida
- Pérdida de la conciencia o desmayo con o sin convulsiones.
Los síntomas temporales sugieren que el evento es un ataque isquémico transitorio (AIT).
Los síntomas de infarto de miocardio (IM) pueden incluir:
- Dolor, malestar, presión, pesadez, sensación de opresión o plenitud en el pecho, brazo o debajo del esternón;
- Malestar que irradia hacia la espalda, la mandíbula, garganta, brazo y estómago;
- Sensación de plenitud, tener indigestión o asfixia;
- Sudoración, náuseas, vómitos o mareo
- Debilidad extrema, ansiedad o dificultad para respirar;
- Latidos cardiacos acelerados o irregulares.
Tumores
En algunos estudios epidemiológicos se ha reportado un incremento en el riesgo de desarrollar cáncer cervical en usuarias de AOC de largo plazo (> 5 años), pero sigue existiendo controversia acerca del grado en que este hallazgo es atribuible a los efectos de confusión del comportamiento sexual y a otros factores tales como el virus del papiloma humano (VPH).
Un meta análisis de 54 estudios epidemiológicos notificó que existe un incremento en el riesgo relativo (RR = 1,24) de tener un diagnóstico de cáncer de mama en mujeres que utilizan actualmente AOC. El exceso de riesgo desaparece gradualmente en el transcurso de 10 años después del cese del uso de AOC. Debido a que el cáncer de mama es raro en mujeres antes de los 40 años, el número excedente de diagnósticos de cáncer de mama en usuarias actuales y recientes de AOC es pequeño en relación con el riesgo global de cáncer de mama. Estos estudios no suministran evidencia de causalidad. El patrón que se observa en el incremento del riesgo puede deberse a un diagnóstico más temprano de cáncer de mama en usuarias de AOC, a efectos biológicos de los AOC o a una combinación de ambos. Los cánceres de mama que se diagnostican en mujeres que alguna vez usaron AOC tienden a ser clínicamente menos avanzados que los cánceres que se diagnostican en mujeres que nunca los utilizaron.
Se han reportado en casos muy poco frecuentes, tumores benignos en el hígado, e incluso de manera aún menos frecuente, tumores malignos en el hígado en usuarias de AOC. En casos aislados, los tumores han llevado a hemorragias intraabdominales que ponen en peligro la vida. Debe considerarse un tumor hepático en el diagnóstico diferencial cuando ocurre dolor abdominal a nivel alto grave, agrandamiento del hígado o signos de hemorragia intraabdominal en mujeres que toman AOC.
Con el uso de AOC de dosis más altas (50 µg de Etinilestradiol), el riesgo de cáncer de endometrio y cáncer de ovario se reduce. No se ha confirmado si esto aplica también para AOC de dosis más bajas.
Otras afecciones
El componente progestágeno en este producto es un antagonista de la aldosterona con propiedades ahorradoras de potasio. En la mayoría de casos, no es de esperarse incremento alguno en los niveles de potasio. Sin embargo, en un estudio clínico en algunos pacientes con disfunción renal leve o moderada y uso concomitante de medicamentos ahorradores de potasio, los niveles de potasio en suero durante la ingesta de Drospirenona incrementaron ligera pero no significativamente. Por consiguiente, se recomienda verificar el potasio sérico durante el primer ciclo de tratamiento en pacientes que presentan insuficiencia renal y un potasio sérico previo al tratamiento en el intervalo de referencia superior y particularmente durante el uso concomitante de medicamentos ahorradores de potasio. Ver también la sección Interacciones.
Las mujeres con hipertrigliceridemia o con historia familiar de la misma, pueden estar en un mayor riesgo de pancreatitis al utilizar AOC.
Aunque se han reportado incrementos pequeños en la presión sanguínea en muchas mujeres que toman AOC, son raros los incrementos clínicamente relevantes. Únicamente en estos casos raros se justifica la descontinuación inmediata del uso de AOC. Si los valores de presión sanguínea constantemente elevados o el incremento significativo en la presión sanguínea no responden adecuadamente al tratamiento antihipertensivo durante la utilizaci6n de un AOC en hipertensión preexistente, debe retirarse el AOC. Donde se considere apropiado, la utilizaci6n de AOC puede reanudarse si los valores normales de la presión pueden alcanzarse con la terapia antihipertensiva.
Se ha reportado que las siguientes condiciones ocurren o se deterioran tanto con el embarazo como con la utilización de AOC, pero la evidencia de asociación con AOC es inconclusa: ictericia o prurito relacionado con colestasis; cálculos biliares; porfiria; lupus eritematoso sistémico; síndrome hemolítico urémico; Corea de Sydenham; herpes gestacional; pérdida auditiva por otosclerosis.
En mujeres con angioedema hereditario, los estrógenos exógenos pueden inducir o exacerbar los síntomas de angioedema.
Las alteraciones de la función hepática agudas o crónicas pueden necesitar la descontinuación de la utilización de AOC hasta que los marcadores de la función hepática regresen a lo normal. La recurrencia de la ictericia colestática y/o del prurito relacionado con colestasis el cual ocurrió durante el embarazo o durante la utilización previa de esteroides sexuales necesita la descontinuación de los AOC.
Aunque los AOC pueden tener efecto sobre la resistencia periférica a la insulina y la tolerancia a la glucosa, no existe evidencia de la necesidad de alterar el régimen terapéutico en diabéticos que utilizan dosis bajas de AOC (que contienen Etinilestradiol < 0,05 mg). Sin embargo, las mujeres diabéticas deben vigilarse cuidadosamente, particularmente en los estadios tempranos de utilización de AOC.
Se han reportado empeoramiento de la depresión endógena, de la enfermedad de Crohn y de colitis ulcerativa durante la utilización de AOC.
Puede ocurrir ocasionalmente cloasma, especialmente en mujeres con historia de cloasma gravídico. Las mujeres con tendencia a cloasma deben evitar la exposición al sol o a radiación ultravioleta mientras toman los AOC.
Este medicamento contiene 48,53 mg de lactosa monohidrato por comprimido. Los pacientes con problemas hereditarios poco frecuentes de intolerancia a la galactosa, deficiencia de lactasa de Lapp o malabsorción de glucosa-galactosa no deben tomar este medicamento.
Este medicamento contiene 0,070 mg de lecitina de soya por comprimido. Los pacientes con hipersensibilidad al maní o a la soya no deben tomar este medicamento.
Examen y consulta medica
Antes de empezar a tomar o de retomar Rosina 20 se debe hacer una historia clínica completa (incluyendo antecedentes familiares) y se debe descartar un embarazo. Se debe tomar la presión arterial y se debe hacer un examen físico, guiándose en las contraindicaciones (ver sección Contraindicaciones) y advertencias (ver sección Advertencias). Es importante que la mujer tenga bien clara la información sobre la trombosis venosa y arterial, incluyendo el riesgo de Rosina 20 en comparación con otros AHC, los síntomas de TEV y TEA, los factores de riesgo conocidos y que hacer en caso de una sospecha de trombosis.
La mujer también debe leer detenidamente el prospecto y seguir los consejos dados. La frecuencia y la naturaleza de los exámenes deben basarse en las guías de práctica establecidas y adaptarse a cada mujer.
Debe advertirse a las mujeres que los anticonceptivos hormonales no protegen contra infecciones de
VIH (SIDA) y otras enfermedades de transmisión sexual.
Reducción de la eficacia
La eficacia de los AOC puede disminuir en caso de, por ejemplo, olvidar tomar comprimidos (ver sección Posología), alteraciones gastrointestinales (ver sección Posología) o medicamentos concomitantes (ver sección Interacciones).
Reducción del control del ciclo
Puede ocurrir sangrado irregular (sangrado intercurrente o manchado) con todos los AOC, especialmente durante los primeros meses de uso. Por consiguiente, la evaluación de cualquier sangrado irregular es significativa únicamente luego del intervalo de adaptación de alrededor de tres ciclos.
Si persisten las irregularidades en el sangrado u ocurren luego de ciclos anteriores regulares, deben entonces considerarse causas no hormonales y se indican medidas diagnosticas adecuadas para excluir malignidad o embarazo. Estas pueden incluir un legrado.
En algunas mujeres puede no ocurrir sangrado por suspensión durante el intervalo libre de comprimidos. Si el AOC se ha tomado de acuerdo con las instrucciones descritas en la sección Posología, es poco probable que la mujer este en embarazo. Sin embargo, si los AOC no se han tomado de acuerdo con estas instrucciones antes del primer sangrado de supresión perdido, o si se pasan dos sangrados de supresión, se debe excluir un embarazo antes de que se continúen los AOC.
SOBREDOSIS:
No ha habido ninguna experiencia de sobredosis con Drospirenona y Etinilestradiol. Con base en la experiencia general con anticonceptivos orales combinados, los síntomas que posiblemente se pueden producir en este caso son: náusea, vómito y en niñas jóvenes ligero sangrado vaginal. No existe un antídoto y el tratamiento adicional debe ser sintomático.
PAUTA POSOLÓGICA Y MODO DE ADMINISTRACIÓN:
Método de administración: uso oral
Pauta posológica
Como tomar Rosina 20
Los comprimidos deben tomarse todos los días aproximadamente a la misma hora, con un poco de líquido, si es necesario, y en el orden indicado en el envase blíster. Se debe tomar un comprimido diario durante 21 días consecutivos. Cada envase posterior se comienza después de un intervalo libre de comprimidos de 7 días, periodo durante el cual se produce sangrado por suspensión. Este por lo general comienza al segundo o tercer día después del último comprimido y es posible que no haya terminado antes de empezar el siguiente envase.
Como empezar a tomar Rosina 20
• Si no tomo anticonceptivos hormonales con anterioridad (en el último mes)
Los comprimidos se deben empezar a tomar el primer día del ciclo natural de la mujer (es decir, el primer día de sangrado menstrual).
• Al cambiar de un anticonceptivo hormonal combinado (anticonceptivo oral combinado (AOC), anillo vaginal o parche transdérmico).
Preferiblemente, la mujer debe comenzar a tomar Rosina 20 el día despues de tomar el último comprimido activo (el último comprimido que contiene los principios activos) de su AOC anterior o, a más tardar, el día siguiente al intervalo habitual sin comprimidos o con comprimidos de placebo de su AOC anterior. En caso de haber usado un parche transdérmico o un anillo vaginal, la mujer debe comenzar a usar Rosina 20 preferiblemente el día de la extracción o, a más tardar, cuando se deba hacer la siguiente aplicación.
• Si se usó un método de solo progestágeno (píldora, inyección, implante solo con progestágeno) o un sistema intrauterino de liberación (SIU) de progestágeno.
La mujer puede cambiar cualquier día de la píldora de solo progestágeno (de un implante o un SIU el día de su retiro, de un método inyectable cuando se deba realizar la siguiente inyección) pero en todos estos casos se debe usar además un método de barrera durante los primero 7 días de estar tomando el comprimido.
• Tras un aborto en el primer trimestre
La mujer puede empezar inmediatamente. Al hacerlo, no necesitara tomar medidas anticonceptivas adicionales.
• Tras un parto o un aborto en el segundo trimestre
Se debe aconsejar a la mujer comenzar a tomar Rosina 20 entre el día 21 y 28 despues del parto o aborto. Si se inicia más tarde, se aconseja usar adicionalmente un método de barrera durante los primeros 7 días. Sin embargo, si ya se tuvo relaciones sexuales, se debe descartar un embarazo antes del inicio real del AOC o la mujer tiene que esperar su primer periodo menstrual.
Para información con respecto a mujeres en periodos de lactancia, ver la sección Fertilidad, embarazo y lactancias.
Como proceder si no se toman algunos comprimidos
Si la usuaria se atrasó menos de 12 horas en tomar el comprimido, la protección anticonceptiva no se reduce. La mujer debe tomar el comprimido tan pronto se acuerde y luego debe tomar los siguientes comprimidos en la hora habitual.
Si se atrasó más de 12 horas en tomar algún comprimido, la protección anticonceptiva puede reducirse. El manejo de los comprimidos olvidados puede guiarse por las siguientes dos reglas básicas:
1. La toma de los comprimidos nunca debe suspenderse por más de 7 días.
2. Se requieren 7 días de toma ininterrumpida de comprimidos para conseguir una supresión adecuada del eje hipotálamo-pituitario-ovárico.
De acuerdo a lo anterior, se pueden dar los siguientes consejos a nivel diario:
Semana 1
La usuaria debe tomar el comprimido olvidado tan pronto se acuerde, incluso si esto significa tomar dos comprimidos a la vez. Posteriormente, seguirá tomando los comprimidos a su hora habitual. Además, se debe usar un método de barrera como el condón durante los 7 días siguientes. Si tuvo relaciones sexuales en los 7 días anteriores, debe considerarse la posibilidad de un embarazo. Entre más comprimidos dejen de tomarse y entre más cerca estén de la fase libre de toma de comprimidos, mayor es el riesgo de embarazo.
Semana 2
La usuaria debe tomar el comprimido olvidado tan pronto se acuerde, incluso si esto significa tomar dos comprimidos a la vez. Posteriormente, seguirá tomando los comprimidos a su hora habitual. Si la mujer tomó correctamente los comprimidos durante los 7 días anteriores al primer comprimido olvidado, no hay necesidad de tener precauciones anticonceptivas adicionales. Sin embargo, si olvidó tomar más de 1 comprimido, debe tomar precauciones adicionales durante los siguientes 7 días.
Semana 3
El riesgo de una menor fiabilidad es inminente debido a la cercanía del intervalo de 7 días libre de toma de comprimidos. Sin embargo, si se ajusta el horario de toma de los comprimidos, se puede prevenir la reducción de la protección anticonceptiva. De esta manera, si se sigue alguna de las dos opciones siguientes, no hay necesidad de tener precauciones anticonceptivas adicionales, siempre y cuando la mujer haya tomado correctamente todos los comprimidos durante los 7 días anteriores al primer comprimido olvidado. Si este no es el caso, deberá seguir la primera opción y, además, tomar precauciones adicionales durante los próximos 7 días.
1. La usuaria debe tomar el comprimido olvidado tan pronto se acuerde, incluso si esto significa tomar dos comprimidos a la vez. Posteriormente, seguirá tomando los comprimidos a su hora habitual. El siguiente blíster se debe iniciar tan pronto como se termine el blíster actual, es decir no se deben dejar espacios entre los envases. Es poco probable que la usuaria presente sangrado por suspensión hasta el final del segundo envase, pero puede presentar manchado o sangrado intercurrente en los días de toma de comprimidos.
2. También se le puede aconsejar suspender la toma de comprimidos activos del blíster actual. Entonces, la mujer debe tener un intervalo sin tomar comprimidos de hasta 7 días, incluidos los días en que olvido tomar comprimidos y, posteriormente, continuar con el siguiente blíster.
Si la mujer olvido tomar comprimidos y posteriormente no presenta sangrado por suspensión en el primer intervalo normal sin comprimidos, se debe considerar la posibilidad de un embarazo.
En caso de trastornos gastrointestinales
Si se presentan trastornos gastrointestinales graves (por ejemplo vómito o diarrea), es posible que no haya una absorción completa y se deban tomar medidas anticonceptivas adicionales.
Si se produce vómito 3-4 horas despues de la toma de comprimidos, se debe tomar un nuevo (reemplazo) comprimido tan pronto como sea posible. Si es posible, este comprimido debe tomarse en las 12 horas siguientes a la hora habitual de la toma de comprimidos. Si transcurren más de 12 horas, deben seguirse las recomendaciones sobre comprimidos olvidados que se da en la sección "Como proceder si no se toman algunos comprimidos". Si la mujer no desea cambiar su esquema habitual de toma de comprimidos, debe tomar el o los comprimidos adicionales de otro blíster.
Como posponer un sangrado por suspensión
Para retrasar un periodo, la mujer debe continuar con otro envase de blíster de Rosina 20 sin tener el intervalo libre de comprimidos. La extensión se puede realizar durante el tiempo que se desee hasta que se termine el segundo envase. Durante la extensión, la mujer puede experimentar sangrado intercurrente o manchado. La toma regular de Rosina 20 se debe reanudar después del intervalo sin comprimidos habitual de 7 días.
Si se quieren cambiar los periodos a otro día de la semana al que la mujer está acostumbrada con su esquema actual, se le puede aconsejar acortar el siguiente intervalo sin comprimidos los días que desee. Cuanto más corto sea el intervalo, mayor será el riesgo de no presentar sangrado por suspensión y de experimentar sangrado intercurrente y manchado durante el paquete posterior (al igual que cuando se retrasa un periodo).
PRESENTACIÓN:
Los comprimidos recubiertos de ROSINA 20 3 mg/0,02 mg están empacados en blíster (es) de PVC/PVDC incoloro-Aluminio, cada blíster está empacado en sobre de aluminio trilaminado (PET/AL/PE) y en una caja plegada con un folleto para el paciente incluido en cada caja.
Tamañs de los empaques:
1 x 21 comprimidos recubiertos.
3 x 21 comprimidos recubiertos.
6 x 21 comprimidos recubiertos.
Puede que no se comercialicen todos los tamaños de envases.
Precauciones especiales para manejo de desechos y otros tipos de manejo
Cualquier producto medicinal no usado o material de desperdicio se debe descartar de acuerdo con los requerimientos locales.
Fabricante:
Gedeon Richter Plc
Budapest- Hungría
GEDEON RICHTER