
SOLIQUA
INSULINA GLARGINA, LIXISENATIDA
Solución inyectable
1 Caja, 1 Pluma prellenada, 3 mL,
1 Caja, 3 Pluma prellenada, 3 mL,
1 Caja, 5 Pluma prellenada, 3 mL,
1 Caja, 10 Pluma prellenada, 3 mL,
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA:
SOLIQUA®
Cada mililitro de SOLIQUA® 30-60 SoloStar contiene 100 unidades de insulina glargina y 33 μg de lixisenatida.
Excipientes: Para consultar la lista completa de excipientes, ver sección Lista de excipientes.
SOLIQUA®
Cada mililitro de SOLIQUA® 10-40 SoloStar contiene 100 unidades de insulina glargina y 50 μg de lixisenatida.
Excipientes: Para consultar la lista completa de excipientes, ver sección Lista de excipientes.
* La insulina glargina se obtiene por tecnología de ADN recombinante en Escherichia coli. La ventana de dosis de la pluma (aplicador) muestra el número de pasos de dosis.
Excipiente(s) con efecto conocido:
Cada mL contiene 2,7 miligramos de metacresol.
FORMA FARMACÉUTICA Y FORMULACIÓN:
SOLIQUA®
Insulina glargina 100 U/mL y lixisenatida 33 μg/mL
SoloStar
Solución inyectable, en pluma (aplicador) prellenada descartable 30-60
SOLIQUA®
Insulina glargina 100 U/mL y lixisenatida 50 μg/mL
SoloStar
Solución inyectable, en pluma (aplicador) prellenada descartable 10-40.
LISTA DE EXCIPIENTES:
Glicerol 85%.
Metionina.
Metacresol.
Cloruro de Zinc.
Ácido clorhídrico concentrado.
Hidróxido sódico.
Agua para inyectables.
INDICACIONES TERAPÉUTICAS:
SOLIQUA® está indicado, para el tratamiento en adultos con diabetes mellitus tipo 2 insuficientemente controlada, para mejorar el control glucémico, como coadjuvante a la dieta y el ejercicio junto con metformina con o sin inhibidores SGLT-2 (para los resultados del estudio con respecto al efecto sobre el control glucémico y las poblaciones estudiadas, ver secciones Advertencias y precauciones y Propiedades farmacodinámicas).
PROPIEDADES FARMACOCINÉTICAS:
Absorción: La proporción insulina glargina/lixisenatida no tiene una repercusión relevante sobre las propiedades farmacocinéticas de insulina glargina y lixisenatida en SOLIQUA®.
Tras la administración subcutánea de las combinaciones de insulina glargina/lixisenatida en pacientes con diabetes tipo 1, la insulina glargina no mostró un pico pronunciado. La exposición a la insulina glargina tras la administración de la combinación de insulina glargina/lixisenatida fue del 86- 88 % en comparación con la administración simultánea por separado de inyecciones de insulina glargina y lixisenatida. Esta diferencia no se considera clínicamente relevante.
Tras la administración subcutánea de las combinaciones de insulina glargina/lixisenatida en pacientes con diabetes tipo 1, la mediana del tmáx de lixisenatida se encontró en un intervalo de entre 2,5 y 3,0 horas. El AUC fue similar aunque se observó un pequeño descenso en la Cmáx de lixisenatida del 22-34 % en comparación con la administración simultánea por separado de inyecciones de insulina glargina y lixisenatida, que no llega a considerarse clínicamente significativo.
No existen diferencias clínicamente relevantes en la tasa de absorción cuando lixisenatida en monoterapia se administra por vía subcutánea en el abdomen, el deltoides o el muslo.
Distribución: Lixisenatida tiene un nivel bajo de unión a las proteínas humanas (55 %). El volumen aparente de distribución de lixisenatida después de la administración subcutánea de las combinaciones de insulina glargina/lixisenatida (Vz/F) es de aproximadamente 100 L. El volumen aparente de distribución de insulina glargina después de la administración subcutánea de las combinaciones de insulina glargina/lixisenatida (Veq/F) es de aproximadamente 1700 L.
Biotransformación y eliminación: Un estudio metabólico en pacientes con diabetes que recibían insulina glargina en monoterapia demuestra que la insulina glargina se metaboliza rápidamente en la terminación carboxilo de la cadena β para formar dos metabolitos activos, M1 (21A-Gly-insulina) y M2 (21A-Gly-des-30B-Thr- insulina).
El principal compuesto circulante en plasma es el metabolito M1. Los hallazgos farmacocinéticos y farmacodinámicos indican que el efecto de la inyección subcutánea de insulina glargina se basa principalmente en la exposición a M1.
Al ser un péptido, la lixisenatida se elimina por medio de la filtración glomerular, seguida de la reabsorción tubular y la posterior degradación metabólica, lo que produce péptidos y aminoácidos más pequeños que se reintroducen en el metabolismo de las proteínas. Tras la administración de varias dosis en pacientes con diabetes tipo 2, la semivida terminal media fue aproximadamente de 3 horas, y el aclaramiento medio aparente (Cl/F) de aproximadamente 35 l/h.
Poblaciones especiales:
Insuficiencia renal: En sujetos con insuficiencia renal leve (aclaramiento de creatinina de 60-90 mL/min, según la fórmula de Cockcroft-Gault), moderada (aclaramiento de creatinina de 30-60 mL/min) y grave (aclaramiento de creatinina de 15-30 mL/min) el AUC de lixisenatida aumentó en un 46%, 51% y 87%, respectivamente.
La insulina glargina no se ha estudiado en pacientes con insuficiencia renal. En pacientes con insuficiencia renal, las necesidades de insulina pueden reducirse a causa de la disminución del metabolismo de la insulina.
Insuficiencia hepática: Dado que la lixisenatida se elimina principalmente mediante el riñón, no se ha llevado a cabo ningún estudio farmacocinético en pacientes con disfunción hepática aguda o crónica. No cabe esperar que la disfunción hepática afecte a la farmacocinética de la lixisenatida.
La insulina glargina no se ha estudiado en pacientes con diabetes con insuficiencia hepática. En pacientes con insuficiencia hepática, las necesidades de insulina pueden reducirse a causa de la disminución del metabolismo de la insulina.
Edad, raza, sexo y peso corporal:
Insulina glargina: El efecto de la edad, la raza y el sexo en la farmacocinética de la insulina glargina no se ha estudiado. En los ensayos clínicos controlados en pacientes que reciben insulina glargina (100 unidades/mL), los análisis de los subgrupos por edad, raza y sexo no mostraron diferencias respecto a la seguridad y a la eficacia.
Lixisenatida: La edad no tiene ningún efecto clínico relevante en la farmacocinética de la lixisenatida. En un estudio farmacocinético realizado en sujetos no diabéticos de edad avanzada, la administración de lixisenatida 20 mcg provocó un aumento medio del AUC de lixisenatida del 29 % en la población de edad avanzada (11 sujetos con edades comprendidas entre los 65 y los 74 años y 7 sujetos ≥ 75 años) en comparación con 18 sujetos con edades comprendidas entre los 18 y los 45 años, que probablemente estuvo relacionado con una función renal reducida en el grupo de edad avanzada.
El origen étnico no tuvo ningún efecto clínicamente relevante en la farmacocinética de la lixisenatida basándose en los resultados de estudios farmacocinéticos realizados en sujetos caucásicos, japoneses y chinos.
El sexo no tiene un efecto clínico relevante en la farmacocinética de la lixisenatida.
El peso corporal no tiene ningún efecto clínico relevante en el AUC de la lixisenatida.
Inmunogenicidad: En presencia de anticuerpos anti-lixisenatida, la exposición a lixisenatida y la variabilidad en la exposición se ven incrementados de manera acusada con independencia del nivel de dosis.
Población pediátrica: No se han llevado a cabo estudios con SOLIQUA® en niños ni en adolescentes menores de 18 años.
PROPIEDADES FARMACODINÁMICAS:
Grupo farmacoterapéutico: Medicamentos antidiabéticos, insulinas y análogos de acción prolongada inyectables, código ATC: A10AE54.
Mecanismo de acción: SOLIQUA® combina dos principios activos que presentan mecanismos de acción complementarios para mejorar del control glucémico: insulina glargina, un análogo de la insulina basal (dirigido principalmente a la glucosa plasmática en ayunas) y lixisenatida, un agonista del receptor GLP-1 (dirigido principalmente a la glucosa posprandial).
Insulina glargina: La actividad principal de la insulina, incluida la insulina glargina, consiste en regular el metabolismo de la glucosa. La insulina y sus análogos disminuyen el nivel de glucosa en sangre mediante la estimulación de la captación de la glucosa periférica, especialmente por parte del tejido adiposo y del músculo esquelético, y la inhibición de la producción de la glucosa hepática. La insulina inhibe la lipólisis y la proteólisis, a la vez que aumenta la síntesis de proteínas.
Lixisenatida: Lixisenatida es un agonista selectivo del receptor GLP-1. El receptor de GLP-1 es la diana del GLP-1 nativo, una hormona endógena de tipo incretina que potencia la secreción de insulina dependiente de glucosa por las células beta pancreáticas y suprime la de glucagón desde las células alfa.
Lixisenatida estimula la secreción de insulina cuando la glucemia aumenta, pero no en normoglucemia, lo que limita el riesgo de que se produzcan episodios de hipoglucemia. De forma paralela, se suprime la secreción de glucagón. En caso de hipoglucemia, se conserva el mecanismo de rescate de la secreción de glucagón. La inyección postprandial de lixisenatida también retrasa el vaciado gástrico y, por ello, reduce la velocidad a la cual la glucosa procedente de las comidas se absorbe y llega a la circulación.
Efectos farmacodinámicos:
SOLIQUA®
La combinación de insulina glargina y lixisenatida no ha repercutido en la farmacodinámica de la insulina glargina. La repercusión de la combinación de insulina glargina y lixisenatida en la farmacodinámica de lixisenatida no se ha analizado en los estudios en fase 1.
En base con un perfil concentración/tiempo relativamente estable de insulina glargina durante 24 horas sin pico pronunciado cuando se administró en monoterapia, el perfil velocidad/tiempo del uso de la glucosa fue similar, cuando se administró la combinación de insulina glargina/lixisenatida. La evolución temporal de la acción de las insulinas, incluida SOLIQUA®, puede variar entre diferentes personas y en la misma persona.
Insulina glargina: En estudios clínicos con insulina glargina (100 unidades/mL), el efecto hipoglucemiante en molaridad (es decir, cuando se expresa en las mismas dosis) de la insulina glargina administrada por vía intravenosa es aproximadamente el mismo que el de la insulina humana.
Lixisenatida: En un estudio controlado con placebo de 28 días de duración en pacientes con diabetes tipo 2 la administración de entre 5 mcg a 20 mcg de lixisenatida tuvo como consecuencia un descenso estadísticamente significativo de la glucemia postprandial después del desayuno, del almuerzo y de la cena.
Vaciado gástrico: Tras una prueba de comida estandarizada. En el mismo estudio antes referenciado, se demostró que lixisenatida retrasa el vaciado gástrico, lo que reduce la velocidad de absorción de la glucosa postprandial. Dicho retraso del vaciado gástrico se había mantenido al final del estudio.
Eficacia clínica y seguridad: La seguridad y eficacia de SOLIQUA® sobre el control glucémico se evaluó en tres estudios clínicos aleatorizados realizados en pacientes con diabetes mellitus tipo 2:
• Añadido a metformina [sin tratamiento previo con insulina].
• Cambio desde una insulina basal.
• Cambio desde agonista del receptor GLP-1.
En cada uno de los ensayos controlados activos, el tratamiento con SOLIQUA® provocó mejoras significativas, tanto clínica como estadísticamente de la hemoglobina A1c (HbA1c).
Alcanzar unos niveles más bajos de HbA1c y conseguir una mayor reducción de HbA1c no aumentó la frecuencia de los episodios de hipoglucemia con el tratamiento combinado en comparación con la insulina glargina en monoterapia (ver sección Reacciones adversas).
En el estudio clínico que añadía el tratamiento a metformina, la administración comenzó en 10 pasos de dosis (10 unidades de insulina glargina y 5 mcg de lixisenatida). En el estudio clínico del cambio desde insulina basal, la dosis inicial fue de 20 pasos de dosis (20 unidades de insulina glargina y 10 mcg de lixisenatida) o de 30 pasos de dosis (30 unidades de insulina glargina y 10 mcg de lixisenatida), ver sección Dosis y vía de administración según la dosis previa de insulina. En ambos estudios, la dosis se ajustó una vez a la semana, según los valores de glucemia basal medidos por el paciente.
Añadido a metformina [sin tratamiento previo con insulina]:
Estudio clínico en pacientes con diabetes tipo 2 no controlados suficientemente con tratamiento con ADO:
Un total de 1170 pacientes con diabetes tipo 2 fueron aleatorizados en un estudio abierto, controlado activo de 30 semanas de duración, para evaluar la eficacia y seguridad de SOLIQUA® en comparación con los componentes por separado, insulina glargina (100 unidades/mL) y lixisenatida (20 mcg).
Pacientes con diabetes tipo 2 tratados con metformina en monoterapia o con metformina en combinación con un segundo ADO que podía ser una sulfonilurea, una glinida, un inhibidor del cotransportador sodio-glucosa tipo 2 (SGLT-2) o un inhibidor de la dipeptidil-peptidasa 4 (DPP-4), y no controlados suficientemente con este tratamiento (intervalo de HbA1c entre 7,5 % y 10 % para pacientes con tratamiento previo con metformina en monoterapia, y entre 7,0 % y 9 % para pacientes con tratamiento previo con metformina y un segundo antidiabético oral), entraron en un periodo de preinclusión de 4 semanas. Durante este periodo de preinclusión, se optimizó el tratamiento con metformina y se interrumpió la administración de cualquier otro ADO. Al final del periodo de preinclusión, los pacientes que seguían inadecuadamente controlados (valor de HbA1c entre 7% y 10%) fueron aleatorizados a SOLIQUA®, insulina glargina o lixisenatida. De los 1479 pacientes que se incluyeron en el periodo de preinclusión, solo se aleatorizaron 1170. Las principales razones para no entrar en la fase de aleatorización fueron un valor de la GPA > 13,9 mmol/L y un valor de la HbA1c < 7% o > 10% al final de la fase de preinclusión.
La población de diabetes tipo 2 aleatorizada presentaba las siguientes características: una edad media de 58,4 años, entre 50 y 64 años en su mayoría (el 57,1%), y un porcentaje de pacientes de sexo masculino del 50,6. El IMC medio al inicio fue 31,7 kg/m2, con un 63,4% de pacientes con un IMC ≥30 kg/m2. La duración media de la diabetes fue aproximadamente 9 años. El tratamiento con metformina de base era obligatorio y el 58% de los pacientes recibía un tratamiento adicional con otro ADO en el momento de la selección, siendo una sulfonilurea en el 54% de los pacientes.
En la semana 30, SOLIQUA® mostró una mejora estadísticamente significativa en el valor de la HbA1c (p < 0,0001) en comparación con los componentes individuales. En un análisis predefinido de esta variable primaria, las diferencias observadas fueron consistentes con respecto al valor de HbA1c inicial (< 8% o ≥ 8%) o al uso de ADO al inicio (metformina en monoterapia o metformina en combinación con otro ADO).
Ver tabla y figura a continuación para las otras variables del estudio.
Resultados a las 30 semanas: Estudio clínico que añadía el tratamiento a metformina (población por IDTm)
|
SOLIQUA® |
Insulina glargina |
Lixisenatida |
|
|
Número de pacientes (IDTm) |
468 |
466 |
233 |
|
HbA1c (%)31 |
|||
|
Inicio (media, después de la fase de preinclusión) |
8,1 |
8,1 |
8,1 |
|
Fin del estudio (media) |
6,5 |
6,8 |
7,3 |
|
Cambio en los MC respecto al inicio (media) |
-1,6 |
-1,3 |
-0,9 |
|
Diferencia en comparación con insulina glargina [IC del 95%] (valor de p) |
-0,3 [-0,4,-0,2] (< 0,0001) |
||
|
Diferencia en comparación con lixisenatida [IC del 95%] (valor de p) |
-0,8 [-0,9,-0,7] (< 0,0001) |
||
|
Número de pacientes (%) que alcanzan HbA1c < 7% en la semana 30* |
345 (74%) |
277 (59%) |
77 (33%) |
|
Glucosa plasmática en ayunas (mmol/L) |
|||
|
Inicio (media) |
9,88 |
9,75 |
9,79 |
|
Fin del estudio (media) |
6,32 |
6,53 |
8,27 |
|
Cambio en los MC respecto al inicio (media) |
-3,46 |
-3,27 |
-1,50 |
|
Diferencia en los MC en comparación con insulina glargina (media) [IC del 95%] (valor de p) |
-0.19 [-0,420 a 0,038] (0,1017) |
||
|
Diferencia en los MC en comparación con lixisenatida (media) [IC del 95%] (valor de p) |
-1,96 [-2,246 a 1,682]} (< 0,0001) |
||
|
GPP a las 2 horas (mmol/l)** |
|||
|
Inicio (media) |
15,19 |
14,61 |
14,72 |
|
Fin del estudio (media) |
9,15 |
11,35 |
9,99 |
|
Cambio en los MC respecto al inicio |
-5,68 |
-3,31 |
-4,58 |
|
Diferencia en los MC en comparación con insulina glargina (media) [IC del 95%] |
-2,38 (-2,79 a -1,96)} |
||
|
Diferencia en los MC en comparación con lixisenatida (media) [IC del 95%] |
-1,10 (-1,63 a -0,57)} |
||
|
Peso corporal medio (kg) |
|||
|
Inicial (media) |
89,4 |
89,8 |
90,8 |
|
Cambio en los MC respecto al inicio (media) |
-0,3 |
1,1 |
-2,3 |
|
Comparación con insulina glargina [IC del 95%] (valor de p) |
-1,4 [-1,9 a -0,9] (< 0,0001) |
||
|
Comparación con lixisenatida [IC del 95%]* |
2,01 [1,4 a 2,6] |
||
|
Número de pacientes (%) que alcanzan HbA1c < 7,0% sin aumento de peso en la semana 30 |
202 (43,2%) |
117 (25,1%) |
65 (27,9%) |
|
Diferencia proporcional en comparación con insulina glargina [IC del 95%] (valor de p) |
18,1 [12,2 a 24,0] (< 0,0001) |
||
|
Diferencia proporcional en comparación con lixisenatida [IC del 95 %]* |
15,2 [8,1 a 22,4] |
||
|
Dosis diaria de insulina glargina |
|||
|
MC de la dosis de insulina en la semana 30 (media) |
39,8 |
40,5 |
ND |
* No incluida en el procedimiento de pruebas step-down predefinido
** GPP a las 2 horas menos el valor de glucosa preprandial.
Figura: Media del valor de la HbA1c (%) al inicio de la selección, en el momento de la aleatorización y en cada punto temporal (para la población que completó el estudio) y en la semana 30-población por IDTm
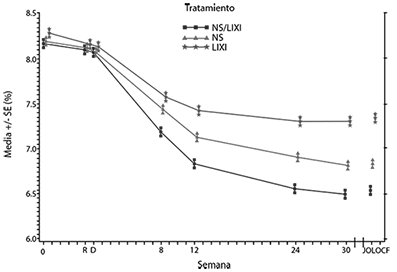
Los pacientes del grupo de SOLIQUA® mostraron un mayor descenso estadísticamente significativo en la media del perfil de 7 puntos de autocontrol de la glucosa plasmática (self-monitored plasma glucose, SMPG) desde el inicio hasta la semana 30 (-3,35 mmol/l en comparación con los pacientes del grupo de insulina glargina (-2,66 mmol/L; diferencia de -0,69 mmol/L) y con los del grupo de lixisenatida (-1,95 mmol/L; diferencia de -1,40 mmol/L) (p < 0,0001 para ambas comparaciones). En todos los puntos de autocontrol, las medias de los valores de glucosa plasmática en la semana 30 fueron inferiores en el grupo de SOLIQUA® que en el de insulina glargina y en el de lixisenatida, con la única excepción del valor antes del desayuno que fue similar entre el grupo de SOLIQUA® y el de insulina glargina.
Cambio desde una insulina basal:
Estudio clínico en pacientes con diabetes tipo 2 no controlados suficientemente con insulina basal: Un total de 736 pacientes con diabetes tipo 2 participaron en el estudio clínico, aleatorizado de 30 semanas de duración, controlado activo, abierto, de 2 grupos paralelos de tratamiento, multicéntrico, para evaluar la eficacia y seguridad de SOLIQUA® en comparación con insulina glargina (100 unidades/mL).
Los pacientes seleccionados presentaban diabetes tipo 2 y recibieron tratamiento con insulina basal durante al menos 6 meses, en una dosis fija de entre 15 U y 40 U en monoterapia o en combinación con 1 o 2 ADO (metformina, una sulfonilurea, una glinida, un inhibidor del SGLT-2 o un inhibidor de la DPP-4), presentaban un valor de la HbA1c de entre 7,5 % y 10 % (con un valor medio de la HbA1c de 8,5 % en la selección) y un valor de la GPA inferior o igual a 10,0 mmol/L o 11,1 mmol/L (en función del tratamiento antidiabético previo).
Después del screening, se incluyó a los pacientes aptos (n = 1018) en una fase de preinclusión de 6 semanas de duración, en la que los pacientes continuaban recibiendo o se cambiaban a insulina glargina, en el caso de que hubieran estado recibiendo otra insulina basal, y se les ajustaba/estabilizaba la dosis de insulina mientras seguían recibiendo metformina (si la recibían previamente). Se interrumpió la administración de cualquier otro ADO.
Al concluir la fase de preinclusión, se aleatorizó a los pacientes que presentaban un valor de la HbA1c de entre 7% y 10%, un valor de la GPA ≤ 7,77 mmol/L y que recibían una dosis diaria de insulina glargina de entre 20 unidades a 50 unidades, al grupo de SOLIQUA® (n = 367) o al de insulina glargina (n = 369).
Esta población de pacientes con diabetes tipo 2 presentaba las siguientes características: una edad media de 60,0 años, una edad de entre 50 y 64 años en su mayoría (56,3%) y un porcentaje de pacientes de sexo femenino del 53,3%. El IMC medio al inicio fue 31,1 kg/m2, con un 57,3% de pacientes con un IMC ≥ 30 kg/m2. La duración media de la diabetes fue aproximadamente 12 años y la duración media del tratamiento previo con insulina basal de alrededor de 3 años. En el momento de la selección el 64,4% de los pacientes recibieron insulina glargina como insulina basal y un 95,0% de los pacientes recibieron al menos un ADO concomitante.
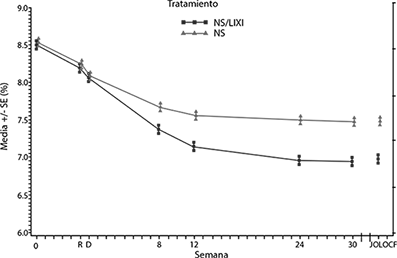
En la semana 30, SOLIQUA® mostró una mejora estadísticamente significativa en el valor de la HbA1c (p < 0,0001) en comparación con insulina glargina.
Ver la tabla y la figura a continuación para las otras variables del estudio.
Resultados a las 30 semanas: Estudio en pacientes con diabetes tipo 2 no controlados que recibían insulina basal (población por IDTm)
|
SOLIQUA® |
Insulina glargina |
|
|
Número de pacientes (IDTm) |
366 |
365 |
|
HbA1c (%) |
||
|
Inicio (media, después de la fase de preinclusión) |
8,1 |
8,1 |
|
Fin de tratamiento (media) |
6,9 |
7,5 |
|
Cambio en los MC respecto al inicio (media) |
-1,1 |
-0,6 |
|
Diferencia en comparación con insulina glargina [IC del 95%] (valor de p) |
-0,5 [-0,6, -0,4] (< 0,0001) |
|
|
Pacientes [n (%)] que alcanzan HbA1c < 7% en la semana 30* |
201 (54,9%) |
108 (29,6%) |
|
Glucosa plasmática en ayunas (mmol/L) |
||
|
Inicio (media) |
7,33 |
7,32 |
|
Fin del estudio (media) |
6,78 |
6,69 |
|
Cambio en los MC respecto al inicio (media) |
-0,35 |
-0,46 |
|
Diferencia en comparación con insulina glargina [IC del 95%] |
0,11 (-0,21 a 0,43) |
|
|
GPP a las 2 horas (mmol/l)** |
||
|
Inicio (media) |
14,85 |
14,97 |
|
Fin del estudio (media) |
9,91 |
13,41 |
|
Cambio en los MC respecto al inicio (media) |
-4,72 |
-1,39 |
|
Diferencia en los MC en comparación con insulina glargina (media) [IC del 95 %] |
-3,33 -3,89 a -2,77 |
|
|
Peso corporal medio (kg) |
||
|
Inicio (media) |
87,8 |
87,1 |
|
Cambio en los MC respecto al inicio (media) |
-0,7 |
0,7 |
|
Comparación con insulina glargina [IC del 95%] (valor de p) |
-1,4 [-1,8 a -0,9] (< 0,0001) |
|
|
Número de pacientes (%) que alcanzan HbA1c <7,0 % sin aumento de peso en la semana 30 |
125 (34,2%) |
49 (13,4%) |
|
Diferencia proporcional en comparación con insulina glargina [IC del 95%] (valor de p) |
20,8 [15,0 a 26,7] (< 0,0001) |
|
|
Dosis diaria de insulina glargina |
||
|
Inicio (media) |
35,0 |
35,2 |
|
Fin del estudio (media) |
46,7 |
46,7 |
|
MC del cambio de la dosis de insulina en la semana 30 (media) |
10,6 |
10,9 |
* No incluida en el procedimiento de pruebas step-down predefinido.
** GPP a las 2 horas menos el valor de glucosa preprandia.
Figura: Media de la HbA1c (%) al inicio de la selección, en el momento de la aleatorización y en cada punto temporal (para la población que completó el estudio) y en la semana 30 (población por IDTm)
Cambio desde agonista del recetor GLP-1:
Estudio clínico en pacientes con diabetes tipo 2 insuficientemente controlados con un agonista del receptor GLP-1: La eficacia y seguridad de SOLIQUA® en comparación con el tratamiento con un agonista del receptor GLP-1 anterior al ensayo sin cambio, se estudiaron en un ensayo aleatorizado, abierto, de 26 semanas.
El ensayo incluyó a 514 pacientes con diabetes mellitus tipo 2 inadecuadamente controlada (nivel de HbA1c de 7% a 9% ambos incluidos) mientras fueron tratados durante al menos 4 meses con liraglutida o exenatida o durante al menos 6 meses con dulaglutida, albiglutida o exenatida de liberación prolongada, todos a la dosis máxima tolerada, y metformina sola o en combinación con pioglitazona, un inhibidor SGLT-2 o ambos. Los pacientes elegibles fueron aleatorizados para recibir SOLIQUA® o para confirmar on su anterior agonista del receptor GLP-1, ambos además de su tratamiento antidiabético oral anterior.
En la selección, el 59,7% de los sujetos recibió un agonista del receptor GLP-1 una o dos veces al día y el 40,3% recibió un agonista del receptor GLP-1 una vez por semana. En la selección, el 6,6% de los sujetos recibieron pioglitazona y el 10,1% un inhibidor de SGLT-2 en combinación con metformina.
La población de estudio tenía las siguientes características: la edad media era de 59,6 años, el 52,5% de los sujetos eran hombres. La duración media de la diabetes fue de 11 años, la duración media del tratamiento previo con un agonista del receptor GLP-1 fue de 1,9 años, el IMC medio fue de aproximadamente 32,9 kg / m2, la TFGe media fue de 87,3 mL/min/1,73 m2 y el 90,7% de los pacientes tenían una TFGe ≥ 60 mL/min.
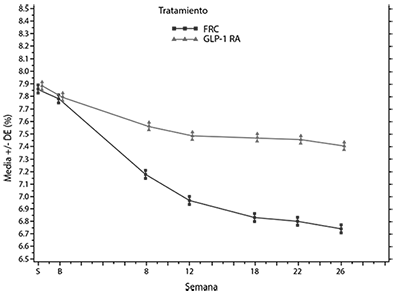
En la semana 26, SOLIQUA® proporcionó una mejora estadísticamente significativa en HbA1c (p < 0,0001). Un análisis preespecificado por el subtipo de agonista del receptor GLP-1 (formulación una vez/dos veces al día o semanalmente) utilizado en la selección, mostró que el cambio de HbA1c en la semana 26 fue similar para cada subgrupo y consistente con el análisis primario de toda la población.
La dosis diaria promedio de SOLIQUA® en la semana 26 fue de 43,5 pasos de dosis. Ver tabla y figura a continuación para las otras variables del estudio.
Resultados a las 26 semanas: Estudio en pacientes con diabetes tipo 2 no controlados con un agonista del receptor GLP-1 (población por IDTm)
|
SOLIQUA® |
Insulina glargina |
|
|
Número de pacientes (IDTm) |
252 |
253 |
|
HbA1c (%) |
||
|
Inicio (media, después de la fase de preinclusión) |
7,8 |
7,8 |
|
Fin de tratamiento (media) |
6,7 |
7,4 |
|
Cambio en los MC respecto al inicio (media) |
-1,0 |
-0,4 |
|
Diferencia en comparación con un agonista del receptor GLP-1 [IC del 95%] (valor de p) |
-0,6 [-0,8 a -0,5] (< 0,0001) |
|
|
Pacientes [n (%)] que alcanzan HbA1c < 7% en la semana 26* |
156 (61,9%) |
65 (25,7%) |
|
Diferencia proporcional (intervalo de confianza del 95%) en comparación con un agonista del receptor GLP-1 |
36.1% (28,1% a 44,0%) |
|
|
Valor de p |
(< 0,0001) |
|
|
Glucosa plasmática en ayunas (mmol/l) |
||
|
Inicio (media) |
9,06 |
9,45 |
|
Fin del estudio (media) |
6,86 |
8,66 |
|
Cambio en los MC respecto al inicio (media) |
-2,28 |
-0,60 |
|
Diferencia en comparación con un agonista del receptor GLP-1 [IC del 95%] (Valor de p) |
-1,67 (-0,21 a 0,43) (< 0,0001) |
|
|
GPP a las 2 horas (mmol/l)** |
||
|
Inicio (media) |
14,85 |
14,97 |
|
Fin del estudio (media) |
9,91 |
13,41 |
|
Cambio en los MC respecto al inicio (media) |
-4,72 |
-1,39 |
|
Diferencia en los MC en comparación con un agonista del receptor GLP-1 (media) [Intervalo de confianza del 95%] (valor de p) |
-2,9 (-3,42 a 2,28) (< 0,0001) |
|
|
Peso corporal medio (kg) |
||
|
Inicio (media) |
||
|
Cambio en los MC respecto al inicio (media) |
||
|
Comparación con agonistas del receptor GLP-1) [Intervalo de confianza del 95%] (valor de p) |
-3,03 [2,417 a 3,643] (< 0,0001) |
|
** GPP a las 2 horas menos el valor de glucosa preprandial.
Figura: Media de la HbA1c (%) por visita durante el periodo de tratamiento aleatorizado de 26 semanas-población por IDTm)
Uso concomitante de SOLIQUA® con inhibidores SGLT-2 (isSGLT2): El uso concomitante de SOLIQUA® con un iSGLT2 está respaldado por un análisis de subgrupos de 3 ensayos clínicos aleatorizados en fase 3 (119 pacientes con la combinación de ratio fijo (CRF) de insulina glargina/lixisenatida que también recibieron un iSGLT2).
Un estudio realizado en Europa y América del Norte, incluyó datos de 26 pacientes (10,1%) que recibieron concomitantemente CRF de insulina glargina/lixisenatida, metformina y un iSGLT2. Dos estudios Fase 3 más del programa de desarrollo clínico japonés específico, realizado en pacientes que no alcanzaron un control glucémico adecuado con ADO, proporcionaron datos de 59 pacientes (22,7%) y 34 pacientes (21,1%), respectivamente, que recibieron concomitantemente un iSGLT2 y CDF de insulina glargina/lixisenatida.
Los datos de estos 3 estudios, mostraron que el inicio con SOLIQUA® en pacientes inadecuadamente controlados con un tratamiento que incluye un iSGLT2 conduce a un cambio mejorado de HbA1c versus los comparadores. No hubo incremento del riesgo de hipoglucemia, ni diferencias relevantes en el perfil de seguridad global entre los pacientes que usaban un iSGLT2 comparados con los que no.
Estudios de eventos cardiovasculares: La seguridad cardiovascular de insulina glargina se ha determinado en el ensayo clínico ORIGIN y la de lixisenatida en el ELIXA. No se ha llevado a cabo ningún ensayo específico de eventos cardiovasculares con SOLIQUA®.
Insulina glargina: El ensayo ORIGIN (Outcome Reduction with Initial Glargine Intervention) consistió en un estudio abierto, aleatorizado y con una población de 12.537 pacientes para comparar LANTUS con el tratamiento de referencia en el tiempo hasta la aparición del evento adverso cardiovascular mayor (MACE). El MACE se mide por la combinación de muerte cardiovascular, infarto de miocardio no mortal y accidente cerebrovascular no mortal. La mediana de la duración del seguimiento del estudio fue de 6,2 años. La incidencia de MACE fue similar entre LANTUS y el tratamiento de referencia en ORIGIN [Hazard Ratio (IC del 95 %) para EACM: 1,02 (0,94-1,11)].
Lixisenatida: El estudio ELIXA consistió en un estudio con doble ciego, aleatorizado, controlado con placebo y multinacional para evaluar los eventos cardiovasculares (CV) durante el tratamiento con lixisenatida en pacientes (n = 6068) con diabetes mellitus tipo 2 tras un Síndrome Coronario Agudo reciente. La variable compuesta primera de eficacia fue el tiempo hasta la primera aparición de cualquiera de estos acontecimientos: muerte cardiovascular, infarto de miocardio no mortal, accidente cerebrovascular no mortal y hospitalización por angina inestable. La mediana de la duración del seguimiento del estudio fue de 25,8 meses para el grupo de lixisenatida y de 25,7 meses para el de placebo.
La incidencia de la variable primaria fue similar entre el grupo de lixisenatida (13,4 %) y el de placebo (13,2 %): el hazard ratio (HR) (IC bilateral del 95 %) para lixisenatida en comparación con placebo: 1,017 (0,886-1,168).
Población pediátrica: La Agencia Europea de Medicamentos ha eximido de la obligación de presentar los resultados de los ensayos realizados con SOLIQUA® en todos los grupos de la población pediátrica en el tratamiento de la diabetes mellitus tipo 2 (ver sección Dosis y vía de administración para consultar la información sobre el uso en la población pediátrica).
CONTRAINDICACIONES:
Hipersensibilidad a los principios activos o a alguno de los excipientes incluidos en la sección Lista de excipientes.
FERTILIDAD, EMBARAZO Y LACTANCIA:
Mujeres en edad fértil: No se recomienda utilizar SOLIQUA® en mujeres en edad fértil que no estén utilizando métodos anticonceptivos.
Embarazo: No se dispone de datos clínicos sobre la exposición a SOLIQUA®, insulina glargina o lixisenatida durante el embarazo en estudios clínicos controlados.
Existe un elevado número de datos en mujeres embarazadas (datos en más de 1.000 embarazos) con insulina glargina que indican que no se producen efectos adversos específicos sobre el embarazo, ni malformaciones específicas, ni toxicidad fetal/neonatal con insulina glargina. Los estudios realizados en animales no han mostrado toxicidad para la reproducción con insulina glargina.
No se dispone de datos suficientes sobre el uso de lixisenatida en mujeres embarazadas. Los estudios con lixisenatida realizados en animales han mostrado toxicidad para la reproducción (ver sección Datos preclínicos sobre seguridad).
SOLIQUA® no debe utilizarse durante el embarazo. Si la paciente está planeando un embarazo o se produce un embarazo, el tratamiento con SOLIQUA® debe interrumpirse.
Lactancia: Se desconoce si lixisenatida o insulina glargina se excreta en la leche materna. No debe administrarse SOLIQUA® durante la lactancia.
Fertilidad: Los estudios en animales con lixisenatida o insulina glargina no indican efectos perjudiciales directos en términos de fertilidad.
EFECTOS SOBRE LA CAPACIDAD DE CONDUCIR Y USAR MAQUINARÍA:
La influencia de SOLIQUA® sobre la capacidad para conducir y utilizar máquinas es nula o insignificante. Sin embargo, la capacidad de concentración y de reacción del paciente puede verse afectada como consecuencia de una hipoglucemia o una hiperglucemia o, por ejemplo, como consecuencia de una alteración visual. Esto puede suponer un riesgo en situaciones en que estas capacidades sean de especial importancia (p.ej. conducir un automóvil o utilizar máquinas).
Se debe advertir a los pacientes que adopten precauciones para evitar una hipoglucemia mientras conducen y utilizan máquinas. Esto es particularmente importante en aquellos pacientes con ausencia o reducción del reconocimiento de los síntomas de aviso de hipoglucemia, o que padecen episodios frecuentes de hipoglucemia. Se debe considerar la conveniencia de conducir o utilizar máquinas en estas circunstancias.
REACCIONES ADVERSAS:
Resumen del perfil de seguridad: Las reacciones adversas notificadas con más frecuencia durante el tratamiento con SOLIQUA® fueron hipoglucemia y reacciones adversas gastrointestinales (ver a continuación sección Descripción de reacciones adversas seleccionadas).
Tabla de reacciones adversas: Las siguientes reacciones adversas relacionadas procedentes de investigaciones clínicas se enumeran a continuación, según el sistema de clasificación de órganos y en orden decreciente de frecuencia (muy frecuentes: ≥ 1/10; frecuentes: ≥ 1/100 a < 1/10; poco frecuentes: ≥ 1/1.000 a < 1/100; raras: ≥ 1/10.000 a < 1/1.000; muy raras: < 1/10.000).
|
Sistema de clasificación de órganos |
Frecuencia |
|||
|
Muy frecuentes |
Frecuentes |
Poco frecuentes |
No conocida |
|
|
Infecciones e infestaciones |
Nasofaringitis Infección del tracto respiratorio superior |
|||
|
Trastornos del sistema inmunológico |
Urticaria |
|||
|
Trastornos del metabolismo y de la nutrición |
Hipoglucemia |
|||
|
Trastornos del sistema nervioso |
Mareos |
Cefalea |
||
|
Trastornos gastrointestinales |
Náuseas Diarrea Vómitos |
Dispepsia Dolor abdominal |
||
|
Trastornos de la piel y del tejido subcutáneo |
Amiloidosis cutánea Lipodistrofia |
|||
|
Trastornos generales y alteraciones en el lugar de administración |
Reacciones en el lugar de la inyección |
Fatiga |
||
Descripción de reacciones adversas seleccionadas:
Hipoglucemia: La siguiente tabla describe la tasa de episodios de hipoglucemia sintomática documentada (≤ 3,9 mmol/L) y de hipoglucemia grave tanto para SOLIQUA® como para el comparador.
Reacciones adversas por episodios de hipoglucemia sintomática documentada o grave
|
Pacientes sin tratamiento previo con insulina |
Cambio desde insulina basal |
Cambio desde un agonista del receptor GLP-1 |
|||||
|
SOLIQUA® |
Insulina glargina |
Lixisenatida |
SOLIQUA® |
Insulina glargina |
SOLIQUA® |
Insulina glargina |
|
|
N |
469 |
467 |
233 |
365 |
365 |
255 |
256 |
|
Episodios de hipoglucemia sintomática documentada* |
|||||||
|
Pacientes con acontecimiento, n (%) |
120 (25,6%) |
110 (23,6%) |
15 (6,4%) |
146 (40,0) |
155 (42,5) |
71 (27,8%) |
6 (2,3%) |
|
Acontecimientos por paciente/año, n |
1,44 |
1,22 |
0,34 |
3,03 |
4,22 |
1,54 |
0,08 |
|
Episodios de hipoglucemia grave** |
|||||||
|
Acontecimientos por paciente-año, n |
0 |
<0,01 |
0 |
0,02 |
<0,01 |
<0,01 |
0 |
* Un episodio de hipoglucemia sintomática documentada consistió en un acontecimiento durante el cual los síntomas característicos de la hipoglucemia aparecieron acompañados de una concentración medida de glucosa plasmática ≤ 3,9 mmol/L.
** Un episodio de hipoglucemia grave sintomática consistió en un acontecimiento que requirió la ayuda de otra persona para administrar activamente carbohidratos o glucagón, o para realizar otras acciones de reanimación.
Trastornos gastrointestinales: Las reacciones adversas gastrointestinales (náuseas, vómitos y diarrea) fueron reacciones adversas que se notificaron frecuentemente durante el periodo de tratamiento. En pacientes tratados con SOLIQUA®, la incidencia de náuseas, diarrea y vómitos relacionados fue del 8,4 %, 2,2 % y 2,2 %, respectivamente.
La mayoría de las reacciones adversas gastrointestinales fueron leves y transitorias.
Trastornos del sistema inmunitario: Se han notificado reacciones alérgicas (urticaria) posiblemente relacionadas con SOLIQUA® en el 0,3% de los pacientes. Se han notificado casos de reacciones alérgicas generalizadas, incluyendo reacciones anafilácticas y angioedema durante el uso de insulina glargina y lixisenatida comercializadas.
Inmunogenicidad: La administración de SOLIQUA® puede desencadenar la formación de anticuerpos anti-insulina glargina y/o anti-lixisenatida.
La incidencia de formación de anticuerpos anti- insulina glargina fue del 21,0% y 26,2%. En aproximadamente el 93% de los pacientes, los anticuerpos anti-insulina glargina mostraron una reactividad cruzada frente a la insulina humana. La incidencia de la formación de anticuerpos anti-lixisenatida fue del 43%, aproximadamente. Ni la presencia de anticuerpos anti-insulina glargina ni la de anticuerpos anti-lixisenatida tuvieron impacto clínicamente relevante en la seguridad y en la eficacia. Trastornos de la piel y del tejido subcutáneo: Pueden producirse lipodistrofia y amiloidosis cutánea en el punto de inyección y retrasar la absorción local de insulina. La rotación continua del punto de inyección dentro de la zona de administración de la inyección puede ayudar a reducir o prevenir estas reacciones (ver sección Advertencias y precauciones).
Reacciones en el lugar de la inyección: Algunos de los pacientes (el 1,7%) que recibieron tratamiento que contenía insulina, incluyendo SOLIQUA®, han experimentado eritema, edema localizado y prurito en el lugar de la inyección.
Frecuencia cardiaca: Se han notificado casos de aumento de la frecuencia cardiaca con el uso de agonistas del receptor GLP1, así como un aumento transitorio en algunos estudios con lixisenatida. No se ha observado un aumento de la media de la frecuencia cardiaca en ninguno de los estudios en fase 3 con SOLIQUA®.
Notificación de sospechas de reacciones adversas: Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del correo farmacovigilancia.peru@sanofi.com.
INCOMPATIBILIDADES:
Este medicamento no debe mezclarse con otros.
INTERACCIONES CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN:
No se han realizado estudios de interacción con SOLIQUA®. La información dada a continuación se basa en los estudios de los monocomponentes.
Interacciones farmacodinámicas: Diversas sustancias afectan al metabolismo de la glucosa y pueden requerir el ajuste de la dosis de SOLIQUA®.
Entre las sustancias que pueden aumentar el efecto hipoglucemiante e incrementar la susceptibilidad a la hipoglucemia, se incluyen los medicamentos antihiperglucemiantes, los inhibidores de la enzima convertidora de la angiotensina (ECA), la disopiramida, los fibratos, la fluoxetina, los inhibidores de la mono amino-oxidasa (MAO), la pentoxifilina, el propoxifeno, los salicilatos y los antibióticos del tipo de las sulfonamidas.
Entre las sustancias que pueden reducir el efecto hipoglucemiante se incluyen los corticosteroides, el danazol, el diazóxido, los diuréticos, el glucagón, la isoniazida, los estrógenos y los progestágenos, los derivados de fenotiazina, la somatropina, los medicamentos simpaticomiméticos(p.ej. epinefrina [adrenalina], salbutamol, terbutalina) las hormonas tiroideas, medicamentos antipsicóticos atípicos (p.ej. clozapina y olanzapina) e inhibidores de la proteasa.
Los betabloqueantes, la clonidina, las sales de litio o el alcohol pueden potenciar o debilitar el efecto hipoglucemiante de la insulina. La pentamidina puede provocar hipoglucemia, que algunas veces puede ir seguida de hiperglucemia.
Además, bajo la influenciade medicamentos simpaticolíticos como los betabloqueantes, la clonidina, la guanetidina y la reserpina, los signos de contrarregulación adrenérgica pueden reducirse o estar ausentes.
Interacciones farmacocinéticas: Lixisenatida es un péptido y no se metaboliza por el citocromo P450. En los estudios in vitro se observó que lixisenatida no afecta a la actividad de las isoenzimas del citocromo P450 o a los trasportadores humanos analizados.
No se conocen interacciones farmacocinéticas para insulina glargina.
Efecto del vaciado gástrico sobre medicamentos orales: El retraso en el vaciado gástrico con lixisenatida puede reducir la tasa de absorción de los medicamentos administrados por vía oral. Los pacientes que reciben medicamentos que tienen un margen terapéutico estrecho o medicamentos que requieren una cuidadosa monitorización clínica, deben seguirse de cerca, especialmente al iniciar el tratamiento con lixisenatida. Estos medicamentos se deben tomar de forma estandarizada en relación con lixisenatida. Si dichos medicamentos se tienen que administrar con alimentos, se debe advertir a los pacientes, si fuera posible, que los tomen con una comida cuando lixisenatida no sea administrada.
Para medicamentos orales que son particularmente dependientes de las concentraciones umbral para la eficacia, como son los antibióticos, debe advertirse a los pacientes que tomen dichos medicamentos como mínimo 1 hora antes o 4 horas después de la inyección de lixisenatida.
Las formulaciones gastrorresistentes que contienen sustancias sensibles a la degradación gástrica, deben administrarse 1 hora antes o 4 horas después de la inyección de lixisenatida.
Paracetamol: Se utilizó paracetamol como un medicamento modelo para evaluar el efecto de lixisenatida sobre el vaciado gástrico. Tras la administración de una dosis única de 1.000 mg de paracetamol, el AUC y el t1/2 del paracetamol no cambiaron, con independencia del momento de su administración (antes o después de la inyección de lixisenatida). Cuando se administró 1 o 4 horas después de 10 mcg de lixisenatida, la Cmáx de paracetamol disminuyó en un 29% y un 31%, respectivamente, y la mediana del tmáx se retrasó en 2,0 y 1,75 horas, respectivamente. Con la dosis de mantenimiento de 20 mcg se ha predecido otro retraso en el tmáx y una Cmáx reducida de paracetamol.
No se observaron efectos sobre la Cmáx y el tmáx de paracetamol cuando se administró paracetamol 1 hora antes de lixisenatida.
Según estos resultados, no se requiere realizar ajustes en la dosis de paracetamol, pero cuando se requiere un inicio de acción rápido por temas de eficacia, debe tenerse en cuenta el retraso de la tmáx observado cuando se administra paracetamol entre 1 y 4 horas después de lixisenatida.
Anticonceptivos orales: Tras la administración de una dosis única de un anticonceptivo oral (etinilestradiol 0,03 mg/levonorgestrel 0,15 mg) 1 hora antes o 11 horas después de 10 mcg de lixisenatida, la Cmáx, el AUC, el t1/2 y el tmáx de etinilestradiol y levonorgestrel permanecieron inalterados.
La administración del anticonceptivo oral 1 hora o 4 horas después de lixisenatida no afectó al AUC ni al t1/2 de etinilestradiol y levonorgestrel, mientras que la Cmáx de etinilestradiol disminuyó en un 52% y un 39%, respectivamente, y la Cmáx de levonorgestrel disminuyó en un 46% y un 20%, respectivamente y la mediana del tmáx se retrasó de 1 a 3 horas.
La reducción de la Cmáx tiene una relevancia clínica limitada y no se requiere un ajuste de la dosis para los anticonceptivos orales.
Atorvastatina: Cuando se administró lixisenatida 20 mcg junto con atorvastatina 40 mg por la mañana, durante 6 días, no se vio afectada la exposición a atorvastatina, mientras que la Cmáx disminuyó en un 31% y el tmáx se retrasó en unas 3,25 horas.
No se observó dicho aumento del tmáx cuando se administró la atorvastatina por la noche y lixisenatida por la mañana, pero la AUC y la Cmáx de atorvastatina se incrementaron en un 27% y un 66%, respectivamente.
Estos cambios no son clínicamente relevantes y, en consecuencia, no se requieren ajustes de la dosis de atorvastatina cuando se administra conjuntamente con lixisenatida.
Warfarina y otros derivados de la cumarina: Tras la administración concomitante de warfarina 25 mg con dosis repetidas de lixisenatida 20 mcg, no se vio afectada el AUC ni el INR (cociente internacional normalizado), mientras que la Cmáx se redujo en un 19% y el tmáx se retrasó en unas 7 horas.
Teniendo en cuenta estos resultados, no se requieren ajustes de la dosis de warfarina cuando se administra conjuntamente con lixisenatida; sin embargo, durante el inicio o el final del tratamiento con lixisenatida, se recomienda una monitorización frecuente del INR en pacientes tratados con warfarina y/o derivados de la cumarina.
Digoxina: Tras la administración concomitante de lixisenatida 20 mcg y digoxina 0,25 mg en estado estacionario, el AUC de digoxina no se vio afectado. El tmáx de digoxina se retrasó en unas 1,5 horas y la Cmáx se redujo en un 26%.
Según estos resultados, no se requiere realizar ajustes en la dosis de digoxina cuando se administra de forma conjunta con lixisenatida.
Ramipril: Tras la administración concomitante de lixisenatida 20 mcg y ramipril 5 mg durante 6 días, el AUC de ramipril aumentó en un 21%, mientras que la Cmáx disminuyó en un 63%. El AUC y la Cmáx del metabolito activo (ramiprilato) no se vieron afectados. El tmáx de ramipril y ramiprilato se retrasó aproximadamente 2,5 horas.
Según estos resultados, no se requiere realizar ajustes en la dosis de ramipril cuando se administra de forma conjunta con lixisenatida.
DATOS PRECLÍNICOS SOBRE SEGURIDAD:
No se han llevado a cabo estudios en animales con la combinación de insulina glargina y lixisenatida para evaluar la toxicidad a dosis repetidas, potencial carcinogénico, genotoxicidad ni toxicidad para la reproducción.
Insulina glargina: Los datos de los estudios no clínicos para insulina glargina no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas, genotoxicidad, potencial carcinogénico y toxicidad para la reproducción.
Lixisenatida: En estudios de carcinogenicidad subcutánea de 2 años, se observaron tumores no letales en células C tiroideas en ratas y ratones, que se consideraron causados por un mecanismo no genotóxico mediado por el receptor GLP-1, al que los roedores son particularmente sensibles. En ratas, se observó hiperplasia y adenoma de células C con todas las dosis y no pudo definirse el nivel sin efectos adversos observados (NOAEL). En ratones, estos efectos ocurrieron para un nivel de exposición 9,3 veces superior a la dosis terapéutica en humanos. En ratones no se observaron carcinomas de células C y en ratas aparecieron carcinomas para una exposición unas 900 veces superior a la dosis terapéutica en humanos. En un estudio de carcinogenicidad subcutánea, de 2 años de duración, en ratones, se observaron 3 casos de adenocarcinoma de endometrio en el grupo de dosis media, con un aumento estadísticamente significativo correspondiente a un nivel de exposición de 97 veces. No se demostró ningún efecto relacionado con el tratamiento.
Los estudios en animales no indicaron efectos lesivos directos con respecto a la fertilidad de machos y hembras en ratas.
Se observaron lesiones reversibles testiculares y epididimarios en perros tratados con lixisenatida. No se observaron efectos relacionados sobre la espermatogénesis en hombres sanos. En estudios de desarrollo embriofetal se observaron, malformaciones, retraso en el crecimiento, retraso en la dosificación y efectos esqueléticos en ratas a todas las dosis (5 veces el ratio de exposición comparado con la exposición en humanos) y en conejos a altas dosis (32 veces el ratio de exposición comparado con la exposición en humanos) de lixisenatida. En ambas especies hubo una ligera toxicidad maternal consistente en la reducción del consumo de alimentos y peso corporal disminuido.
El crecimiento neonatal se redujo en ratas macho expuestas a elevadas dosis de lixisenatida durante los últimos estadios de la gestación y durante la lactancia, y se observó un ligero incremento de la mortalidad de la camada.
ADVERTENCIAS Y PRECAUCIONES:
Trazabilidad: Con objeto de mejorar la trazabilidad de los medicamentos biológicos, el nombre y el número de lote del medicamento administrado deben estar claramente registrados.
SOLIQUA® no se debe utilizar en pacientes con diabetes mellitus tipo 1 o para el tratamiento de la cetoacidosis diabética.
Se debe enseñar a los pacientes a realizar una rotación continua del punto de inyección para reducir el riesgo de sufrir lipodistrofia y amiloidosis cutánea. Hay un posible riesgo de retraso de la absorción de insulina y empeoramiento del control de la glucemia tras las inyecciones de insulina en puntos con estas reacciones. Se ha notificado que un cambio repentino en el punto de inyección en una zona no afectada produce hipoglucemia. Se recomienda vigilar la glucosa en sangre después de cambiar el punto de inyección y podrá considerarse el ajuste de las medicaciones antidiabéticas.
Hipoglucemia: Hipoglucemia fue la reacción adversa observada notificada con mayor frecuencia durante el tratamiento con SOLIQUA® (ver sección Reacciones adversas). La hipoglucemia puede aparecer si la dosis de SOLIQUA® es mayor que la que se necesita.
Los factores que incrementan la susceptibilidad a la hipoglucemia requieren particularmente una estrecha monitorización y pueden necesitar ajustar la dosis. Estos factores incluyen:
• El cambio del área de inyección.
• El incremento de la sensibilidad a la insulina (p.ej. al eliminar factores de estrés).
• La actividad física desacostumbrada, aumentada o prolongada.
• Una enfermedad intercurrente (p.ej. vómitos, diarrea).
• Ingesta inadecuada de alimentos.
• Omisión de comidas.
• Consumo de alcohol.
• Ciertos trastornos de descompensación del sistema endocrino, (p.ej. hipotiroidismo e insuficiencia adrenocortical o de la pituitaria anterior).
• El tratamiento concomitante con ciertos medicamentos (ver sección Interacciones con otros medicamentos y otras formas de interacción).
• Lixisenatida y/o insulina en combinación con una sulfonilurea puede dar lugar a un incremento del riesgo de hipoglucemia. Por lo tanto, SOLIQUA® no se debe administrar con una sulfonilurea.
La dosis de SOLIQUA® debe ser individualizada de acuerdo a la respuesta clínica y ajustarse según las necesidades de insulina del paciente (ver sección Dosis y vía de administración).
Pancreatitis aguda: El uso de agonistas del receptor del péptido similar al glucagón tipo 1 (GLP-1) se ha asociado a un riesgo de desarrollar pancreatitis aguda. Se han notificado pocos acontecimientos de pancreatitis aguda con lixisenatida, aunque no se ha establecido una relación causal. Debe informarse a los pacientes sobre los síntomas característicos de la pancreatitis aguda: dolor abdominal intenso y persistente.
Si hay sospecha de pancreatitis, se debe interrumpir el tratamiento con SOLIQUA® y, en caso de confirmarse la pancreatitis aguda, no se debe volver a instaurar el tratamiento con lixisenatida. Se debe tener precaución en pacientes con antecedentes de pancreatitis.
Enfermedad gastrointestinal grave: El uso de agonistas del receptor del GLP-1 podría asociarse a reacciones adversas gastrointestinales. SOLIQUA® no se ha estudiado en pacientes con enfermedades gastrointestinales graves, incluyendo la gastroparesia grave y, por tanto, no se recomienda su uso en estos pacientes.
Insuficiencia renal grave: No existe experiencia terapéutica en pacientes con insuficiencia renal grave (aclaramiento de creatinina menor de 30 mL/min) o con enfermedad renal en etapa terminal. No se recomienda su uso en pacientes con insuficiencia renal grave o con enfermedad renal en etapa terminal (ver secciones Dosis y vía de administración y Propiedades farmacocinéticas).
Medicamentos concomitantes: El retraso del vaciado gástrico con lixisenatida puede reducir la tasa de absorción de los medicamentos administrados por vía oral. SOLIQUA® se debe utilizar con precaución en pacientes que reciben medicamentos orales que requieren una rápida absorción gastrointestinal, una cuidadosa monitorización clínica o tienen un margen terapéutico estrecho. Las recomendaciones específicas sobre la toma de dichos medicamentos se facilitan en la sección Interacciones con otros medicamentos y otras formas de interacción.
Deshidratación: Respecto a las reacciones adversas gastrointestinales, debe advertirse a los pacientes tratados con SOLIQUA® del riesgo potencial de deshidratación, y tomar precauciones para evitar la depleción de líquidos.
Formación de anticuerpos: La administración de SOLIQUA® puede dar lugar a la formación de anticuerpos anti insulina glargina y/o anti-lixisenatida. En raras ocasiones, la presencia de estos anticuerpos puede precisar un ajuste de la dosis de SOLIQUA® para corregir una tendencia a la hiperglucemia o a la hipoglucemia.
Prevención de errores de medicación: Se debe instruir a los pacientes para comprobar siempre la etiqueta de la pluma (aplicador) antes de cada inyección para evitar confusiones accidentales entre las dos concentraciones diferentes de SOLIQUA® y confusiones con otros medicamentos inyectables para la diabetes.
Para evitar errores de dosificación y sobredosis potenciales, ni los pacientes ni los profesionales sanitarios deben utilizar una jeringa para pasar el medicamento del cartucho de la pluma (aplicador) precargada a una jeringa.
Poblaciones no estudiadas: El paso desde un agonista del receptor GLP-1 no ha sido estudiado.
SOLIQUA® no se ha estudiado en combinación con inhibidores DPP-4, sulfonilureas, glinidas, pioglitazona e inhibidores de SGLT-2.
Excipientes: Este medicamento contiene menos de 1 mmol (23 mg) de sodio por dosis, por lo que se considera esencialmente “exento de sodio”.
Este medicamento contiene metacresol, que puede provocar reacciones alérgicas.
DOSIS Y VÍA DE ADMINISTRACIÓN:
SOLIQUA® está disponible en dos plumas (aplicadores) que proporcionan opciones diferentes de dosificación, es decir la pluma (aplicador) de SOLIQUA® (10-40) y la pluma (aplicador) de (30-60), respectivamente. La diferencia entre las dosis de las plumas (aplicadores) se basa en el intervalo de dosis de la pluma (aplicador).
• SOLIQUA® 100 unidades/mL + 50 microgramos/mL pluma (aplicador) precargada libera pasos de dosis de 10- 40 unidades de insulina glargina en combinación con 5-20 mcg de lixisenatida. (Aplicador de SOLIQUA® [10-40]).
• SOLIQUA® 100 unidades/mL + 33 microgramos/mL pluma (aplicador) precargada libera pasos de dosis de 30-60 unidades de insulina glargina en combinación con 10-20 mcg de lixisenatida. (Aplicador de SOLIQUA® [30-60]).
Para evitar errores de medicación el médico se debe asegurar que incluye en la prescripción, pluma (aplicador) correcta de SOLIQUA® y el número de pasos de dosis (ver sección Advertencias y precauciones).
Posología: La dosis debe ser individualizada según la respuesta clínica y ajustarse de acuerdo a las necesidades de insulina del paciente. La dosis de lixisenatida se incrementa o disminuye junto con la dosis de insulina glargina y depende también de la pluma (aplicador) utilizada.
Dosis de inicio: El tratamiento con insulina basal o agonistas del receptor del péptido 1 similar a glucagón (GLP-1), o hipoglucemiantes orales distintos de metformina e inhibidores SGLT-2, se deben suspender antes del inicio del tratamiento con SOLIQUA®.
La dosis de inicio de SOLIQUA® se basa en el tratamiento antidiabético anterior y se deben tener en cuenta la información de la siguiente tabla para no exceder la dosis de inicio recomendada para lixisenatida de 10 mcg:
|
Tratamiento anterior |
||||
|
Pacientes no tratados previamente con insulina (tratamiento con antidiabéticos orales o agonistas del receptor GLP-1) |
Insulina glargina (100 unidades/mL)** ≥ 20 a < 30 unidades |
Insulina glargina (100 unidades/mL)** ≥ 30 a ≤ 60 unidades |
||
|
Dosis de inicio y pluma (aplicador) |
Pluma (aplicador) de SOLIQUA® (10-40) |
10 pasos de dosis (10 unidades/5 mcg )* |
20 pasos de dosis (20 unidades/10 mcg) |
|
|
Pluma (aplicador) de SOLIQUA® (30-60) |
30 pasos de dosis (30 unidades/10 mcg)* |
|||
* Unidades de insulina glargina (100 unidades/mL)/mcg de lixisenatida.
** Si se utilizara una insulina basal diferente:
• Para insulina basal dos veces al día o insulina glargina (300 unidades/mL), la dosis total diaria anteriormente utilizada se reduciría un 20% al elegir la dosis de inicio de SOLIQUA®.
• Para cualquier otra insulina basal se deben aplicar las mismas reglas que para insulina glargina (100 unidades/mL).
La máxima dosis diaria es de 60 unidades de insulina glargina y 20 mcg de lixisenatida que corresponden a 60 pasos de dosis.
SOLIQUA® debe inyectarse una vez al día, dentro de la hora anterior a una comida. Es preferible administrar la inyección prandial antes de la misma comida cada día, cuando se halla elegido la comida más adecuada.
Ajuste de dosis: SOLIQUA® se debe dosificar de acuerdo con las necesidades de insulina individuales del paciente. Se recomienda optimizar el control glucémico mediante el ajuste de dosis de acuerdo al valor de la glucosa plasmática en ayunas (ver sección Propiedades farmacodinámicas). Se recomienda cuidadosa monitorización de la glucosa durante el cambio de dosis y en las siguientes semanas:
• Si el paciente comienza con la pluma (aplicador) de SOLIQUA® (10-40), la dosis puede ajustarse hasta 40 pasos de dosis con esta pluma (aplicador).
• Para dosis > 40 pasos de dosis/día, el ajuste debe continuar con la pluma (aplicador) de SOLIQUA® (30-60).
• Si el paciente comienza con la pluma (aplicador) de SOLIQUA® (30-60), la dosis puede ajustarse hasta 60 pasos de dosis con esta pluma (aplicador).
• Para dosis total diaria > 60 pasos de dosis/día, SOLIQUA® no se debe utilizar.
Los pacientes que ajustan la cantidad o el horario de administración deben realizarlo sólo bajo supervisión médica con una monitorización de glucosa adecuada (ver sección Advertencias y precauciones).
Poblaciones especiales:
Pacientes de edad avanzada (≥ 65 años): SOLIQUA® se puede utilizar en pacientes de edad avanzada. La dosis se debe ajustar de forma individual, de acuerdo a la monitorización glucémica. En pacientes de edad avanzada, el deterioro progresivo de la función renal puede producir una disminución constante de las necesidades de insulina. Para lixisenatida no es necesario ajustar la dosis en función de la edad. La experiencia terapéutica con SOLIQUA® en pacientes ≥ 75 años es limitada.
Insuficiencia renal: SOLIQUA® no está recomendado en pacientes con insuficiencia renal grave ni en la etapa terminal de la enfermedad renal, ya que no existe suficiente experiencia terapéutica sobre el uso de lixisenatida. No es necesario ajustar la dosis en pacientes con insuficiencia renal leve o moderada. En pacientes con insuficiencia renal, las necesidades de insulina se pueden reducir a causa de la disminución de su metabolismo.
En pacientes con insuficiencia renal de leve a moderada en tratamiento con SOLIQUA®, puede ser necesario realizar controles de glucosa y ajustes de dosis frecuentes.
Insuficiencia hepática: No es necesario ajustar la dosis en pacientes con insuficienciahepática (ver sección Propiedades farmacocinéticas). En pacientes con insuficiencia hepática, las necesidades de insulina se pueden reducir a causa de la disminución de la capacidad de gluconeogénesis y de la disminución del metabolismo de la insulina. En pacientes con insuficiencia hepática en tratamiento con SOLIQUA®, puede ser necesario realizar controles de glucosa y ajustes de dosis frecuentes.
Población pediátrica: No existe uso relevante de SOLIQUA® en la población pediátrica.
Forma de administración: SOLIQUA® se administra por vía subcutánea en el abdomen, deltoide o muslo.
Los lugares de inyección deben rotarse dentro de una misma área (abdomen, deltoide o muslo) de una inyección a otra para reducir el riesgo de lipodistrofia y amiloidosis cutánea (ver sección Advertencias y precauciones y Reacciones adversas).
Se debe instruir al paciente para utilizar siempre una aguja nueva. La reutilización de las agujas de las plumas (aplicador) de insulina incrementa el riesgo de bloqueo que puede dar lugar a sobre o infradosis. En el caso de bloqueo de la aguja, los pacientes deben seguir las instrucciones descritas en las Instrucciones de Uso que acompañan el prospecto (ver sección Precauciones especiales para la eliminación del medicamento).
SOLIQUA® no se debe pasar del cartucho de la pluma (aplicador) precargada a una jeringa para evitar errores de dosificación y posibles sobredosis (ver sección Advertencias y precauciones).
SOBREDOSIS Y TRATAMIENTO:
Puede aparecer hipoglucemia y reacciones adversas gastrointestinales si el paciente se trata con más dosis de SOLIQUA® de lo que necesita.
Los episodios leves de hipoglucemia se pueden tratar normalmente con carbohidratos por vía oral, pudiéndose requerir ajustes de la dosis del medicamento, de las pautas dietéticas o del ejercicio físico.
Los episodios hipoglucémicos más graves con coma, convulsiones o trastornos neurológicos se pueden tratar con glucagón intramuscular/subcutáneo o con solución glucosadaconcentrada por vía intravenosa. Puede ser necesario repetir la ingesta de carbohidratos y someter al paciente a observación porque la hipoglucemia puede reaparecer tras una aparente recuperación clínica.
En el caso de reacciones adversas gastrointestinales, debe iniciarse tratamiento de soporte apropiado en función de los signos y síntomas clínicos del paciente.
PRECAUCIONES ESPECIALES PARA LA ELIMINACIÓN DEL MEDICAMENTO:
Antes del primer uso, la pluma (aplicador) debe sacarse de la nevera y conservarse por debajo de 25 ºC durante 1 o 2 horas.
El cartucho se debe inspeccionar antes de usarlo. Sólo se debe utilizar si la solución es transparente, incolora, carece de partículas sólidas visibles y presenta una consistencia acuosa. SOLIQUA® no debe mezclarse con otra insulina o diluirse. La mezcla o dilución puede cambiar su tiempo/perfil de acción y la mezcla puede formar precipitados.
Se debe insertar siempre una aguja nueva antes de cada uso. Las agujas no deben reutilizarse. El paciente debe desechar la aguja después de cada inyección.
En el caso de bloqueo de las agujas los pacientes deben seguir las instrucciones descritas en las “Instrucciones de Uso” que acompañan al prospecto.
Las plumas (aplicadores) vacías nunca se deben reutilizar y se deben desechar de forma segura. Paraprevenir la posible transmisión de enfermedades, cada aplicador debe utilizarse exclusivamente por un solo paciente.
Se debe comprobar siempre la etiqueta de insulina antes de cada inyección para evitar errores de medicación entre SOLIQUA® y otros medicamentos antidiabéticos inyectables, incluyendo los dos aplicadores (plumas) diferentes de SOLIQUA® (ver sección Advertencias y precauciones).
Antes de utilizar SOLIQUA®, se deben leer cuidadosamente las instrucciones de uso incluidas en el prospecto.
REVISIÓN LOCAL:
Versión 2.0
Octubre de 2020.
NATURALEZA Y CONTENIDO DEL ENVASE:
Caja de cartón x 1, 3, 5 y 10 lapiceros (aplicadores) precargados conteniendo un cartucho de vidrio tipo I incoloro x 3 mL cada uno.
PRECAUCIONES ESPECIALES DE CONSERVACIÓN:
Mantener este medicamento fuera de la vista y del alcance de los niños. No administrar si observa el empaque dañado o deteriorado.
Conservar en refrigeración entre 2 °C y 8 °C, en su embalaje original a fin de protegerla de la luz. No congelar, ni colocar cerca del compartimento del congelador o de un acumulador de frío.
SOLIQUA® sólo se debe utilizar si la solución es clara, incolora, sin partículas visibles. SOLIQUA® no se debe mezclar con ninguna otra insulina ni diluir.
Después del primer uso: Almacenar lejos del calor o luz directa a temperatura no mayor a 30 °C, máximo por 14 días. No refrigerar. No congelar. No almacenar con la aguja puesta.
La tapa se debe poner de vuelta en la pluma (aplicador) después de cada inyección a fin de protegerla de la luz.
TIEMPO DE VIDA ÚTIL:
No administrar luego de la fecha de expira indicada en el envase.
REFERENCIA:
Agencia Europea de Medicamentos (EMA)-Resumen de las Características del Producto. SULIQUA. Fecha de última actualización 10/08/2020.
Disponible en: https://www.ema.europa.eu/en/documents/product-information/suliqua-epar- product-information_en.pdf.