
ULTIBRO BREEZHALER
BROMURO DE GLICOPIRRONIO, INDACATEROL
Polvo para inhalación
Inhalador , Cápsulas duras
DESCRIPCIÓN Y COMPOSICIÓN:
Forma farmacéutica: Polvo para inhalación en cápsulas duras de 110 µg de indacaterol y 50 µg de glicopirronio.
Cápsulas de polvo blanco o casi blanco compuestas de una parte superior de color amarillo transparente, en la que está impreso en tinta negra el logotipo de la empresa ( ), y de una parte inferior incolora transparente en el que está impreso el código IGP110.50 del producto en tinta azul bajo dos barras azules.
Sustancias farmacéuticas: Cada CÁPSULA contiene 143 µg de maleato de indacaterol (que equivalen a 110 µg de indacaterol) y 63 µg de bromuro de glicopirronio (que equivalen a 50 µg de glicopirronio).
La dosis administrada (es decir, la dosis que sale por la boquilla del inhalador) equivale a 85 µg de indacaterol y 43 µg de glicopirronio.
Principios activos: Indacaterol y glicopirronio.
Excipientes:
• Dentro de la cápsula: Lactosa monohidratada, estearato de magnesio.
• En la valva de la cápsula: Hipromelosa, agua purificada, carragenina, cloruro de potasio, tartrazina.
INDICACIONES: ULTIBRO™ BREEZHALER® está indicado como tratamiento broncodilatador de mantenimiento para el alivio de los síntomas en pacientes adultos con enfermedad pulmonar obstructiva crónica (EPOC).
CONTRAINDICACIONES: ULTIBRO™ BREEZHALER® está contraindicado en pacientes con hipersensibilidad a los principios activos o a cualquiera de los excipientes.
EMBARAZO, LACTANCIA Y FECUNDIDAD:
Embarazo: No se dispone de información acerca del uso de ULTIBRO™ BREEZHALER® en mujeres embarazadas.
Los estudios en animales no sugieren efectos perjudiciales directos ni indirectos en términos de toxicidad para la reproducción a una exposición clínicamente relevante.
El indacaterol puede inhibir el parto debido al efecto relajante sobre el músculo liso uterino. Por lo tanto, ULTIBRO™ BREEZHALER® debe utilizarse durante el embarazo únicamente si los beneficios esperados para la paciente justifican el potencial riesgo para el feto.
Lactancia: No se sabe si el indacaterol o el glicopirronio o sus metabolitos pasan a la leche materna. Los datos farmacocinéticos/toxicológicos disponibles muestran que indacaterol, glicopirronio y sus metabolitos se excretan en la leche de ratas lactantes. Así pues, ULTIBRO™ BREEZHALER® debe utilizarse durante la lactancia únicamente si los beneficios esperados para la mujer justifican el posible riesgo para el lactante (véase Datos de toxicidad preclínica).
Fecundidad: Los estudios de reproducción y otros datos en animales no indican ningún problema con respecto a la fertilidad en machos o hembras.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS: La influencia de este medicamento sobre la capacidad para conducir y utilizar máquinas es nula o insignificante. Sin embargo, la aparición de mareo puede influir sobre la capacidad para conducir y utilizar máquinas.
REACCIONES ADVERSAS: La presentación del perfil de seguridad de ULTIBRO™ BREEZHALER® se basa en la experiencia de uso del medicamento y de sus fármacos componentes.
Resumen del perfil de seguridad: La experiencia de seguridad con ULTIBRO™ BREEZHALER® comprende hasta 15 meses de exposición al medicamento administrado en la dosis terapéutica recomendada.
ULTIBRO™ BREEZHALER® mostró un perfil de reacciones adversas similar a los componentes individuales. Como contiene indacaterol y glicopirronio, se puede esperar en la combinación, el tipo y gravedad de las reacciones adversas asociadas con cada uno de estos componentes.
Los síntomas característicos del perfil de seguridad son los típicamente anticolinérgicos y betadrenérgicos que se relacionan con los fármacos componentes de la asociación. Otras reacciones adversas muy frecuentes relacionadas con el producto farmacéutico (descritas con una frecuencia ≥3% y con mayor asiduidad que con el placebo) fueron la tos y el dolor bucofaríngeo (que incluye la irritación de garganta).
Resumen tabulado de reacciones adversas: Se han ordenado por clase de órgano, aparato o sistema del MedDRA las reacciones adversas notificadas durante los seis primeros meses de dos ensayos clínicos fundamentales de fase III de 6 y 12 meses de duración, respectivamente (Tabla 1, base de datos de seguridad básica de 6 meses). Dentro de cada clase de órgano, aparato o sistema, las reacciones adversas se han ordenado por frecuencia registrada en el grupo de ULTIBRO™ BREEZHALER®, primero figura la más frecuente. En cada grupo de frecuencia, las reacciones se especifican por orden decreciente de gravedad. También se indica la categoría de frecuencia de cada reacción adversa aplicando la siguiente convención (CIOMS III): muy frecuentes (≥1/10); frecuentes (≥1/100, <1/10); infrecuentes (≥1/1000, <1/100); raras (≥1/10 000, <1/1000); muy raras (<1/10 000), incluidas las notificaciones aisladas.
|
Tabla 1 Reacciones adversas notificadas en la base de datos central de seguridad de 6 meses |
|
|
REACCIONES ADVERSAS |
CATEGORÍA DE FRECUENCIA |
|
Infecciones e infestaciones |
|
|
Infección de las vías respiratorias altas2 |
Muy frecuente |
|
Rinofaringitis2 |
Frecuente |
|
Infección de las vías urinarias2 |
Frecuente |
|
Sinusitis2 |
Frecuente |
|
Rinitis2 |
Frecuente |
|
Trastornos del sistema inmunitario |
|
|
Hipersensibilidad2 |
Infrecuente |
|
Trastornos del metabolismo y de la nutrición |
|
|
Diabetes mellitus e hiperglucemia2 |
Infrecuente |
|
Trastornos psiquiátricos |
|
|
Insomnio2 |
Infrecuente |
|
Trastornos del sistema nervioso |
|
|
Mareos2 |
Frecuente |
|
Cefalea2 |
Frecuente |
|
Parestesia2 |
Infrecuente |
|
Trastornos oculares |
|
|
Glaucoma1 |
Infrecuente |
|
Trastornos cardíacos |
|
|
Cardiopatía isquémica2 |
Infrecuente |
|
Fibrilación auricular2 |
Infrecuente |
|
Taquicardia2 |
Infrecuente |
|
Palpitaciones2 |
Infrecuente |
|
Trastornos respiratorios, torácicos y del mediastino |
|
|
Tos2 |
Frecuente |
|
Dolor bucofaríngeo, incluida la irritación de garganta2 |
Frecuente |
|
Broncoespasmo paradójico3 |
Infrecuente |
|
Epistaxis2 |
Infrecuente |
|
Trastornos gastrointestinales |
|
|
Dispepsia2 |
Frecuente |
|
Caries dentales2 |
Frecuente |
|
Gastroenteritis3 |
Frecuente |
|
Sequedad bucal2 |
Infrecuente |
|
Trastornos de la piel y del tejido subcutáneo |
|
|
Prurito o exantema2 |
Infrecuente |
|
Trastornos del aparato locomotor y del tejido conjuntivo |
|
|
Dolor músculoesquelético2 |
Frecuente |
|
Espasmo muscular2 |
Infrecuente |
|
Mialgia2 |
Infrecuente |
|
Dolor en las extremidades3 |
Infrecuente |
|
Trastornos renales y urinarios |
|
|
Obstrucción vesical y retención urinaria2 |
Infrecuente |
|
Trastornos generales y en el lugar de la administración |
|
|
Fiebre (pirexia)1 |
Frecuente |
|
Dolor de pecho2 |
Frecuente |
|
Edema periférico2 |
Infrecuente |
|
Cansancio2 |
Infrecuente |
|
1 Reacción adversa observada con ULTIBRO™ BREEZHALER®, pero no con los componentes individuales. 2 Reacción adversa observada con ULTIBRO™ BREEZHALER® y, al menos, con uno de los componentes individuales. 3 Reacción adversa observada, al menos, con uno de los componentes individuales, pero no con ULTIBRO™ BREEZHALER®; categoría de frecuencia de acuerdo con la sección del Resumen de las Características del producto de los componentes individuales. |
|
Descripción de reacciones adversas específicas: La tos se observó de forma frecuente, pero por lo general era de intensidad leve.
Notificación de sospechas de reacciones adversas: Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización.
Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento.
INTERACCIONES CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN:
La administración simultánea de indacaterol y glicopirronio por vía inhalatoria oral no afectó la farmacocinética individual de cada fármaco en el estado estacionario.
No se han realizado estudios de interacción específicos con ULTIBRO™ BREEZHALER®. La información sobre las posibles interacciones de UL TIBRO™ BREEZHALER®se basa en el potencial de interacción de los dos fármacos que lo componen.
Uso concomitante no recomendado.
Bloqueantes adrenérgicos ß: Los bloqueantes adrenérgicos ß pueden paliar o antagonizar los efectos de los agonistas adrenérgicos ß2.
Por consiguiente, ULTIBRO™ BREEZHALER® no debe administrarse junto con bloqueantes adrenérgicos ß (incluidos los colirios), a menos que su uso sea absolutamente indispensable.
En caso de necesidad, se debe dar preferencia a los bloqueantes adrenérgicos ß cardioselectivos, aunque éstos deben administrarse con precaución.
Anticolinérgicos: No se ha estudiado la administración concomitante de ULTIBRO™ BREEZHALER® con otros medicamentos conteniendo anticolinérgicos y por lo tanto, no está recomendada.
Simpaticomiméticos: La administración concurrente de otros simpaticomiméticos (solos o en asociación) puede potenciar los efectos no deseados del indacaterol (véase Advertencias y precauciones).
Precaución necesaria con el uso concomitante:
• Tratamiento hipocaliémico: El tratamiento simultáneo con derivados de la metilxantina, corticoides o diuréticos no ahorradores de potasio puede potenciar el posible efecto hipopotasémico de los agonistas adrenérgicos ß2, por lo tanto se debe utilizar con precaución. (véase Advertencias y precauciones).
Para tener en cuenta con el uso concomitante:
• Interacciones asociadas al metabolismo y a transportadores: La inhibición de los agentes principales del metabolismo de indacaterol, CYP3A4 y la glucoproteína P (P-gp) aumenta hasta dos veces la exposición sistémica del fármaco. La magnitud de la exposición aumenta debido a las interacciones, si bien no afecta a la seguridad de acuerdo con la experiencia adquirida con el tratamiento con indacaterol en los ensayos clínicos de hasta un año de duración y utilizando dosis de hasta el doble de la dosis máxima recomendada de indacaterol.
• Cimetidina u otros inhibidores del transporte de cationes orgánicos: En un estudio clínico efectuado en voluntarios sanos, la cimetidina, un inhibidor del transporte de cationes orgánicos que contribuye supuestamente a la eliminación renal del glicopirronio, aumentó la exposición total (AUC) al glicopirronio en un 22% y redujo la depuración renal en un 23%. A juzgar por la magnitud de estas variaciones, no cabe esperar que se produzcan interacciones farmacológicas de interés clínico cuando se administra glicopirronio junto con cimetidina u otros inhibidores del transporte de cationes orgánicos.
ESTUDIOS CLÍNICOS: El programa de estudios clínicos de fase III de ULTIBRO™ BREEZHALER® comprendió cinco estudios en los que participaron más de 5.000 pacientes: 1)un ensayo de 26 semanas de duración comparativo con placebo y con los tratamientos activos (indacaterol una vez al día, glicopirronio una vez al día y tiotropio en régimen abierto una vez al día); 2)un ensayo de 26 semanas de duración controlado con el tratamiento activo (fluticasona-salmeterol dos veces al día); 3)un ensayo de 64 semanas controlado con tratamiento activo glicopirronio una vez al día, tiotropio en régimen abierto una vez al día, 4)un ensayo de 52 semanas de duración comparativo con placebo) y 5)un estudio de tolerancia al ejercicio de 3 semanas de duración comparativo con placebo y con un tratamiento activo (tiotropio una vez al día).
En cuatro de estos estudios se reclutaron pacientes que presentaban un diagnóstico clínico de EPOC de moderada a grave. En el ensayo de 64 semanas se reclutaron pacientes que presentaban EPOC de grave a muy grave
Efectos sobre la función pulmonar: ULTIBRO™ BREEZHALER® produjo mejoras clínicamente importantes en la función pulmonar (medida a través del volumen espiratorio máximo en un segundo, FEV1) en varios estudios clínicos.
En los estudios de fase III, los efectos broncodilatadores se observaron en un plazo de 5 minutos después de la administración de la primera dosis y se mantuvieron desde la primera dosis hasta el fin del intervalo de administración de 24 horas. No hubo atenuación del efecto broncodilatador con el transcurso del tiempo.
La magnitud del efecto fue dependiente del grado de reversibilidad de la limitación al flujo de aire basal (analizado por la administración de un broncodilatador antagonista muscarínico de corta duración y un broncodilatador agonista beta2 de corta duración): Los pacientes con el grado más bajo de reversibilidad basal (<5%) generalmente presentaron una respuesta broncodilatadora inferior que los pacientes con un grado de reversibilidad basal superior (≥5%). A las 26 semanas (variable principal), ULTIBRO™ BREEZHALER® aumentó el FEV1 valle en 80 ml en pacientes (ULTIBRO™ BREEZHALER® n=82; placebo n=42) con el grado más bajo de reversibilidad (<5%) (p=0,053) y en 220 ml en aquellos pacientes (ULTIBRO™ BREEZHALER® n=392, placebo n=190) con un grado de reversibilidad basal superior (≥5%) comparado con placebo (p<0,001).
ULTIBRO™ BREEZHALER® aumentó el FEV1 mínimo después de la administración en 200 ml en comparación con el placebo al cabo de 26 semanas (p<0,001) y produjo aumentos significativos en comparación con los respectivos monofármacos (indacaterol y glicopirronio) así como, con el brazo de tratamiento de tiotropio (véase la Tabla 2).
|
Tabla 2. FEV1 mínimo después de la administración (media minimocuadrática) al día 1 y la semana 26 (criterio principal de valoración) |
||
|
Diferencia entre |
Día 1 |
Semana 26 |
|
ULTIBRO™ BREEZHALER® - placebo |
190 ml (p<0,001) |
200 ml (p<0,001) |
|
ULTIBRO™ BREEZHALER® - indacaterol |
80 ml (p<0,001) |
70 ml (p<0,001) |
|
ULTIBRO™ BREEZHALER® - glicopirronio |
80 ml (p<0,001) |
90 ml (p<0,001) |
|
ULTIBRO™ BREEZHALER® - tiotropio |
80 ml (p<0,001) |
80 ml (p<0,001) |
El FEV1 medio antes de la administración (promedio de valores determinados 45 y 15 minutos antes de administrar la dosis matinal del fármaco en estudio) fue clínicamente importante y estadísticamente significativo a favor de ULTIBRO™ BREEZHALER® a la semana 26 en comparación con la asociación de fluticasona-salmeterol (100 ml, p<0,001), a la semana 52 en comparación con el placebo (189 ml, p<0,001) y en todas las visitas efectuadas hasta la semana 64 en comparación con el glicopirronio (70-80 ml, p<0,001) y el tiotropio (60-80 ml, p<0,001). A la semana 26, ULTIBRO™ BREEZHALER® produjo mejoras estadísticamente significativas del FEV1 máximo comparado con placebo en las primeras 4 horas después de la dosis (330 ml) (p<0,001).
AUC del FEV1: ULTIBRO™ BREEZHALER® aumentó el área bajo la curva (AUC0-12) del FEV1 (criterio de valoración principal) en 140 ml al cabo de 26 semanas (p<0,001) en el estudio comparativo con fluticasona-salmeterol.
Criterios sintomáticos:
Disnea: ULTIBRO™ BREEZHALER® redujo significativamente la disnea a juzgar por el Índice Transicional de Disnea (ITD) y produjo una mejora clínicamente importante y estadísticamente significativa de la puntuación focal del ITD a la semana 26 en comparación con el placebo (1,09, p<0,001), el tiotropio (0,51, p=0,007) y la fluticasona-salmeterol (0,76, p=0,003). Las mejoras en comparación con indacaterol y glicopirronio fueron de 0,26 y 0,21 respectivamente.
Un porcentaje significativamente mayor de pacientes tratados con ULTIBRO™ BREEZHALER® respondieron con mejoras de 1 o más puntos en el índice focal del ITD a la semana 26 en comparación con el placebo (68,1% y 57,5% respectivamente, p=0,004). Un porcentaje mayor de pacientes del grupo de ULTIBRO™ BREEZHALER® presentó respuestas clínicamente importantes a la semana 26 en comparación con el tiotropio (68,1% con ULTIBRO™ BREEZHALER® versus 59,2% con el tiotropio, p=0,016) y con la fluticasona-salmeterol (65,1% con ULTIBRO™ BREEZHALER® versus 55,5% con la fluticasona-salmeterol, p=0,088).
Calidad de vida relacionada con la salud: ULTIBRO™ BREEZHALER® administrado una vez al día también produjo un efecto estadísticamente significativo en la calidad de vida relacionada con la salud valorada a través del Cuestionario de salud respiratoria del St George"s Hospital [SGRQ] a la semana 26, a juzgar por la reducción de la puntuación total del SGRQ en comparación con el placebo (-3,01, p=0,002) y el tiotropio (-2,13, p=0,009), así como a la semana 64 en comparación con el tiotropio (-2,69, p<0,001).
Un mayor porcentaje de pacientes que recibieron ULTIBRO™ BREEZHALER® respondieron con una mejora clínicamente importante en la puntuación del SGRQ (definida como una disminución de al menos 4 unidades con respecto al valor inicial) a la semana 26 en comparación con el placebo (63,7% y 56,6%, respectivamente, p=0,088) y con el tiotropio (63,7% con ULTIBRO™ BREEZHALER® y 56,4% con el tiotropio, p=0,047) y a la semana 64 en comparación con el glicopirronio y con el tiotropio (57,3% con ULTIBRO™ BREEZHALER® frente al 51,8% con el glicopirronio, p=0,055, y frente al 50,8% con el tiotropio, p=0,051, respectivamente).
Actividades cotidianas: ULTIBRO™ BREEZHALER® produjo una mejora estadísticamente superior con respecto al tiotropio en el porcentaje de «días en que el paciente se sentía capaz de llevar a cabo las actividades cotidianas habituales» en el período de 26 semanas (8,45%, p<0,001). A la semana 64, ULTIBRO™ BREEZHALER® mostró mejora numérica con respecto al glicopirronio (1,95%; p=0,175) y una mejora estadística con respecto al tiotropio (4,96%; p=0,001).
Exacerbaciones de la EPOC: A las 64 semanas que comparaba ULTIBRO™ BREEZHALER® (n=729), glicopirronio (n=739) y tiotropio (n=737), ULTIBRO™ BREEZHALER® redujo la tasa anualizada de exacerbaciones moderadas o graves de la EPOC en un 12% en comparación con el glicopirronio (p=0,038) y en un 10% en comparación con el tiotropio (p=0,096).
El número de exacerbaciones moderadas o graves de la EPOC/paciente-años fue de 0,94 para ULTIBRO™ BREEZHALER® (812 eventos), 1,07 para glicopirronio (900 eventos) y 1,06 para tiotropio (898 eventos).
ULTIBRO™ BREEZHALER® demostró ser clínica y estadísticamente superior al glicopirronio y el tiotropio a la hora de reducir el porcentaje de cualquier exacerbación de la EPOC (leve, moderada o grave): la reducción porcentual fue del 15% en comparación con el glicopirronio (p=0,001) y del 14% en comparación con el tiotropio (p=0,002).
El número de todas las exacerbaciones de la EPOC/paciente-años fue de 3,34 para ULTIBRO™ BREEZHALER® (2.893 eventos), 3,92 para glicopirronio (3.294 eventos) y 3,89 para tiotropio (3.301 eventos).
En un ensayo de 26 semanas que comparaba ULTIBRO™ BREEZHALER® (n=258) y fluticasona/salmeterol (n=264), el número de exacerbaciones moderadas o graves de la EPOC/paciente-años fue de 0,15 versus 0,18 (18 eventos versus 22 eventos), respectivamente (p=0,512), y el número de todas las exacerbaciones de la EPOC/paciente-años (leve, moderada o grave) fue de 0,72 versus 0,94 (86 eventos versus 113 eventos), respectivamente (p=0,098).
Uso de medicamentos de rescate: Durante 26 semanas, ULTIBRO™ BREEZHALER® administrado una vez al día redujo significativamente el uso de medicamentos de rescate (salbutamol): en 0,96 inhalaciones por día (p<0,001) en comparación con el placebo y 0,54 inhalaciones por día (p<0,001) en comparación con el tiotropio y en 0,39 inhalaciones por día (p=0,019) en comparación con la fluticasonasalmeterol.
Durante 64 semanas, esta reducción fue de 0,76 inhalaciones por día (p<0,001) en comparación con el tiotropio .
Tolerancia al ejercicio: ULTIBRO™ BREEZHALER® (administrado por la mañana) redujo la hiperinsuflación dinámica y prolongó el tiempo de esfuerzo sostenido desde la primera dosis en adelante. Durante el primer día de tratamiento, la capacidad inspiratoria en ejercicio mejoró sensiblemente (250 ml, p<0,001) en comparación con el placebo. Al cabo de tres semanas de tratamiento, ULTIBRO™ BREEZHALER® mejoró más la capacidad inspiratoria (320 ml, p<0,001) y aumentó el tiempo de resistencia al ejercicio (59,5 segundos, p=0,006) que el placebo. Población pediátrica La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con ULTIBRO™ BREEZHALER® en los diferentes grupos de la población pediátrica en enfermedad pulmonar obstructiva crónica (EPOC).
DATOS PRECLÍNICOS SOBRE SEGURIDAD:
Información relacionada con ULTIBRO™ BREEZHALER®: El programa de toxicología comparada efectuado con ULTIBRO™ BREEZHALER® comprendió evaluaciones de la seguridad farmacológica in vitro e in vivo, estudios de toxicidad por vía inhalatoria a dosis repetidas en ratas y perros y un estudio de desarrollo embriofetal por vía inhalatoria en ratas.
Se observó un aumento aparente de la frecuencia cardíaca en perros a todas las dosis de ULTIBRO™ BREEZHALER® y a cada componente en monoterapia. Los efectos de ULTIBRO™ BREEZHALER® sobre la frecuencia cardíaca eran de mayor magnitud y duración que los observados con cada monofármaco por separado, lo cual es indicativo de una respuesta aditiva. También fue aparente el acortamiento de los intervalos electrocardiográficos y la disminución de la presión sanguínea sistólica y diastólica. La administración de indacaterol a perros, solo o como parte de ULTIBRO™ BREEZHALER®, se asoció con una incidencia y gravedad similar de lesiones en el miocardio. Las exposiciones sistémicas (AUC) al nivel sin efecto adverso observable (NOAEL) para las lesiones en el miocardio fueron 64 y 59 veces mayores que las observadas en humanos, para cada componente respectivamente.
No se observaron efectos sobre el embrión o el feto a ningún nivel de dosis de ULTIBRO™ BREEZHALER® durante un estudio de desarrollo embriofetal en ratas. Las exposiciones sistémicas (AUC) al nivel sin efecto adverso observable (NOAEL) fueron 79 y 126 veces mayores que en humanos, para indacaterol y glicopirronio respectivamente.
Información relacionada con el indacaterol: Los efectos sobre el sistema cardiovascular atribuibles a las propiedades agonistas beta2 de indacaterol incluyeron taquicardia, arritmias y lesiones miocárdicas en perros. En roedores se observó una leve irritación de las fosas nasales y laringe. Todos estos hallazgos se observaron con exposiciones suficientemente superiores a las esperadas en humanos.
Aunque el indacaterol no afectó a la capacidad reproductora general en un estudio de fertilidad en ratas, se observó un descenso en el número de descendientes de la progenie F1 en un estudio peri y post-desarrollo a una exposición 14 veces más elevada que en humanos tratados con indacaterol. Indacaterol y sus metabolitos se transfirieron rápidamente a la leche de ratas lactantes. Indacaterol no fue embriotóxico o teratogénico en ratas o conejos.
Los estudios de genotoxicidad no revelaron ningún poder mutagénico o clastógenico. Se evaluó la carcinogenicidad en un estudio de dos años en ratas y en un estudio transgénico de seis meses en ratones. El aumento de la incidencia de leiomiomas de ovarios benignos e hiperplasia focal del músculo liso de ovarios en ratas fue consistente con hallazgos similares observados con otros agonistas beta2-adrenérgicos. No se observó evidencia de carcinogenicidad en ratones. En estos estudios, las exposiciones sistémicas (AUC) en ratas y ratones a niveles de efecto adverso no observable fueron como mínimo 7 y 49 veces superiores, respectivamente, a las observadas en humanos tratados con indacaterol una vez al día a la dosis máxima terapéutica recomendada.
Información relacionada con el glicopirronio: Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas, genotoxicidad, potencial carcinogénico, toxicidad para la reproducción y el desarrollo.
Los efectos atribuibles a las propiedades antagonistas del receptor muscarínico del bromuro de glicopirronio incluyeron aumentos leves a moderados de la frecuencia cardíaca en los perros, opacidad del cristalino en ratas y, cambios reversibles asociados con secreciones glandulares reducidas en ratas y perros. Se observó irritación leve o cambios adaptativos en el tracto respiratorio en las ratas. Todos estos hallazgos se produjeron con exposiciones consideradas superiores a la esperada en humanos.
El glicopirronio no fue teratogénico en ratas o conejos tras la administración por inhalación.
La fertilidad y desarrollo pre y postnatal no se vieron afectados en ratas. El bromuro de glicopirronio y sus metabolitos no cruzaron significativamente la barrera placentaria en ratones, conejos y perros preñados. El bromuro de glicopirronio (incluidos sus metabolitos) se excretó en la leche de ratas lactantes y alcanzó concentraciones hasta 10 veces más elevadas en la leche que en la sangre de las progenitoras.
Los estudios de genotoxicidad no mostraron ningún efecto mutagénico o clastogénico para el bromuro de glicopirronio. Los estudios de carcinogenicidad realizados en ratones transgénicos por vía oral y en ratas por vía inhalatoria no revelaron indicios de carcinogenicidad a exposiciones sistémicas (AUC) de aproximadamente 53 veces más elevadas en ratones y de 75 veces más elevadas en ratas que la dosis máxima recomendada una vez al día para humanos.
ADVERTENCIAS Y PRECAUCIONES: ULTIBRO™ BREEZHALER® no debe administrarse con productos que contienen otros agonistas adrenérgicos ß de acción prolongada o antagonistas muscarínicos de acción prolongada, que son las clases farmacológicas a las que pertenecen los principios activos de ULTIBRO™ BREEZHALER® (véase Interacciones).
Asma: ULTIBRO™ BREEZHALER® no debe utilizarse para el tratamiento del asma, pues no se tienen datos en esta indicación.
Los agonistas adrenérgicos ß2 de acción prolongada pueden aumentar el riesgo de que ocurran acontecimientos adversos graves relacionados con el asma, incluso decesos de origen asmático, cuando se utilizan para el tratamiento del asma.
No debe utilizarse contra episodios agudos: ULTIBRO™ BREEZHALER® no está indicado para el tratamiento de los episodios agudos de broncoespasmo.
Hipersensibilidad relacionada con el indacaterol: Se han notificado reacciones de hipersensibilidad inmediatamente después de la administración de indacaterol, que es uno de los fármacos componentes de ULTIBRO™ BREEZHALER®. Si se manifiestan signos indicativos de reacciones alérgicas (especialmente dificultad para respirar o ingerir, hinchazón de lengua, labios y rostro, urticaria o erupción cutánea), se debe retirar de inmediato ULTIBRO™ BREEZHALER® e instituir un tratamiento alternativo.
Broncoespasmo paradójico: No se ha observado broncoespasmo paradójico en los ensayos clínicos realizados con ULTIBRO™ BREEZHALER®. Sin embargo, la administración de ULTIBRO™ BREEZHALER® puede provocar un broncoespasmo paradójico que puede llegar a ser potencialmente mortal. En caso de broncoespasmo paradójico, se debe retirar de inmediato ULTIBRO™ BREEZHALER® e instituir un tratamiento alternativo.
Efectos anticolinérgicos vinculados al glicopirronio:
• Glaucoma de ángulo estrecho: No se dispone de datos en pacientes con glaucoma de ángulo estrecho, por lo tanto ULTIBRO™ BREEZHALER® debe utilizarse con cautela en estos pacientes.
• Se debe asesorar a los pacientes sobre los signos y síntomas de dicho glaucoma de ángulo estrecho agudo y hay que pedirles que dejen de utilizar ULTIBRO™ BREEZHALER® cuando aparezcan tales signos o síntomas.
• Retención urinaria: No se dispone de datos en pacientes con retención urinaria, por lo tanto, ULTIBRO™ BREEZHALER® se debe utilizar con precaución en estos pacientes.
Pacientes con disfunción renal grave: En pacientes con insuficiencia renal de leve a moderada se observó un aumento promedio moderado en la exposición sistémica total (AUClast) a glicopirronio de hasta 1,4 veces y de hasta 2,2 veces en pacientes con insuficiencia renal grave y enfermedad renal terminal. En los pacientes con disfunción renal grave (filtración glomerular estimada inferior a 30 ml/min/1,73 m2) incluyendo los de enfermedad renal terminal, que necesitan diálisis, ULTIBRO™ BREEZHALER® sólo se debe utilizar si los beneficios previstos justifican los riesgos potenciales (véase Farmacología clínica). Es necesario vigilar de cerca la posible aparición de reacciones adversas en dichos pacientes.
Efectos cardiovasculares: ULTIBRO™ BREEZHALER® debe utilizarse con precaución en pacientes con trastornos cardiovasculares (insuficiencia coronaria, infarto agudo de miocardio, arritmias cardiacas, hipertensión). Los agonistas adrenérgicos ß2 pueden provocar un efecto cardiovascular clínicamente significativo en algunos pacientes, a juzgar por los aumentos de la frecuencia del pulso, la tensión arterial o los síntomas. Ante tales manifestaciones, podría ser necesario interrumpir el tratamiento. Además, los agonistas adrenérgicos ß pueden producir alteraciones del ECG, como el aplanamiento de la onda T, la prolongación del intervalo QT y la depresión del segmento ST, si bien se desconoce el significado clínico de tales anomalías. Por lo tanto, los agonistas beta2-adrenérgicos de larga duración se deben utilizar con precaución en pacientes con conocimiento o sospecha de prolongación del intervalo QT o tratados con medicamentos que afectan al intervalo QT.
Los pacientes con cardiopatía isquémica inestable, insuficiencia ventricular izquierda, antecedentes de infarto de miocardio, arritmia (excluyendo fibrilación atrial estable crónica), antecedentes de síndrome de QT largo o aquellos con prolongación del intervalo QTc (>450 ms) (método Fridericia), se excluyeron de los ensayos clínicos, y por lo tanto, no se dispone de experiencia en este grupo de pacientes. ULTIBRO™ BREEZHALER® debe utilizarse con precaución en este grupo de pacientes.
Hipocaliemia: Los agonistas adrenérgicos ß2 pueden producir una hipocaliemia significativa capaz de provocar efectos adversos cardiovasculares. La disminución del potasio sérico suele ser transitoria y no requiere suplementos. En los pacientes con enfermedad pulmonar obstructiva crónica (EPOC) grave, la hipocaliemia puede verse potenciada por la hipoxia y el tratamiento concomitante (véase Interacciones), lo cual puede aumentar la susceptibilidad a las arritmias cardíacas.
En los estudios clínicos en los que ULTIBRO™ BREEZHALER® se administró en la dosis terapéutica recomendada no se ha observado que la hipocaliemia produzca efectos clínicamente importantes (véase Farmacología clínica).
Hiperglucemia: La inhalación de dosis elevadas de agonistas adrenérgicos ß2 puede aumentar la glucosa plasmática. Tras el inicio del tratamiento con ULTIBRO™ BREEZHALER® es necesaria una vigilancia más estrecha de la glucemia en los pacientes diabéticos.
En los estudios clínicos, la mayoría de los pacientes tratados con ULTIBRO™ BREEZHALER® experimentaron alteraciones clínicamente considerables de la glucemia (4,1%) a la dosis recomendada comparado con placebo (2,3%). ULTIBRO™ BREEZHALER® no ha sido investigado en pacientes con diabetes mellitus no controlada.
• Alteraciones generales: ULTIBRO™ BREEZHALER® se debe utilizar con precaución en pacientes con trastornos convulsivos o tirotoxicosis, y en pacientes que responden de forma inusual a los agonistas beta2- adrenérgicos.
• Excipientes: Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp o problemas de absorción de glucosa o galactosa no deben tomar este medicamento.
POSOLOGÍA Y ADMINISTRACIÓN:
Posología: La dosis recomendada de ULTIBRO™ BREEZHALER® es la inhalación diaria del contenido de una cápsula de 110/50 µg usando el inhalador de ULTIBRO™ BREEZHALER®.
Se recomienda que ULTIBRO™ BREEZHALER® se administre a la misma hora cada día. Si se olvida una dosis, se debe administrar tan pronto como sea posible en el mismo día. Se debe indicar a los pacientes que no se administren más de una dosis al día.
Poblaciones especiales:
• Disfunción renal: ULTIBRO™ BREEZHALER® puede administrarse en la dosis recomendada a pacientes con disfunción renal leve a moderada. En los pacientes con disfunción renal grave o con nefropatía terminal que necesitan diálisis sólo puede administrarse en la dosis recomendada si los beneficios previstos justifican los posibles riesgos. Véanse Advertencias y precauciones y Farmacología clínica.
• Disfunción hepática: ULTIBRO™ BREEZHALER® puede administrarse en la dosis recomendada a pacientes con disfunción hepática leve a moderada. No se dispone de datos en pacientes con disfunción hepática grave, por lo tanto se debe tener precaución en estos pacientes. Véase Farmacología clínica.
• Pacientes pediátricos: No existe una recomendación de uso específica para ULTIBRO™ BREEZHALER® en la población pediátrica (menores de 18 años) para la indicación de EPOC. No se ha establecido la seguridad y eficacia de ULTIBRO™ BREEZHALER® en niños. No se dispone de datos.
• Pacientes geriátricos: ULTIBRO™ BREEZHALER® puede administrarse en la dosis recomendada a los pacientes mayores de 75 años de edad.
Modo de administración: Las cápsulas de ULTIBRO™ BREEZHALER® sólo deben administrarse por vía inhalatoria oral, usando únicamente el inhalador de ULTIBRO™ BREEZHALER®. No deben ingerirse las cápsulas (véase Sobredosis).
Al prescribir ULTIBRO™ BREEZHALER®, se debe enseñar a los pacientes a utilizar correctamente el inhalador. Cuando no se observe una mejoría en la respiración, hay que preguntar al paciente si ha ingerido el medicamento en vez de inhalarlo.
Las cápsulas de ULTIBRO™ BREEZHALER® deben conservarse siempre dentro de los blísteres para protegerlas de la humedad y sólo deben extraerse INMEDIATAMENTE ANTES DE USARLAS (véase Conservación).
INSTRUCCIONES DE USO Y MANIPULACIÓN:
Envase de ULTIBRO™ BREEZHALER®: Un envase de ULTIBRO™ BREEZHALER® contiene:
• Un inhalador de ULTIBRO™ BREEZHALER®.
• Uno o más blísteres que contienen las cápsulas de ULTIBRO™ BREEZHALER® que se introducen en el inhalador.
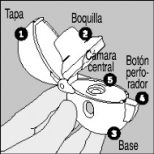
Utilice únicamente el inhalador de ULTIBRO™ BREEZHALER® incluido en este envase. No utilice las cápsulas de ULTIBRO™ BREEZHALER® con otro inhalador, ni use el inhalador de ULTIBRO™ BREEZHALER® para tomar otros medicamentos en cápsulas.
No presione la cápsula a través de la lámina para extraerla del blíster.
Deseche el inhalador después de 30 días de uso. Pregunte al farmacéutico cómo desechar los medicamentos y los inhaladores que ya no necesita.
No ingiera las cápsulas de ULTIBRO™ BREEZHALER®. El polvo de las cápsulas debe inhalarse.
Cómo utilizar el inhalador:
|
|
Retire el capuchón protector. |
|
|
Abra el inhalador: Sujete firmemente la base del inhalador e incline la boquilla para abrirlo. |
|
|
Prepare la cápsula: Separe uno de los blísteres de la tira por la línea de perforación. Despegue la lámina protectora del blíster para exponer la cápsula. No presione la cápsula a través de la lámina. |
|
|
Extraiga la cápsula: Las cápsulas deben conservarse siempre dentro de los blísteres y deben retirarse sólo antes de utilizarlas. Con las manos secas, extraiga la cápsula del blíster. No ingiera la cápsula. |
|
|
Inserte la cápsula: Coloque la cápsula en la cámara del inhalador. No coloque nunca la cápsula directamente en la boquilla. |
|
|
Cierre el inhalador: Cierre por completo el inhalador. Deberá oír un «clic» en el momento en que se cierra totalmente. |
|
|
Perfore la cápsula: Sujete el inhalador en posición vertical con la boquilla hacia arriba. Presione firmemente ambos botones pulsadores a la vez. Deberá oír un «clic» en el momento en que se perfora la cápsula. No presione más de una vez los botones pulsadores. |
|
|
Suelte del todo los botones pulsadores. |
|
|
Espire (expulse el aire): Antes de introducir la boquilla en la boca, espire (expulse el aire) profundamente. No sople nunca dentro de la boquilla. |
|
|
Inhale el medicamento: Antes de inspirar (tomar aire): • Sujete el inhalador de modo que los botones pulsadores queden situados a la derecha y a la izquierda (no arriba y abajo). • Introduzca la boquilla en la boca y cierre los labios en torno a ella. • Inspire (tome aire) de forma rápida y constante, y tan profundamente como pueda. No presione los botones pulsadores. |
|
|
Nota: Cuando inspire a través del inhalador, la cápsula girará en la cámara y usted deberá oír un zumbido. Notará un gusto dulzón a medida que el medicamento penetra en los pulmones. Si no oye un zumbido, puede que la cápsula esté atascada en el compartimento. Si es así, abra el inhalador y libérela con cuidado dando golpecitos en la base del aparato. No intente liberar la cápsula presionando los botones pulsadores. En caso necesario, repita los pasos 9 y 10. |
|
|
Contenga la respiración: Contenga la respiración todo lo posible (por lo menos 5-10 segundos), al tiempo que extrae el inhalador de la boca. Seguidamente espire (expulse el aire). Abra el inhalador para comprobar si queda polvo en la cápsula. Si queda, cierre el inhalador y repita los pasos 9 a 12. La mayoría de las personas son capaces de vaciar la cápsula en una o dos inhalaciones. Algunas personas a veces tosen brevemente inmediatamente después de inhalar el medicamento. Si tal es su caso, no se preocupe: si la cápsula está vacía, es que ha recibido la dosis completa. |
|
|
Extraiga la cápsula: Cuando haya terminado de inhalar su dosis diaria de ULTIBRO™ BREEZHALER®, abra de nuevo la boquilla, incline el inhalador para que salga la cápsula vacía y deseche ésta. Cierre el inhalador y coloque de nuevo el capuchón. No conserve las cápsulas en el inhalador de ULTIBRO™ BREEZHALER®. |
Recuerde:
• No ingiera las cápsulas de ULTIBRO™ BREEZHALER®.
• Utilice únicamente el inhalador de ULTIBRO™ BREEZHALER® contenido en este envase.
• Las cápsulas de ULTIBRO™ BREEZHALER® deben conservarse siempre dentro de los blísteres y deben retirarse sólo antes de utilizarlas.
• No coloque nunca una cápsula directamente en la boquilla del inhalador de ULTIBRO™ BREEZHALER®.
• No presione más de una vez los botones pulsadores.
• No sople nunca dentro de la boquilla del inhalador de ULTIBRO™ BREEZHALER®.
• Suelte siempre los botones pulsadores antes de inhalar.
• No lave nunca con agua el inhalador de ULTIBRO™ BREEZHALER®. Manténgalo seco. Véase más adelante «Cómo limpiar el inhalador».
• No desmonte nunca el inhalador de ULTIBRO™ BREEZHALER®.
• Utilice siempre el inhalador de ULTIBRO™ BREEZHALER® nuevo incluido en cada caja nueva del medicamento ULTIBRO™ BREEZHALER®.
• No conserve las cápsulas en el inhalador de ULTIBRO™ BREEZHALER®.
• Mantenga siempre el inhalador de ULTIBRO™ BREEZHALER® y las cápsulas de ULTIBRO™ BREEZHALER® en un lugar seco.
Información complementaria: Ocasionalmente, fragmentos muy pequeños de la cápsula pueden atravesar el filtro y penetrar en la boca. En tal caso, puede que note esos fragmentos en la lengua. No es peligroso ingerirlos ni inhalarlos. Las probabilidades de que la cápsula se fragmente aumentan si se perfora más de una vez (paso 7).
Cómo limpiar el inhalador: No lave nunca con agua el inhalador. Si desea limpiar el inhalador, frote la boquilla por dentro y por fuera con un paño limpio y seco que no deje pelusa para eliminar los restos de polvo.
Manténgalo seco.
Vida útil: 18 meses.
Fabricante: Novartis Pharma Stein AG – Suiza.
Revisión de texto: 13 de Septiembre de 2013
NOVARTIS PHARMA AG, Basilea (Suiza)
® Marca registrada
SOBREDOSIS: No existe información acerca de la sobredosificación clínicamente relevante con ULTIBRO™ BREEZHALER®.
Una sobredosis puede provocar los efectos extremos típicos de los estimulantes adrenérgico ß2, a saber, taquicardia, temblores, palpitaciones, cefalea, náuseas, vómitos, somnolencia, arritmias ventriculares, acidosis metabólica, hipopotasemia e hiperglucemia, o pueden inducir efectos colinérgicos, como presión intraocular elevada (produciendo dolor, trastornos visuales o enrojecimiento de los ojos), estreñimiento o dificultades de evacuación. Está indicado un tratamiento sintomático y de apoyo. En casos graves debe hospitalizarse al paciente. Cabe la posibilidad de utilizar betabloqueantes cardioselectivos para el tratamiento de los efectos adrenérgicos ß2, pero sólo bajo la supervisión de un médico y con extrema precaución, ya que el uso de betabloqueantes pueden provocar broncoespasmo.
FARMACOLOGÍA CLÍNICA:
Propiedades farmacodinámicas: Grupo farmacoterapéutico: Fármacos para enfermedades obstructivas de las vías respiratorias, adrenérgicos en combinación con anticolinérgicos, código ATC: R03AL04.
Mecanismo de acción:
• ULTIBRO™ BREEZHALER®: Cuando el indacaterol y el glicopirronio se administran asociados en ULTIBRO™ BREEZHALER® su eficacia resulta aditiva, pues actúan de forma distinta en receptores y vías diferentes para lograr la relajación del músculo liso. Debido a la densidad diferencial de receptores adrenérgicos ß2 y receptores M3 entre las vías respiratorias centrales y las vías respiratorias más periféricas, los agonistas ß2 deberían relajar estas últimas de forma más eficaz, mientras que un compuesto anticolinérgico podría ser más eficaz en las vías respiratorias de mayor tamaño. Así pues, la asociación de un agonista adrenérgico ß2 y un antagonista muscarínico puede resultar beneficiosa a la hora de obtener una broncodilatación óptima en todas las regiones del pulmón humano.
• Indacaterol: El indacaterol es un agonista adrenérgico ß2 de acción ultraprolongada, que se administra una vez al día. Los efectos farmacológicos de los agonistas adrenérgicos ß2, como el indacaterol, se atribuyen, al menos parcialmente, a la estimulación de la adenilato-ciclasa intracelular, la enzima que cataliza la conversión del trifosfato de adenosina (ATP) en 3",5"-fosfato de adenosina (monofosfato cíclico o AMPc). Las concentraciones elevadas de AMPc relajan el músculo liso de los bronquios. Los estudios in vitro indican que el indacaterol ejerce una mayor actividad agonista en los receptores ß2 que en los receptores ß1 y ß3.
Cuando es inhalado, el indacaterol actúa localmente como broncodilatador en el pulmón. El indacaterol es un agonista casi total en los receptores adrenérgicos ß2 humanos, con potencia nanomolar. Aunque los receptores ß2 son los receptores adrenérgicos que predominan en el músculo liso bronquial y los receptores ß1 son los receptores preponderantes en el corazón humano, también existen receptores adrenérgicos ß2 en este último órgano, que abarcan del 10 al 50% de los receptores adrenérgicos totales. Se desconoce la función precisa de los receptores adrenérgicos ß2 en el corazón, pero su presencia plantea la posibilidad de que incluso los agonistas adrenérgicos ß2 extremadamente selectivos puedan ejercer efectos cardíacos.
Glicopirronio: El glicopirronio es un antagonista (anticolinérgico) de los receptores muscarínicos de acción prolongada, que se administra por inhalación una vez al día como tratamiento broncodilatador de mantenimiento de la EPOC. Los nervios parasimpáticos constituyen la vía neural broncoconstrictora principal de las vías respiratorias, y el tono colinérgico es el componente reversible clave de la obstrucción del flujo de aire en la EPOC. El glicopirronio bloquea la acción broncoconstrictora de la acetilcolina en las fibras musculares lisas de las vías respiratorias y eso hace que estas últimas se dilaten.
El bromuro de glicopirronio es un antagonista que presenta una extrema afinidad por el receptor muscarínico.En los estudios de fijación competitiva a receptores, su selectividad por los receptores humanos M3 fue 4 veces mayor que la que tiene por los receptores humanos M2.
Efectos farmacodinámicos: La asociación de indacaterol y glicopirronio en ULTIBRO™ BREEZHALER® mostró un rápido inicio de acción en los 5 minutos posteriores a su administración (véase Estudios clínicos, Tabla 3). El efecto permanece constante durante el intervalo de administración de 24 horas (véase Estudios clínicos, Figuras 1 y 2).
El efecto broncodilatador medio derivado de las determinaciones seriadas del volumen espiratorio máximo en el primer segundo (FEV1) por espacio de 24 horas fue de 0,32 litros al cabo de 26 semanas de tratamiento. Se observó un efecto significativamente mayor con ULTIBRO™ BREEZHALER® que con el indacaterol, el glicopirronio o el tiotropio en monoterapia (la diferencia fue de 0,11 litros para cada comparación en el subgrupo de pacientes sometidos a espirometrías seriadas).
Con el paso del tiempo no hubo signos de taquifilaxia en el efecto de ULTIBRO™ BREEZHALER® en comparación con el placebo o los respectivos fármacos componentes.
Efectos sobre la frecuencia cardíaca: Se compararon los efectos sobre la frecuencia cardíaca después de una dosis única de 4 veces la dosis terapéutica recomendada de ULTIBRO™ BREEZHALER® repartida en cuatro tomas que se administraron con una hora de diferencia entre sí, en voluntarios sanos, con los efectos producidos por el placebo, indacaterol, glicopirronio y salmeterol.
ULTIBRO™ BREEZHALER® produjo un aumento máximo de la frecuencia cardíaca de +5,69 latidos por minuto (90% CI [2,71, 8,66]) y una disminución máxima de -2,51 latidos por minuto (90% CI [-5,48, 0,47]), en comparación con el placebo a tiempos equiparables. En general, no se observaron indicios de que ULTIBRO™ BREEZHALER® tenga un efecto farmacodinámico sistemático sobre la frecuencia cardíaca a lo largo del tiempo.
Cuando se investigó la frecuencia cardíaca en pacientes con EPOC que recibieron niveles de dosis supraterapéuticas , no se observaron efectos significativos de ULTIBRO™ BREEZHALER® sobre la frecuencia cardíaca media durante 24 horas, ni sobre la frecuencia cardíaca al cabo de 30 minutos, 4 horas y 24 horas.
Intervalo QT: No se tienen indicios de que los fármacos componentes de ULTIBRO™ BREEZHALER® (indacaterol y glicopirronio) prolonguen el intervalo QT en las dosis clínicas. Un estudio minucioso del QT en voluntarios sanos con dosis inhaladas de indacaterol (hasta dos veces la dosis terapéutica máxima recomendada) no reveló ningún efecto clínicamente importante sobre el intervalo QT. De forma similar, para glicopirronio tampoco se observó una prolongación de dicho intervalo en otro estudio minucioso del QT tras la inhalación de una dosis inhalada de 8 veces la dosis terapéutica recomendada.
Los efectos de ULTIBRO™ BREEZHALER® sobre el intervalo QTc se investigaron en voluntarios sanos tras la inhalación de 440/200 µg del medicamento (la dosis se repartió en cuatro tomas que se administraron con una hora de diferencia entre sí). La mayor diferencia con respecto al placebo a tiempos equiparables fue de 4,62 ms (IC del 90%: 0,40, 8,85 ms), la mayor disminución a tiempos equiparables fue de -2,71 ms (IC del 90%: -6,97, 1,54 ms), lo cual indica que ULTIBRO™ BREEZHALER® no ejerce ningún efecto importante sobre el intervalo QT como cabía esperar de las propiedades de sus fármacos componentes.
En pacientes con EPOC, dosis supraterapeúticas entre 116 µg/ 86 µg y 464 µg/86 µg de ULTIBRO™ BREEZHALER® mostraron una proporción más elevada de pacientes con aumentos del QTcF en comparación con el valor basal entre 30 ms y 60 ms (intervalo desde 16,0% a 21,6% vs. 1,9% para placebo), pero no hubieron aumentos del QTcF >60 ms con respecto al valor basal. El nivel de dosis más elevado de ULTIBRO™ BREEZHALER® de 464 µg/86 µg también mostró una proporción más elevada de valores QTcF absolutos >450 ms (12,2% vs. 5,7% para placebo).
Potasio sérico y glucemia: En voluntarios sanos tras la administración de 4 veces la dosis terapéutica recomendada de ULTIBRO™ BREEZHALER®, el efecto sobre el potasio sérico fue muy bajo (diferencia máxima –0,14 mmol/l comparado con placebo). El efecto máximo sobre la glucemia fue de 0,67 mmol/l.
Farmacocinética:
• Absorción: Tras la inhalación de ULTIBRO™ BREEZHALER®, la mediana de tiempo transcurrido hasta alcanzar las concentraciones plasmáticas máximas de indacaterol y glicopirronio era de unos 15 y 5 minutos, respectivamente.
En base a los datos de comportamiento in vitro, se espera que la dosis de indacaterol liberada a los pulmones sea similar para ULTIBRO™ BREEZHALER® e indacaterol en monoterapia. La exposición a indacaterol en estado estacionario tras la inhalación de ULTIBRO™ BREEZHALER® fue similar o ligeramente inferior a la exposición sistémica tras la inhalación de indacaterol en monoterapia.
Tras la inhalación de ULTIBRO™ BREEZHALER®, la biodisponibilidad absoluta de indacaterol se ha estimado que variaba entre el 61% y el 85% de la dosis liberada, y la del glicopirronio fue aproximadamente del 47% de la dosis liberada.
La exposición a glicopirronio en estado estacionario tras la inhalación de ULTIBRO™ BREEZHALER® fue similar a la exposición sistémica tras la inhalación de glicopirronio en monoterapia.
— Indacaterol: Las concentraciones de indacaterol en estado estacionario se lograban en un plazo de 12 a 15 días tras la administración de una dosis única diaria. La tasa de acumulación media de indacaterol (es decir, el AUC registrado durante el intervalo de administración de 24 horas los días 14 o 15 con respecto al día 1) era de entre 2,9 y 3,8 con dosis únicas diarias inhaladas de entre 60 y 480 µg (dosis liberada).
— Glicopirronio: Cuando el glicopirronio se administraba por inhalación una vez al día durante varios días a pacientes con EPOC, alcanzaba su estado farmacocinético estacionario en un plazo de una semana después de iniciar el tratamiento. Las concentraciones plasmáticas máxima y mínima del glicopirronio determinadas en el estado estacionario para un régimen de dosis una vez al día eran de 166 pg/ml y 8 pg/ml, respectivamente (media de valores en cada caso). La exposición al glicopirronio en el estado estacionario (AUC durante el intervalo de administración de 24 horas) era aproximadamente entre 1,4 y 1,7 veces mayor que la obtenida después de la primera dosis.
• Distribución
— Indacaterol: Tras la infusión intravenosa, el volumen de distribución (Vz) del indacaterol fue 2,557 l, que es indicativo de una amplia distribución. La fijación del indacaterol a proteínas séricas o plasmáticas humanas in vitro fue 95,% .
— Glicopirronio: Tras la administración intravenosa, el volumen de distribución en el estado estacionario del glicopirronio era de 83 l y su volumen de distribución en la fase terminal fue 376 l. El volumen aparente de distribución en la fase terminal tras la inhalación fue casi 20 veces mayor, lo cual es un reflejo de la eliminación mucho más lenta después de la inhalación. La fijación del glicopirronio a proteínas plasmáticas humanas in vitro era de entre 38 y 41% en la gama de concentraciones de 1 a 10 ng/ml.
• Biotransformación y metabolismo:
— Indacaterol: Tras la administración oral de indacaterol radioactivo en un estudio ADME (absorción, distribución, metabolismo y eliminación) en el ser humano, el indacaterol inalterado era el principal componente en el suero y representaba aproximadamente una tercera parte del AUC de 24 horas relacionado con el fármaco. El metabolito más abundante en el suero era un derivado hidroxilado. Otros metabolitos importantes eran un O-glucurónido fenólico del indacaterol y el indacaterol hidroxilado. Se identificaron asimismo otros metabolitos: un diastereoisómero del derivado hidroxilado, un N-glucurónido del indacaterol y productos resultantes de la C-desalquilación y la N-desalquilación.
Estudios in vitro indicaron que la UGT1A1 es el principal contribuyente del aclaramiento metabólico de indacaterol. Sin embargo, tal y como se mostró en un ensayo clínico en poblaciones con diferentes genotipos UGT1A1, el genotipo UGT1A1 no afectó significativamente a la exposición sistémica de indacaterol.
Se hallaron metabolitos oxidativos en incubaciones con versiones recombinadas de los citocromos CYP1A1, CYP2D6 y CYP3A4. Se concluyó que la isoforma CYP3A4 es la principal responsable de la hidroxilación del indacaterol. Estudios in vitro indicaron, asimismo, que el indacaterol es un sustrato con poca afinidad por la bomba de expulsión P-gp.
— Glicopirronio: Los estudios de metabolismo in vitro revelan vías metabólicas concordantes del bromuro de glicopirronio entre los animales y los seres humanos. Se apreció hidroxilación, que produjo varios metabolitos mono y bihidroxilados, y una hidrólisis directa, que dio lugar a la formación de un derivado del ácido carboxílico (M9). In vivo, el M9 se formó a partir de la fracción de dosis tragada del bromuro de glicopirronio inhalado. Se encontraron en orina de humanos conjugados glucuronido y/o sulfato de glicopirronio después de la inhalación repetida, sumando aproximadamente el 3% de la dosis liberada.
Múltiples isoenzimas CYP contribuyen a la biotransformación oxidativa del glicopirronio. No es probable que la inhibición o inducción del metabolismo del glicopirronio dé como resultado un cambio relevante en la exposición sistémica a la sustancia activa. Los estudios de inhibición in vitro indicaron que el bromuro de glicopirronio carece de capacidad para inhibir las enzimas CYP1A2, CYP2A6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 o CYP3A4/5, los transportadores de expulsión MDR1, MRP2 o MXR y los transportadores de captación OCT1 o OCT2. Los estudios de inducción enzimática in vitro no han arrojado indicios de que el bromuro de glicopirronio indujese de forma clínicamente importante las isoformas investigadas del citocromo P450 o la enzima UGT1A1 y los transportadores MDR1 y MRP2.
• Eliminación:
— Indacaterol: En los ensayos clínicos en los que se recogieron muestras de orina, la cantidad de indacaterol que se excretaba inalterado por vía renal era generalmente inferior al 2,5% de la dosis liberada. La depuración renal del indacaterol era de entre 0,46 y 1,20 l/h en promedio. Comparada con la depuración sérica del indacaterol de 23,3 l/h, es evidente que la depuración renal desempeña un papel secundario (aproximadamente entre el 2 y el 5% de la depuración sistémica) en la eliminación del indacaterol disponible sistémicamente.
En un estudio ADME (absorción, distribución, metabolismo y eliminación) en el ser humano se excretaba en las heces humanas fundamentalmente como fármaco original inalterado (el 54% de la dosis) y, en menor grado, en forma de metabolitos de indacaterol hidroxilados (el 23% de la dosis). El descenso de las concentraciones séricas de indacaterol era multifásico, con una semivida terminal media comprendida entre 45,5 y 126 horas. La semivida efectiva, calculada a partir de la acumulación de indacaterol tras dosis repetidas, variaba entre 40 y 52 horas, lo que es coherente con los 12 a 15 días que se tarda aproximadamente en alcanzar el estado estacionario.
— Glicopirronio: Después de la administración I.V. de bromuro de [3H]-glicopirronio a seres humanos, la eliminación urinaria media de radioactividad en 48 horas era del 85% de la dosis. Un 5% adicional de la dosis se halló en la bilis.
La eliminación renal del compuesto original representa entre el 60 y el 70% de la depuración total del glicopirronio disponible sistémicamente, mientras que los procesos de depuración no renales representan entre el 30 y el 40% de la depuración total. El aclaramiento biliar contribuye al aclaramiento no renal, sin embargo, se cree que la mayor parte del aclaramiento no renal se debe al metabolismo.
La depuración renal media de dicho fármaco era de entre 17,4 y 24,4 l/h. La secreción tubular activa contribuye a la eliminación renal del glicopirronio. Se ha recuperado en la orina hasta el 23% de la dosis liberada en forma de compuesto original.
Las concentraciones plasmáticas de glicopirronio disminuyen de forma multifásica. La semivida de eliminación terminal media fue más prolongada (33 a 57 horas) tras la inhalación que luego de la administración intravenosa (6,2 horas) u oral (2,8 horas). La pauta de eliminación sugiere una absorción pulmonar sostenida de glicopirronio o el ingreso de dicha sustancia en la circulación general 24 horas o más de 24 horas después de la inhalación.
• Linealidad o no linealidad:
— Indacaterol: La exposición sistémica al indacaterol aumentaba de forma proporcional a la dosis (liberada) de forma proporcional a la misma (120 a 480 µg).
— Glicopirronio: En los pacientes con EPOC, la exposición sistémica y la eliminación urinaria total de glicopirronio en el estado estacionario aumentaron de forma prácticamente proporcional a la dosis en el intervalo de dosis (liberada) de 44 µg a 176 µg.
Poblaciones especiales:
— ULTIBRO™ BREEZHALER®: Un análisis farmacocinético poblacional de pacientes con EPOC realizado tras la inhalación de ULTIBRO™ BREEZHALER® no reveló efectos significativos de la edad, el sexo biológico y el peso (corporal magro) sobre la exposición sistémica al indacaterol y el glicopirronio. Se identificó como covariable el peso corporal magro (que depende del peso y de la altura). Se observó una correlación inversamente proporcional entre la exposición sistémica y el peso corporal magro (o peso corporal); no obstante, dada la magnitud de la variación o la precisión predictiva del peso corporal magro, no se recomienda realizar ajustes de la dosis.
El tabaquismo y el FEV1 inicial no tuvieron efectos evidentes sobre la exposición sistémica al indacaterol y el glicopirronio tras la inhalación de ULTIBRO™ BREEZHALER®.
— Indacaterol: Un análisis poblacional del efecto de la edad, el sexo biológico y el peso sobre la exposición sistémica en pacientes con EPOC tras la inhalación mostró que el indacaterol puede utilizarse en la dosis recomendada en pacientes de cualquier edad (adultos hasta 88 años), peso (32 - 168 kg), sexo, o raza sobre la farmacocinética de indacaterol.
No indicó ninguna diferencia entre subgrupos étnicos en esta población.
— Glicopirronio: Un análisis farmacocinético poblacional de los datos obtenidos en pacientes con EPOC permitió identificar al peso corporal y la edad como factores que contribuían a la variabilidad interindividual de la exposición sistémica. La dosis recomendada de glicopirronio de 50 µg puede administrarse una vez al día en personas de cualquier edad y peso corporal.
El sexo, el tabaquismo y el FEV1 basal no tuvieron efectos evidentes sobre la exposición sistémica.
• Pacientes con disfunción hepática:
— ULTIBRO™ BREEZHALER®: La farmacocinética clínica de los fármacos componentes de ULTIBRO™ BREEZHALER® indica que este medicamento puede usarse en la dosis recomendada en pacientes con disfunción hepática entre leve y moderada. No se dispone de datos en pacientes con disfunción hepática grave.
— Indacaterol: Los pacientes con disfunción hepática leve o moderada no presentaban diferencias importantes en la Cmáx o el AUC del indacaterol. Tampoco la fijación a proteínas era diferente entre los sujetos con disfunción leve o moderada y los sujetos sanos de referencia. No se realizaron estudios en sujetos con disfunción hepática grave.
— Glicopirronio: No se efectuaron estudios clínicos en pacientes con disfunción hepática. El glicopirronio se elimina de la circulación general principalmente por vía renal (véase Farmacología clínica - Eliminación). No cabe esperar que una alteración del metabolismo hepático del glicopirronio vaya a producir un aumento clínicamente importante de la exposición sistémica.
Pacientes con disfunción renal:
— ULTIBRO™ BREEZHALER®: La farmacocinética clínica de los fármacos componentes de ULTIBRO™ BREEZHALER® indica que este medicamento puede usarse en la dosis recomendada en pacientes con disfunción renal entre leve y moderada, En los pacientes con disfunción renal grave o con nefropatía terminal que necesitan diálisis sólo puede administrarse en la dosis recomendada si los beneficios previstos justifican los posibles riesgos.
— Indacaterol: Debido a la muy escasa contribución de la vía renal a la eliminación total del organismo del maleato de indacaterol, no se realizó un estudio en sujetos con disfunción renal.
— Glicopirronio: La disfunción renal afecta la exposición sistémica al glicopirronio. Se observó un aumento medio moderado en la exposición sistémica total (AUClast) que puede ser hasta 1,4 veces mayor en los sujetos con disfunción renal leve o moderada y hasta 2,2 veces mayor en los sujetos con disfunción renal grave y nefropatía terminal. El bromuro de glicopirronio puede usarse en la dosis recomendada en pacientes con EPOC y disfunción renal entre leve y moderada (filtración glomerular estimada [eGFR] ≥30 ml/min/1,73 m2).
• Origen étnico:
— ULTIBRO™ BREEZHALER®: No se observó diferencias importantes en cuanto a la exposición sistémica total (AUC) para ambos compuestos entre japoneses y caucásicos. No se dispone de datos suficientes sobre la farmacocinética en otras etnias o razas.
— Indacaterol: No se identificaron diferencias entre subgrupos étnicos. Se dispone de escasa experiencia terapéutica en personas de raza negra.
— Glicopirronio: No se apreciaron diferencias importantes de exposición sistémica total (AUC) entre sujetos de origen japonés y sujetos caucásicos. No se dispone de datos farmacocinéticos suficientes en personas de otras razas o etnias.
CONSERVACIÓN:
Conservar a menos de 30 °C. Conservar en el envase original a fin de protegerlo de la humedad.
ULTIBRO™ BREEZHALER® no debe utilizarse tras la fecha de caducidad («EXP») indicada en el envase.
ULTIBRO™ BREEZHALER® debe conservarse fuera del alcance y de la vista de los niños.