
XANAX
ALPRAZOLAM
Tabletas
1 Caja , 20 Tabletas , 0.25 Miligramos
1 Caja , 20 Tabletas , 0.50 Miligramos
1 Caja , 100 Tabletas , 0.50 Miligramos
1 Caja , 20 Tabletas , 1 Miligramos
1 Caja , 100 Tabletas , 0.25 Miligramos
1 Caja , 30 Tabletas , 0.25 Miligramos
1 Caja , 10 Tabletas , 0.25 Miligramos
1 Caja , 10 Tabletas , 0.50 Miligramos
1 Caja , 30 Tabletas , 0.50 Miligramos
1 Caja , 10 Tabletas , 1 Miligramos
1 Caja , 30 Tabletas , 1 Miligramos
1 Caja , 100 Tabletas , 1 Miligramos
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
XANAX 0,25 mg Tableta
Cada TABLETA contiene: 0,25 mg de alprazolam, excipientes c.s.p.
Cajas x 10, 20, 30, 100 tabletas en empaque blíster.
XANAX 0,5 mg Tableta
Cada TABLETA contiene: 0,5 mg de alprazolam, excipientes c.s.p.
Cajas x 10, 20, 30, 100 tabletas en empaque blíster.
XANAX 1,00 mg Tableta
Cada TABLETA contiene: 1 mg de alprazolam, excipientes c.s.p.
Cajas x 10, 20, 30, 100 tabletas en empaque blíster.
INDICACIONES Y USO
Trastornos de ansiedad: XANAX en tabletas está indicado para el tratamiento del trastorno de ansiedad (una enfermedad que se aproxima más al diagnóstico de trastorno de ansiedad generalizada según el Manual Diagnóstico y Estadístico de la APA [DSM-III-R]) o el alivio a corto plazo de los síntomas de ansiedad. La ansiedad o la tensión relacionada con el estrés de la vida diaria no requieren generalmente tratamiento con un ansiolítico.
El trastorno de ansiedad generalizada se caracteriza por una ansiedad poco realista o ansiedad y preocupación excesiva (expectativa aprensiva) durante los cuales la persona se ha sentido frecuentemente afectada, por dos o más circunstancias de la vida, durante 6 meses o más. Por lo menos 6 de los siguientes 18 síntomas están a menudo presentes en estos pacientes: Tensión motora (temblor, fasciculaciones, o sensación de temblor; tensión muscular, dolores o molestias; inquietud; tendencia a la fatiga); Hiperactividad neurovegetativa (falta de aliento o sofocación, palpitaciones y aceleración de la frecuencia cardiaca; sudoración; o enfriamiento y sudoración de manos; sequedad de la boca; mareos o aturdimiento; nauseas, diarrea; u otro malestar abdominal; sofocos o escalofríos; micción frecuente; dificultad para deglutir o “nudo en la garganta”); Vigilancia y seguimiento (sensación de nerviosismo; respuesta de sobresalto exagerada; dificultad para concentrarse o de “mente en blanco” debido a la ansiedad; preocupación por caerse o quedarse dormido; irritabilidad). Estos síntomas no deben ser secundarios a otros trastornos psiquiátricos o ser causados por ningún factor orgánico.
La ansiedad relacionada con la depresión responde al XANAX.
Trastorno de pánico: XANAX está indicado también para el tratamiento del trastorno de pánico, con o sin agorafobia.
Se realizaron estudios que respaldaban esta afirmación en pacientes cuyos diagnósticos se aproximaban a los criterios de DSM-II-R/IV para el trastorno de pánico (ver Estudios clínicos).
El trastorno de pánico (DSM-IV) se caracteriza por ataques de pánico recurrentes inesperados; es decir, un periodo discreto de miedo o malestar intenso en el que cuatro (o más) de los siguientes síntomas se desarrollan de manera abrupta y alcanzan su nivel máximo en un lapso de 10 minutos (1) palpitaciones, taquicardia, o aceleración de la frecuencia cardiaca; (2) sudoración; (3) temblores; (4) disnea o sofocación; (5) sensación de asfixia; (6) dolor o malestar torácico; (7) nauseas o malestar abdominal; (8) sensación de mareos, inestabilidad, aturdimiento, o desmayo; (9) desrealización (impresión de irrealidad) o despersonalización (separarse de una mismo); (10) miedo a perder el control; (11) miedo a la muerte; (12) parestesias (sensación de entumecimiento o hormigueo); (13) escalofríos o sofocos.
La demostración de la eficacia de XANAX mediante estudios clínicos sistemáticos se limita a una duración de 4 meses para el trastorno de la ansiedad y de 4 a 10 semanas para el trastorno de pánico; no obstante, se ha tratado a pacientes con trastorno de pánico sobre una base abierta de hasta 8 meses sin pérdida aparente del beneficio. El médico debe reexaminar periódicamente la utilidad del tratamiento en cada paciente individualmente.
CONTRAINDICACIONES: Las tabletas de XANAX están contraindicadas en pacientes con sensibilidad conocida a este fármaco u otras benzodiacepinas. XANAX puede utilizarse en pacientes con glaucoma de ángulo abierto que están recibiendo terapia apropiada, pero está contraindicado en pacientes con glaucoma de ángulo estrecho agudo.
XANAX está contraindicado con ketoconazol e itraconazol, ya que estas medicaciones alteran significativamente el metabolismo oxidativo mediado por el citocromo P450 3A (CYP3A) (ver Farmacología clínica, Advertencias y Precauciones: Interacciones farmacológicas).
REACCIONES ADVERSAS: De producirse efectos secundarios con XANAX Tabletas, éstos se observan por lo general al inicio del tratamiento y usualmente desaparecen con la continuación del medicamento. En el paciente tratado habitualmente, es posible que los efectos secundarios más frecuentes se deban a una extensión de la actividad farmacológica del alprazolam, por ejemplo, sopor o aturdimiento.
Los datos que se citan en las dos tablas siguientes son estimaciones de la incidencia de eventos clínicos desfavorables entre pacientes que participaron bajo las siguientes condiciones clínicas: estudios clínicos controlados con placebo de duración relativamente corta (es decir, cuatro semanas) con dosis de hasta 4 mg/día de XANAX (para el tratamiento del trastorno de ansiedad o para el alivio a corto plazo de los síntomas de la ansiedad) y estudios clínicos controlados con placebo a corto plazo (de hasta diez semanas) con dosis de hasta 10 mg/día de XANAX en pacientes con trastorno de pánico, con o sin agorafobia.
Estos datos no pueden ser empleados para predecir de manera precisa la incidencia de eventos desfavorables en el curso de la práctica médica habitual donde las características de los pacientes, y otros factores a menudo difieren de los observados en estudios clínicos.
No se pueden comparar estas cifras con las obtenidas de otros estudios clínicos que implican productos farmacéuticos relacionados y placebo dado que cada grupo de estudios farmacológicos se realizan bajo un diferente conjunto de condiciones.
No obstante, la comparación de las cifras mencionadas puede proveer al prescriptor de cierta base para estimar las contribuciones relativas de los factores inherentes al medicamento y los no relacionados a éste a la incidencia de eventos desfavorables en la población estudiada. Inclusive este uso debe tomarse con precaución, ya que un medicamento puede aliviar un síntoma en un paciente pero inducirlo en otro. (Por ejemplo, un ansiolítico puede mejorar la sequedad de la boca [un síntoma de ansiedad] en algunos sujetos, pero lo induce [evento desfavorable] en otros).
Además, para los trastornos de ansiedad, las cifras citadas pueden proveer al prescriptor de indicios en lo respecta a la frecuencia con la que la intervención del médico (por ejemplo, aumento de la vigilancia, disminución de la dosis o interrupción de la farmacoterapia) puede ser necesaria debido al evento clínico desfavorable.
Eventos adversos que surgieron durante el tratamiento reportados en estudios controlados con placebo de trastornos de ansiedad
|
Trastorno de ansiedad |
|||
|
Incidencia de síntomas que surgieron durante el tratamiento† |
Incidencia de intervenciones debido a los síntomas |
||
|
XANAX |
PLACEBO |
XANAX |
|
|
Número de Pacientes |
565 |
505 |
565 |
|
% de pacientes que reportan trastornos: |
|||
|
Del Sistema Nervioso Central |
|||
|
Sopor |
41,0 |
21,6 |
15,1 |
|
Aturdimiento |
20,8 |
19,3 |
1,2 |
|
Depresión |
13,9 |
18,1 |
2,4 |
|
Cefalea |
12,9 |
19,6 |
1,1 |
|
Confusión |
9,9 |
10,0 |
0,9 |
|
Insomnio |
8,9 |
18,4 |
1,3 |
|
Nerviosismo |
4,1 |
10,3 |
1,1 |
|
Síncope |
3,1 |
4,0 |
* |
|
Mareos |
1,8 |
0,8 |
2,5 |
|
Acatisia |
1,6 |
1,2 |
* |
|
Cansancio/adormecimiento |
* |
* |
1,8 |
|
Gastrointestinales |
|||
|
Sequedad de la boca |
14,7 |
13,3 |
0,7 |
|
Estreñimiento |
10,4 |
11,4 |
0,9 |
|
Diarrea |
10,1 |
10,3 |
1,2 |
|
Naúseas/vómitos |
9,6 |
12,8 |
1,7 |
|
Sialorrea |
4,2 |
2,4 |
* |
|
Cardiovasculares |
|||
|
Taquicardia/Palpitaciones |
7,7 |
15,6 |
0,4 |
|
Hypotensión |
4,7 |
2,2 |
* |
|
Sensoriales |
|||
|
Visión borrosa |
6,2 |
6,2 |
0,4 |
|
Musculoesqueléticos |
|||
|
Rigidez |
4,2 |
5,3 |
* |
|
Temblor |
4,0 |
8,8 |
0,4 |
|
Cutáneos |
|||
|
Dermatitis/Alergia |
3,8 |
3,1 |
0,6 |
|
Otros |
|||
|
Congestión nasal |
7,3 |
9,3 |
* |
|
Aumento de peso |
2,7 |
2,7 |
* |
|
Pérdida de peso |
2,3 |
3,0 |
* |
|
* Ninguno reportado. † Están incluidos los eventos reportados en un 1% o más de pacientes tratados con XANAX. |
|||
Además de los eventos desfavorables relativamente comunes (es decir, mayores al 1%) enumerados en la tabla anterior, se han reportado los siguientes eventos adversos en asociación con el uso de benzodiazepinas: distonía, irritabilidad, dificultades en la concentración, anorexia, amnesia transitoria o deterioro de la memoria, pérdida de coordinación, fatiga, convulsiones, sedación, habla entrecortada, ictericia, debilidad musculoesquelética, prurito, diplopía, disartria, cambios en la libido, irregularidades menstruales, retención e incontinencia urinaria
Eventos que surgieron durante el tratamiento reportados en estudios controlados con placebo de trastorno de pánico
|
Trastorno de pánico |
||
|
Incidencia de síntomas que surgieron durante el tratamiento * |
||
|
XANAX |
PLACEBO |
|
|
Número de pacientes |
1388 |
1231 |
|
% de pacientes que reportan trastornos: |
||
|
Del Sistema Nervioso Central |
||
|
Sopor |
76,8 |
42,7 |
|
Fatiga y cansancio |
48,6 |
42,3 |
|
Alteraciones en la coordinación |
40,1 |
17,9 |
|
Irritabilidad |
33,1 |
30,1 |
|
Deterioro de la memoria |
33,1 |
22,1 |
|
Aturdimiento/Mareos |
29,8 |
36,9 |
|
Insomnio |
29,4 |
41,8 |
|
Cefalea |
29,2 |
35,6 |
|
Trastorno cognitivo |
28,8 |
20,5 |
|
Disartria |
23,3 |
6,3 |
|
Ansiedad |
16,6 |
24,9 |
|
Movimientos involuntarios anormales |
14,8 |
21,0 |
|
Disminución de la líbido |
14,4 |
8,0 |
|
Depresión |
13,8 |
14,0 |
|
Confusión |
10,4 |
8,2 |
|
Fasciculaciones |
7,9 |
11,8 |
|
Incremento de la libido |
7,7 |
4,1 |
|
Cambios en la líbido (no especificados) |
||
|
Debilidad |
7,1 |
8,4 |
|
Trastornos en el tono muscular |
6,3 |
7,5 |
|
Síncope |
3,8 |
4,8 |
|
Acatisia |
3,0 |
4,3 |
|
Agitación |
2,9 |
2,6 |
|
Desinhibición |
2,7 |
1,5 |
|
Parestesias |
2,4 |
3,2 |
|
Locuacidad |
2,2 |
1,0 |
|
Trastornos vasomotores |
2,0 |
2,6 |
|
Desrealización |
1,9 |
1,2 |
|
Anormalidades en el sueño |
1,8 |
1,5 |
|
Miedo |
1,4 |
1,0 |
|
Sensación de calor |
1,3 |
0,5 |
|
Gastrointestinales |
||
|
Hiposialia |
32,8 |
34,2 |
|
Estreñimiento |
26,2 |
15,4 |
|
Naúseas/vómitos |
22,0 |
31,8 |
|
Diarrea |
20,6 |
22,8 |
|
Malestar abdominal |
18,3 |
21,5 |
|
Sialorrea |
5,6 |
4,4 |
|
Cardiorespiratorios |
||
|
Congestión nasal |
17,4 |
16,5 |
|
Taquicardia |
15,4 |
26,8 |
|
Dolor torácico |
10,6 |
18,1 |
|
Hiperventilación |
9,7 |
14,5 |
|
Infección de las vías respiratorias superiores |
4,3 |
3,7 |
|
Sensoriales |
||
|
Visión borrosa |
21,0 |
21,4 |
|
Acúfenos |
6,6 |
10,4 |
|
Musculoesqueléticos |
||
|
Calambres musculares |
2,4 |
2,4 |
|
Rigidez muscular |
2,2 |
3,3 |
|
Cutáneos |
||
|
Sudoración |
15,1 |
23,5 |
|
Sarpullido |
10,8 |
8,1 |
|
Otros |
||
|
Aumento del apetito |
32,7 |
22,8 |
|
Disminución del apetito |
27,8 |
24,1 |
|
Aumento de peso |
27,2 |
17,9 |
|
Pérdida de peso |
22,6 |
16,5 |
|
Dificultadaes al miccionar |
12,2 |
8,6 |
|
Trastornos menstruales |
10,4 |
8,7 |
|
Disfunción sexual |
7,4 |
3,7 |
|
Edema |
4,9 |
5,6 |
|
Incontinencia |
1,5 |
0,6 |
|
Infección |
1,3 |
1,7 |
|
* Están incluidos los eventos reportados en un 1% o más de pacientes tratados con XANAX |
||
Además de los eventos desfavorables relativamente comunes (es decir, mayores al 1%) enumerados en la tabla anterior, se han reportado los siguientes eventos adversos en asociación con el uso de XANAX: convulsiones, alucinaciones, despersonalización, alteraciones del gusto, diplopía, elevación de la bilirrubina, elevación de enzimas hepáticas, e ictericia.
Se ha asociado el trastorno de pánico con trastornos depresivos graves primarios y secundarios y con un incremento de reportes de suicidio entre los pacientes no tratados con el medicamento (ver Precauciones: Generales).
Eventos adversos reportados como motivos para la suspensión del medicamento en el tratamiento del trastorno de pánico en estudios controlados con placebo: En una amplia base de datos que constaba tanto de estudios controlados como no controlados en los que 641 pacientes recibieron XANAX, los síntomas que surgieron por la interrupción del medicamento que tuvieron lugar a una tasa de más del 5% en pacientes tratados con XANAX y a una tasa mayor que la del grupo tratado con placebo fueron los siguientes:
Incidencia de síntomas que surgieron por la interrupción del medicamento
Porcentaje de eventos reportados por 641 pacientes con trastorno de pánico tratados con XANAX
|
Sistema Corporal/Evento |
|
|
Neurológicos |
|
|
Insomnio |
29,5 |
|
Aturdimiento |
19,3 |
|
Movimientos involuntarios anormales |
17,3 |
|
Cefalea |
17,0 |
|
Fasciculaciones |
6,9 |
|
Alteraciones en la coordinación |
6,6 |
|
Debilidad |
5,8 |
|
Psiquiátricos |
|
|
Ansiedad |
19,2 |
|
Fatiga y cansancio |
18,4 |
|
Irritabilidad |
10,5 |
|
Trastorno cognitivo |
10,3 |
|
Deterioro de la memoria |
5,5 |
|
Depresión |
5,1 |
|
Estado de confusión |
5,0 |
|
Gastrointestinales |
|
|
Naúseas/vómitos |
16,5 |
|
Diarrea |
13,6 |
|
Hiposialia |
10,6 |
|
Metabólicos-Nutritionales |
|
|
Aumento de peso |
13,3 |
|
Disminución del apetito |
12,8 |
|
Trastornos del tono muscular |
5,9 |
|
Dermatológicos |
|
|
Sudoración |
14,4 |
|
Cardiovasculares |
|
|
Taquicardia |
12,2 |
|
Sentidos especiales |
|
|
Visión borrosa |
10,0 |
De los estudios citados, no se ha determinado si los síntomas estuvieron claramente relacionados con la dosis y duración del tratamiento con XANAX en pacientes con trastorno de pánico. Asimismo, se han reportado convulsiones por abstinencia con la rápida disminución o suspensión abrupta de XANAX Tabletas (ver Advertencias).
Para interrumpir el tratamiento en pacientes que reciben XANAX, se debe reducir lentamente la dosis de acuerdo con la buena práctica médica. Se sugiere que la dosis diaria de XANAX se disminuya en no más de 0,5 mg cada tres días (ver Posología y administración). Algunos pacientes se pueden beneficiar de una reducción incluso más lenta de la dosis. En un estudio controlado de suspensión de medicamento posterior a la comercialización de pacientes con trastorno de pánico que comparó este esquema recomendado de disminución progresiva con un esquema de disminución progresiva más lenta, no se observó ninguna diferencia entre grupos en la proporción de pacientes a los que se les disminuyó la dosis a cero; no obstante, el esquema de disminución más lenta se asoció con una reducción de los síntomas vinculados al síndrome de abstinencia.
Como con todas las benzodiazepinas, se han reportado en raras instancias reacciones paradójicas tales como estimulación, incremento de la espasticidad muscular, perturbaciones del sueño, alucinaciones y otros efectos adversos del comportamiento tales como agitación, ira, irritabilidad, y comportamiento agresivo y hostil. En muchos de los reportes espontáneos de casos de efectos adversos del comportamiento, los pacientes recibían de manera concomitante otros medicamentos depresores del SNC y/o fueron descritos como que padecían de enfermedades psiquiátricas subyacentes. Si se produce cualquiera de los eventos anteriores, se debe interrumpir la administración de alprazolam. Reportes aislados publicados que implicaban a un pequeño número de pacientes han sugerido que los pacientes que padecen de trastorno límite de la personalidad, antecedente de un comportamiento violento o agresivo, o que sea alcohólicos o drogadictos pueden correr el riesgo de presentar dichos eventos. Se han reportado casos de irritabilidad, hostilidad, y pensamientos intrusos durante la suspensión de alprazolam en pacientes con trastorno de estrés postraumático.
Reportes posteriores a la introducción al mercado: Se han reportado varias reacciones adversas al medicamento en asociación con el uso de XANAX desde su introducción al mercado. La mayoría de estas reacciones se reportó a través del sistema de notificación voluntaria de eventos médicos. Debido a la naturaleza espontánea de la notificación de eventos médicos y la falta de controles, no se puede determinar fácilmente una relación causal con respecto al uso de XANAX. Los eventos reportados incluyen: trastorno gastrointestinal, hipomanía, manía, elevación de enzimas hepáticas, hepatitis, insuficiencia hepática, síndrome de Stevens-Johnson, angioedema, edema periférico, hiperprolactinemia, ginecomastía, y galactorrea (ver Precauciones).
ESTUDIOS CLÍNICOS
Trastornos de ansiedad: Se comparó XANAX en tabletas con placebo en estudios clínicos doble ciego (con dosis de hasta 4 mg/día) en pacientes a los que se les diagnosticó ansiedad o ansiedad con sintomatología depresiva asociada.
XANAX fue considerablemente mejor que el placebo en cada uno de los periodos de evaluación de estos estudios de 4 semanas según los siguientes instrumentos psicométricos: Impresiones Globales del Médico, Escala de Apreciación de la Ansiedad de Hamilton, Síntomas Objetivo, Impresiones Globales del Paciente y Escala de Autoevaluación de Síntomas.
Trastorno de pánico: El respaldo de la efectividad de XANAX en el tratamiento del trastorno de pánico provino de tres estudios a corto plazo, controlados con placebo (de hasta 10 semanas) en pacientes cuyos diagnósticos se aproximaban a los criterios DSM-III-R para trastorno de pánico.
La dosis promedio de XANAX fue de 5-6 mg/día en dos de los estudios, y las dosis de XANAX se fijaron en 2 y 6 mg/día en el tercer estudio. En los tres estudios, XANAX fue superior al placebo en una variable definida como “el número de pacientes sin ataques de pánico” (rango, 37-83% cumplió con este criterio), así como en una calificación de mejoramiento global. En dos de los tres estudios, XANAX fue superior al placebo en una variable definida como “cambio a partir de la línea base sobre el número de ataques de pánico por semana” (rango, 3.3-5.2), y a su vez en una escala de apreciación de la fobia. Un subgrupo de pacientes que mejoraron al recibir XANAX durante un tratamiento a corto plazo en uno de estos estudios continuó sobre una base abierta de hasta 8 meses, sin pérdida aparente del beneficio.
ADVERTENCIAS
Dependencia y reacciones por el retiro, incluyendo convulsiones: Ciertos eventos adversos clínicos, algunos que ponen en riesgo la vida, son una consecuencia directa de la dependencia física a alprazolam. Éstos incluyen un espectro de síntomas de retiro: el más importante es la convulsión (ver Abuso y dependencia farmacológica). Incluso después de un uso de relativamente corto plazo a dosis <4 mg/día, existe cierto riesgo de dependencia. Los datos del sistema de informe espontáneo sugieren que el riesgo de dependencia y su severidad parece ser mayor en pacientes tratados con dosis mayores a 4 mg/día y por períodos más prolongados (más de 12 semanas). Sin embargo, en un estudio de descontinuación posterior a la comercialización controlado de pacientes con trastorno de pánico que recibieron las tabletas de XANAX, la duración del tratamiento (3 meses en comparación con 6 meses) no tuvo un efecto sobre la capacidad del paciente de reducir gradualmente la dosis a cero. En contraste, los pacientes tratados con dosis de las tabletas de XANAX mayores a 4 mg/día tuvieron más dificultad para reducir gradualmente hasta dosis cero que aquéllos tratados con menos de 4 mg/día.
La importancia de la dosis y los riesgos de XANAX como tratamiento para el trastorno de pánico: Debido a que el tratamiento del trastorno de pánico a menudo requiere el uso de la media de dosis diarias de XANAX por encima de 4 mg, el riesgo de dependencia entre los pacientes con trastorno de pánico puede ser mayor que entre las los tratados por ansiedad menos grave. La experiencia en estudios de interrupción aleatorizado controlado con placebo de pacientes con trastorno de pánico mostraron una alta tasa de síntomas de rebote y abstinencia en pacientes tratados con XANAX en comparación con pacientes tratados con placebo.
La recaída o regreso de la enfermedad se definió como un retorno de los síntomas característicos del trastorno de pánico (principalmente ataques de pánico) hasta niveles aproximadamente iguales a aquéllos observados en la basal antes de iniciar el tratamiento activo. El rebote significa un retorno de los síntomas del trastorno de pánico hasta un nivel sustancialmente mayor en frecuencia o más severo en intensidad que el observado en la basal. Los síntomas de retiro se identificaron como aquéllos que generalmente no fueron característicos del trastorno de pánico y que se produjeron por primera vez más frecuentemente durante la descontinuación que en la basal.
En una prueba clínica controlada en la cual 63 pacientes fueron randomizados a las tabletas de XANAX y donde se buscaron específicamente los síntomas de retiro, los siguientes se identificaron como síntomas de retiro: percepción sensorial intensificada, problemas de concentración, disosmia, conciencia disminuida, parestesia, calambres musculares, tirón muscular, diarrea, visión borrosa, disminución del apetito y pérdida de peso. Otros síntomas, como ansiedad e insomnio, se observaron frecuentemente durante la descontinuación, pero no se pudo determinar si se debieron a un regreso de la enfermedad, rebote o retiro.
En dos estudios controlados de 6 a 8 semanas de duración donde se midió la capacidad de los pacientes de descontinuar la medicación, 71%–93% de pacientes tratados con las tabletas de XANAX redujeron gradualmente por completo la terapia en comparación con 89%–96% de pacientes tratados con placebo. En un estudio de descontinuación posterior a la comercialización controlado de pacientes con trastorno de pánico tratados con las tabletas de XANAX, la duración del tratamiento (3 meses en comparación con 6 meses) no tuvo un efecto sobre la capacidad de los pacientes de reducir gradualmente hasta la dosis cero.
Asimismo, se han observado convulsiones en asociación con la reducción de la dosis o descontinuación de las tabletas de XANAX, de la forma de liberación inmediata de alprazolam. Se observaron convulsiones atribuibles a XANAX después de la descontinuación del fármaco o la reducción de la dosis en 8 de 1980 pacientes con trastorno del pánico o en pacientes que participan en ensayos clínicos donde se permitieron las dosis de XANAX mayores a 4 mg/día por más de 3 meses. Cinco de estos casos se produjeron claramente durante la reducción de dosis abrupta, o la descontinuación de las dosis diarias de 2 a 10 mg. Se produjeron tres casos en situaciones donde no hubo una relación clara para la reducción de la dosis abrupta o la descontinuación. En un caso, la convulsión se produjo después de la descontinuación de una dosis única de 1 mg después de la reducción gradual a una tasa de 1 mg cada tres días desde 6 mg al día. En dos otros casos, la relación para reducir gradualmente no está determinada, en ambos casos, los pacientes habían estado recibiendo dosis de 3 mg al día antes de la convulsión. La duración del uso en los 8 casos anteriores osciló de 4 a 22 semanas. Ha habido informes voluntarios ocasionales de pacientes que desarrollan convulsiones mientras aparentemente reducen gradualmente la dosis de XANAX. El riesgo de convulsión parece ser mayor 24-72 horas después de la descontinuación (ver Dosificación y administración para conocer la reducción gradual recomendada y el programa de descontinuación).
Estado Epilepticus y su tratamiento: El sistema de informe voluntario de eventos médicos muestra que se han informado convulsiones por el retiro en asociación con la descontinuación de las tabletas de XANAX. En la mayoría de los casos, sólo se informó una convulsión; sin embargo, también se informaron múltiples convulsiones y estados epilepticus.
Síntomas entre las dosis: Se ha informado ansiedad temprano en la mañana y emergencia de síntomas de ansiedad entre las dosis de las tabletas de XANAX en pacientes con trastorno de pánico que toman las dosis de mantenimiento prescritas. Estos síntomas pueden reflejar el desarrollo de tolerancia o un intervalo de tiempo entre las dosis que es más prolongado que la duración de la acción clínica de la dosis administrada. En cualquier caso, se presume que la dosis prescrita no es suficiente para mantener los niveles en plasma por encima de aquéllos necesarios para prevenir los síntomas de recaída, rebote o de retiro durante todo el curso de intervalo entre la administración.
Riesgo de reducción de la dosis: Pueden ocurrir reacciones de retiro cuando se produce la reducción de la dosis por alguna razón. Esto incluye la reducción gradual con un propósito pero también la reducción inadvertida de la dosis (por ejemplo, olvido del paciente, el paciente es admitido en un hospital). Por ende, la dosificación de XANAX debe reducirse o descontinuarse gradualmente (ver Dosificación y administración).
Depresión del SNC y desempeño alterado: Debido a sus efectos depresivos en el SNC, los pacientes que reciben XANAX deben ser advertidos acerca de realizar tareas riesgosas o actividades que requieren de una alerta mental completa como operar maquinarias o conducir automóviles. Por la misma razón, los pacientes deben ser advertidos sobre la ingesta simultánea de alcohol y otros fármacos depresivos del SNC durante el tratamiento con XANAX.
Riesgo de daño fetal: Las benzodiacepinas pueden causar potencialmente daño fetal cuando se administran a mujeres embarazadas. Si alprazolam se utiliza durante el embarazo, o si la paciente queda embarazada mientras toma este fármaco, la paciente debe ser advertida sobre el riesgo potencial al feto. Debido a la experiencia con otros miembros de la clase de benzodiacepinas, se supone que alprazolam es capaz de causar un aumento del riesgo de anormalidades congénitas cuando se administra a mujeres embarazadas durante el primer trimestre. Debido a que el uso de esos fármacos rara vez es cuestión de urgencia, su uso durante el primer trimestre siempre debe ser evitado. La posibilidad que una mujer potencialmente fértil quede embarazada al momento del inicio de la terapia debe considerarse. Se debe indicar a las pacientes que si quedan embarazadas durante la terapia o planean quedar embarazadas deben comunicarles a sus médicos su deseo de descontinuar el fármaco.
Interacción de alprazolam con fármacos que inhiben el metabolismo a través de citocromo P450 3A: El paso inicial en el metabolismo de alprazolam es la hidroxilación catalizada mediante el citocromo P450 3A (CYP3A). Los fármacos que inhiben esta vía metabólica tienen un efecto profundo sobre la depuración de alprazolam. Como consecuencia, alprazolam debe evitarse en pacientes que reciben inhibidores muy potentes de CYP3A. Con los fármacos que inhiben CYP3A en menor medida pero aún en un grado significativo, alprazolam debe utilizarse sólo con precaución y considerando la reducción de la dosis apropiada. Para algunos fármacos, se ha cuantificado una interacción con alprazolam con los datos clínicos; para otros fármacos, se predicen interacciones de los datos in vitro y/o experiencia con fármacos similares en la misma clase farmacológica.
A continuación se presentan ejemplos de fármacos conocidos por inhibir el metabolismo de alprazolam y/o benzodiacepinas relacionadas, presumiblemente a través de la inhibición de CYP3A.
Inhibidores potentes de CYP3A:
• Agentes antimicóticos azoles: Ketoconazol e itraconazol son inhibidores potentes de CYP3A y han demostrado in vivo aumentar las concentraciones en plasma de alprazolam 3,98 veces y 2,70 veces, respectivamente. La coadministración de alprazolam con estos agentes no es recomendada. Otros agentes antimicóticos tipo azoles también se consideran inhibidores potentes de CYP3A y no se recomienda la coadministración de alprazolam con ellos (ver Contraindicaciones).
Los fármacos que demostraron ser inhibidores de CYP3A en base a los estudios clínicos que incluyen alprazolam (se recomienda precaución y consideración de la reducción de dosis apropiada de alprazolam durante la coadministración con los siguientes fármacos) son:
– Nefazodona: La coadministración de nefazodona aumentó la concentración de alprazolam dos veces.
– Fluvoxamina: La coadministración de fluvoxamina casi duplicó la concentración en plasma máxima de alprazolam, disminuyó la depuración en 49%, aumento la vida media en 71%, y disminuyó el desempeño psicomotor medido.
– Cimetidina: La coadministración de cimetidina aumentó la concentración en plasma máxima de alprazolam en 86%, disminuyó la depuración en 42%, y aumentó la vida media en 16%.
Otros fármacos que posiblemente afectan el metabolismo de alprazolam: Otros fármacos que posiblemente afectan el metabolismo de alprazolam mediante la inhibición de CYP3A se discuten en la sección de Precauciones (ver Precauciones: Interacciones farmacológicas).
PRECAUCIONES
General
• Suicidio: Al igual que con otros medicamentos psicotrópicos, se indican las precauciones usuales con respecto a la administración del fármaco y el tamaño de la prescripción para pacientes con depresión severa y aquéllos en los cuales existe una razón para esperar una idea o planes suicidas concebidos. El trastorno de pánico se ha asociado con trastornos depresivos mayores secundarios y primarios y aumento de la cantidad de informes de suicidio entre los pacientes no tratados.
• Manía: Se ha informado episodios de hipomanía en asociación con el uso de las tabletas de XANAX en pacientes con depresión.
• Efecto uricosúrico: Alprazolam tiene un efecto uricosúrico débil. Aunque se ha informado que otras medicaciones con un efecto uricosúrico débil causan insuficiencia renal aguda, no ha habido casos informados de insuficiencia renal aguda atribuible a la terapia con alprazolam.
Uso en pacientes con enfermedad concomitante: Se recomienda que la dosificación se limite a la dosis efectiva más pequeña para evitar el desarrollo de ataxia o sobre sedación que puede ser un problema particular en los pacientes adultos mayores o débiles (ver Dosificación y administración). Se deben tener en cuenta las precauciones usuales en los pacientes tratados con insuficiencia renal, hepática o pulmonar. Ha habido informes raros de muerte en pacientes con enfermedad pulmonar severa poco después del inicio del tratamiento con las tabletas de XANAX. Se ha observado una disminución de la tasa de eliminación sistémica de alprazolam (por ejemplo, aumento de la vida media en plasma) en pacientes con enfermedad hepática alcohólica y pacientes obesos que reciben las tabletas de XANAX (ver Farmacología clínica).
Información para los pacientes
Para asegurar el uso seguro y efectivo de XANAX, el médico debe proporcionar al paciente la siguiente orientación:
1. Informe a su médico sobre cualquier consumo de alcohol y medicamentos que esté tomando en este momento, incluyendo medicamentos que compre sin prescripción médica. Generalmente no se debe consumir alcohol durante el tratamiento con las benzodiacepinas.
2. No se recomienda para utilizarse durante el embarazo. Por ende, informe a su médico si está embarazada, si planea tener un hijo o si queda embarazada mientras toma esta medicación.
3. Informe a su médico si está dando de lactar.
4. Hasta que experimente de qué forma la medicación lo afecta, no conduzca un auto ni opere maquinaria potencialmente peligrosa, etc.
5. No incremente la dosis incluso si piensa que la medicación “no funciona más” sin consultar a su médico. Las benzodiacepinas, incluso cuando se utilizan como se recomiendan, pueden producir dependencia emocional y/o física.
6. No deje de tomar la medicación abruptamente o disminuya la dosis sin consultar a su médico, ya que pueden ocurrir síntomas de retiro.
• Consejos adicionales para los pacientes con trastorno de pánico: El uso de XANAX en dosis superiores a 4 mg/día, a menudo es necesario para tratar el trastorno de pánico, se acompaña de riesgos que es necesario considerar con cuidado. Cuando se utiliza en dosis superiores a 4 mg/día, lo que puede o no ser necesarios para su tratamiento, XANAX tiene el potencial de causar dependencia física y emocional severa en algunos pacientes y estos pacientes puede ser muy difícil de terminar el tratamiento. En dos ensayos controlados de 6 a 8 semanas de duración, donde se midió la capacidad de los pacientes a suspender la medicación, de 7 a 29% de los pacientes tratados con XANAX no completamente disminuir la terapia. En un estudio postcomercialización con interrupción controlada de los pacientes con trastorno de pánico, los pacientes tratados con dosis de XANAX más de 4 mg/día tuvieron mayor dificultad disminuyendo a cero la dosis que los pacientes tratados con menos de 4 mg/día. En todos los casos, es importante que su médico le ayudará a poner fin a esta medicación de manera cuidadosa y segura para evitar el uso demasiado prolongado de XANAX.
Además, el uso prolongado en dosis superiores a 4 mg/día parece aumentar la incidencia y la gravedad de las reacciones de abstinencia cuando se suspende el XANAX. Estos son generalmente menores, pero las convulsiones pueden ocurrir, especialmente si se reduce la dosis demasiado rápido o interrumpir la medicación abruptamente. Ataque puede ser mortal.
Pruebas de laboratorio: Las pruebas de laboratorio no se requieren ordinariamente en otros pacientes sanos. Sin embargo, cuando el tratamiento es prolongado, se recomienda recuentos de sangre periódicos, análisis de orina, y análisis de química sanguínea para mantener la buena práctica médica.
Interacciones farmacológicas:
• Uso con otros depresivos del SNC: Si las tabletas de XANAX se combinarán con otros agentes psicotrópicos o fármacos anticonvulsivos, se debe considerar cuidadosamente la farmacología de los agentes que se emplearán, en particular con compuestos que podrían potenciar la acción de las benzodiacepinas. Las benzodiacepinas, incluyendo alprazolam, producen efectos depresivos aditivos en el SNC cuando se coadministran con otros medicamentos psicotrópicos, anticonvulsivos, antihistamínicos, etanol y otros fármacos que producen la depresión del SNC.
• Uso con imipramina y desipramina: Se han informado que las concentraciones en plasma en estado estable de imipramina y desipramina aumentan un promedio de 31% y 20%, respectivamente, mediante la administración concomitante de las tabletas de XANAX en dosis de hasta 4 mg/día. Se desconoce la significancia clínica de estos cambios.
• Fármacos que inhibe el metabolismo de alprazolam a través del citocromo P450 3A: El paso inicial en el metabolismo de alprazolam es la hidroxilación catalizada por el citocromo P450 3A (CYP3A). Los fármacos que inhiben esta vía metabólica pueden tener un efecto profundo en la depuración de alprazolam (ver Contraindicaciones y Advertencias para los fármacos adicionales de este tipo).
• Fármacos demostraron ser inhibidores de CYP3A de significancia clínica posible en base a los estudios clínicos que incluyen alprazolam (se recomienda tener precaución durante la coadministración con alprazolam):
– Fluoxetina: La coadministración de fluoxetina con alprazolam aumentó la concentración en plasma máxima en 46%, disminuyó la depuración en 21%, aumentó la vida media en 17%, y disminuyó el desempeño psicomotor medido.
– Propoxifeno: La coadministración de propoxifeno disminuyó la concentración en plasma máxima de alprazolam en 6%, disminuyó la depuración en 38%, y aumentó la vida media en 58%.
– Anticonceptivos orales: La coadministración de anticonceptivos orales aumentó la concentración en plasma máxima de alprazolam en 18%, disminuyó la depuración en 22%, y aumentó la vida media en 29%.
• Los fármacos y otras sustancias demostraron ser inhibidores de CYP3A en base a los estudios clínicos que incluyen benzodiacepinas metabolizadas de manera similar a alprazolam o en base a estudios in vitro con alprazolam u otras benzodiacepinas (se recomienda precaución durante la coadministración con alprazolam): Los datos disponibles de estudios clínicos de benzodiacepinas diferentes a alprazolam sugieren una posible interacción farmacológica con alprazolam para los siguientes fármacos: diltiazem, isoniazida, antibióticos macrólidos como eritromicina y claritromicina, y jugo de toronja. Los datos de los estudios in vitro de alprazolam sugieren una posible interacción farmacológica con alprazolam para los siguientes: sertralina y paroxetina. Sin embargo, los datos de un estudio de interacción farmacológica in vivo que incluyen una dosis única de alprazolam 1 mg y dosis en estado estable de sertralina (50 a 150 mg/día) no revelaron ningún cambio clínicamente significativo en la farmacocinética de alprazolam. Los datos de los estudios in vitro de benzodiacepinas diferentes al alprazolam sugieren una posible interacción farmacológica para los siguientes: ergotamina, ciclosporina, amiodarona, nicardipina, y nifedipina. Se recomienda precaución durante la coadministración de cualquiera de éstos con alprazolam (ver Advertencias).
• Fármacos que demostraron ser inductores de CYP3A: Carbamazepina puede aumentar el metabolismo de alprazolam y por ende puede disminuir los niveles en plasma de alprazolam.
Interacciones farmacológicas/de prueba de laboratorio: Aunque se han informado ocasionalmente interacciones entre las benzodiacepinas y las pruebas de laboratorio clínicas empleadas comúnmente, no existe un patrón consistente para un fármaco específico o una prueba específica.
Carcinogénesis, mutagénesis, problemas de la fertilidad: No se observó evidencia de potencial carcinogénico durante los estudios de bioensayo de 2 años de alprazolam en ratas a dosis de hasta 30 mg/kg/día (150 veces la dosis humana diaria máxima recomendada de 10 mg/día) y en ratones a dosis de hasta 10 mg/kg/día (50 veces la dosis humana diaria máxima recomendada).
Alprazolam no fue mutagénico en la prueba de micronúcleo de rata a dosis de hasta 100 mg/kg, que es 500 veces la dosis humana diaria máxima recomendada de 10 mg/día. Alprazolam tampoco fue mutagénico in vitro en el Ensayo de Daño de ADN/Elución alcalina o el ensayo de Ames.
Alprazolam no produjo problemas en la fertilidad en las ratas a dosis de hasta 5 mg/kg/día, que es 25 veces la dosis humana diaria recomendada máxima de 10 mg/día.
Embarazo:
• Efectos teratogénicos: Embarazo categoría D: (ver la sección de Advertencias).
• Efectos no teratogénicos: Se debe considerar que el niño nacido de una madre que está recibiendo benzodiacepinas puede estar en cierto riesgo de síntomas de retiro del fármaco durante el período postnatal. Asimismo, se ha informado flacidez neonatal y problemas respiratorios en niños nacidos de madres que reciben benzodiacepinas.
Labor y parto: Alprazolam no tiene un uso establecido durante la labor ni el parto.
Madres lactantes: Se sabe que las benzodiacepinas se excretan en la leche humana. Se debe asumir que alprazolam también. Se ha informado que la administración crónica de diazepam a madres lactantes causa que sus infantes se vuelvan alertagados y pierdan peso. Como norma general, las madres que tienen que utilizar alprazolam no deben dar de lactar.
Uso pediátrico: No se ha establecido la seguridad y eficacia de alprazolam en individuos por debajo de 18 años de edad.
Uso geriátrico: Los adultos mayores pueden ser más sensibles a los efectos de las benzodiacepinas. Muestran concentraciones de alprazolam en plasma más altas debido a la reducida depuración del fármaco en comparación con una población más joven que recibe las mismas dosis. La dosis efectiva más pequeña de alprazolam debe utilizarse en los adultos mayores para evitar el desarrollo de ataxia y sobre sedación (ver Farmacología clínica y Dosificación y administración).
POSOLOGÍA Y ADMINISTRACIÓN: Las dosis deben individualizarse en búsqueda del máximo efecto beneficioso. Mientras la dosis diaria habitual que se proporciona líneas abajo cumplirá con las necesidades de la mayoría de los pacientes, habrá algunos que requerirán dosis mayores a 4 mg/día. En dichos casos, se debe aumentar cuidadosamente la dosis para evitar efectos adversos.
Trastorno de ansiedad y síntomas transitorios de ansiedad: El tratamiento para pacientes con ansiedad debe comenzar con una dosis de 0,25 a 0,5 mg administrada tres veces por día. La dosis puede incrementarse hasta alcanzar un efecto terapéutico máximo en intervalos de 3 a 4 días, hasta llegar a una dosis diaria máxima de 4 mg/día, administrada en dosis divididas. Debe emplearse la dosis efectiva más baja posible y se debe evaluar frecuentemente la necesidad de seguir con el tratamiento. El riesgo de dependencia puede incrementarse con la dosis y la duración del tratamiento.
En todos los pacientes, se debe disminuir la dosis gradualmente cuando se suspende el tratamiento o cuando se disminuye la dosis diaria. Aunque no existen datos recopilados de manera sistemática que respalden un esquema específico de suspensión, se sugiere que la dosis diaria sea disminuida en no más de 0,5 mg cada 3 días. Algunos pacientes pueden requerir que la disminución de la dosis sea aún más lenta.
Trastorno de pánico: El tratamiento exitoso de muchos pacientes con trastorno de pánico ha requerido el uso de XANAX en dosis mayores a 4 mg al día. En estudios controlados que se llevaron a cabo para establecer la eficacia de XANAX en el trastorno de pánico, se emplearon dosis en el rango de 1 a 10 mg al día. La dosis media utilizada fue de aproximadamente 5 a 6 mg al día. Entre los aproximadamente 1700 pacientes que participaron en el programa de desarrollo del trastorno de pánico, alrededor de 300 recibieron XANAX en dosis de más de 7 mg/día, incluyendo a aproximadamente 100 pacientes que recibieron dosis máximas superiores a 9 mg/día. Algunos pacientes requirieron hasta dosis de 10 mg al día para alcanzar una respuesta satisfactoria.
Ajuste de la dosis: El tratamiento puede iniciarse con una dosis de 0,5 mg tres veces al día. Dependiendo de la respuesta, se puede aumentar la dosis en intervalos de 3 a 4 días con incrementos de no más de 1 mg por día. Puede ser aconsejable ajustar más lentamente los niveles de dosis superiores a 4 mg/día para permitir una expresión total del efecto farmacodinámico de XANAX. Para disminuir la posibilidad de síntomas interdosis, los periodos de administración deben distribuirse lo más equitativamente posible todo el tiempo que el paciente esté despierto, es decir, sobre un esquema de tres a cuatro veces al día.
Por lo general, el tratamiento debe iniciarse con una dosis baja para minimizar el riesgo de respuestas adversas en pacientes especialmente susceptibles al medicamento. Se debe continuar incrementando la dosis hasta alcanzar una respuesta terapéutica aceptable (es decir, una reducción considerable o la eliminación completa de los ataques de pánico), hasta que se presente intolerancia, o se alcance la dosis máxima recomendada.
Mantenimiento de la dosis: Para pacientes que reciben dosis superiores a 4 mg/día, se aconseja realizar una evaluación periódica y considerar la reducción de la dosis. En un estudio controlado de dosis-respuesta posterior a la comercialización, los pacientes tratados con dosis de XANAX mayores a 4 mg/día durante 3 meses pudieron disminuir progresivamente la dosis a un 50% de su dosis de mantenimiento total sin pérdida aparente del beneficio clínico. Debido al peligro de reacciones por abstinencia, se debe evitar la suspensión abrupta del tratamiento (ver Advertencias, Precauciones y Abuso y dependencia al medicamento).
Se desconoce la duración necesaria del tratamiento de pacientes con trastorno de pánico que responden al XANAX. Luego de un periodo extenso libre de ataques, se puede intentar una suspensión cuidadosamente supervisada mediante disminución gradual; no obstante, existe evidencia de que esto puede ser a menudo difícil de lograr sin la recurrencia de síntomas y/o la manifestación de fenómenos de abstinencia.
Reducción de la dosis: Debido al peligro de reacciones por abstinencia, se debe evitar la suspensión abrupta del tratamiento (ver Advertencias, Precauciones y Abuso y dependencia al medicamento).
En todos los pacientes, se debe disminuir la dosis gradualmente cuando se suspende el tratamiento o cuando se disminuye la dosis diaria. Aunque no existen datos recopilados de manera sistemática que respalden un esquema específico de suspensión, se sugiere que la dosis diaria sea disminuida en no más de 0,5 mg cada 3 días. Algunos pacientes pueden requerir que la disminución de la dosis sea aún más lenta.
En cualquier caso, la reducción de la dosis debe llevarse a cabo bajo estricta supervisión y debe ser gradual. Si se presentan síntomas de abstinencia significativos, se debe volver a establecer el régimen de dosis anterior y, sólo luego de la estabilización, se debe intentar un régimen menos rápido de suspensión. En un estudio controlado de suspensión de medicamento posterior a la comercialización de pacientes con trastorno de pánico que comparó este esquema recomendado de disminución progresiva con un esquema de disminución progresiva más lenta, no se observó ninguna diferencia entre grupos en la proporción de pacientes a los que se les disminuyó la dosis a cero; no obstante, el esquema de disminución más lenta se asoció con una reducción de los síntomas vinculados al síndrome de abstinencia. Se sugiere que la dosis se disminuya en no más de 0,5 mg cada tres días, entendiendo que algunos pacientes pueden beneficiarse de una suspensión aún más gradual. Algunos pacientes pueden demostrar ser resistentes a todos los regímenes de suspensión.
Administración en poblaciones especiales: En pacientes de edad avanzada y en pacientes con hepatopatía avanzada o con enfermedades debilitantes, la dosis inicial habitual es de 0,25 mg, administrada dos o tres veces al día; la que puede incrementarse gradualmente de ser necesario y si es tolerada.
Los pacientes de edad avanzada pueden ser especialmente susceptibles a los efectos de las benzodiacepinas. Si se producen efectos secundarios con la dosis de inicio recomendada, ésta puede disminuirse.
SOBREDOSIS
Experiencia clínica: Las manifestaciones por sobredosis de alprazolam incluyen somnolencia, confusión, alteración en la coordinación, disminución de los reflejos y coma. Se han reportado decesos en asociación con sobredosis de alprazolam como monoterapia, como con otras benzodiazepinas. Además se han reportado decesos en pacientes que recibieron sobredosis con una combinación de una única benzodiazepina incluyendo alprazolam y alcohol; los niveles de alcohol observados en algunos de estos pacientes han sido inferiores a los comúnmente asociados con la letalidad inducida por consumo de alcohol.
La DL50 oral aguda en ratas es de 331-2171 mg/kg. Otros experimentos en animales han indicado que se puede producir colapso cardiopulmonar luego de dosis masivas administradas por vía intravenosa de alprazolam (superiores a 195 mg/kg; 975 veces la dosis diaria máxima recomendada en humanos de 10 mg/día). Se puede reanimar a los animales mediante ventilación mecánica con presión positiva e infusión intravenosa de bitartrato de norepinefrina.
Experimentos con animales han sugerido que posiblemente la diuresis forzada o la hemodiálisis sean de escaso valor en el tratamiento de la sobredosis.
Tratamiento general de la sobredosis: Reportes de sobredosis con XANAX Tabletas son limitados. Como en todos los casos de sobredosis de medicamentos, se debe monitorear la respiración, frecuencia del pulso, y presión arterial. Se deben emplear medidas de apoyo generales, junto con un lavado gástrico inmediato. Se deben administrar líquidos por vía intravenosa y mantener una ventilación pulmonar adecuada. Si se presenta un caso de hipotensión, éste puede combatirse mediante el uso de vasoconstrictores. La diálisis es de valor limitado. Como con el tratamiento de sobredosis intencional con cualquier medicamento, se debe tener en cuenta que puede haberse ingerido múltiplos agentes.
El flumazenil, un antagonista específico de los receptores para benzodiazepinas está indicado para la reversión total o parcial de los efectos de sedación de las benzodiazepinas y puede utilizarse en situaciones en las que se conoce o sospecha una sobredosis con una benzodiazepina. Antes de administrar flumazenil, se deben establecer las medidas necesarias para asegurar el mantenimiento de las vías respiratorias, la ventilación y un acceso endovenoso. El tratamiento con flumezil está concebido como adyuvante, y no como substituto, del tratamiento de la sobredosis de benzodiazepinas. Se debe monitorear a los pacientes tratados con flumazenil para evitar la sedación, depresión respiratoria, y otros efectos residuales de las benzodiazepinas durante un período adecuado luego del tratamiento. El prescriptor debe estar consciente del riesgo de convulsiones en asociación con el tratamiento con flumazenil, especialmente en pacientes que utilizan benzodiazepinas a largo plazo y ante la sobredosis de antidepresivos cíclicos. Se debe consultar el inserto completo del empaque de flumazenil antes de su uso.
ABUSO Y DEPENDENCIA AL MEDICAMENTO
Dependencia física y psíquica: Los síntomas de abstinencia, similares en cuanto a carácter a los observados con sedantes/hipnóticos y alcohol, se han producido luego de la suspensión de benzodiazepinas, incluyendo XANAX. Los síntomas pueden oscilar entre disforia leve e insomnio y un síndrome mayor que puede incluir calambres abdominales y musculares, vómitos, sudoración, temblores y convulsiones. A menudo resulta difícil distinguir entre los signos y síntomas que surgen por la abstinencia y la recurrencia de la enfermedad en pacientes que se someten a reducción de la dosis. La estrategia a largo plazo para el tratamiento de estos fenómenos variará de acuerdo a sus causas y el objetivo terapéutico. En el caso que sea necesario, el tratamiento inmediato de síntomas de abstinencia requiere la reinstitución del tratamiento con dosis de XANAX suficientes para suprimir los síntomas. Se ha reportado el fracaso de otras benzodiazepinas para suprimir totalmente estos síntomas de abstinencia. Esta imposibilidad se ha atribuido a una tolerancia cruzada incompleta, la cual, no obstante, puede a su vez reflejar el uso de un régimen de dosis inadecuado de la benzodiazepina substituida o los efectos de medicamentos concomitantes.
Aunque es difícil distinguir la abstinencia y la recurrencia en ciertos pacientes, el transcurso del tiempo y la naturaleza de los síntomas pueden ser útiles. Por lo general, un síndrome de abstinencia incluye la aparición de nuevos síntomas, tiende a aparecer al final de la disminución progresiva de la dosis o poco después de su suspensión, y disminuirá con el tiempo. En el trastorno de pánico recurrente, los síntomas similares a los observados antes del tratamiento pueden reaparecer ya sea temprana o tardíamente, los cuales van a persistir.
Mientras la severidad e incidencia de los fenómenos de abstinencia parecen estar relacionadas a la dosis y duración del tratamiento, se han reportado síntomas de abstinencia, incluidas convulsiones, solamente después de tratamientos breves con XANAX con dosis dentro del rango recomendado para el tratamiento de la ansiedad (por ejemplo, de 0,75 a 4 mg/día). Los signos y síntomas de abstinencia son a menudo más notorios luego de una rápida disminución de la dosis o su abrupta suspensión. El riesgo de presentar convulsiones por abstinencia puede incrementarse con dosis por encima de 4 mg/día (ver Advertencias).
Los pacientes, especialmente aquellos que presenten antecedentes de convulsiones o epilepsia, no deben interrumpir abruptamente ningún medicamento que deprima el SNC, incluyendo XANAX. Se recomienda que todos los pacientes tratados con XANAX que requieran una reducción de la dosis la realicen gradualmente, bajo estricta supervisión (ver Advertencias y Posología y administración).
La dependencia psicológica representa un riesgo con todas las benzodiazepinas, incluyendo XANAX. El riesgo de presentar dependencia psicológica se puede a su vez incrementar con dosis mayores a 4 mg/día y con el uso a largo plazo; el que se incrementa aún más en pacientes con antecedentes de alcoholismo y drogadicción. Algunos pacientes han tenido dificultades considerables al disminuir progresivamente y suspender XANAX, especialmente aquellos que reciben dosis mayores durante periodos extendidos. Individuos propensos a adicciones deben estar bajo cuidadosa vigilancia cuando reciban XANAX. Como con todos los ansiolíticos, la repetición de recetas debe limitarse a las que se encuentran bajo supervisión médica.
Clase de sustancias controladas: Alprazolam es una sustancia controlada bajo la Ley de Sustancias Controladas de la Agencia Antidrogas de los Estados Unidos y XANAX Tabletas se ha asignado al Programa IV.
DESCRIPCIÓN: Las tabletas XANAX contienen alprazolam, que es un análogo de triazol de la clase 1,4 benzodiacepinas de activos del sistema nervioso central-compuestos.
El nombre químico del alprazolam es 8-cloro-1-metil-6-fenil-4H-s-triazol [4,3-α] [1,4] benzodiacepina.
La fórmula estructural está representada de esta manera:
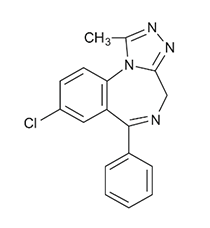
Alprazolam es un polvo blanco cristalino, que es soluble en metanol o etanol, pero que no tiene apreciable solubilidad en agua a pH fisiológico.
Cada tableta de XANAX, para administración oral, contiene 0,25 mg, 0,5 o 1 del alprazolam.
FARMACOLOGÍA CLÍNICA
Farmacodinámica: Los agentes del SNC de la clase de las 1,4 benzodiazepina supuestamente ejercen sus efectos al unirse a varios receptores estereoespecíficos en diversos sitios dentro del sistema nervioso central. Se desconoce su mecanismo de acción exacto. Todas las benzodiazepinas producen, clínicamente, una actividad depresora del sistema nervioso dependiente de la dosis, que varía desde un leve deterioro del desempeño de actividades hasta la hipnosis.
Farmacocinética:
• Absorción: El alprazolam se absorbe rápidamente luego de su administración oral. Las concentraciones plasmáticas máximas se producen de 1 a 2 horas después de la administración. Las concentraciones plasmáticas son proporcionales a la dosis administrada; se observaron concentraciones máximas de 8,0 a 37 mg/mL en un rango de dosis de 0,5 a 3,0 mg.
Mediante una metodología de ensayo específica, se ha descubierto que la semivida de eliminación media de alprazolam es de 11,2 horas (rango de 6,3 a 26,9 horas) en adultos sanos.
• Distribución: El alprazolam se une in vitro (80 por ciento) a la proteína sérica humana. La albúmina sérica representa la mayor parte de la unión.
• Metabolismo/Eliminación: El alprazolam se metaboliza ampliamente en humanos, principalmente mediante el citocromo 3A4 (CYP3A4), en dos metabolitos principales en el plasma: 4-hidroxialprazolam y α-hidroxialprazolam. Asimismo, se encontró una benzofenona derivada del alprazolam en humanos. Sus semividas parece ser similares a la del alprazolam. Las concentraciones plasmáticas de 4-hidroxialprazolam y α-hidroxialprazolam relacionadas a la concentración inalterada del alprazolam fueron siempre menores al 4%. Las potencias relativas reportadas en los experimentos de unión a receptores de benzodiazepinas y en modelos animales de inhibición inducida de convulsiones son 0,20 y 0,66, respectivamente, para 4-hidroxialprazolam y α-hidroxialprazolam. Dichas concentraciones bajas y las potencias más bajas de 4- hidroxialprazolam y α-hidroxialprazolam sugieren que es improbable que contribuyan en gran medida a los efectos farmacológicos del alprazolam. El metabolito de benzofenona es esencialmente inactivo.
Alprazolam y sus metabolitos se excretan principalmente en la orina.
• Poblaciones especiales: Se han reportado cambios en la absorción, la distribución, el metabolismo y la eliminación de benzodiazepinas en una variedad de enfermedades incluyendo alcoholismo, deterioro de la función hepática y deterioro de la función renal. Asimismo, se han demostrado cambios en los pacientes geriátricos. Se ha observado una semivida media de alprazolam de 16.3 horas en sujetos de edad avanzada sanos (rango: 9,0-26,9 horas, n=16) en comparación con 11.0 horas (rango: 6,3-15,8 horas, n=16) en sujetos adultos sanos. En pacientes con hepatopatía por consumo de alcohol, la semivida de alprazolam osciló entre 5,8 y 65,3 horas (media: 19,7 horas, n=17) en comparación con una semivida entre 6,3 y 26,9 horas (media 11,4 horas, n=17) en sujetos sanos. En un grupo de sujetos con obesidad, la semivida de alprazolam osciló entre 9,9 y 40,4 horas (media= 21,8 horas, n=12) en comparación con una semivida entre 6,3 y 15,8 horas (media= 10,6 horas, n=12) en sujetos sanos.
Debido a su similitud con otras benzodiazepinas, se asume que alprazolam experimenta pasaje transplacentario y se excreta a través de la leche humana.
– Raza: Las concentraciones máximas y la semivida de alprazolam son superiores en aproximadamente 15% y 25% en asiáticos en comparación con los caucásicos.
– Pacientes pediátricos: No se ha estudiado la farmacocinética de alprazolam en pacientes pediátricos.
– Sexo: El sexo no tiene efecto alguno sobre la farmacocinética de alprazolam.
– Consumo de cigarros: Las concentraciones de alprazolam pueden disminuirse hasta en un 50% en los fumadores en comparación con los no fumadores.
Interacciones medicamentosas: El alprazolam se elimina principalmente a través del citocromo P450 3A (CYP3A). La mayor parte de las interacciones que se han documentado con el alprazolam se producen con otros medicamentos que inhiben o inducen el CYP3A4.
Se esperaría que los compuestos que son inhibidores potentes del CYP3A incrementen las concentraciones plasmáticas del alprazolam. Los productos farmacéuticos que se han estudiado in vivo, junto con su efecto sobre el incremento del AUC del alprazolam, son los siguientes: ketoconazol, 3,98 veces; itraconazol, 2,70 veces; nefazodona, 1,98 veces; fluvoxamina, 1,96 veces; y eritromicina, 1,61 veces (ver Contraindicaciones, Advertencias y Precauciones: Interacciones medicamentosas).
Se esperaría que los inductores del CYP3 A disminuyeran las concentraciones de alprazolam, lo que se ha observado in vivo. La depuración oral de alprazolam (administrada en una dosis única de 0,8 mg) se incrementó de 0,90±0,21 mL/min/kg a 2,13±0,54 mL/min/kg y la eliminación t1/2 se redujo (de 17,1±4,9 a 7,7 ±1,7 h) luego de administrar 300 mg/día de carbamazepina durante 10 días (ver Precauciones: Interacciones medicamentosas). No obstante, la dosis de carbamazepina utilizada en este estudio fue bastante baja en comparación con las dosis recomendadas (1000-1200 mg/día); se desconoce el efecto a dosis usuales de carbamazepina.
Aún no se ha determinado la capacidad del alprazolam para inducir los sistemas enzimáticos hepáticos humanos; no obstante, ésta no es una propiedad de las benzodiazepinas en general. Además, el alprazolam no afectó la protombina o los niveles plasmáticos de warfarina en los voluntarios varones a los que se administró oralmente warfarina sódica.
ESTUDIOS EN ANIMALES: Cuando las ratas fueron tratadas con alprazolam a los 3, 10 y 30 mg/kg/día (15 a 150 veces la dosis máxima recomendada en humanos) por vía oral durante 2 años, una tendencia a un aumento dosis-dependiente en el número de cataratas se observó en las mujeres y una tendencia a un aumento dosis dependiente de la vascularización de la córnea se observó en los hombres. Estas lesiones no aparecieron hasta después de 11 meses de tratamiento.
Fabricado por:
Sanico NV- Bélgica
Acondicionado por:
Pfizer Italia S.R.L.- Italia
Importado por:
PFIZER S.A.
Av. Javier Prado Este 6230, 2do piso
Lima 12 - Perú
Teléfono: 615-2100, Fax: 615-2106
LLD basado en USPI (23.08 2011) V1
ALMACENAMIENTO: Conservar a temperatura ambiente controlada de 15 °C a 30 °C.